Antecedentes
La alergia es una respuesta inmunitaria anómala, generalmente causada por una excesiva producción de inmunoglobulina E (IgE) como respuesta a antígenos ambientales o alérgenos.1 Se estima que de 30 a 40 % de la población mundial padece una o más enfermedades alérgicas,2 sin embargo, la comparabilidad de los estudios de prevalencia es baja debido a la aplicación de diversas metodologías para el diagnóstico y la definición de la enfermedad, lo que puede explicar las variaciones en los estimadores registrados.3
Algunos estudios informan aumento de la prevalencia de las enfermedades alérgicas en el mundo. Esta tendencia es mayor en los países en desarrollo como Colombia, donde en 2010 se registró un incremento de la prevalencia de síntomas que alcanzó 12 % para el asma y 32 % para rinitis alérgica en comparación con las prevalencias de 1994: 10 y 23 %, respectivamente.4,5
Yepes Núñez y colaboradores evaluaron por primera vez en Colombia los beneficios inducidos por la inmunoterapia subcutánea para ácaros de polvo en la calidad de vida de 76 pacientes con rinitis alérgica y asma, por medio de los cuestionarios Kidscreen-27 y SF-36: la inmunoterapia subcutánea fue bien tolerada e influyó positivamente en la calidad de vida de personas con rinitis alérgica y asma sensibilizadas a los ácaros de polvo.6 A pesar de lo anterior, en Colombia y América Latina el conocimiento respecto al impacto en la calidad de vida y el bienestar socioeconómico de los individuos y de sus familias a causa de las enfermedades alérgicas es limitado.2
Tradicionalmente, los tratamientos para las enfermedades alérgicas se basan en la prescripción de medicamentos que tienen como objetivo el control de los procesos inflamatorios o fisiológicos involucrados en la respuesta de la alergia, que logran mejorar los síntomas, evitar recaídas y exacerbaciones y mejorar la calidad de vida de los pacientes.7,8 A pesar de esto, los fármacos de uso más frecuente como los antihistamínicos, corticosteroides e inhibidores de la calcineurina no han mostrado cambiar el curso clínico de la enfermedad.7,8 Durante las últimas décadas se han desarrollado nuevas opciones terapéuticas como la inmunoterapia (ITE), que consiste en cualquier tipo de tratamiento que actúe sobre el sistema inmunológico, por ejemplo, las vacunas antialérgicas o vacunas con extractos alergénicos.8
En la actualidad, la ITE subcutánea con alérgenos es la única que tiene como objetivo modular la respuesta inmune alérgica produciendo un cambio significativo en el curso clínico de la enfermedad.9,10,11,12 Al parecer, el impacto es mayor si la ITE se inicia en edades tempranas. Sánchez y colaboradores, en 64 pacientes con asma alérgica, compararon el efecto de la inmunoterapia en reducir el número de exacerbaciones y el requerimiento de esteroides y betaagonistas; encontraron un mayor impacto cuando la ITE se inició en pacientes menores de 14 años monosensibilizados.11
La Organización Mundial de la Salud (OMS) define la ITE como un tratamiento con alérgenos que consiste en la administración oral o subcutánea a un sujeto alérgico, de cantidades gradualmente crecientes del extracto alergénico al cual se encuentra sensibilizado, con el objetivo de disminuir la sintomatología causada por la exposición al alérgeno implicado y la prevención de sensibilizaciones adicionales o el empeoramiento de la enfermedad subyacente.9,13 Actualmente se le atribuyen cambios en la respuesta inmune, tanto inmediatos como tardíos, y la acción sobre mecanismos humorales y celulares involucrados en la respuesta alérgica.14 Entre estos cambios se encuentran los siguientes:15
Modulación de la respuesta de anticuerpos alérgeno-específicos: Se presenta aumento inicial de la IgE sérica seguido de disminución gradual con el paso de meses o años de tratamiento. Además, se produce aumento de la inmunoglobulina G4 (IgG4) y de la inmunoglobulina A (IgA) específica, que captan los alérgenos antes que entren en contacto con la IgE unida a células efectoras, impidiendo que basófilos y mastocitos se activen; igualmente dificultan la presentación a linfocitos T por parte de las células presentadoras de antígeno, al competir con ellas.15,16
Disminución en el reclutamiento y activación de células proinflamatorias: La ITE aumenta la producción de IL10 y de células T reguladoras que modulan de forma eficiente el umbral de activación de mastocitos y basófilos, disminuyendo la liberación de histamina mediada por IgE. La IL10 regula la función y la actividad de eosinófilos y suprime la producción de IL5 por parte de las células T.17
Cambios en el patrón de respuesta de las células T alérgeno-específicas: En los últimos años se han descrito nuevas células T diferentes a las T helper, que han sido denominadas células T reguladoras y tienen la capacidad de modificar a la baja la respuesta Th1 y Th2 por medio del factor de crecimiento transformante (TGF) y la producción de IL10.18 Parecen estar implicadas en la respuesta inmunológica de los pacientes que reciben inmunoterapia subcutánea, pero no en quienes reciben inmunoterapia sublingual.19
La ITE aplicada por vía subcutánea debe administrarse en dosis seriadas, crecientes y semanales, según una pauta preestablecida por el fabricante o por el alergólogo (fase de iniciación), hasta llegar a la dosis máxima, que se repite de forma mensual (fase de mantenimiento).20 Los principales inconvenientes son la necesidad de asistir recurrentemente a un servicio especializado para la administración de la ITE y el mayor riesgo de reacciones adversas de tipo sistémico.20
La ITE por vía sublingual es administrada en gotas, al principio en el consultorio y después se prescribe de forma domiciliaria diariamente.14 Esta modalidad ha mostrado un menor riesgo de reacciones sistémicas aun cuando su administración requiere entre 50 y 100 veces las concentraciones necesarias por vía subcutánea.19
Como consideración general, los mecanismos por los cuales actúa la ITE subcutánea y sublingual son similares; sin embargo, al parecer, en la subcutánea la respuesta humoral es mayor que en la ruta sublingual, mientras que en esta última predomina la anergia celular. Las diferencias parecen estar relacionadas con el sitio de aplicación.21,22 La eficacia de la ITE con extractos alergénicos (granos de polen, hongos, alérgenos de animales, ácaros, himenópteros y cucarachas) para la disminución de síntomas, recaídas, complicaciones y la mejoría de la calidad de vida se ha comprobado en ensayos clínicos controlados en pacientes con asma, conjuntivitis y rinitis alérgica,12,23 por lo tanto, esta modalidad terapéutica es reconocida y aprobada por varias organizaciones internacionales especialistas en la materia (OMS, Global Initiative for Asthma [GINA], Allergic Rhinitis and its Impact on Asthma [ARIA], European Academy of Allergy and Clinical Immunology [EAACI], Tercer Consenso Internacional Pediátrico), que señalan su seguridad en niños y adultos.9,24,25,26,26,28,29
La ITE por vía sublingual es administrada en gotas, al principio en el consultorio y después se prescribe de forma domiciliaria diariamente.14 Esta modalidad ha mostrado un menor riesgo de reacciones sistémicas aun cuando su administración requiere entre 50 y 100 veces las concentraciones necesarias por vía subcutánea.19
Como consideración general, los mecanismos por los cuales actúa la ITE subcutánea y sublingual son similares; sin embargo, al parecer, en la subcutánea la respuesta humoral es mayor que en la ruta sublingual, mientras que en esta última predomina la anergia celular. Las diferencias parecen estar relacionadas con el sitio de aplicación.21,22
La eficacia de la ITE con extractos alergénicos (granos de polen, hongos, alérgenos de animales, ácaros, himenópteros y cucarachas) para la disminución de síntomas, recaídas, complicaciones y la mejoría de la calidad de vida se ha comprobado en ensayos clínicos controlados en pacientes con asma, conjuntivitis y rinitis alérgica,12,23 por lo tanto, esta modalidad terapéutica es reconocida y aprobada por varias organizaciones internacionales especialistas en la materia (OMS, Global Initiative for Asthma [GINA], Allergic Rhinitis and its Impact on Asthma [ARIA], European Academy of Allergy and Clinical Immunology [EAACI], Tercer Consenso Internacional Pediátrico), que señalan su seguridad en niños y adultos.9,24,25,26,26,28,29
A pesar de los múltiples beneficios de la ITE, la seguridad es uno de los temas que despierta mayor temor en cuanto a su implementación, debido a la posibilidad de reacciones severas o complicaciones mayores, entre las que puede mencionarse la anafilaxia como la de mayor riesgo.30,31 En la literatura mundial se informa una tasa de reacciones sistémicas por inyección de aproximadamente 0.2 % (0.026 a 0.37 %) en Estados Unidos y 0.01 a 0.3 % en Europa,30,31 así como cifras de incidencia de reacciones adversas mortales de 1 por cada 1.5 a 2.5 millones de dosis.31 Se han identificado algunos factores de riesgo para presentar dichas reacciones: tener asma no controlada, reacciones sistémicas previas, falta de supervisión médica durante la aplicación, uso simultáneo de medicamentos bloqueadores de los receptores betaadrenérgicos, embarazo, niveles de triptasa sérica basal elevada y enfermedades cardiacas o pulmonares.32
Entre las reacciones adversas descritas para la ITE se encuentran principalmente las locales que dependen del tipo de extracto aplicado, la dosis administrada y otros factores no controlables como el tipo de piel del paciente.22 Las reacciones locales consisten en prurito, rubor, ardor, edema, calor local o nódulos en la zona de inyección. Entre las reacciones sistémicas están la urticaria, el angioedema, las crisis asmáticas y la anafilaxia, entre otras.9 Por esta razón, es importante reconocer los signos y síntomas de forma temprana, además de administrar la ITE en el lugar adecuado, con un diagnóstico acertado y a la dosis indicada.18
El objetivo de este estudio fue evaluar la frecuencia de las reacciones sistémicas adversas y su relación con la edad, el sexo, diagnóstico y tipo de extracto de ITE administrado, en una cohorte de pacientes con diagnóstico de dermatitis atópica, asma, rinitis y conjuntivitis alérgicas, que recibieron ITE subcutánea con extractos tirosinados de Dermatophagoides farinae, Dermatophagoides pteronyssinus y Blomia tropicalis, extractos que adicionan L-tirosina como adyuvantes depot para prolongar la liberación de alérgeno.
Métodos
Se analizó una cohorte retrospectiva de pacientes atendidos entre 2007 y 2015 en el servicio de alergología clínica de una institución prestadora de servicios de salud de la Universidad de Antioquia IPS Universitaria, en Medellín, Colombia. El estudio fue aprobado por el comité de ética de esa institución y se cumplió con los criterios de la Declaración de Helsinki en su versión de 2013, así como con la normatividad colombiana vigente. Dado que el estudio comprendió la revisión de bases de datos secundarias, no se requirió de consentimiento informado de los usuarios.
Se eligió a pacientes con diagnóstico confirmado por médico alergólogo de al menos una de las siguientes condiciones: asma alérgica, rinitis alérgica, conjuntivitis alérgica o dermatitis atópica, y que como indicación recibieron tratamiento supervisado con ITE. Este consistía en la aplicación de la vacuna comercial Tyrovac™ (Tyrosin, Laboratorios Allergy Therapeutics, Subcutánea, Reino Unido) del extracto alergénico de ácaros de polvo doméstico.
La administración de la ITE se realizó con una dosis inicial de un frasco (260 TU/0.5 mL) dividido en dos fracciones, con intermedio de 30 minutos para la aplicación; en los individuos menores de 18 años la dosis fue de 0.2 mL y 0.2 mL y para mayores de esa edad, de 0.2 mL y 0.3 mL, repitiendo la dosis a los 8 días y continuando con dosis mensuales de mantenimiento de 0.4 mL y 0.5 mL, respectivamente. Ningún paciente debió recibir medicamentos (antihistamínicos o corticosteroides) previamente, con el fin de evitar reacciones adversas. Las inyecciones se administraron por vía subcutánea con jeringas de insulina, en la parte superior del brazo, intercalando los lados derecho e izquierdo en cada dosis.
Los pacientes con diagnóstico de asma fueron vigilados después de la aplicación durante al menos 60 minutos y los restantes con otras enfermedades alérgicas, durante 30 minutos. Si un paciente presentaba una reacción adversa sistémica inmediata era evaluado por el médico alergólogo a cargo, quien clasificaba la reacción según los criterios de clasificación de las reacciones sistémicas a la inmunoterapia de la OMS (Cuadro 1) e indicaba el manejo correspondiente. Se instruyó al paciente y a sus acompañantes para la identificación de reacciones adversas tardías, en cuyo caso debían asistir al servicio de urgencias e informar al servicio de alergología clínica.
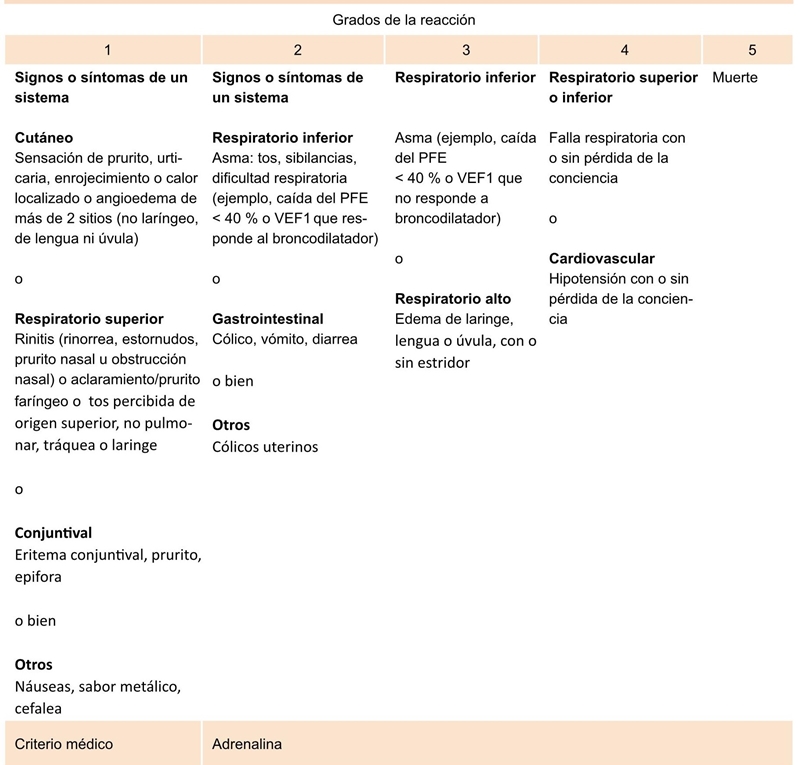
La puntuación incluye un sufijo que denota el tiempo y administración de adrenalina como consecuencia de la aparición de los síntomas o signos de la reacción sistémica: a) Menor a 5 minutos; b) Entre 5 y 10 minutos; c) Entre 10 y 20 minutos; d) Mayor a 20 minutos; z) No aplicación de adrenalina. JACI 2010; 125(3):569-574
Cuadro 1 Sistema de clasificación de las reacciones sistémicas con inmunoterapia subcutánea según la Organización Mundial de Alergias
Para la recolección de la información se revisó la base de datos del servicio, donde se registran las principales características sociodemográficas (edad, sexo, ciudad de residencia), clínicas (diagnósticos de alergias, reacciones adversas experimentadas, manejos no farmacológicos de las reacciones adversas, tiempo de observación) y farmacológicas (dosis de la ITE, frecuencia de administración, tipo de extracto, medicamentos para el manejo de reacciones adversas) de los sujetos que reciben ITE en la institución. Se elaboró un formato estandarizado que fue aplicado por dos médicos residentes de alergología clínica. Posteriormente se realizó la tabulación en un programa automatizado (Excel™. Microsoft en su versión para Windows), verificando los posibles errores en la digitación, la información perdida y las inconsistencias.
Los datos fueron analizados con un programa estadístico (Stata MP™, StataCorp versión 13.1 para Windows). Se realizó análisis descriptivo de las variables sociodemográficas y clínicas de los participantes, con registro de mediana, rango intercuartílico (RI), media aritmética y desviación estándar.
Para determinar la seguridad de la intervención se calculó la proporción de incidencia de reacciones adversas sistémicas con su intervalo de confianza de 95 % (IC 95 %) y la razón de reacción-inyección. Se evaluó el criterio de normalidad con la prueba de Shapiro-Wilk y después se realizó un análisis exploratorio evaluando la asociación entre la edad y el riesgo de reacción adversa sistémica con la U de Mann-Whitney para la comparación de las sumas de rangos.
La asociación con el sexo, el diagnóstico, el tipo de extracto y haber recibido más de un extracto según el riesgo de reacciones adversas se evaluó con análisis bivariado mediante la obtención de χ2 de independencia o la prueba exacta de Fisher, así como con el cálculo de la razón de proporciones de incidencia (riesgo relativo, RR) por medio de un modelo lineal generalizado de regresión de Poisson con varianza robusta para ajustar la RR y los IC 95 % por múltiples variables. Un valor de p < 0.05 se consideró estadísticamente significativo
Resultados
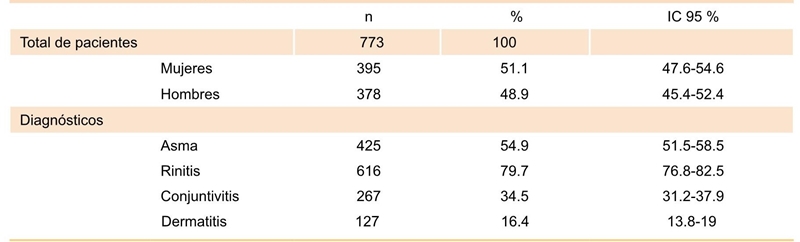
De una cohorte histórica del servicio de alergología se incluyeron 773 pacientes que cumplieron los criterios de inclusión. La edad mediana de los pacientes fue de 11 años (RI= 8); hubo una mayor proporción de mujeres. Se identificaron diferencias significativas entre la edad y el sexo: la edad fue menor en los hombres (p < 0.0001). El diagnóstico más frecuente fue rinitis alérgica, seguido de asma alérgica, conjuntivitis alérgica y dermatitis atópica (Cuadro 2).
Todos los pacientes fueron vacunados con ácaros de polvo doméstico, no se indicó vacunación para otra fuente distinta de alérgenos. Los extractos más usados fueron los dirigidos a la familia Pyrogliphidae y en menor frecuencia contra Blomia tropicalis. La forma más usual de tratamiento fue la combinación de dos extractos; menos de 6 % recibió uno o tres extractos (Cuadro 3). Fueron administradas 12 546 dosis de ITE, 11 773 (93.83 %) correspondientes a dosis de mantenimiento, con una mediana de dosis por paciente de 13 (RI = 15), mínimo una dosis y máximo 62.
Caracterización de las reacciones sistémicas
Se registraron 45 reacciones sistémicas, para una proporción de incidencia de 5.8 % (IC 95 %, 4.1-7.5 ) a la administración de la ITE subcutánea con extractos tirosinados para ácaros del polvo doméstico, con una razón de reacción de 0.35 por cada 100 inyecciones administradas. Respecto a las alergias respiratorias, 24 pacientes tenían diagnóstico de asma alérgica (53.3 %), 37 de rinitis alérgica (82.2 %), 25 de conjuntivitis alérgica (55.6 %) y 7 de dermatitis atópica (15.6 %).
En 5 pacientes no fue posible clasificar el grado de severidad, por no contar con la caracterización de las mismas en las bases de datos secundarias; de los pacientes restantes, 12 (30 %) presentaron una reacción sistémica grado 1, 27 (67.5 %) grado 2 y 1 (2.5 %) grado 3; ninguno manifestó reacciones de mayor grado de severidad. El principal sistema comprometido fue el respiratorio, seguido por la piel, sistema ocular y sistema nervioso; en ningún caso hubo compromiso del sistema cardiovascular.
El tiempo transcurrido entre la aplicación de la dosis y la presentación de la reacción sistémica fue menor a una hora en 37 pacientes y en 3 fue tardía (Cuadro 4).
Relación de aspectos demográficos y clínicos según la reacción adversa sistémica
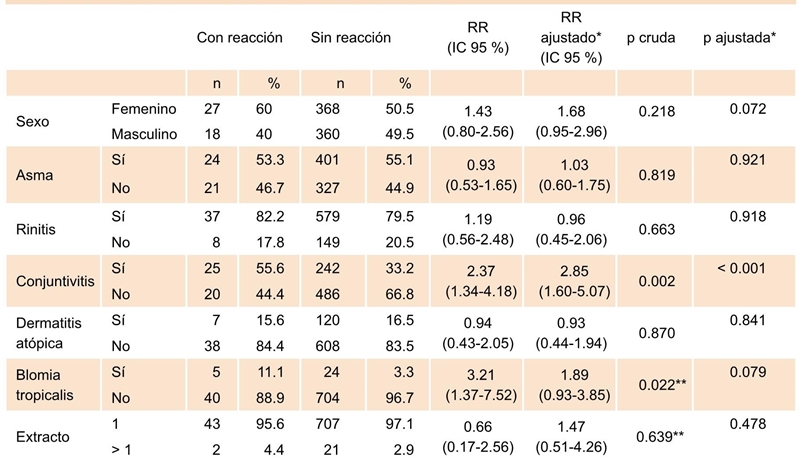
Al evaluar la asociación entre los diagnósticos de los pacientes y el riesgo de presentar reacción adversa, se encontró que tener conjuntivitis alérgica incremento 1.85 veces más el riesgo de presentar una reacción adversa, lo que no se presentó con otros diagnósticos. No se encontró un mayor riesgo de reacción sistémica de acuerdo con otras características sociodemográficas o clínicas (Cuadro 5).
Caracterización del manejo de las reacciones sistémicas
De los 40 pacientes que contaban con descripción de las reacciones sistémicas en bases de datos secundarias, la adrenalina fue administrada en 32 (80 %). Una segunda dosis de adrenalina fue necesaria en 2 pacientes, debido a no respuesta a la primera dosis. Los 8 pacientes que no recibieron adrenalina presentaron una reacción sistémica grado 1. Los otros tratamientos recibidos fueron la administración de oxígeno por cánula nasal (50 %), salbutamol (47.5 %) y antihistamínicos (40 %). El tiempo de observación para todos los pacientes fue superior a una hora (Cuadro 6).
Discusión
Estudios clínicos han señalado la eficacia y bajo riesgo de reacciones adversas tras la aplicación de la ITE subcutánea.33,34 Pese a ello, esta alternativa terapéutica no ha alcanzado el amplio uso que se esperaría debido a las restricciones generadas por el temor a los efectos secundarios.35
La seguridad de la inmunoterapia con extractos modificados ha sido demostrada en diversos estudios.33,34 Hernández y colaboradores evaluaron la seguridad de la ITE después de tres años en un programa de clúster, con 1837 dosis administradas a 77 pacientes con edades entre los 2 y 5 años, entre quienes se encontró solo una reacción sistémica, que equivalió a una razón de reacción de 0.1 por cada 100 inyecciones.36
En el presente estudio se reportaron 12 546 dosis utilizando el esquema rush en 773 pacientes entre los 2 y 70 años de edad con enfermedad alérgica que recibieron ITE subcutánea con extractos tirosinados de ácaros del polvo doméstico; 1540 dosis correspondieron a pacientes ≤ 5 años, con una razón de reacción de 0.32 por cada 100 inyecciones.
La proporción de incidencia fue de 5.8 % y la razón de reacción fue de 0.35 por cada 100 inyecciones administradas. Casanovas y colaboradores utilizaron extractos modificados con la participación de 1068 pacientes con diagnóstico de rinoconjuntivitis o asma sensibilizados a ácaros del polvo doméstico o granos de polen; encontraron 5 reacciones sistémicas inmediatas y 3 tardías después de la aplicación de 2136 inyecciones (0.66 % por paciente y 0.4 % por inyección).37 Estos resultados muestran una reacción por inyección similar a la identificada en el presente estudio, donde se incluyeron pacientes sensibilizados únicamente a ácaros del polvo doméstico y de un solo centro de referencia.
Algunos estudios han evidenciado resultados similares: Sager y colaboradores administraron extractos de alérgenos polimerizados despigmentados a 175 pacientes, para un total de 2261 inyecciones, con una razón de 0.6 reacciones por cada 100 inyecciones;38 Moreno y colaboradores evaluaron 488 pacientes tratados con extractos de alérgenos estandarizados biológicamente para enfermedades alérgicas respiratorias, 433 pacientes completaron el estudio, para un total de 17 526 inyecciones y 50 reacciones sistémicas (0.3 reacciones por cada 100 inyecciones, 30 de grado 2 y 20 de grado 3).35 Los estudios de Moreno y Sager muestran una razón de reacciones que varió de 0.3 a 0.6 por cada 100 inyecciones,35,38 datos similares a los obtenidos en el estudio que reportamos, donde la razón fue de 0.35 por cada 100 inyecciones. Sin embargo, la proporción de reacciones grado 2 en el presente estudio fue de 67.5 %, similar a la identificada por Moreno (60 %) y diferente en las reacciones grado 3, donde fue de 2.5 y 40 %, respectivamente.35
Es importante resaltar que la administración de adrenalina fue el tratamiento de elección en las reacciones sistémicas grados 2 y 3. En las reacciones grado 1, fue recibida por 33 % de los pacientes; el uso de adrenalina en estos casos se deja a criterio del médico. Los datos se pueden asociar con un equipo médico adecuadamente capacitado para dar una respuesta oportuna.39
En un estudio prospectivo y multicéntrico que evaluó la seguridad de la inmunoterapia subcutánea con extractos de ácaros de polvo doméstico (Dermatophagoides pteronyssinus o farinae) en 261 pacientes con enfermedad alérgica,40 con las que se registraron 110 reacciones de las 2290 dosis administradas, de ellas solo 12 fueron sistémicas (0.5 %).40
En otro análisis, retrospectivo observacional, efectuado en el mismo centro de referencia donde se llevó a cabo la investigación que se informa, se evaluó la presencia de reacciones adversas en pacientes que recibían inmunoterapia ultra rash con extractos polimerizados despigmentados para ácaros de polvo doméstico. Solo 8 pacientes presentaron reacciones sistémicas, que equivalieron a 0.1 % reacciones por inyección y a 1.3 % de los pacientes,41 proporciones inferiores a las del actual estudio (5,8 %). Teniendo en cuenta que las características demográficas y la selección de los pacientes pudo ser similar, se podría considerar que la composición de los extractos desempeña un papel importante en esta diferencia. Así lo demuestran Cardona y colaboradores al evaluar la seguridad y la eficacia de la inmunoterapia contra ácaros del polvo doméstico en 292 pacientes que recibían extractos con l-tirosina;42 Encontraron 40 reacciones sistémicas entre 3760 aplicaciones (1.06 % reacción por aplicación y 11.64 % por paciente),42 proporciones superiores a las de nuestra investigación.
En la década de 1980, en una revisión se encontró una incidencia de 30 % de reacciones sistémicas en pacientes que recibieron ITE subcutánea para el asma,43 pero en los últimos 20 años, la prevalencia de las reacciones sistémicas se ha informado de 0.25 a 4 %.44,45,46,47
El asma se ha descrito como un factor de riesgo crítico en el desarrollo de reacciones sistémicas.48,49,50 Por esta razón, la ITE no debe administrarse a pacientes con asma inestable o con disminución de 70 % del volumen espiratorio forzado en 1 segundo (FEV1) del valor predicho. Este parámetro estuvo controlado en el presente estudio y se comprobó previamente a la administración de la ITE; al evaluar el asma en relación con la presencia de la reacción sistémica no se hallaron diferencias estadísticamente significativas, por lo tanto, no se presentó asociación entre el asma y la reacción sistémica. Sin embargo, como un hallazgo exploratorio se halló una posible relación con la conjuntivitis alérgica, la cual fue ajustada por aspectos clínicos y demográficos (edad, sexo, asma, rinitis, conjuntivitis, dermatitis, extracto de Blomia tropicalis, cantidad de extractos y dosis de reacción), pero es necesario realizar otras investigaciones analíticas y experimentales para demostrar esta posible relación.
Una visión general de los datos de seguridad de la ITE muestra el bajo riesgo de reacciones sistémicas; cuando se presentan son de gravedad leve o moderada y con buena respuesta si se siguen las recomendaciones de la OMS o de la EAACI.51,52,53 Entre esas recomendaciones se encuentran revisar que el tratamiento de la reacción sea el adecuado, que las dosis sean correctas, que se disponga de equipos para tratamiento de emergencia y que se registre la existencia de contraindicaciones como asma inestable, tratamiento con betabloqueadores, exacerbaciones de los síntomas alérgicos, etcétera, antes de la administración de la ITE.35 Las futuras directrices o recomendaciones deben limitar al máximo las reacciones adversas. En la literatura mundial se han reportado víctimas mortales de la ITE de forma excepcional, pero al realizar el análisis se han confirmado errores en los aspectos mencionados.54,55,56 En nuestra investigación no se identificaron eventos fatales.
Los resultados permiten reconocer que la ITE es una modalidad segura en los pacientes alérgicos debidamente seleccionados, sin embargo, el hecho de que algunos presentaran reacciones adversas sistémicas durante la fase de mantenimiento, hace evidente que las causas tal vez no estén completamente descritas y que el conocimiento acerca de los factores que contribuyen a los efectos secundarios no es suficiente.57
Dada la naturaleza de la cohorte histórica abordada en esta investigación, se identificaron algunas limitaciones como el posible subregistro de las reacciones adversas. Las fortalezas fueron el número representativo de inyecciones, la cuidadosa selección de los pacientes y el uso de escalas, tanto objetivas como subjetivas, dirigidas por personal médico para la evaluación de los síntomas.
Conforme los resultados reportados en la literatura mundial51,52,53 y los encontrados en el presente estudio, se puede concluir que la administración de la ITE subcutánea con extractos tirosinados Dermatophagoides farinae, Dermatophagoides pteronyssinus y Blomia tropicalis es segura en diferentes alergias mediadas por IgE, y que para limitar al máximo las reacciones sistémicas graves se requiere que la indicación y aplicación sea realizadas conforme a las características de cada paciente y llevada a cabo por personal experto.











 nova página do texto(beta)
nova página do texto(beta)