Introducción
La actividad endotelial generada a partir de estados proinflamatorios y procoagulantes está directamente relacionada con inóculos mal regulados y coexistencias microbiológicas que exacerban el potencial protrombótico que involucran fenómenos biomoleculares generadores de vasculitis y apoptosis. Es bien conocida la relación entre infección viral e infección bacteriana; no obstante no es frecuente evidenciar tantos aislamientos virales como los encontrados en nuestra paciente potencializando inflamación, coagulación y apoptosis.
Presentación del caso
Paciente de 59 años de edad con cuadro clínico de una semana de evolución consistente en incremento del trabajo respiratorio y aumento de la clase funcional asociado a fiebre no cuantificada, sin antecedentes de importancia. Acude a centro de referencia donde presenta deterioro de los índices de oxigenación con requerimiento de ventilación mecánica, por lo que deciden remitirlo a unidad de cuidados intensivos (UCI). Ingresa a UCI con tensión arterial de 70/40, frecuencia cardiaca de 130 latidos por minuto, frecuencia respiratoria asistida por máscara Ambu, saturación de 85%, temperatura de 39 oC, bajo efectos residuales de sedación y relajación.
Como hallazgos de importancia al examen físico hipoventilación con crépitos bilaterales. Se plantea impresión diagnóstica de insuficiencia respiratoria aguda y neumonía adquirida en la comunidad grupo IV. Laboratorios de ingreso registrados en la Tabla 1.
Tabla 1: Laboratorios de ingreso.
| Química | Resultado | Hematología | Resultado |
|---|---|---|---|
| Nitrógeno ureico | 15 mg/dL | Glóbulos blancos | 22,500 x×mm3 |
| Creatinina | 0.8 mg/dL | Hemoglobina | 14 g/dL |
| Bilirrubinas totales | 0.8 mg/dL | Hematocrito | 42% |
| ASAT | 27 mg/dL | Plaquetas | 125,000 x mm3 |
| ALAT | 17 mg/dL | Tiempo protrombina | 31 segundos |
| Fosfatasa alcalina | 75 mg/dL | Tiempo trombina | 10 segundos |
| Troponina I | Negativa |
ASAT = aspartato aminotransferasa. ALAT = alanino aminotransferasa.
Monitoria de la ventilación mecánica con distensibilidades de 55 cm de agua, trabajo respiratorio de 12 Jouls por litro con meseta de 27 cm de agua y presión de conducción de 17 cm, razón por la cual se ajusta volumen tidal por peso predicho y se prefija presión positiva al final de espiración por bucle presión/volumen y meseta. Se avanza línea central subclavia derecha documentándose presión de fin de lleno subóptimas, saturación venosa de 45% con resistencias vasculares sistémicas de 480 dinas superficie corporal segundo adicionalmente con acidemia metabólica, hiperlactatemia y consumo severo de base exceso con predictores de bajo gasto y de hipoperfusión tisular con gradiente venoarterial de dióxido de carbono de 12 mm de mercurio y cociente metabólico anaeróbico en 2, motivo por el cual se inician terapias tempranas dirigidas por objetivos. Es llevada a escanografía de tórax, la cual reporta colapsos posterobasales con atelectasias e infiltrados intersticiales reticulares (Figura 1).

Figura 1: Escanografía de tórax. Infiltrados intersticiales segmento lateral y paracardiaco del lóbulo medio y língula, colapsos posterobasales más atelectasias subsegmentarias y colecciones pleurales bilaterales.
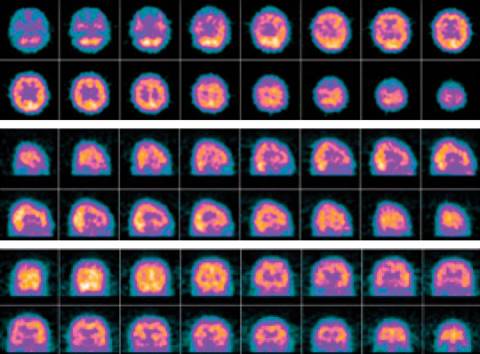
Paciente sin factores predictores de multidrogo resistencia, por lo que se inician betalactámicos más aminoglucósidos. Durante su estancia presenta disfunción cognitiva con CAM-ICU positivo con alteración mental, pensamiento desorganizado, inatención y conciencia fluctuante, lo que requirió despliegue de protocolo institucional de sedación dolor y deliro, adicionalmente hemiplejía izquierda con desviación de la comisura bucal y parálisis de la mirada conjugada hacia la derecha con escala de NIHSS (National Institute Health Stroke Scale) de 15; razón por la cual es llevada a escanografía de cráneo referida en la Figura 2.
Ante la evolución neurológica se inician estudios de extensión con ecocardiograma Doppler dúplex color transtorácico, el cual fue normal, así como estudio contrastado de cuatro vasos de cuello, Holter de ritmo eléctrico y perfil metabólico completo también normales; se reciben reportes de microbiología detallados en la Tabla 2; requiere escalamiento antibiótico, por lo cual se inicia glicopéptido más inhibidor de hemaglutinina y neuraminidasa.
Tabla 2: Panel viral respiratorio y lavado broncoalveolar.
| Reportes de microbiología lavado broncoalveolar y panel viral | |
|---|---|
| Perfil respiratorio viral: | |
| Método: inmunofluorescencia indirecta-IFI | |
| Muestra | Asp. Nasofaríngeo |
| Celularidad | ++ |
| Screening viral: pool 7 virus | Positivo |
| Virus sincitial respiratorio | Negativo |
| Parainfluenza 1 | Positivo |
| Parainfluenza 2 | Negativo |
| Parainfluenza 3 | Positivo |
| Influenza A | Negativo |
| Influenza B | Positivo |
| Adenovirus | Negativo |
| Cultivo de gérmenes comunes | |
| Muestra: | Lavado broncoalveolar |
| Cultivo: | Antibiograma |
| Se obtuvo crecimiento de: | |
| Staphylococcus aureus | |
| Clindamicina | Sensible |
| Cloranfenicol | Sensible |
| Eritromicina | Sensible |
| Oxacilina | Resistente |
| Penicilina | Resistente |
| Trimetoprima sulfametoxazol | Sensible |
| Vancomicina | Sensible |
| Tetraciclina | Sensible |
Ante los hallazgos escanográficos y la persistencia del síndrome motoneurona superior, se decide realizar tomografía cerebral con emisión de fotón único por medicina nuclear relacionada en la Figura 3. Evoluciona con recuperación de los índices de oxigenación y de ventilación sin deuda de oxígeno, bajo gasto ni sufrimiento mitocondrial, se realiza monitoria en asa cerrada documentándose compliance de 80 cm de agua, resistencias de 4 cm/L/s y presión elástica alveolar de fin de espiración de 1 cm de agua; con trabajo respiratorio de 0.5 Jouls por litro bajo asistencia proporcional de 30%, presión positiva al final de la espiración de 8 cm de agua y fracción inspirada de oxígeno de 32%, motivo por el cual se realiza prueba única de ventilación diaria en tubo en t definiéndose ausencia de predictores de falla de extubación, por lo que se decide liberar de la ventilación mecánica.
Debido a los resultados de medicina nuclear se realizaron estudios de hipercoagulabilidad documentados en la Tabla 3, por lo que se decide iniciar anticoagulación oral directa. Ante evolución clínica con recuperación de las escalas pronósticas neurológicas, se decide traslado a piso por medicina interna y neurología.
Tabla 3: Estudios de hipercoagulabilidad.
| Reportes de glicoproteínas e hipercoagulabilidad | |||
|---|---|---|---|
| Proteína S de la coagulación: actividad (funcional) | 41.0* | % | 52 a 118 |
| Proteína C de la coagulación: actividad (funcional) | 54.0* | % | 70 a 140 |
| Método: coagulometría | |||
| *Dato confirmado | |||
| Inhibidor del activador del plasminógeno (PAI1) | 35.80* | ng/mL | 1.0 a 25 |
| Método: inmunoensayo | |||
| * Dato confirmado | |||
| Dímero D | 10* | ng/dL | 0.5 |
| Método: técnica látex | |||
| * Dato confirmado | |||
Discusión
Al margen de la presentación clínica de la sepsis severa generada por la respuesta del huésped al antígeno y al patrón molecular de reconocimiento, existen escenarios inadvertidos que definen en la línea de tiempo y los desenlaces al interior de la unidad de cuidados intensivos; esta circunstancia se debe a mecanismos generadores de disfunción en la plasminogénesis, los cuales potencializan el riesgo protrombótico durante la sepsis. Está bien definido que la activación del mononuclear en la iniciación de la respuesta inmunitaria condiciona la liberación del factor tisular y la activación de trombina. Al mismo tiempo vías anticoagulantes asociadas al endotelio, principalmente el sistema de la proteína C, son alteradas por citocinas proinflamatorias, lo que asociado a la inactivación de sistemas endógenos fibrinolíticos dificulta seriamente la remoción de fibrina como resultado de una regulación en ascenso de su principal inhibidor, el inhibidor de la activación del plasminógeno tisular (IAP1). El incremento en la generación de fibrina y el depósito de coágulos en los capilares contribuyen directamente en la disfunción capilar y en la hipoperfusión tisular condicionando disfunción orgánica múltiple.1 El sistema de la proteína C, además de generar efecto anticoagulante mediante la inhibición del complejo trombina-trombomodulina y producir degradación, decantación y depuración de los factores V y VIII, regula la adhesión plaquetaria bajo ciertas circunstancias de flujo; además tiene un peso importante en la defensa del huésped frente al inóculo en virtud de la quelación in vitro del péptido microbiano circulante, propio de las enterobacterias tipo lipopolisacárido a partir de una esfingosina quinasa S1P-R1 fortaleciendo además la barrera de permeabilidad vascular.2
No menos importante es el sistema de la proteína S igualmente comprometido durante la sepsis, tiene implicaciones trascendentales durante el estrés oxidativo y la apoptosis, ya que es uno de los dos ligandos funcionales del monocito en la primera línea de defensa que condiciona señales intracelulares para la modulación de la quinasa 4 de la interleuquina 1(IRAK4), Toll-like receptor y factor de transcripción nuclear/Factor nuclear Kappa Beta.2 La pérdida del equilibrio en la hemostasis generada a partir de la disfunción del sistema de la proteína C aporta serios efectos deletéreos en relación con el control del inóculo, además de potencializar fases protrombóticas a partir del factor inhibidor de la fibrinólisis derivado de la trombina (TAFI, Thrombin Activatable Fibrinolysis Inhibitor, por sus siglas en inglés), el cual remueve residuos de lisina de los terminales carboxilos desde la fibrina, de este modo reduce el secuestro de plasminógeno en la matriz de fibrina necesario para ser eficiente la fibrinólisis.
Adicionalmente, el modulador alostérico de la trombina, la trombomodulina en su porción extracelular del dominio de la lectina resulta ser proinflamatoria en virtud del bloqueo de las anafilotoxinas C3a y C5a y el mediador vaso activo de las bradiquininas comprometiendo seriamente la opsonificación bacteriana. Por otro lado, este compuesto protrombótico y proinflamatorio condiciona la generación de receptores de productos finales de glicosilaminación (RAGE, por sus siglas en inglés) por los grupos de proteínas de alta morbilidad (HMGB1P), los cuales regulan el reclutamiento de los polimorfonucleares; la trombomodulina bloquea también la vía alterna del complemento promoviendo sus inhibidores endógenos; los factores del complemento H e I bloquean C3b y C4b.3-7
Más allá de la activación del monocito en la primera línea de defensa y sus efectos deletéreos en la coagulación, inflamación y apoptosis, también los patrones moleculares de reconocimiento están inmersos en estados de hipercoagulabilidad. Shin y colaboradores evidenciaron que el tratamiento con agonistas del Toll-like receptor 2 (TLR 2) marcados con peptidoglucano en células endoteliales humanas de cordón umbilical, células capilares de compartimentos pulmonares y células coronarias endoteliales, además de producir expresión en sus superficies de IL-6, IL-8 y E-selectina aumentando el reclutamiento de polimorfonucleares y el potencial trombogénico,8-11 generaban incremento del IAP1 y disminución en la activación del plasminógeno tisular y de los inhibidores de la vía del factor tisular. Estos estudios demostraron que la activación del TLR 2 por estructuras bacterianas está relacionada con fuga capilar en la sepsis e íntimamente ligada con vías de coagulación y activación de células endoteliales,12 Los marcadores de actividad fibrinolítica resultan ser una herramienta muy útil durante el abordaje diagnóstico en este tipo de pacientes, tal es el caso del dímero D, el cual está inmerso en síndromes sépticos por grupos específicos de inóculos como se documentó en nuestra paciente. Sin embargo, es trascendental tener en cuenta las condiciones de temperatura y de tiempo de transporte de los biomarcadores de actividad endotelial y actividad de coagulación para evaluar la hemostasis y la inflamación a partir de la interpretación del inhibidor de la activación del plasminógeno tisular y del dímero D, ya que fácilmente podrían presentarse falsos positivos y datos que se marginen de la realidad, como lo demostraron Palmer y colaboradores, quienes definen su periodo de latencia de análisis de 24 h a una temperatura de 4 oC.13
La coexistencia microbiológica entre enfermedades virales estacionales como precursoras de la sobreinfección bacteriana es muy frecuente y podría explicar en buena parte los aislamientos identificados en esta presentación. Una revisión realizada por Abramson y Mills documenta que uno de los primeros reportes de infección viral que podría incrementar la susceptibilidad a infecciones bacterianas fue publicado en 1908, asimismo la coinfección bacteriana fue asociada tempranamente con las muertes originadas por la pandemia de 1918 y cerca de 34% de las generadas por la pandemia de 2009 por el virus de la influenza A (H1N1). La coinfección bacteriana comúnmente ocurre en los primeros seis días de la infección viral por influenza y por lo general los aislamientos más frecuentes corresponden a Streptococcus pneumoniae y a Staphylococcus aureuss.14-17 Estas infecciones virales también están inmersas en escenarios de hipercoagulabilidad, oxidación y apoptosis a partir de la activación de patrones moleculares asociados a daño celular (DAMP) relacionados durante la respuesta del sistema innato inmunológico siendo determinantes de la severidad de la enfermedad y de la inflamación.
Existe evidencia que documenta la acumulación de fosfolípidos y de grupos proteicos de alta movilidad (HMGB1P) durante la infección por virus de la influenza que generan lesión pulmonar e importante disfunción hematológica y vasculitis.18 Patel y colaboradores demostraron en modelos animales que la administración de antagonista del Toll-like receptor 4 (TLR 4) durante el tratamiento del virus de la influenza (Eritoran) bloquea los patrones moleculares relacionados con daño celular aminorando el grado de lesión pulmonar.19
Teniendo en cuenta la estrecha relación entre inflamación y coagulación así como la importancia de conocer la predisposición genética, los diferentes grados de lesión y el tipo de respuesta del huésped resulta importante controlar rápidamente la carga antigénica y evitar disfunciones relacionadas que podrían llegar a generar desenlaces fatales. Sin embargo, en ciertos grupos de pacientes sin factores de riesgo de multidrogo resistencia resulta muy difícil predecir escenarios clínicos relacionados como en el caso de nuestra paciente.20-22
Conclusiones
Las manifestaciones protrombóticas y hemorrágicas en el contexto de las disfunciones hematológicas inmersas en los síndromes sépticos resultan ser un gran reto para el personal de atención medica al interior de las unidades de cuidados intensivos en virtud de la complejidad que implica su identificación certera y precoz, motivo por el cual se hace necesaria la sospecha clínica y diagnóstica sobre la base de la predicción casuística. Asimismo, la articulación entre respuesta innata inmunitaria con patrones moleculares de reconocimiento y péptidos microbianos sugestivos de ser reconocidos podrían ayudar al análisis en el plano diagnóstico como marcadores de afectación en la plasminogénesis y activación de fenómenos protrombóticos que impactan en desenlaces clínicos.











 nueva página del texto (beta)
nueva página del texto (beta)