Introducción
La pausa al final de la inspiración (PFI), también llamada «pausa inspiratoria», se ha utilizado desde la década de los 70 en pacientes con ventilación mecánica (VM) invasiva y ha tenido diversas aplicaciones: medir la presión meseta (Pmeseta) y establecer estrategias de ventilación protectora para el síndrome de distrés respiratorio agudo (SDRA), obtener información sobre la mecánica ventilatoria, e incluso como una herramienta para intentar mejorar el intercambio gaseoso; sin embargo, su uso es controvertido. En este artículo se abordan los mecanismos fisiológicos, fisiopatológicos y la recopilación de la evidencia actualizada sobre el uso de la PFI en VM.
La pausa al final de la inspiración
La PFI se realiza con el cierre de la válvula inspiratoria al final de la entrega del flujo aéreo y al ingreso de la totalidad del volumen corriente (Vt) a la vía respiratoria, y termina hasta que se abre la válvula exhalatoria, en este intervalo hay ausencia de flujo aéreo (flujo cero). Puede ser programada en modo ventilatorio controlado por volumen (VC-VM) de forma constante, es decir, ocasionando en cada inspiración obligatoria o asistida. Tradicionalmente se piensa que favorece una ventilación más homogénea al permitir una redistribución del gas en los alveolos a pesar de tener diferentes constantes de tiempo y propiedades resistivas y elásticas.1
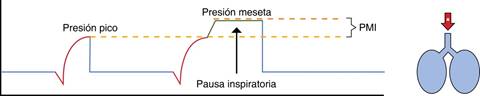
La PFI también puede realizarse de forma manual en cualquier momento en el paciente bajo VM cada que el clínico lo considere necesario con el fin de obtener información que contribuya a evaluar la mecánica respiratoria, de esta forma puede realizarse también en modos controlados por presión (PC-VM), ya sean controlados, asistidos o incluso espontáneos (Figura 1).2
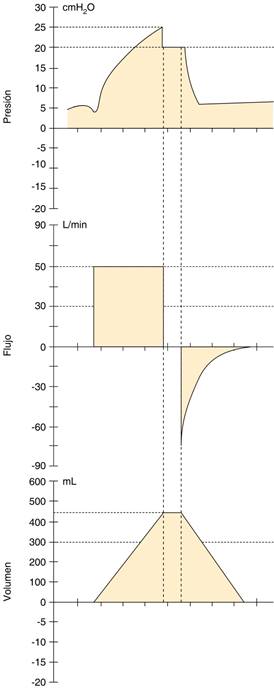
Figura 1: Curvas del ventilador mecánico en VM invasiva en modo asisto-control-volumen-. En la segunda curva (flujo-tiempo) se observa ausencia de flujo (cero flujo) posterior al flujo inspiratorio cuadrático, correspondiendo al tiempo de la PFI, esta ausencia de flujo genera que el Vt quede «atrapado» en el sistema respiratorio del paciente, que puede observarse en la tercera curva (Vt-tiempo), durante este lapso se puede observar la Pmeseta en la primera curva (presión-tiempo) correspondiente a 20 cmH2O.
Medición de la presión meseta y presión de distensión alveolar en el síndrome de distrés respiratorio agudo (SDRA)
La Pmeseta es el valor de la presión de la vía aérea abierta al realizar una PFI después de la oclusión de la vía aérea, posterior a la inspiración y en flujo cero. Su finalidad es la estimación de la presión alveolar (Palv) debido a que en ausencia de flujo al retirar la presión ejercida por la resistencia de la vía aérea (Raw), la -presión de la vía aérea (Paw) disminuye y en teoría sólo se medirá la presión ejercida directamente en los alveolos, que en un pequeño lapso permitirá mejor acomodación del aire ingresado en los acinos más distales, de tal forma que cuanto más presión se ejerza en los sacos alveolares por el aire ingresado, mayor Pmeseta se obtendrá. Los principales determinantes de la Pmeseta son el volumen corriente ingresado (Vt) de forma directamente proporcional y la distensibilidad del sistema respiratorio (Crs) de forma inversamente proporcional, de tal manera que a mayor Vt y menor Crs, mayor será la Pmeseta.3
Se requiere que no existan fugas en la vía respiratoria para que su medición sea fiable.3 Existe controversia sobre el tiempo en que debe medirse la Pmeseta durante la PFI, se han postulado de 0.2 a 0.5 s; sin embargo, existen opiniones de mantener la PFI hasta un periodo de estabilización y tomar esa medición como óptima (hasta 2 o 3 s),4 aunque si la presión se modifica en algún momento por el uso de los músculos espiratorios o inspiratorios del paciente no será útil dicha medición. En la práctica clínica se presentan dos opciones para medir la Pmeseta: 1) programar una PFI constante a cada ciclo respiratorio y 2) realizar una PFI manual cada que se requiera evaluar. Tradicionalmente se recomienda realizar al menos una PFI cada 12 h en síndrome de distrés respiratorio agudo (SDRA) para monitorear la Pmeseta y mantenerla < 30 cmH2O,5 pero recientemente se ha recomendado una meta < 27 debido a su asociación con menor mortalidad.6
La presión de distensión alveolar (DP, driving pressure) engloba el concepto del acomodamiento del Vt de acuerdo a una Cst dada, para su cálculo puede optarse por cualquiera de las siguientes fórmulas: 1) Vt/Cst y 2) Pmeseta - PEEP; la segunda fórmula facilita su medición debido a su simplicidad y a que existen interfaces de algunos ventiladores modernos que muestran su valor constantemente. Un incremento inapropiado del Vt, una Cst reducida y un PEEP que ocasione sobredistensión pulmonar puede elevar la DP, lo que se asocia a menor sobrevida en pacientes con SDRA. Mantener una DP < 13 a 15 cmH2O se asocia a menor mortalidad7 e incluso podría asociarse a una disminución en los días bajo VM.8
Cálculo de la distensibilidad estática del sistema respiratorio
La Crs y la elastancia (Ers) describen la facilidad o dificultad del sistema respiratorio para expandirse en respuesta a una presión y volumen. La Crs se define por el cambio en el volumen (ΔV) dividido entre el cambio en la presión (ΔP), mientras que la E se define por su opuesto: ΔP/ΔV. La distensibilidad pulmonar estática (Cst) implica un concepto de normalización de la medición de la distensibilidad toracopulmonar en pacientes intubados y bajo VM al realizar una PFI en un intento por suprimir la presión resistiva y medir el volumen de inflación pulmonar en dicho momento. El ΔV es el cambio del volumen pulmonar durante la inflación pulmonar menos el volumen pulmonar al final de la espiración. Un defecto del cálculo de la Cst es que no se recogen los cambios de distensibilidad que se observan con la aplicación de diferentes volúmenes corrientes.3
Los pacientes con SDRA por lo regular presentan valores de Cst < 40 mL/cmH2O y pueden disminuir los días siguientes al inicio de la VM; sin embargo, esto no se relaciona directamente con su pronóstico en cuestión de mortalidad.9 En la práctica clínica la medición de la Cst se realiza con la siguiente fórmula: Cst = Vt/Pmeseta-PEEP, debido a que el ΔV es el volumen corriente (Vt) que ingresa y egresa del sistema respiratorio a partir de 0 ml, es decir: ΔV = Vt-0 mL, entre la Pmeseta menos la presión positiva al final de la espiración (PEEP) que se encuentre programada, en caso de no colocar PEEP deberá sustituirse por 0 cmH2O. Si se mantiene programada una PFI constante a cada ciclo respiratorio, se ha recomendado que sea de 0.2 a 0.5 s, por lo regular los ventiladores mecánicos de tercera generación otorgan de esta forma la medición constante de la Cst. Recientemente se ha descrito la medición de la Cst sin necesidad de realizar PFI a través del gráfico de flujo-tiempo.10
Cálculo de la resistencia de la vía aérea
La Raw incluye el conjunto de la resistencia de las vías aéreas del paciente, la impuesta por el tubo endotraqueal y los equipos de medición, y la resistencia del tejido pulmonar y la caja torácica. Para su cálculo se requiere realizar una PFI para obtener el valor de la Pmeseta. La diferencia entre la Paw y la Pmeseta se conoce como presión transaérea (Pta) y se entiende como la presión resistiva al flujo de aire que ingresa en el sistema respiratorio. Los valores normales de la Pta en pacientes adultos son de aproximadamente 2.5 a 4 cmH2O.3 Asimismo, puede calcularse el valor de la Raw en pacientes con flujo inspiratorio constante con la siguiente fórmula: [Resistance = (Peak Pressure - Plateau Pressure) / Flow L/sec], donde Pmax es la presión inspiratoria máxima generada en el sistema respiratorio, medida al final de la entrega de flujo y previa a la PFI.11
Efectos de la PFI en la Pma y la oxigenación
Un efecto controvertido de la PFI es el incremento de la Pma y su repercusión en la difusión de oxígeno en la membrana alveolo-capilar. La presión media de la vía aérea en ventilación espontánea es en promedio de 0 cmH2O en ausencia de movimientos musculares inspiratorios y espiratorios, siendo ligeramente negativa en la inspiración (de -1 a -2 cmH2O) y positiva en la espiración (de 1 a 2 cmH2O). El gradiente de presión inspiratoria es producido por el diafragma, los demás músculos inspiratorios y el sistema pleural al crear una diferencia con presión barométrica. Durante la VM invasiva, la Pma está determinada por la PEEP, la DP y el tiempo inspiratorio (Tinsp). La fórmula simplificada de la Pma es la siguiente: Pma = PEEP + [(Pplateau-PEEP) × Tinsp].12 Por tanto, la pausa inspiratoria puede tener efecto de la Pma, pero dependerá del tiempo de pausa y de la relación de la inspiración con la espiración (I:E).
Un estudio comparó la repercusión en la difusión de oxígeno con el uso de PFI programada en 0.5 s con relación I:E de 1:3 s y se observó que la Pma tuvo un incremento con la PFI programada de forma continua contra los que no la tuvieron (9.7 ± 4 versus 8.8 ± cmH2O); sin embargo, no hubo diferencia significativa en el gradiente alveolo arterial de oxígeno (PA-aO2) con PFI contra los pacientes sin PFI (185.3 ± 86.5 versus 184.9 ± 84.9 mmHg).13 Por lo que se concluye que la PFI tiene un efecto en la presión media de la vía aérea bajo ventilación mecánica, pero no parece tener un efecto sustancial en la oxigenación.
PFI continua y aclaramiento de la PaCO2
En el paciente bajo ventilación mecánica invasiva se han propuesto diversas estrategias con el objetivo de disminuir la relación espacio muerto/volumen corriente (Vd/Vt) y presión parcial de dióxido de carbono (PaCO2) mediante la programación de una pausa al final de la inspiración (PFI) continua. Surge una interrogante de riesgo-beneficio, puesto que sigue siendo hasta el momento pragmático hacer una recomendación con evidencia de esta estrategia, si bien no conocemos los beneficios fisiológicos para mejorar la mecánica del sistema respiratorio, se intenta atribuir beneficio en pacientes con síndrome de dificultad respiratoria aguda (SDRA) como medida terapéutica ante un estado de hipercapnia (sin repercutir el pH), teniendo en cuenta que este escenario no es motivo de preocupación.14
Diversos grupos de trabajo han propuesto estudios buscando asociación entre una prolongación de la PFI como mejora en los niveles de PaCO2 y espacio muerto.15 Bajo la premisa de una difusión de CO2 dependiente del tiempo y la prolongación de la PFI aumentará el tiempo disponible para el intercambio gaseoso alveolar (Figura 1).15-17
Aguirre-Bermeo y colaboradores14 estudian una muestra poblacional que incluyó 13 pacientes con SDRA, a los cuales se programa una PFI prolongada (0.12 ± 0.04 a 0.7 s) otros parámetros como la fracción inspirada de oxígeno (FiO2), la presión positiva al final de la espiración (PEEP), el flujo inspiratorio y la frecuencia respiratoria se mantuvieron constantes; obteniendo la disminución en el Vd/Vt y la PaCO2 (0.70 ± 0.07 a 0.64 ± 0.08, p < 0.001 y 54 ± 9 a 50 ± 8 mmHg, p = 0,001), si bien existe una diferencia entre grupos por pruebas de hipótesis, no incluyen medidas de asociación que respalden los resultados de forma significativa.
Alain Mercat y colaboradores18,19 reportaron una serie de 16 casos con una prolongación de PFI (0.7-1.2 s) durante una hora con el cuidado de no incrementar el PEEPi, obteniendo un incremento en la presión media de la vía aérea (PVAm) (20.6 ± 2.3 frente a 17.6 ± 2.1 cm H2O, p < 0.01), a pesar de ello no mejoró significativamente la PO2, se observó una disminución de PaCO2 en 14 pacientes (PFI 0.2 s = 67 mmHg ± 13 PFI 0.7-1.2 s = 62 ± 13) sin cambios hemodinámicos asociados, es importante destacar que los resultados mostrados en las respectivas Tablas y gráficas del estudio sólo presentan diferencias entre grupos por prueba de hipótesis, pero no demuestran algo concluyente.
Devaquet y colaboradores20 extendieron el tiempo inspiratorio (de 0.7 ± 0.2 a 1.4 ± 0.3 s) aumentando el tiempo de pausa inspiratoria de 0 a 20%. Observaron que esta modificación disminuyó significativamente tanto el Vd/Vt (alrededor de 10%) como la PaCO2 (alrededor de 11%) con diferencia entre grupos por pruebas de hipótesis, sin medidas de asociación que refuercen la evidencia; sin embargo, la prolongación de la PIF puede conducir a efectos posiblemente adversos como la producción de AutoPEEP (PEEPi) y la inversión de la relación I/E junto con aumentos en la presión media de la vía aérea.
Hasta el momento no es pertinente aseverar que la programación de una PFI continua como intervención dinámica ante una alteración de la PaCO2, la evidencia disponible es contradictoria, no permite hacer recomendaciones a favor o en contra, ya que diversos factores podrían influir en la decisión.
Maniobra de pausa inspiratoria durante la ventilación espontánea: índice de presión muscular (IPM) DP transpulmonar dinámica
Un desafío durante la VM controlada es evitar la lesión pulmonar inducida por ventilación mecánica (VILI) mediante estrategias protectoras y progresar tan rápido como sea posible a la ventilación espontánea debido a sus beneficios bien conocidos como favorecer el proceso en el retiro del ventilador, prevenir la atrofia muscular y disfunción diafragmática.21-24 Sin embargo, en pacientes con un pulmón demasiado enfermo (p. ej. SDRA) los esfuerzos inspiratorios excesivos posiblemente sean deletéreos y pueden culminar en lesión pulmonar autoinfligida por el paciente (P-SILI, patient-self induced lung injury).21
El P-SILI en teoría podría generar daño pulmonar por sobredistensión en la zonas dependientes de gravedad y aledañas durante la VM invasiva espontánea, con riesgo de generar Vt elevado, incontrolado y posiblemente dañino por distribución anómala del flujo dentro de la vía respiratoria (pendelluft).23,25 En el modo ventilatorio espontáneo presión soporte (PSV) debe programarse según las necesidades del paciente y su demanda ventilatoria. La presión soporte (PS) es el principal parámetro, es la presión positiva generada al inicio del ciclo respiratorio del paciente para alcanzar un Vt objetivo.
Una estrategia novedosa descrita para identificar la PS ideal es a través de la maniobra de PFI para la cuantificación de esfuerzo inspiratorio del paciente sin la necesidad de herramientas específicas como el balón esofágico para medir la presión esofágica (Pes).26 Permite la evaluación del esfuerzo de los músculos inspiratorios, se determina índice de presión muscular (PMI, por sus siglas en inglés), presenta relación clínica y validación con la presión muscular al final de la inspiración, Pes, entre otros parámetros del trabajo respiratorio,27 además de que el PMI se ve influenciado directamente según el nivel de PS otorgado al paciente.26 Para su evaluación debe realizarse la diferencia entre presión de retroceso elástico del sistema respiratorio (PelRs) y la presión total aplicada a las vías respiratorias, de tal forma que la Paw es igual a la PEEP más la PS más la presión generada por los músculos inspiratorios al inicio de la inspiración, obteniendo la Pmáx. La PelRs puede estimarse mediante la Pmeseta que se realiza a través de la PFI medida en aproximadamente 0.5 a 2 s (Figura 2). Por tanto, el PMI es igual a la Pmeseta menos la Pmax. El valor ideal propuesto se describe en 2 a 6 cmH2O. Valores por debajo o arriba indicarían sobreasistencia o subasistencia ventilaroria respectivamente y en consecuencia miotrauma y P-SILI. A través de este índice se podría titular una PS adecuada.26,28,29
Asimismo, la PFI permite evaluar la driving pressure (DP) transpulmonar dinámica (ΔP L ) de manera confiable,29,30 esta presión indica la tensión pulmonar dinámica durante cada inspiración en ventilación espontánea,28,31 para su evaluación previamente se necesita la medición de la presión de deflección durante la oclusión (ΔPOCC) mediante una pausa espiratoria durante un solo esfuerzo inspiratorio o 5 s, que desenmascara el esfuerzo de músculos respiratorios y se genera una presión negativa que puede o no vencer la PEEP programada, una vez obtenida la ΔPOCC podrá estimarse la ΔPL y asimismo la presión muscular (Pmus)29-33 (Figura 3).
La manera convencional de titular la PS ha sido a través del Vt objetivo y la frecuencia respiratoria; sin embargo, podríamos optar por herramientas más sofisticadas que guíen el soporte respiratorio y la ventilación mecánica protectora espontánea e incluso la optimización de la sedación y ajuste durante la movilización temprana sin olvidar la clínica del paciente. La Tabla 1 resume las principales fórmulas y valores de referencia para una monitorización de la ventilación espontánea en pacientes bajo VM invasiva.
Tabla 1: Aplicaciones de la pausa al final de la inspiración en modo de ventilación con presión soporte.
| Prueba | Fórmula | Valor de referencia |
|---|---|---|
| Presión muscular (Pmus) | -0.75 x Δ POCC | > 15 cmH2O riesgo de miotrauma |
| Driving pressure transpulmonar dinámica | (Presión pico-PEEP) – (0.66 x Δ POCC) | > 20 cmH2O riesgo de PSILI |
| PMI/Índice de presión muscular | Presión meseta - presión pico | > 2 cmH2O sobre asistencia |
| > 6 cmH2O subasistencia |
Nota: la presión de deflección durante la oclusión (Δ POCC) siempre es un valor negativo.
Repercusión hemodinámica de la PFI y el incremento del TI
La interacción cardiopulmonar debe tomarse en cuenta en pacientes bajo VM debido a que el flujo venoso proveniente de la vena cava (VC) y las arterias pulmonares disminuye durante el TI en la VM con presión positiva, si bien los cambios de presión de la vía aérea (Paw) no generan repercusión significativa en el estado hemodinámico en sujetos sanos, los pacientes críticos serán más susceptibles a incrementos de la presión torácica.34 Por lo tanto, incrementar el TI con la PFI tendrá mayor repercusión en el retorno venoso (RV) y disminuye el gasto cardiaco (GC).35,36
Norstrom demostró que incluso incrementos pequeños de la Pma con la aplicación de PFI disminuyen levemente el GC y la tensión arterial sistémica (TA).34 El incremento en el TI tiene mayor repercusión en pacientes con disminución previa del GC, por ejemplo, en condición de hipovolemia.37 Debe tomarse en cuenta que un incremento del TI al aplicar una PFI de 0.3 s con una frecuencia respiratoria (FR) de 15 por min incrementa el tiempo de presión positiva intratorácica sostenida hasta 4.5 s por min, 4.5 min por h y 108 min en 24 h, lo que en teoría podría repercutir hemodinámicamente en ese lapso; sin embargo, los efectos cardiovasculares netos de esta aseveración se desconocen.
Discusión
La PFI nos permite medir la Pmeseta, meta clave de la ventilación protectora en SDRA, asociada a mortalidad en valores > 27 a 30 cmH2O, por lo que se recomienda medir al menos una vez cada 12 h,5 aunque podría considerarse medirla de manera más frecuente en caso de existir cambios significativos en la mecánica ventilatoria del paciente como disminución de la Cst o modificaciones en el Vt o PEEP. La medición puede hacerse de forma simple con el comando de pausa inspiratoria manual en una duración de 0.2 a 3 s.3
La medición de la Cst con la PFI puede brindar información de la mecánica ventilatoria en SDRA, por lo que se puede considerar su monitoreo desde el inicio de la ventilación invasiva y mientras ésta se mantenga, estos pacientes comúnmente presentan valores < 40 mL/cmH2O; sin embargo, la utilidad pronóstica del valor del Cst no está bien establecida,9 debido a que puede presentarse una disminución posterior a los primeros días de VMI y después observarse un incremento de la misma con la resolución de la enfermedad.
Mantener una PFI en cada ciclo respiratorio podría contribuir al decremento de la PaCO2, por lo que podría considerarse su uso en patologías que ocasionen hipercapnia de difícil tratamiento, siempre y cuando se mantengan estrategias de liberación del aire atrapado y metas de protección pulmonar en caso de SDRA que se acompañe de hipercapnia; sin embargo, hacen falta estudios aleatorizados controlados que puedan confirmar esta aseveración. Esta estrategia no está considerada en las guías formales de manejo del SDRA.3
A pesar de que existen estudios experimentales que asocian una disminución del GC e hipotensión con el uso de PFI,34 su repercusión clínica en pacientes graves bajo VMI no está bien esclarecida. En condiciones de hipovolemia o compromiso severo del RV (p. ej. hemorragia grave, reanimación cardiopulmonar, embolismo pulmonar agudo, etcétera) sería preferible no utilizarla.38
Conclusión
La PFI es una herramienta que nos permite medir la Pmeseta y brindar información sobre la mecánica ventilatoria y guiar una estrategia de ventilación protectora en SDRA. A pesar de que se ha observado una disminución con el uso de la PaCO2, se requieren amplios ensayos clínicos para establecer una recomendación sobre su uso, asimismo no existen estudios que avalen el uso de PFI para mejoría de la oxigenación y mortalidad. Por último, el efecto de la repercusión hemodinámica con el uso de la PFI ha sido demostrado en estudios experimentales; sin embargo, su impacto en pacientes graves bajo VM no está bien determinado.











 nueva página del texto (beta)
nueva página del texto (beta)