Introducción
El daño cerebral traumático (DCT) se considera la principal causa de incapacidad y muerte en la edad pediátrica, entre 1 y 7% de los menores de 18 años son afectados por esta causa en el mundo.1 En los Estados Unidos 1.7 millones de adultos y niños son atendidos por esta patología cada año, de ellos 30% se producen entre cero y 14 años2 y cerca de 500,000 visitan los departamentos de urgencias médicas.3 Los fenómenos responsables de la mortalidad son en gran número de ellos la hipertensión intracraneal (HTIC) y la hipotensión arterial.4
El traumatismo craneoencefálico grave (TCEg) se asocia con frecuencia a lesiones traumáticas y no traumáticas del sistema respiratorio, que provocan una reducción de la presión arterial de oxígeno (PaO2)5 y retención de dióxido de carbono, lo que puede requerir del uso de la ventilación artificial mecánica (VAM) para su corrección.6 La VAM permite utilizar estrategias terapéuticas como la hiperventilación moderada y transitoria para lograr valores de presión arterial de dióxido de carbono (PaCO2) entre 30-35 mmHg, que asociado con la mejoría de la PaO2, desencadena vasoconstricción cerebral y de esta forma se disminuye el flujo sanguíneo cerebral (FSC) y también se puede reducir la presión intracraneal (PIC).7 Esta maniobra representa una de las medidas de primera línea para el control de la HTIC.8
Por otro lado, la necesidad de VAM en la mayoría de los enfermos con TCEg propicia la aparición de complicaciones relacionadas con la asistencia sanitaria como las neumonías asociadas con la ventilación (NAV)9 y otras infecciones.
Después de un TCEg, los mecanismos de defensa del paciente se encuentran alterados, deprimidos, lo que aumenta el riesgo de aparición de infecciones oportunistas, lo que a su vez genera que se comporte como una enfermedad anergizante.10 A nivel pulmonar generalmente se produce disminución de la capacidad vital y de la capacidad residual funcional, lo que facilita el desarrollo de atelectasias, diversos grados de alteración de la permeabilidad vascular y edema pulmonar no cardiogénico.11
Todos estos factores en su conjunto facilitan el desarrollo de hipoxemia, que requiere para su corrección de niveles de presión positiva al final de la espiración (PEEP), la que recluta alvéolos y disminuye el shunt intrapulmonar; sin embargo, provoca alteraciones hemodinámicas, incrementa la PIC y disminuye la presión de perfusión cerebral (PPC) por aumento de la presión intratorácica y reducción del retorno venoso.6,12
El objetivo del presente estudio fue identificar la relación entre el empleo de la PEEP y el comportamiento subsecuente de la PIC y la PPC en el paciente pediátrico crítico con TCEg, en la Unidad de Cuidados Intensivos Pediátricos (UCIP) del Hospital General Provincial Docente «Roberto Rodríguez» de Morón, Ciego de Ávila, Cuba.
Material y métodos
Se realizó un estudio descriptivo, prospectivo de los pacientes pediátricos (de un mes de nacidos hasta 17 años) atendidos en la UCIP del Hospital General Provincial Docente «Roberto Rodríguez» de Morón, Ciego de Ávila, Cuba, por un TCEg en el periodo de enero de 2003 a diciembre de 2017, quienes durante su evolución presentaron hipoxemia por diferentes causas y fue necesario aplicar diversos niveles de PEEP durante la ventilación para su corrección.
Se consideró TCEg a todo paciente con lesión traumática craneal y escala de coma de Glasgow (ECG) entre tres y ocho puntos. A todos los casos se les realizó monitorización de la PIC a través de una ventriculostomía lateral al exterior del lado más afectado, determinado por clínica o por tomografía axial computarizada (TAC).
Debido a la necesidad de particularizar los umbrales de tratamiento de la PIC en diferentes edades pediátricas,13-15 los pacientes se dividieron de acuerdo con los valores de la PIC promedio para cada grupo de edad establecidos por los autores. Lactantes: valores normales de 3-6 mmHg, se dividieron en a) menor de 6 mmHg y b) mayor de 6 mmHg. De uno a 14 años valores normales de 3-10 mmHg, se divide en: a) menor de 10 mmHg y b) mayor de 10 mmHg. Los niños entre cinco y 17 años valores normales de 7-15 mmHg se dividen en: a) menor de 15 mmHg y b) mayor de 15 mmHg.
Todos los pacientes fueron ingresados en la UCIP bajo régimen de ventilación artificial mecánica (VAM), con modalidad volumen control regulado por presión (VCRP) y parámetros ventilatorios para inicio de la VAM con volumen tidal (VT) entre 5-7 mL/kg de peso, frecuencia respiratoria (Fr) acorde a la edad, PEEP de 6 cmH2O, relación I/E 1:2 y FiO2 de 0.5%.
Se realizó la sedoanalgesia con benzodiacepinas de acción corta (midazolam) con dosis de 0.3-0.6 mg/kg/h y opiáceos (fentanilo) de 3-6 µg/kg/h, ambas en infusión continua para lograr un nivel de sedación profundo y de esta forma garantizar una oxigenación cerebral adecuada por encima de 90 mmHg.
Al ingreso se aplicaron las medidas de primer nivel para el control de la PIC según protocolo de manejo del TCEg7 en forma escalonada y aditiva, que incluyen además de la sedoanalgesia antes descrita, el drenaje de líquido cefalorraquídeo (LCR) a razón de 5 mL cada 15 minutos, hasta cuatro veces en una hora, manitol 20% entre 0.25-1 g/kg de peso por dosis o solución salina hipertónica al 3% entre 6-10 mL/kg/dosis/cuatro h.
También se empleó la hiperventilación moderada transitoria (PaCO2 entre 30-35 mmHg), bloqueo neuromuscular con vecuronio 0.1 mg/kg/h en infusión continua, además del uso de la craniectomía descompresiva (CD) en los casos indicados, utilizada según el protocolo de manejo del servicio de neurocirugía como medida de primer nivel. A los casos en los cuales no se controlaron las cifras elevadas de PIC, se les aplicaron las medidas de segunda línea de tratamiento.7
Para calcular la PPC adecuada para cada grupo de edad se consideraron los valores inferiores de presión arterial media (PAM) permisibles, por debajo de los cuales existiría riesgo de hipoxemia y los valores máximos de PIC para cada grupo de edad, por encima de los cuales existiría riesgo de desarrollo de algún tipo de herniación cerebral, considerando óptimos: para los lactantes y niños hasta cuatro años: 47 mmHg, por lo que los resultados se dividieron en a) menores de 47 mmHg y b) mayores de 47 mmHg y para los niños entre cinco y 17 años la cifra normal es 50 mmHg, por lo que también fueron divididos en a) menores de 50 mmHg y b) mayores de 50 mmHg.
En los pacientes que mostraron PPC disminuida por debajo del umbral considerado como normal para su grupo de edad, se controlaron las causas: ante incrementos de la PIC se utilizaron las medidas de control de primer y segundo nivel descritas anteriormente. La disminución de la tensión arterial media (TAM) se controló con el uso de fluidoterapia, de preferencia solución salina 0.9% a 20 mL/kg de peso por dosis o solución salina hipertónica 3% en las dosis antes señaladas, sobre todo en los casos que mostraron cifras elevadas de PIC coexistentes con hipovolemia. En los casos en los que la hipotensión arterial se hizo refractaria, se asociaron al tratamiento vasopresores como la norepinefrina de 0.1-1 µg/kg de peso por minuto, una vez restablecida la volemia.
Los valores de PEEP empleados al inicio de la VAM hasta la identificación de las causas de la hipoxemia (SO2 menor de 90 mmHg y PaO2 por gasometría menor de 70 mmHg) fueron calculados a 6 cmH2O. Posteriormente, se planificó un incremento de 2 cmH2O cada minuto, comprobando antes y después los valores de PIC y de PPC así como la SaO2, PaO2 y la relación SaO2/FiO2.
El universo estuvo representado por 41 casos portadores de TCEg y la muestra quedó constituida por 19 casos que desarrollaron hipoxemia durante su evolución y necesitaron del uso de PEEP en algún momento de su periodo de ventilación artificial.
Todos los pacientes a los que se les aplicó PEEP, mostraban PIC y PPC normal para cada grupo de edad y presentaban estabilidad hemodinámica. A los menores de un año no se les planificaron cifras de PEEP mayores de 10 cmH2O.
Cuando la PEEP provocó incrementos de la PIC, se aplicaron las medidas de tratamiento apropiadas en cada caso y se detuvo el escalamiento en la maniobra ventilatoria. Si la PPC estaba disminuida se corrigieron las causas y se mantuvo la PEEP, siempre que no fuera por aumento de la PIC. En los casos que presentaban ECG de tres puntos y/o cifras de PIC por encima del umbral a pesar del tratamiento, se realizaron otras estrategias terapéuticas para mejorar la oxigenación.
Los enfermos fueron distribuidos según variables como la edad y el sexo, ECG al ingreso, causas responsables de la hipoxemia, valores de PIC y PPC después de aplicarles PEEP de 8, 10, 12, 14 y 16 mmHg, SO2 al inicio y final de la PEEP, relación ECG al ingreso y resultados según la escala de resultados de Glasgow (ERG) al egreso.
Los datos se recogieron en una hoja de compilación de datos, éstos fueron obtenidos de los expedientes clínicos y de las hojas de problemas de la unidad de cuidados intensivos desde la admisión hasta su egreso del centro y toda esta información fue vertida en una base de datos creada por los autores en el sistema SPSS versión 20 para su análisis, utilizando el porcentaje como manera de resumen y se aplicó la prueba de bondad de ajuste del χ2 a algunas variables. Los resultados se expresan en Tablas y gráficos para su mejor comprensión.
El seguimiento se realizó mensual en las consultas externas de neurocirugía los primeros seis meses, luego de forma trimestral y semestral dependiendo del estado del paciente hasta los dos años cuando fueron considerados definitivamente como alta médica.
A todos los pacientes (padres y/o tutores) al ingresar en la UCIP se les llenaron las planillas de consentimiento informado para procedimientos y tratamientos a utilizar, con énfasis en las ventajas, desventajas y complicaciones de cada uno de ellos en el paciente con TCEg ingresado en las unidades de atención al adulto grave. El estudio fue aprobado por el Comité de Ética de la Investigación y del Consejo Científico del Hospital Morón y cumple con las directrices establecidas para los estudios en humanos. Se mantendrán los procedimientos éticos en cuanto a la confidencialidad de los resultados.
Resultados
Se estudiaron 19 niños que sufrieron TCEg, a los cuales por diferentes causas se les asoció hipoxemia requiriendo VAM y el uso de PEEP. El grupo de edades predominante fue el de cinco a 17 años con 14 niños (73.68%) (p < 0.001), seguido del de uno a cuatro años con tres (15.79%) y los menores de un año, dos (10.53%).
En relación al sexo tuvimos 14 masculinos (73.68%) (p < 0.39) y cinco femeninos (26.32%).
Del total de casos, nueve (47.36%) ingresaron con una ECG de ocho puntos, tres (15.79%) entre seis y siete puntos, cinco (26.32%) entre cuatro y cinco puntos y dos (10.53%) con tres puntos.
Después del tratamiento inicial para el control de la PIC se observó que 16 pacientes (84.21%) de los tres grupos tenían valores de PIC por debajo del umbral considerado como normal para su edad y sólo tres (15.79%) mostraban valores elevados, estos últimos no continuaron con la maniobra y se establecieron otras estrategias ventilatorias para mejorar la oxigenación (Figura 1).

Figura 1: Valores de la presión intracraneal después del tratamiento inicial. Fuente: Historias clínicas.
Las causas de hipoxemia encontradas fueron la NAV en 12 niños (63.15%), atelectasias en cuatro (21.05%), contusiones pulmonares en cuatro (21.05%), síndrome de distrés respiratorio agudo (SDRA) en tres (15.78%) y otras etiologías en dos casos (10.52%) (n = 19).
Los incrementos de la PEEP de ocho y 10 cmH2O no modificaron la PIC ni la PPC en ningún grupo etario; 14 niños (87.50%) requirieron incrementar la PEEP a 12 cmH2O, los dos lactantes no necesitaron de escalamiento en la maniobra. De estos 14, en el grupo de uno a cuatro años, uno (7.14%) incrementó la PIC y disminuyó la PPC. En el grupo de cinco a 17 años, un paciente (7.14%) mostró incremento en la PIC y en tres (21.43%) se evidenciaron caídas en la PPC, incluyendo el paciente que tuvo ascenso de las cifras de PIC.
Necesitaron continuar escalando en los valores de PEEP hasta 14 cmH2O, 12 niños (85.71%). De éstos, uno (8.33%) en el grupo de uno a cuatro años presentó un incremento de la PIC y disminución de la PPC y los otros 11 (91.67%) pertenecían al grupo entre cinco y 17 años. Dos (16.67%) mostraron aumento de la PIC y cinco (41.67%) disminución de la PPC, incluidos los dos que presentaron elevación de la PIC.
Escalaron a 16 cmH2O de PEEP nueve casos (56.25%), todos en el grupo de cinco a 17 años. En cuatro enfermos de nueve (44.44%), los valores de PIC ascendieron por encima de 15 mmHg y la PPC disminuyó por debajo de los valores normales para el grupo de edad en todos los pacientes (100%) (Tablas 1 y 2).
Tabla 1: Relación de la presión positiva al final de la espiración sobre la presión intracraneal en el paciente con traumatismo craneoencefálico grave.
| Pacientes (n) | PEEP | Presión intracraneal (mmHg) | |||||
|---|---|---|---|---|---|---|---|
| < 1 año | 1-4 años | 5-17 años | |||||
| < 6, n (%) | > 6, n (%) | < 10, n (%) | > 10, n (%) | < 15, n (%) | > 15, n (%) | ||
| 16 | 8 | 2 (12.50) | — | 2 (12.50) | — | 12 (75.00) | — |
| 16 | 10 | 2 (12.50) | — | 2 (12.50) | — | 12 (75.00) | — |
| 14 | 12 | — | — | 1 (7.14) | 1 (7.14) | 11 (78.58) | 1 (7.14) |
| 12 | 14 | — | — | — | 1 (8.33) | 9 (75.00) | 2 (16.67) |
| 9 | 16 | — | — | — | — | 5 (55.56) | 4 (44.44) |
PEEP = presión positiva al final de la espiración.
A los menores de un año se les aplica la presión positiva al final de la espiración hasta 10 cmH2O.
Fuente: historias clínicas.
Tabla 2: Relación de la presión positiva al final de la espiración sobre la presión de perfusión cerebral en el paciente con traumatismo craneoencefálico grave.
| Pacientes (n) | PEEP | Presión de perfusión cerebral (mmHg) | |||||
|---|---|---|---|---|---|---|---|
| < 1 año | 1-4 años | 5-17 años | |||||
| < 47, n (%) | > 47, n (%) | < 47, n (%) | > 47, n (%) | < 50, n (%) | > 50, n (%) | ||
| 16 | 8 | — | 2 (12.50) | — | 2 (12.50) | 1 (6.25) | 11 (68.75) |
| 16 | 10 | — | 2 (12.50) | — | 2 (12.50) | 1 (6.25) | 11 (68.75) |
| 14 | 12 | — | — | 1 (7.14) | 1 (7.14) | 3 (21.43) | 9 (64.29) |
| 12 | 14 | — | — | 1 (8.33) | — | 5 (41.67) | 6 (50.00) |
| 9 | 16 | — | — | — | — | 9 (100.00) | — |
PEEP = presión positiva al final de la espiración.
A los menores de un año se les aplica la presión positiva al final de la espiración hasta 10 cmH2O.
Fuente: historias clínicas.
La oxigenación medida a través de la SO2 sistémica capilar comienza a mejorar cuando los niveles de PEEP se encuentran por encima de 12 cmH2O. En seis casos de nueve (66.67%) en los que los niveles de PEEP fueron de 16 cmH2O, la oxigenación ascendió por encima de 90 mmHg (Figura 2).

Figura 2: Valores de la saturación de oxígeno con diferentes niveles de presión positiva al final de la espiración. Fuente: historias clínicas.
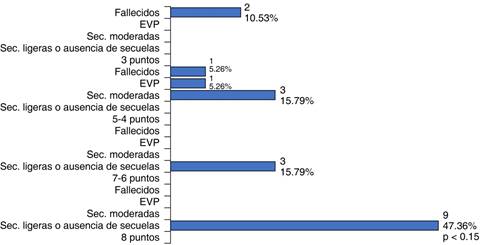
Al evaluar la relación entre la ECG y la ERG se evidenció que todos los pacientes con ECG de ocho puntos, nueve niños (47.36%) (p < 0.15), presentaron una ERG grado V, y de los niños con ECG tres puntos, todos fallecieron (ERG grado I) (Figura 3).
Discusión
A lo largo de los años, se han descrito múltiples efectos tanto positivos como negativos del uso de PEEP. Entre los positivos se encuentran la mejoría en la oxigenación, la corrección de las atelectasias, la disminución del daño pulmonar inducido por el ventilador y de la NAV.16 Los negativos están relacionados con la reducción del gasto cardiaco por disminución de la precarga del ventrículo derecho,17 el desarrollo de volutraumas, el aumento en la presión intratorácica, el deterioro hemodinámico, la elevación de la PIC y la caída de la PPC.16
La aplicación de PEEP es necesaria en el paciente con hipoxemia y el tratamiento personalizado requiere del control estricto de la PIC y la PPC para su uso si se presenta en pacientes con TCEg.
El grupo etario más afectado en la serie fueron los niños entre cinco y 17 años, condición que los autores relacionan con la disminución de la custodia por parte de los padres, el desarrollo de autonomía propia en los adolescentes y la falta de percepción del peligro a estas edades.
El sexo masculino predominó en este estudio, lo que coincide con Vaughan KA y colaboradores,1 que se explica por la hiperactividad propia de los varones y la participación de éstos en actividades más arriesgadas en relación con las hembras, lo cual puede predisponer la ocurrencia de traumatismos.
El predominio de la ECG al ingreso de ocho puntos en esta serie pudo influir en los resultados. Es conocido que los pacientes con mejor puntaje de esta escala tienen mejor pronóstico en relación con aquéllos que muestran puntajes deprimidos, por lo que se considera el estado clínico al ingreso como uno de los factores predictivos de mortalidad más relevantes en esta enfermedad.8,18
En 84.2% de los casos se alcanzó el control precoz de la PIC con las medidas de primer nivel incluyendo la CD, lo que condujo a que se lograran adecuados valores de PPC y PAM, con lo cual se mantuvo un flujo sanguíneo cerebral óptimo, se evitaron episodios de isquemia e hipoxia cerebral no deseados, los cuales se describen con frecuencia en estos pacientes y han sido documentados por otros autores.18,19
Las neumonías, las atelectasias, los traumas, el SDRA y el tromboembolismo pulmonar se han descrito como causas de hipoxemia,20 lo que coincide con lo encontrado en nuestra serie. Según Díaz21 y su equipo, las NAV tienen como factor de riesgo el TCEg, la sedación profunda, los estados postquirúrgicos y la inmunosupresión, todos presentes en estos pacientes, a la vez que pueden ser un factor desencadenante de SDRA.
La extrapolación de los resultados obtenidos en pacientes adultos sobre los efectos de la PEEP en la PIC y la PPC a pacientes pediátricos no es adecuada por las diferencias fisiopatológicas entre niños y adultos, la interrelación entre los sistemas respiratorio y neurológico aún no se evalúa en éstos, aunque se conoce que existe una tolerancia cardiovascular elevada para soportar las altas presiones en las vías aéreas de los infantes por disímiles razones.12
Belda y colegas informaron que no existen incrementos de la PIC ni caída de la PPC cuando los niveles de PEEP son menores de 10 cmH2O. Cuando los valores se encontraron entre 10 y 15 cmH2O provocaron aumentos de la PIC; sin embargo, la PPC se mantuvo en todos los casos por encima de 60 mmHg y no se modificó con incrementos de la PEEP.22
En un estudio realizado por Solodov y colaboradores se observó un incremento de la PIC y disminución de la PPC con valores de PEEP por encima de 20 cmH2O en pacientes con hemorragia intracraneal.23 Según McGuire y su equipo, incrementos de PEEP de 10 y 15 cmH2O provocaron elevación de la PIC,24 con lo cual estamos de acuerdo.
En el TCEg con PaCO2 elevada, la sobredistensión alveolar producida al aplicar PEEP genera incrementos de la PIC, velocidad de flujo Doppler, saturación de oxígeno en el golfo de la yugular y la PaCO2; sin embargo, el reclutamiento alveolar logrado con la PEEP provoca una caída de la PaCO2, mejoramiento de la oxigenación cerebral por incremento de la PaO2, vasoconstricción y disminución del volumen circulante intracraneal, y por esta causa disminución o escaso efecto en la PIC, por tal motivo podemos inferir que los efectos de la PEEP dependen en gran medida de la mecánica pulmonar de cada paciente.25
Nemer y colegas mostraron la influencia directa de la PEEP en la saturación de oxígeno y en la presión parcial de oxígeno tisular, considerándola una alternativa que mejora la oxigenación y no influye en la PIC y la PPC.26
En esta serie se encontró que la PIC aumentó por encima de los valores normales cuando las cifras de PEEP se incrementaron por encima de 12 cmH2O, valor ligeramente superior a lo informado por otros autores,27 lo que los autores relacionan con el efecto de reacomodación intracraneal obtenido con la craniectomía descompresiva y con los mecanismos buffer presentes en los infantes.
La relación PaO2/FiO2 se considera un índice que permite evaluar el intercambio de oxígeno a nivel pulmonar, aunque entre ellas no existe una relación lineal (PaO2/FiO2 y FiO2), ya que la primera puede evidenciar diferentes comportamientos para diferentes valores de FiO2,28 dicha relación se modifica ante diferentes valores de PEEP.
Según Sánchez Casado y colaboradores, con esta herramienta se puede infravalorar la intensidad del daño pulmonar y la respuesta verdadera ante diferentes niveles de PEEP, mientras que el gradiente alvéolo-arterial de O2 es el que identifica de forma útil las alteraciones entre el capilar y el alvéolo y su respuesta ante el uso de PEEP.29 Otros autores utilizan el índice de oxigenación (PaO2/FiO2 x presión media respiratoria)30 para determinar el grado de oxigenación.
Existen múltiples estudios donde se utiliza la relación PaO2/FiO2 para conocer la oxigenación después de la aplicación de PEEP.11,20,22,28,29,31 Los autores de este manuscrito siguen la SaO2 que resulta de fácil y rápida aplicación y puede ser obtenida en la cabecera del enfermo.
Para los incrementos de la PIC y la caída de la PPC provocados por niveles de PEEP superiores a 12 cmH2O se utilizaron estrategias terapéuticas. La elevación de la PIC fue revertida con la elevación del nivel de terapia intensiva (TIL) disminuyendo la PEEP. La caída de la PPC respondió al aporte de fluidos, al uso de vasopresores y a la reducción de los niveles de PEEP. Ambos métodos sin influencia en la mortalidad.
La mortalidad estuvo estrechamente relacionada con el estado clínico de los pacientes al ingreso, donde se pudo confirmar que los casos con ECG en tres puntos y valores de PIC elevados por encima de los normales y refractaria al tratamiento fueron los más afectados.
Conclusiones
En el presente estudio predominaron las secuelas ligeras o la ausencia de secuelas y sólo tres casos fallecieron. Una limitación de los resultados obtenidos fue el tamaño pequeño de la muestra, lo que no permitió establecer conclusiones definitivas y nos conduce a recomendar el diseño de otros estudios sobre el tema.
Como conclusiones podemos plantear que el uso de PEEP para corregir la hipoxemia en el paciente pediátrico con daño cerebral grave de origen traumático es una alternativa terapéutica aplicable, siempre que se cuente con monitorización continua de la PIC y la PPC. La corrección de la HIC y la inestabilidad hemodinámica son condiciones indispensables para la implementación de una adecuada estrategia ventilatoria. Los incrementos progresivos de la PEEP por encima de 12 mmHg provocan aumento de la PIC y caída de la PPC, lo que tiene influencia directa en los resultados.











 nueva página del texto (beta)
nueva página del texto (beta)