Introducción
Se ha identificado en los pacientes con COVID-19 que existe una respuesta inflamatoria muy severa asociada a la sepsis, por lo que es de interés analizar los parámetros de laboratorio que permitirían identificar oportunamente dicha respuesta inflamatoria, así como si el volumen medio plaquetario (VMP) puede ser un indicador temprano de mortalidad en dicha población a fin de realizar las intervenciones que permitan mejorar la condición del paciente.
Un porcentaje considerable de casos de pacientes con sepsis se podrían evitar mediante la aplicación de prácticas de buena higiene, lavado de manos, partos en ambientes limpios, y a través de las mejoras en el saneamiento y nutrición (especialmente entre niños menores de cinco años), la provisión de agua limpia y potable en zonas de bajos recursos, y los programas de vacunación para poblaciones en riesgo.1-3
La incidencia y prevalencia de la sepsis dependen de las definiciones y registros que se utilicen. En México, el estudio de Carrillo en el 2009, describió el comportamiento de la sepsis en nuestro país en el que incluyeron 135 Unidades de Cuidados Intensivos (UCI) públicas y privadas de 24 estados de la República Mexicana; de los 49,957 internamientos anuales se presentaron 11,183 casos de sepsis (27.3%), la mortalidad por esta causa fue de 30.4%.2,3 Las causas más frecuentes fueron: abdominal 47%, pulmonar 33%, tejidos blandos 8%, vías urinarias 7% y misceláneas 5%.1,2
Desde luego, la mortalidad total depende de la incidencia de choque séptico, que es alrededor de 35 a 45% de los pacientes con dicho diagnóstico.2 La mortalidad total por hospital para la sepsis es de cerca de 40%, lo que significa cerca de 215,000 muertes anuales en EUA y sitúa a este síndrome en el décimo lugar entre las causas de muerte en ese país.1,2,4
En un estudio reciente de Vélez, realizado del 1o de enero de 2011 al 31 de diciembre de 2017, hubo 1,544 ingresos a la UCI de su hospital y 42.81% tuvieron entre sus diagnósticos: sepsis, infección severa (según la definición previa) y choque séptico, con una media de 9.64 días de estancia, casi el doble de la estancia promedio actual de la UCI; también se observa que 33.28% fallecieron.5 Si se estima el costo real por día de estancia en la UCI en un hospital de tercer nivel con el tabulador del Instituto Mexicano del Seguro Social (IMSS) de 2019, que es de $34,232 pesos por día, entonces se calculan $218’127,673.28 pesos en dicho periodo de tiempo, $36’354,612.21 pesos anuales en una UCI de apenas nueve camas.5
En la actualidad, existe una serie de marcadores biológicos de sepsis ampliamente descritos; sin embargo, su susceptibilidad es variable, siendo algunos como la interleucina 6 (IL-6) capaces de señalar en general la magnitud del proceso inflamatorio, independientemente si hay o no infección; mientras que otros (como la detección de endotoxinas o proteínas que ligan lipoproteínas), marcan la presencia de infección, pero no la respuesta del enfermo infectado.4
Un biomarcador anatómico poco utilizado, pero reportado en los hemogramas rutinarios, es el volumen medio plaquetario (VMP), que ha demostrado su utilidad en el pronóstico de estados inflamatorios-trombóticos-metabólicos como eventos isquémicos cerebrales y cardiacos.6-8 En el pasado, su uso se limitaba al diagnóstico de alteraciones plaquetarias inusuales; no obstante, en la actualidad ha adquirido gran importancia en patología clínica.6,9,10
La detección temprana de sepsis progresiva sería útil como estratificación del riesgo, monitoreando la progresión de la enfermedad y la eficacia terapéutica.11 Aunque los estudios recientes han intentado identificar biomarcadores prometedores que pueden predecir severidad y mortalidad en las primeras etapas de la sepsis, no hay actualmente ningún factor pronóstico que puede predecir severidad y mortalidad en las etapas tempranas de la sepsis.11
Antecedentes. La sepsis es una de las enfermedades mortales más comunes. Se define como una disfunción orgánica causada por una respuesta desregulada del huésped a un proceso infeccioso determinado.1 Es una de las pocas condiciones médicas que ataca por igual y con gran ferocidad tanto a poblaciones en zonas de escasos recursos como a las del mundo de altos ingresos.1,2 A nivel mundial se estima que entre 20 y 30 millones de pacientes son afectados por esta grave entidad.2,3 Cada hora, aproximadamente 1,000 personas y cada día alrededor de 24,000 pacientes mueren a causa de la sepsis en todo el mundo.2,3 En la población con ingresos medios bajos, la sepsis es responsable de más de 100,000 casos de muertes maternas cada año y, en algunos países, es la mayor amenaza durante el embarazo.2,3
Las enfermedades crónicas o inmunosupresoras se encuentran entre las comorbilidades de mayor prevalencia, incluidas las siguientes: enfermedad pulmonar obstructiva crónica (EPOC), insuficiencia cardiaca congestiva (ICC), enfermedades oncológicas y diabetes mellitus (DM).1-3 También se ha visto que pacientes con enfermedades crónicas tienen mayor riesgo de adquirir sepsis, comparado con los pacientes sin comorbilidades.1,2,4
Los síntomas y signos específicos de sepsis son inespecíficos, además de que el diagnóstico microbiológico tarda algunos días.4,12 Cabe resaltar que la detección temprana de la sepsis se ha asociado a disminución de la mortalidad.4,12
La mortalidad por sepsis se puede reducir considerablemente mediante la adopción de programas para la detección oportuna y temprana, así como la implementación del tratamiento de emergencia estandarizado.1,3 Sin embargo, estas intervenciones se aplican actualmente en menos de uno de cada siete pacientes de manera oportuna.1,3 La sepsis con frecuencia se diagnostica de manera tardía y esto se debe a múltiples factores dentro de los que se incluyen los inherentes a los pacientes, cuidadores primarios, personal médico y paramédico, quienes no cuentan con los conocimientos suficientes para su reconocimiento.1,3 También, en muchas ocasiones, el cuadro clínico y las herramientas diagnósticas para su detección resultan poco específicas.1,3
Otra de las dificultades radica en la rehabilitación de los pacientes afectados por la sepsis.1,3 El desenlace de la sepsis se observa muy a menudo como binario (el paciente muere [fracaso] o sobrevive [éxito]).1,3 En estudios centrados en la mortalidad hospitalaria y duración de la estancia hospitalaria como medida de resultados).1,3 Sin embargo, un número similar de pacientes que ingresan a los hospitales mueren posterior al egreso hospitalario en ambos extremos de la disponibilidad de recursos (mundo de altos ingresos vs el de medianos y bajos ingresos).1,3 Además, el conocimiento y entendimiento es escaso sobre los efectos a largo plazo de la sepsis, y el acceso a la rehabilitación de los supervivientes es deficiente, a pesar de existir pruebas de que al menos uno de cada cinco pacientes tienen problemas de salud física, cognitiva o mental a largo plazo.1,3
Los programas de mejora del diagnóstico de sepsis apuntan a un reconocimiento precoz de la sepsis por medio de un esfuerzo formal de detección sistemática y del tratamiento de los pacientes, una vez que se les ha identificado como sépticos.12
La gravedad de la disfunción orgánica es evaluada con sistemas de puntuación que cuantifican las anomalías según los hallazgos clínicos, de laboratorio o las intervenciones terapéuticas.1,3 Pero las diferencias en estos sistemas de puntuación también han dado lugar a inconsistencias.1,4,12 El puntaje predominante en el uso actual es la evaluación secuencial de falla orgánica o SOFA (por sus siglas en inglés Sepsis Related Organ Failure Assessment) en la cual una puntuación más alta se asocia con una mayor probabilidad de mortalidad; sin embargo, su cálculo requiere múltiples variables de laboratorio, lo que limita su factibilidad.1,4,12
Las escalas de gravedad para la evaluación de pacientes en estado crítico han sido ampliamente utilizadas en las Unidades de Cuidados Intensivos (UCI) con el objetivo de predecir mortalidad, caracterizar la gravedad de la enfermedad y establecer el grado de disfunción orgánica.1,4,12 Asimismo, sirven para evaluar el uso de recursos y facilitar la comunicación entre el personal de salud.1,4,12
La escala pronóstica SOFA se compone de la suma del puntaje obtenido de la evaluación de seis órganos.1,4,12 Cada órgano recibe un valor que va de cero a cuatro puntos, calificado según el grado de disfunción.1,4,12 Fue desarrollado por consenso en diciembre de 1994 con el nombre de «evaluación de falla orgánica relacionada a sepsis» y posteriormente fue denominada «evaluación de fallo orgánico secuencial».1,4,12
La disfunción orgánica se identifica como un cambio agudo en la puntuación SOFA total ≥ 2 puntos como consecuencia de la infección.1,4,12 Se puede suponer que la puntuación SOFA de referencia es cero en pacientes que no se sabe que tengan disfunción orgánica preexistente.1,4,12
Una puntuación SOFA ≥ 2 refleja un riesgo de mortalidad general de aproximadamente 10% en una población de un hospital general con sospecha de infección.1 Incluso los pacientes que presentan una disfunción moderada pueden deteriorarse aún más, lo que enfatiza la gravedad de esta afección y la necesidad de una intervención rápida y adecuada.3
Un modelo clínico desarrollado con regresión logística multivariable identificó que dos de tres variables clínicas (puntuación de la escala de coma de Glasgow de 13 o menos, presión arterial sistólica de 100 mmHg o menos, y frecuencia respiratoria de 22 por min o más) ofrecieron validez predictiva similar a la de la puntuación SOFA.1 Este concepto definido como qSOFA (quick SOFA, por sus siglas en inglés) fue descrito en el 2016 en el tercer consenso internacional para la sepsis y el choque séptico, donde determinaron que puede servir para considerar una posible infección en pacientes en quienes no se ha diagnosticado infección previamente, no requiere pruebas de laboratorio, se puede realizar de manera rápida y utilizar para el tamizaje de pacientes en quienes se sospecha un cuadro de sepsis probable.1 Se sugiere que los criterios qSOFA (mayor o igual a dos) pueden ser utilizados de manera inmediata por los clínicos para evaluar la disfunción de órganos, para iniciar o intensificar la terapia en su caso, y para considerar la derivación a la atención crítica o aumentar la frecuencia de seguimiento, si aún no han llevado a cabo este tipo de acciones.1
Con la intención de mejorar el pronóstico, se requiere de experiencia clínica.3 Con la intención de facilitar su identificación temprana se han buscado herramientas que han incluido una serie de criterios clínicos y de laboratorio, así como escalas de tamizaje de pacientes en quienes se sospecha un cuadro de sepsis.3 Sin embargo, actualmente no existe un estándar de oro para diagnosticar la sepsis.3
El CURB-65 es un índice del grado de severidad para las neumonías adquiridas en la comunidad, y va asociado a la necesidad de tratamiento.3,13 La ventaja del uso de esta escala es que provee un mayor rango de sensibilidad y especificidad, permitiendo así que los pacientes estén estratificados según su riesgo. Se recomienda tratamiento ambulatorio para el bajo riesgo, ingreso o seguimiento cercano para el riesgo moderado, considerar el ingreso en UCI para el riesgo considerado severo, e ingreso inmediato en UCI para el riesgo alto.3,13 Esta herramienta tiene una sensibilidad validada de 68% y una sensibilidad de 86%, según los estudios realizados por Lim.3,13
Los biomarcadores pueden ser la clave para la medicina personalizada en la sepsis; un biomarcador debe ayudar rápidamente a los médicos que se enfrentan con un paciente enfermo en su decisión sobre el mejor tratamiento posible.14
COVID-19 es una enfermedad viral emergente, primero identificada en Wuhan, China, en diciembre del 2019. Los primeros casos fueron identificados como neumonía de causa desconocida y en febrero del 2020 la Organización Mundial de Salud la describió como COVID-19 (Coronavirus disease 2019).15 La enfermedad fue declarada emergencia internacional el 30 de enero del 2020.15 Inicialmente, el virus fue llamado 2019 nCoV y posteriormente renombrado como SARS-CoV-2, ya que el virus es muy similar al causante de SARS.15 Se trata de un virus de cadena simple de RNA con apariencia de corona en microscopia electrónica por presencia de glucoproteínas en su envoltura.15 La subfamilia Orthocoronavirinae clasifica a los coronavirus en cuatro géneros: alfacoronavirus (alphaCoV), Betacoronavirus (betaCoV), Deltacoronavirus (deltaCoV), y Gammacoronavirus (gammaCoV).15
Los coronavirus pueden causar enfermedad en animales como camellos, gatos y murciélagos.15 Existen siete coronavirus humanos:15
1. (HCoVs) que pueden infectar humanos HCoV-OC43, HCoV-HKU1 (betaCoVs); HCoV-229E, HCoV-NL63 (alphaCoVs), que pueden ser responsables de 5% de enfermedades respiratorias con 2% de la población como portador sano.15
2. SARS-CoV, MERS-CoV y SARS-CoV-2 (betaCoVs).15
El virus es termosensible y es inactivado por solventes lipídicos;15 puede ser transmitido por gotas y por aerosoles, con un periodo de incubación de tres días a dos semanas.15 También se ha propuesto la transmisión por contacto.15
La manifestación clínica de COVID-19 puede ser variada, desde casos asintomáticos o leves hasta situaciones tan graves como la insuficiencia respiratoria aguda mediada con datos consistentes de neumonía.15
Existen escalas de evaluación pronóstica como la escala CURB-65, que tiene una sensibilidad de 68%, especificidad del 86% con AUC 0.78.15
Reportes de la literatura internacional han identificado varios factores de riesgo de muerte en adultos hospitalizados; en particular la edad avanzada, los niveles de dímero D superiores a 1,000 ng/mL y una puntuación de SOFA elevada desde su ingreso.15
Los criterios de gravedad relacionados con la enfermedad COVID-19 se analizan desde el punto de vista demográfico y hallazgos de laboratorio.15 La edad avanzada es un criterio de gravedad (> 60 años); así como comorbilidades, siendo la hipertensión arterial la más común, seguida de diabetes mellitus y enfermedad coronaria.15 En cuanto a los hallazgos de laboratorio, niveles elevados de: leucocitos, ALT, DHL, troponina I ultrasensible, CPK, Dímero D, Ferritina sérica, IL-6, prolongación del tiempo de protrombina, aumento de creatinina y procalcitonina; así como linfopenia.15
El VMP se refiere a la medición geométrica del tamaño de las plaquetas y tiene una relación inversa con el número de éstas. Es, además, un indicador de la activación plaquetaria.8,16
Las plaquetas son los más pequeños y extremadamente reactivos componentes mórficos de la sangre.8,16 Están involucrados en primer lugar en los procesos de fibrosis y mantenimiento de la hemostasia.9,10,16 Los trombocitos están presentes en la sangre durante 8 a 12 días.10,16 El plasma de individuos sanos muestra el recuento de plaquetas de aproximadamente 140,000-350,000/μL.9,16
El VMP es un marcador de inflamación, trombosis y disfunción endotelial que ha adquirido importancia en relación a su significado en enfermedades que tienen como sustrato un componente inmunoinflamatorio y protrombótico.16 Su implementación en la evaluación clínica cotidiana de enfermos con factores de riesgo, es una maniobra costo-efectiva que orienta al médico a la toma de decisiones y en el seguimiento de la conducta terapéutica. 9,10,16
La participación de las plaquetas sanguíneas en una respuesta inflamatoria se asocia con la liberación de citoquinas que atraen leucocitos y facilitan la adhesión al endotelio en el sitio del daño.9,10,16 Durante el proceso inflamatorio, las plaquetas pueden interactuar con los leucocitos formando agregados plaquetas-leucocitos.10,16 Por otra parte, las plaquetas apoyan los leucocitos contra las infecciones bacterianas a través del contacto directo, la encapsulación de bacterias y la liberación de especies reactivas de oxígeno.7,8,17
En pacientes con inflamación activa, la concentración y elevación de citoquinas proinflamatorias, principalmente IL-6, puede conllevar a liberación de plaquetas.17 Esto está asociado con estimulación y generación de trombopoyetina por la IL-6 y con el efecto directo de esta citoquina en los megacariocitos.17 La IL-6 causa un incremento en la ploidía del núcleo del megacariocito y un incremento en el volumen citoplasmático, que en consecuencia conlleva a la producción de un número de plaquetas de gran tamaño.7,9,17
Las plaquetas son las primeras en acumularse en el sitio de daño, donde cambian de forma y muestra la formación de pseudópodos, liberando así de manera local contenido granular citoplasmático y factores de agregación, cuando es activada por los agonistas clásicos, como ADP, TXA2, PAF, y citoquinas inflamatorias, por ejemplo, IL-1, IL-6 y TNF alfa indicando así el proceso de fibrosis e inflamación.7,9,17
La morfología plaquetaria básica se evalúa durante una prueba sanguínea de rutina que proporciona información valiosa sobre el recuento de plaquetas, el volumen medio plaquetario, el ancho de distribución de plaquetas (PDW) y el nivel de plaquetas.7,17
Los analizadores hematológicos modernos permiten la evaluación de VMP en una biometría hemática.17 No se cuenta con un punto de corte establecido, porque los valores son cambiantes y varían según la población, la técnica utilizada para medirlo y el tiempo de realización de la prueba; no obstante, está establecido que los valores superiores a 9.5 femtolitros (fL), se asocia con enfermedades que tienen como sustrato la inflamación, disfunción endotelial y un estado protrombótico.9,16
Se consideran plaquetas grandes aquellas con VMP mayor a 15 fL y plaquetas gigantes con VMP mayor a 20 fL.17
Debido a su relación con procesos inflamatorios no es sorprendente que el recuento de plaquetas y tendencias de sus respectivos componentes en éstas se asocien con el pronóstico en pacientes críticos y/o sépticos, a raíz de lo cual se han realizado diversas investigaciones buscando evidenciar su relación.7,17
En el 2012, investigadores de la Klinikum St. Georg realizaron un estudio con 191 pacientes con sepsis documentada.18 Evaluaron el VMP al ingreso, en el momento del diagnóstico de sepsis, y durante el curso de la enfermedad comparando estos datos con un grupo control con diagnóstico de sangrado de tubo digestivo.18 Los resultados mostraron que el VMP en la admisión y al inicio de los síntomas se asoció fuertemente con mortalidad como desenlace.18 De los 183 pacientes con sepsis, 21.5% de los que murieron tenían el VMP mayor al de los supervivientes (9.6 vs 9.19 fL, respectivamente).18
En el 2015 Chany su grupo determinaron que si bien el VMP no predijo el choque y la mortalidad a los 28 días en pacientes con sepsis grave, la relación de VMP/plaquetas en el momento de la admisión a la sala de urgencias y en el día uno es un marcador de pronóstico prometedor para la mortalidad a los 28 días en pacientes con sepsis grave.19
En el 2016, Sánchez y su equipo evaluaron a 202 pacientes divididos en dos grupos, (sepsis y no sepsis) de 101 pacientes cada uno, documentaron que los pacientes con sepsis durante siete días presentaron incremento del VMP persistente y significativo (p < 0.001), además la elevación permaneció constante durante la evolución de la sepsis y por arriba de 7.4 fL.4 Demostrando así la asociación de infección bacteriana con incremento del VPM a su ingreso y durante la presencia de sepsis.4
En el 2017 Vélez determinó que el volumen medio plaquetario igual o mayor a 8.7 fL se asoció con un incremento en la mortalidad en los pacientes con sepsis.5
El volumen medio plaquetario refleja la activación plaquetaria y a su producción en la médula ósea.19 Un incremento en el volumen plaquetario se ha observado en pacientes con sepsis.19 Algunos estudios sugieren que el incremento en el VMP es un marcador de predicción en individuos con sepsis.19 Una relación inversa entre el conteo plaquetario y el volumen medio plaquetario es normalmente visto en condiciones fisiológicas y algunas condiciones patológicas, tales como la sepsis.19
Un estudio previo realizado por Oh Ho Geun en el 2017, encontró que la división VMP/Conteo de plaquetas es un mejor marcador pronóstico de mortalidad a los 28 días en pacientes con sepsis severa que el VMP o el conteo plaquetario por sí solos.19,20 Por lo tanto, se plantea investigar si el índice VMP/Conteo de plaquetas, así como el VMP incrementados se asocia con la presencia de sepsis.19
Aunque la evaluación de rutina de los parámetros plaquetarios ha estado disponible desde hace muchos años, su importancia clínica no se ha aclarado por completo y su uso diagnóstico ha sido limitado, el volumen medio plaquetario como indicador temprano de infección de origen bacteriano de fácil acceso y bajo costo ha representado durante los últimos años una posible herramienta alternativa coadyuvante para el diagnóstico de sepsis, mejorando así su pronóstico.6
Esto se plantea en los estudios realizados por el seguimiento de los pacientes, principalmente por el Instituto Klinikum St. Georg en el 2012, Chan en el 2015, Sánchez en 2016 y Vélez en el 2017; que dieron seguimiento del recuento plaquetario en sus respectivos estudios, descubrieron que los picos de cambio en el VMP se realizan comparativamente respecto a su fecha de ingreso al día tres (explicado por el curso de la enfermedad) y en el día siete (máximo pico de cambio en el tamaño en sus respectivos estudios).
El estudio realizado por Manrique en el 2019, propone la puntuación SOFA (Sequential Organ Failure Assessment, por sus siglas en inglés), que incluye que una serie de criterios clínicos, de laboratorio y de manejo sean utilizados para el estudio de los pacientes en su protocolo.21 Se asume que la puntuación SOFA basal es cero (0), en pacientes sin disfunción orgánica preexistente, mientras que, para definir los criterios clínicos que identifican los pacientes infectados con sepsis, el grupo de trabajo recomienda emplear un cambio en la puntuación SOFA inicial de dos puntos o más para representar la disfunción orgánica.21 Vale la pena mencionar que solamente los valores de laboratorio que actualmente cuentan hacia el diagnóstico de sepsis, son el lactato y los incluidos en la escala de SOFA, incluyendo plaquetas, bilirrubina y creatinina.22
La trombocitopenia es un fenómeno común en pacientes con sepsis.19 Esto es conocido por ser causado por una falta de producción y un gasto excesivo del consumo plaquetario, pero el mecanismo exacto es desconocido.19 El VMP es un indicador del tamaño promedio de las plaquetas, que es inversamente relacionado al conteo plaquetario.19 Esta relación es asociada con los efectos de mantener homeostasis y preservación de una masa plaquetaria constante.19 Muchos estudios sugieren que el VMP se incrementa bajo condiciones sépticas.19
Becchi, en el 2006, sugirió que la coagulación y la activación plaquetaria puede ocurrir en las etapas tempranas de la sepsis.19 Las plaquetas cambian su forma durante la activación, que podría incrementar el VMP en las fases tempranas de la sepsis.19 En un estudio, el conteo plaquetario en pacientes con sepsis disminuyó hasta el tercer día tras la admisión y se mantuvo estable a partir de ese día.19 En este estudio, los puntajes fueron basados en los resultados de estudios de laboratorio realizados en la admisión, así que el conteo plaquetario usado puede no haber sido el más bajo conteo plaquetario.19
El conteo plaquetario juega un rol pivote en procesos tromboembólicos, inflamación e inmunomodulador; aproximadamente 40% de los pacientes con sepsis tienen conteo plaquetario < 80,000/mm3.19
La trombocitopenia significativa, debido al consumo plaquetario y la depleción de factores de la coagulación durante la sepsis, ha sido reportado en no supervivientes.19 Aunque el volumen medio plaquetario está inversamente asociado con el conteo plaquetario en pacientes saludables, las implicaciones clínicas para asociaciones entre el VMP y el conteo plaquetario no han sido determinados en el choque séptico.19
El VMP es una medida adecuada del tamaño plaquetario y refleja la reactividad de las plaquetas.19 Las plaquetas con un VMP elevado están más activos y grandes, volviéndose más activos y grandes, volviéndose más protrombóticos y que conllevan a una adhesión plaquetaria y la agregación.19 Un VMP elevado usualmente refleja una producción compensadora en la médula ósea después de una destrucción plaquetaria inducida por el estrés, tal como ocurre durante la sepsis.19 Muchos estudios sugieren que los cambios en el VMP están observados durante la infección, sepsis, la enfermedad arterial coronaria, enfermedades cerebrovasculares, trombosis venosa y arterial, así como desórdenes inflamatorios crónicos.4 Estudios previos revelan la superioridad del VMP/Conteo plaquetario y el VMP como predictores de severidad en pacientes con sepsis.4 Se propone que un resultado > 5 fL/mm3 se asocia con estados proinflamatorios, tales como la sepsis.4
En este estudio se buscó encontrar la sensibilidad, especificidad, valor predictivo positivo, valor predictivo negativo y máxima eficiencia diagnóstica de la elevación del volumen medio plaquetario en los pacientes con diagnóstico de sepsis secundario a neumonía por COVID-19. Los niveles nos indicaron que el VMP elevado, disponible en las biometrías hemáticas, puede fungir como un biomarcador para identificar a los pacientes con sospecha de sepsis. Estos resultados abrirán el camino a otros estudios para establecer el diagnóstico y tratamiento oportunos y con ello disminuir la mortalidad de los pacientes que cursan con esta enfermedad.
Fundamentación teórica
Cada año, de 20 a 30 millones de personas a nivel global enferman de sepsis y a pesar de los avances tecnológicos y terapéuticos, se ha presentado a nivel mundial un incremento de la incidencia y la prevalencia de la sepsis, cuyos alcances son epidémicos; su base fisiopatológica está claramente descrita en la bibliografía como un proceso proinflamatorio y si bien hasta el momento no existe un estándar de oro para su diagnóstico, en los últimos años se ha desarrollado particular interés en marcadores biológicos que lo faciliten.
En pacientes que cursan con un proceso inflamatorio, el aumento en la concentración de citoquinas proinflamatorias puede conducir a la liberación de plaquetas, activación plaquetas/leucocitos, lo que conlleva posteriormente a una disminución en el número de plaquetas (asociado a severidad del proceso infeccioso) e inversamente cambio en la morfología plaquetaria (aumentando así su tamaño a valores variables de VMP).
Está demostrado que el incremento del volumen medio plaquetario se correlaciona con enfermedades que tienen como sustrato la inflamación, por lo que en la literatura existe evidencia de su utilidad como un marcador de inflamación, trombosis y disfunción endotelial; que en los últimos años ha adquirido importancia, en relación a su significado en enfermedades que tienen como sustrato un componente inmunoinflamatorio y protrombótico, como lo es la sepsis.
Implementar la medición del volumen medio plaquetario como parte de la evaluación clínica cotidiana de enfermos con sospecha de sepsis podría servir como biomarcador que, por su bajo costo y disponibilidad, oriente al médico respecto a la toma de decisiones y en el seguimiento de la conducta terapéutica.
A su vez, esto podría permitir disminución en costos hospitalarios y el acceso a herramientas diagnósticas de rápida disponibilidad y sin necesidad de equipos médicos de alta tecnología que no son accesibles en todos los hospitales alrededor del país, pudiendo determinar de manera oportuna y económica manejos y decisiones oportunas en pacientes con esta enfermedad, algo que al momento es necesario para optimizar la atención en los pacientes con COVID-19.
Se ha identificado en los pacientes con COVID-19 que existe una respuesta inflamatoria muy severa, por lo que es de interés analizar los parámetros de laboratorio que permitirían identificar oportunamente dicha respuesta inflamatoria, así como si el VMP puede ser un indicador temprano de mortalidad en dicha población a fin de realizar las intervenciones que permitan mejorar la condición del paciente.
Por otro lado, el diagnóstico definitivo de sepsis requiere de experiencia clínica; con la intención de facilitar su identificación temprana se han buscado de herramientas que incluyen criterios clínicos y de laboratorio, así como escalas de tamizaje de pacientes en quienes se sospecha un cuadro de sepsis, pese a lo cual aun en la actualidad no existe un estándar de oro para diagnosticar la sepsis.1
Aunque desarrollos sustanciales se han realizado en el entendimiento de patogénesis básicas en la sepsis y en la correlación compleja con el huésped, el patógeno y el ambiente que afectan la incidencia y el curso de la enfermedad, la sepsis se ha resistido tercamente en todos los esfuerzos para exitosamente desarrollar y desplazar nuevos y mejorados tratamientos.13
Recientemente se ha explorado el valor diagnóstico de los marcadores de inflamación que podrían ayudar a diferenciar procesos infecciosos de los que no lo son, así como definir pronóstico, predecir la gravedad, permitiendo iniciar un plan terapéutico adecuado y medir el grado de respuesta.14
En la actualidad existen una serie de marcadores biológicos de sepsis ampliamente descritos; sin embargo, muchos de ellos se encuentran limitados por los costos y disponibilidad en gran parte de las unidades hospitalarias, lo que resulta en una escasa utilidad clínica en el escenario clínico actual.2,3
La búsqueda intencionada de nuevas herramientas que faciliten el diagnóstico u orienten respecto al pronóstico del enfermo nos han conducido a mirar de nuevo hacia los paraclínicos básicos disponibles en toda unidad hospitalaria.20
El volumen medio plaquetario reportado en los hemogramas rutinarios, se ha asociado a estados inflamatorios-trombóticos-metabólicos.16
Hasta el momento se desconoce la utilidad del volumen plaquetario medio como un marcador alternativo para el diagnóstico de sepsis.
El volumen medio plaquetario mayor de 7.4 femtolitros (fL) y el VMP/Conteo plaquetario > 5 fL/mm3 son marcadores biológicos de inflamación de los procesos infecciosos bacterianos.
Hipótesis
Pregunta de investigación: ¿el VMP es útil como biomarcador de la respuesta inflamatoria en pacientes con COVID-19 y como indicador temprano de mortalidad en los pacientes con COVID-19?
Hipótesis estadística
Ho. El volumen medio plaquetario con un tamaño de 7.4 fL no es útil como marcador temprano de respuesta inflamatoria e indicador de mortalidad en paciente con COVID-19.
Ha. El volumen medio plaquetario con un tamaño menor de 7.4 fL es útil como marcador temprano de respuesta inflamatoria e indicador de mortalidad en paciente con COVID-19.
H1. La sensibilidad del volumen medio plaquetario como marcador temprano de respuesta inflamatoria e indicador de mortalidad en paciente con COVID-19 es de 80%.
H0. La sensibilidad del volumen medio plaquetario como marcador temprano de respuesta inflamatoria e indicador de mortalidad en paciente con COVID-19 es igual o menor de 80%.
H2. La especificidad del volumen medio plaquetario como marcador temprano de respuesta inflamatoria e indicador de mortalidad en paciente con COVID-19 es de 60%.
H0. La especificidad del volumen medio plaquetario como marcador temprano de respuesta inflamatoria e indicador de mortalidad en paciente con COVID-19 es igual o menor de 60%.
H3. El factor predictivo positivo del volumen medio plaquetario como marcador temprano de respuesta inflamatoria e indicador de mortalidad en paciente con COVID-19 es de 40%.
H0. El factor predictivo positivo del volumen medio plaquetario como marcador temprano de respuesta inflamatoria e indicador de mortalidad en paciente con COVID-19 es menor o igual a 40%.
H4. El factor predictivo negativo del volumen medio plaquetario como marcador temprano de respuesta inflamatoria e indicador de mortalidad en paciente con COVID-19 es de 60%.
H0. El factor predictivo negativo del volumen medio plaquetario como marcador temprano de respuesta inflamatoria e indicador de mortalidad en paciente con COVID-19 es igual o menor de 60%.
H5. El factor de máxima verosimilitud del volumen medio plaquetario como marcador temprano de respuesta inflamatoria e indicador de mortalidad en paciente con COVID-19 es de 70%.
H0. El factor de máxima verosimilitud del volumen medio plaquetario como marcador temprano de respuesta inflamatoria e indicador de mortalidad en paciente con COVID-19 es de igual o menor de 70%.
Objetivo general. Determinar la utilidad del VMP como marcador de la respuesta inflamatoria e indicador temprano de mortalidad en pacientes con COVID-19.
Objetivos específicos. Determinar la sensibilidad del volumen medio plaquetario como marcador temprano de respuesta inflamatoria e indicador de mortalidad en paciente con COVID-19.
Determinar la especificidad del volumen medio plaquetario como marcador temprano de respuesta inflamatoria e indicador de mortalidad en paciente con COVID-19.
Determinar el factor predictivo positivo del volumen medio plaquetario como marcador temprano de respuesta inflamatoria e indicador de mortalidad en paciente con COVID-19.
Determinar el factor predictivo negativo del volumen medio plaquetario como marcador temprano de respuesta inflamatoria e indicador de mortalidad en paciente con COVID-19.
Determinar el factor de máxima verosimilitud del volumen medio plaquetario como marcador temprano de respuesta inflamatoria e indicador de mortalidad en paciente con COVID-19.
Material y métodos
• Tipo del estudio. Se realizó un estudio de cohorte, observacional, prospectivo, comparativo y longitudinal.
• Población. Universo: pacientes mayores de 18 años que ingresan a la UCI y que requirieron atención en esta unidad con diagnóstico o sospecha de COVID-19.
Pacientes ingresados a la UCI del HGR 1 del IMSS del estado de Querétaro o población de referencia de otros Estados.
• Tiempo y lugar: se consideró un año para su realización. Se realizó en el HGR-1 del IMSS Delegación Querétaro.
Muestra y Técnica muestral
Muestra secuencial: pacientes ingresados a la UCI del HGR 1. La selección se realizó por casos consecutivos hasta que se completó la muestra.
Grupos de comparación
Grupo I: pacientes con diagnóstico de sospecha o confirmación por PCR para SARS-CoV-2 y con qSOFA mayor o igual a dos puntos y que cuenten con sepsis por clínica y laboratorio.
Grupo II: pacientes con diagnóstico de sospecha o confirmación por PCR para SARS-CoV-2 con qSOFA menor a dos que no tengan sepsis. Se realizó pareamiento por edad y sexo.
Tamaño de la muestra. Se utiliza la fórmula para tamaño de muestra para dos proporciones.
Criterios de selección
Criterios de inclusión
Enfermos ingresados a la UCI sin diagnóstico o sospecha de infección con diagnóstico de sospecha o confirmación para SARS-CoV-2.
Pacientes mayores de 18 años.
Autorización por parte del paciente, familiares o persona responsable en caso de que el paciente se encuentre incapaz de firmar el consentimiento informado.
Criterios de exclusión
Pacientes con sospecha diagnóstica de sepsis con un qSOFA > 2 puntos, pero con patología hematológica que altere la medición del VMP.
Pacientes con diagnóstico de enfermedad hematológica previa (cáncer, leucemia o alteraciones en la coagulación).
Pacientes con diagnóstico de enfermedad isquémica cardiaca o cerebrovascular.
Técnicas e instrumentos
Cuando se contó con la aprobación por parte del Comité Local de Investigación y el Comité de Ética del HGR-1 se acudió a la UCI donde:
Al ingreso de todo paciente a la UCI sospechoso o confirmado de COVID-19, se calculó qSOFA y se solicitó biometría hemática.
Aquellos con qSOFA > 2 y sospecha clínica de infección ingresaron al grupo 1, y se corroboró una vez se contó con un hemocultivo o urocultivo, y aquellos con qSOFA < 2 y sin sospecha de sepsis ingresaron al grupo 2. A ambos grupos se les solicitó biometría hemática diariamente, donde se tomaron el valor de VMP y se siguió durante su estancia en la UCI a fin de identificar la evolución del VMP y su relación con la respuesta inflamatoria y mortalidad, además de aplicar la escala de CURB 65.
Procedimientos
Las muestras fueron tomadas del catéter venoso central por personal del servicio de enfermería como parte de los paraclínicos solicitados rutinariamente en la unidad, por lo que no se generó un costo extra para los pacientes involucrados ni para la institución. Se tomó un tubo (morado para procesar la biometría hemática) y se llevó al laboratorio central del HGR1 IMSS, donde con el equipo Coulter LH 788 analyzer se procesaron las biometrías hemáticas con un resultado disponible en sistema de los 30 minutos a las dos horas aproximadamente.
Análisis estadístico. Todos los datos fueron analizados utilizando los softwares Prism® (GraphPad®, Estados Unidos), versión 8, para Windows® y SPSS® (IBM®, Estados Unidos), versión 22, para Windows®. Se utilizó estadística descriptiva para las características clínicas y sociodemográficas recabadas.
Las variables cuantitativas con distribución normal se reportaron en media y desviación estándar, mientras que las variables cuantitativas con distribución no normal fueron mostradas en mediana y rango intercuartílico (RIC). Para determinar la normalidad en la distribución de las frecuencias se ejecutó una prueba Kolmogorov-Smirnov en los grupos con más de 50 observaciones y una prueba de Shapiro-Wilk en aquellos con menos de 50.
Las variables cualitativas o categóricas se describieron en porcentajes. Se empleó estadística bayesiana para el cálculo del intervalo de credibilidad en estas variables. La comparación de las características clínicas y sociodemográficas se realizó con la prueba t de Student para analizar la diferencia de medias para dos muestras independientes, para las medianas se empleó la U de Mann-Whitney y para las variables cualitativas la χ2 o la prueba exacta de Fisher. Los datos de medición del VMP en los seguimientos en múltiples puntos de tiempo se procesaron mediante el análisis de la varianza (ANOVA). Se utilizó la prueba de esfericidad de Geisser-Greenhouse para evaluar la correlación de los datos de medición repetidos. La diferencia menos significativa (LSD) se empleó para la comparación por pares y se consideró la corrección de Sidak cuando fue apropiado.
Para calcular el valor de corte teórico del VMP y de la relación VMP/CP, se empleó la ecuación de la regresión logística, el cálculo de la curva característica operativa del receptor (ROC) y el índice de Youden, por el método de Wilson Brown. Asimismo, se obtuvieron sensibilidad, especificidad, los valores predictivos positivo y negativo, la razón de verosimilitud positiva y los valores de OR e intervalo de confianza (IC) del 95% para el valor predictivo calculado, por el método Baptista-Pike.
Todos los valores de p informados de estos análisis fueron de dos colas con un valor de p < 0.05.
Consideraciones éticas. En el presente estudio se contempló la reglamentación ética vigente al someterse a un Comité de Investigación Local en Salud, ante el cual se presentó para su revisión, evaluación y aceptación.
El presente protocolo se realizó bajo la normatividad vigente internacional de acuerdo a la declaración de Helsinki sobre principios éticos para las investigaciones médicas en seres humanos de junio de 1964, en donde se insta a los médicos a promover y velar por la salud de los pacientes, incluidos los que participan en la investigación médica, y tener como principio proteger la vida, la salud, la integridad, y el derecho a la autodeterminación. Así como a la Norma Oficial Mexicana 012 SSA 3-2012, para la ejecución de proyectos de investigación para la salud de los seres humanos.
El estudio se llevó a cabo con confidencialidad en los datos de identificación de los pacientes, de acuerdo al reglamento de la Ley General de Salud en materia de investigación para la salud, establecida en el artículo 14; refiere que la investigación que se realice en seres humanos deberá desarrollarse conforme a ciertas bases:
Fracción I; se ajustará a los principios éticos y científicos.
Fracción VI; deberá ser realizada por profesionales de la salud con conocimiento y experiencia.
Fracción VII; contará con dictamen favorable de las comisiones de investigación, ética y bioseguridad.
Fracción VIII; se llevará a cabo en cuanto se tenga la autorización del titular de la institución de salud.
El protocolo y la carta de consentimiento se encuentran apegados a la Ley General de Salud y su Reglamento en Materia de Investigación; y a las Guías de la Conferencia Internacional de Armonización (ICH) sobre las Buenas Prácticas Clínicas (GCP). Los pacientes o sus familiares fueron informados de los objetivos y la confidencialidad del estudio. Así mismo se explicaron los riesgos y beneficios tanto en forma verbal como escrita. Todos los pacientes que ingresaron al estudio lo hicieron con previo consentimiento informado. Los datos de los pacientes fueron codificados y sólo los investigadores tienen acceso a la información. En todo momento se mantuvo la confidencialidad de los datos. El presente estudio no confirió riesgo adicional alguno a los de la atención médica que recibieron por el padecimiento que presentaban.
Resultados
Se obtuvo una muestra de 86 pacientes, de los cuales 35 (40.7%) fueron del sexo femenino y 51 (59.3%) del sexo masculino. La media de la edad del grupo fue de 50.1 (± 14.2) años, siendo 50.2 (± 15.1) años para las mujeres y 50.0 (± 13.8) años para los hombres. Esta diferencia no fue estadísticamente significativa (t de Student no pareada 0.06028, p = 0.9521).
La mediana de la escala qSOFA fue de uno (RIC 1-2) puntos. De la totalidad de los pacientes incluidos en el estudio, 45 (52.3%) seleccionados tuvieron un puntaje menor de dos y fueron clasificados como «ausencia de respuesta inflamatoria sistémica» y 41 (47.7%) tuvieron un puntaje ≥ 2 y se definieron como «presencia de respuesta inflamatoria». La mediana de la escala de CURB-65 fue de uno (RIC 1 - 2) puntos.
Cuarenta y un pacientes (47.7%) presentaron un hemocultivo positivo.
En total, 51 pacientes (59.3%) seleccionados refirieron la presencia de, al menos, una comorbilidad. Del total de la población de estudio, 24 (27.9%) pacientes presentaron una; 20 (23.3%) dos y 7 (8.1%) tres comorbilidades.
El contraste entre los volúmenes medios plaquetarios (VMP), en función de la ausencia o presencia de respuesta inflamatoria sistémica (qSOFA ≥ 2) se muestra en la Figura 1. No se encontraron diferencias estadísticamente significativas en cuanto al tiempo de evolución (F = 1.246, dF = 58, p = 0.1072) o el contraste de la condición experimental (LSD p > 0.999). Para el primer día de internamiento, el VMP no mostró una asociación significativa con la presencia de respuesta inflamatoria (área bajo la curva [AUC] 0.5984, p = 0.1166) y un VMP ≥ 7.4 fL no predijo un mayor riesgo de esta condición (prueba exacta de Fisher p = 0.519).

Figura 1: Mediana del volumen medio plaquetario de los participantes por cada día de internamiento y su contraste de acuerdo con la ausencia o presencia de respuesta inflamatoria sistémica.Los puntos representan la mediana y la dispersión el error estándar. Ns, ANOVA de un factor p > 0.05.
La mediana de la relación VMP/Conteo plaquetario (CP) en el tercer día de internamiento fue de 3.63 (RIC 2.14 - 6.60) y en el séptimo día fue de 2.89 fL/mm3 (RIC 1.96-4.94). Esta diferencia fue estadísticamente significativa (U de Mann-Whitney 2,245, p = 0.0386) (Figura 2). No obstante, esta relación no se asoció significativamente con la presencia de respuesta inflamatoria sistémica, tanto en el tercer día (AUC 0.5133, p = 0.8322) como en el séptimo (AUC 0.5193, p = 0.7876). En ambos casos, una VMP/CP ≥ 5 fL/mm3 no predijo un mayor riesgo de la presencia de respuesta inflamatoria sistémica (prueba exacta de Fisher p > 0.999 y 0.387, respectivamente).
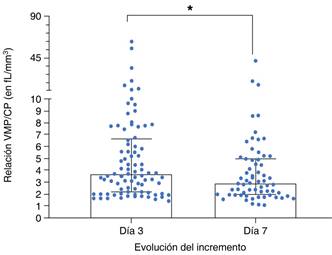
Figura 2: Contraste entre la mediana de la relación volumen medio plaquetario/ conteo plaquetario en función del tiempo de internamiento en la UCI de los participantes. Cada punto representa la medición por participante. Las columnas representan la mediana y la dispersión el rango intercuartílico.* Prueba de Mann-Whitney p < 0.05.
Del universo de estudio, 40 pacientes (46.3%) participantes egresaron de la Unidad de Cuidados Intensivos (UCI) por mejoría y 46 (53.5%) por defunción. Para el primer día de internamiento, el VMP no mostró una asociación significativa con la presencia de respuesta inflamatoria (área bajo la curva [AUC] 0.6011, p = 0.1073). Sin embargo, un VMP ≥ 7.4 fL aumentó 3.1 veces la mortalidad entre los seleccionados (IC del 95% 1.3-7.5, p = 0.0169 (Figura 3).

Figura 3: Proporción de pacientes que presentaron mortalidad de acuerdo con un volumen plaquetario medio ≥ 7.4 fL.
Este valor tuvo una sensibilidad de 62.2% (IC del 95% 46.1-75.9), una especificidad de 69.6% (IC del 95% 55.2-80.9), un valor predictivo positivo (VPP) de 57.5% (IC del 95% 42.2-71.5), un valor predictivo negativo (VPN) de 69.6% (IC del 95% 55.2-80.9) y una razón de verosimilitud positiva (RVP) de 1.79.
Respecto a la relación VMP/CP, este valor no se asoció con la mortalidad de los pacientes de manera significativa tanto en el tercer día (AUC 0.5823, p = 0.1896), como en el séptimo día (AUC 0.6405, p = 0.0523) del internamiento. De igual manera, una VMP/CP ≥ 5 fL/mm3 no predijo un mayor riesgo de mortalidad entre los participantes del estudio (prueba exacta de Fisher p > 0.497 y 0.387 para el tercer y séptimo día, respectivamente).
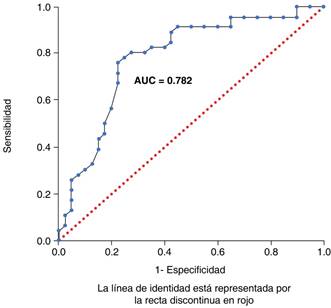
La mortalidad de los participantes fue independiente del sexo (prueba exacta de Fisher p = 0.513), de su escolaridad (χ2 de Pearson 13.085, p = 0.108), de la presencia de un hemocultivo positivo (prueba exacta de Fisher p = 0.829) o de la presencia de comorbilidades (prueba exacta de Fisher p = 0.126). Una mayor edad se asoció con una mayor proporción de mortalidad de manera significativa (AUC = 0.7815, IC del 95% 0.6801-0.8830, p < 0.0001) (Figura 4).
Discusión
La COVID-19 se comporta como una infección compleja que puede involucrar diversos órganos, aparatos o sistemas en su anfitrión.23 Asimismo, diversos estudios sugieren que los perfiles hematológicos cambian durante el curso de la enfermedad del SARS-CoV-2.24
En este contexto, además de las funciones en la hemostasia, los trombocitos o plaquetas desempeñan un papel fundamental en la respuesta inflamatoria y su número y volumen puede variar en paralelo con la gravedad de la presencia de infecciones sistémicas.25 A través de una mediación cruzada con el sistema inmunológico, las plaquetas han surgido como moduladores críticos de la aterotrombosis y la inflamación vascular, y como células efectoras en el combate de la infección microbiana.26
Estudios recientes revelan que la modulación de los procesos inflamatorios por plaquetas puede ocurrir a través de la interacción con neutrófilos, de la internalización de patógenos y secreción de citocinas, de las proteínas microbicidas plaquetarias (PMP) y otros reguladores inflamatorios.27
El VMP suele emplearse como un marcador de la tasa de producción y activación de plaquetas en la médula ósea.17 Asimismo, en pacientes con neumonía grave, el endotelio microvascular se daña por mediadores inflamatorios, hipoxia, patógenos y toxinas liberadas durante la reproducción, y las plaquetas se activan en un estado de hipercoagulabilidad, lo que resulta en un aumento significativo del consumo de plaquetas y un aumento compensatorio de las plaquetas de la médula ósea, dando como resultado que este parámetro se encuentre significativamente elevado.28
En el caso de la infección por SARS-CoV-2, Ozder, a través de un estudio analítico, comparativo, observacional, longitudinal y prospectivo que evaluó el papel diagnóstico del VPM en pacientes adultos con diabetes mellitus, encontraron que la media de este parámetro fue significativamente mayor (11.21 ± 0.61 fL) en comparación con los resultados de las últimas visitas de rutina de los mismos individuos con diabetes previos al desarrollo de la COVID-19 (10.59 ± 0.96 fL) (p < 0.0001).29
A pesar de lo anterior, en el presente estudio, las medianas de los VMP oscilaron entre 7 y 8 fL, independientemente del día del internamiento o la gravedad clínica de los pacientes establecida como un qSOFA ≥ 2 puntos (Figura 4), similar lo reportado Ozcelik y colaboradores, quienes encontraron que la media del VMP fue baja en un grupo de 43 pacientes adultos hospitalizados en una UCI por COVID-19 y significativamente menor que en el grupo de 54 pacientes ingresados por influenza (p < 0.027).30
Sin embargo, se identificó que un VMP ≥ 7.4 fL aumentó 3.1 veces la mortalidad entre los seleccionados (IC del 95% 1.3 - 7.5, p = 0.016) (Figura 2). Este hallazgo es similar a lo reportado por Güçlü, quien por medio de un estudio analítico, observacional, longitudinal y prospectivo que investigó la relación entre la mortalidad en COVID-19 y el recuento de plaquetas, el VPM y el ancho de distribución de las plaquetas, reportó que por cada unidad (fL) de incremento en el VPM entre el primer y tercer día de hospitalización, la mortalidad por COVID-19 aumentó 1.76 veces de manera significativa (p < 0.05); concluyendo que: «además de la capacidad pulmonar del paciente, el VMP se puede utilizar como prueba auxiliar para predecir la mortalidad en pacientes con COVID-19».31
Conclusiones
El mecanismo de cambio en los índices plaquetarios en pacientes con COVID-19 probablemente sea multifactorial.32 El pronóstico adverso en pacientes con un VMP elevado puede estar asociado con un mayor riesgo de estrés oxidativo, trombosis y apoptosis en plaquetas activadas.33 El mayor VMP entre los no supervivientes de la COVID-19 podría deberse a la trombocitopenia que, como ocurre en otros coronavirus, sea consecuencia de una infección directa de la médula ósea; en segundo lugar, debido a la destrucción de plaquetas por parte del sistema inmunológico y, en tercer lugar, el consumo de plaquetas debido a la agregación en los pulmones.33
En consecuencia, la producción de plaquetas aumenta a medida que disminuye el recuento de plaquetas y un mayor número de plaquetas jóvenes implica una mayor actividad que las plaquetas menos jóvenes. De esta manera, después de la destrucción de plaquetas inducida por estrés, la disminución del conteo plaquetario estimula aún más a los megacariocitos para que produzcan una gran cantidad de plaquetas, lo que conduce a un aumento del VMP.34











 nova página do texto(beta)
nova página do texto(beta)