Introducción
Desde la identificación del virus del SARS-CoV-2 en Wuhan, China, en diciembre de 2019, su dispersión ha generado un impacto global debido a su elevada morbilidad, 22.9% ha cursado con una forma grave de hipoxemia y mortalidad de 5.6%,1 con una variación dependiendo de la población analizada, asociada con un impacto directo en la economía mundial debido al elevado costo que su atención implica. Consecuentemente, los recursos disponibles en el campo de la medicina crítica han sido intensamente explotados en la búsqueda de estrategias terapéuticas que permitan modificar la evolución natural de la enfermedad.2
Aunque la información disponible varía de acuerdo al centro hospitalario, se estima que de 7 a 14% de los pacientes infectados por el SARS-CoV-2 requieren de ingreso a la Unidad de Cuidados Intensivos y de este porcentaje, 29 a 75% requieren de soporte ventilatorio invasivo con una mortalidad que varía de 12 a 81%.3
En el ámbito mundial, se estima un aproximado de un millón de muertes reportadas hasta septiembre de 2020 con una marcada diferencia entre países y poblaciones. La mediana de edad se modificó dependiendo de la expectativa de vida entre poblaciones, siendo 81 años en países europeos como Alemania, 79 años en Estados Unidos hasta un descenso de 11 años en la mediana de edad en países con descendencia hispano-latinoamericana.
La forma grave de COVID-19 predominó en la población masculina, pacientes con obesidad, diabetes mellitus descontrolada, neumopatías crónicas, falla hepática y renal, así como neoplasias hematológicas.4
En México, en una cohorte realizada de enero a julio de 2020, se estimó que 9.7% de los casos con infección confirmada requirió soporte ventilatorio mecánico invasivo, con una mortalidad de 70.9% de los pacientes bajo dicho soporte, representando así 11.5% de los casos con criterios de gravedad. De igual forma, se encontró una mediana de edad de 62 años en dichas muertes, un franco predominio por el sexo masculino (65.3%) y población con hipertensión, obesidad y diabetes.5
Dentro de los pacientes que requirieron soporte ventilatorio, cerca de 98% cumplió con los criterios de Berlín para el diagnóstico de síndrome de insuficiencia respiratoria aguda (hipoxemia de inicio agudo, PaO2/FiO2 < 300 mmHg, presencia de opacidades bilaterales en el control de imagen no explicadas por falla cardiaca).6
Durante su inicio, se desconocía con exactitud el mecanismo fisiopatológico que producía el deterioro respiratorio; sin embargo, presentaba una similitud clínica con el síndrome de insuficiencia respiratoria aguda (SIRA) por otras causas.
El SIRA fue descrito inicialmente en 1967 por Ashbaugh;7 sin embargo, la falta de una definición estandarizada representó un obstáculo significativo. Fue hasta 1988 que Murray y colaboradores establecieron las bases para la definición actual al incluir criterios radiológicos, relación PaO2/FiO2 con el uso de PEEP durante el soporte ventilatorio, así como la distensibilidad pulmonar.8
Es hasta 1994 que en el marco de la conferencia para el Consenso Americana-Europea se emitió la primera definición de SIRA a partir del inicio agudo de hipoxemia (PaO2/FiO2 < 200 mmHg) con afección radiológica bilateral sin evidencia de hipertensión auricular izquierda, donde se acuñó el concepto de lesión pulmonar aguda (PaO2/FiO2 < 300 y > 200 mmHg).9
Por último, en 2012 se estableció la definición operacional del Consenso de Berlín, la cual es vigente hasta la actualidad y que utiliza criterios de temporalidad, imagen de tórax, etiología del edema pulmonar y gravedad de la hipoxemia, con una validación para predicción de mortalidad con AUROC de 0.577 (IC 95%: 0.561-0.593, p < 0.001). Dicho consenso permitió establecer una relación entre la gravedad de la hipoxemia con un incremento en la mortalidad y en días promedio de soporte ventilatorio en los sobrevivientes.10
El SIRA se desarrolla secundario a lesiones, los cuales son clasificados como pulmonares (directos) o sistémicos (indirectos). Dentro de los factores de riesgo directos se encuentran la neumonía y el síndrome de aspiración pulmonar que junto a la sepsis de origen no pulmonar conforman más de 85% de las causas de SIRA.11
El SIRA secundario a la infección por SARS-CoV-2 difiere significativamente de otras causas convencionales. En 2020, Gattinoni propuso dos distintos fenotipos evolutivos de la enfermedad. El fenotipo «L» caracterizado por baja elastancia, bajo peso pulmonar y bajo índice ventilación/perfusión (V/Q) debido a la disregulación en la vasoconstricción pulmonar hipóxica; éste puede progresar al fenotipo «H», el cual asemeja al SIRA convencional con baja distensibilidad y elevado peso pulmonar asociado con alteración en la vasorreactividad pulmonar, coagulopatía y fenómenos microtrombóticos, situación que pone en escena al óxido nítrico como potencial estrategia terapéutica.12
Ante la presencia de pacientes con SIRA severo e hipoxemia refractaria a terapéuticas de rescate, el papel de mecanismos fisiopatológicos adicionales al desarrollo de cortocircuitos intrapulmonares como la vasoconstricción hipóxica figuró como una de las principales ventanas terapéuticas.13-15
La vasoconstricción hipóxica consiste en el mecanismo intrínseco de la vasculatura pulmonar que permite acoplar la perfusión pulmonar a las unidades alveolares adecuadamente ventiladas, con la intención de optimizar la oxigenación sistémica. Se produce a partir de la constricción de pequeñas arterias intrapulmonares en respuesta a la hipoxemia y produce directamente un incremento en la presión de la arteria pulmonar, la cual en escenarios extremos reviste de una primordial importancia clínica debido al elevado riesgo de desarrollar disfunción ventricular derecha.16 En la mayoría de los casos, la vasoconstricción hipóxica es provocada por consolidaciones o atelectasias focales, lo que condiciona la aparición de dicho fenómeno en segmentos pulmonares localizados. Dicha constricción vascular produce una derivación del flujo sanguíneo desde la región afectada hacia territorios pulmonares con una mayor oxigenación.15-18
Este fenómeno «compensatorio» ha revestido una vital importancia en el paciente con infección por SARS-CoV-2. El sistema renina-angiotensina (RAS, por sus siglas en inglés) ha sido relacionado como una vía central en la fisiopatología de esta enfermedad. La enzima convertidora de angiotensina tipo 2 (ECA2) constituye el principal receptor funcional para el virus, permitiéndole su ingreso a la célula del epitelio respiratorio a través de la interacción con la proteasa de serina transmembrana tipo 2 (TMPRSS-2, por sus siglas en inglés) y posteriormente a los neumocitos tipo II (células conocidas por su expresión de elevados niveles de ECA2). Una vez que se constituyen los complejos ECA2 SARS-CoV-2, dicha enzima sufre de una pérdida total de la actividad funcional dando paso a una disregulación importante en el RAS.12,16,19,20
Dicha disregulación produce una reducción en la generación de angiotensina 1-7 (con funciones vasodilatadoras y antiinflamatorias potentes) y la acumulación de angiotensina II, la cual al unirse con el receptor de angiotensina tipo I (AT1) produce una respuesta vasoconstrictora potente, siendo junto a los fenómenos protrombóticos que se han asociado a esta enfermedad los principales mecanismos de la hipoxemia grave que suelen presentarse.20-22
Dentro de las estrategias de soporte ventilatorio que han permitido reducir la mortalidad en el paciente con SIRA, el uso de bajos volúmenes corrientes (6 mL/kg de peso predicho) constituye uno de los principales pilares.23,24 La presencia de regiones pulmonares dependientes contribuyen significativamente al desarrollo de hipoxemia, debido a la presencia de cortocircuitos en alveolos perfundidos no ventilados, asociándose al desarrollo de hiperinsuflación y excesivo estrés en regiones ventiladas, por lo que el uso de PEEP como método de reclutamiento alveolar se ha asociado con una reducción directa en la mortalidad.25,26
Una vez que se ha logrado un soporte ventilatorio óptimo con PEEP individualizado, volumen tidal bajo y presión meseta (Pmes) menor a 27 mmHg, se debe mantener una presión de conducción (Pmes-PEEP) menor a 15 para lograr disminución en la mortalidad.26
En pacientes con SIRA grave (PaO2/FiO2 < 150 mmHg) pese a establecerse el soporte ventilatorio en metas de protección alveolar y/o el uso de bloqueo neuromuscular, la ventilación mecánica en posición prono en sesiones de al menos 16 horas consecutivas ha demostrado una reducción significativa en la mortalidad, estableciendo así su uso como una alternativa terapéutica segura, fácil de reproducir y de bajo costo.27-30
En el escenario de hipoxemia refractaria existen estrategias terapéuticas de rescate que permiten prevenir complicaciones graves producto de la hipoxemia e incluso la muerte en pacientes con insuficiencia respiratoria grave refractaria. Dichas estrategias permiten mejorar la oxigenación de forma transitoria; sin embargo, su impacto en la mortalidad aún permanece en discusión y requiere de infraestructura e insumos especializados con un incremento significativo en el costo del tratamiento comparado con la conducta estándar. No obstante, pese al uso de estrategias de rescate, la mortalidad asociada a los pacientes que cursan con hipoxemia grave refractaria persiste de 71 a 94%.27,28,31,32
El SIRA se asocia con reducción efectiva de la capacidad residual funcional potenciada por la oclusión dinámica de las vías aéreas en regiones dependientes durante la posición en supino, el uso de la ventilación mecánica en prono desde el año 1976 ha sido asociada con una mejoría franca en la oxigenación de pacientes con hipoxemia severa.33
Más tarde, los resultados del ensayo clínico del PROSEVA lograron demostrar una reducción en la mortalidad de los pacientes con SIRA severo cuando el soporte ventilatorio en prono fue iniciado de forma temprana y por un tiempo prolongado (12-16 horas).27
El cambio de posición del compartimento torácico y abdominal al colocarse en prono genera cambios en la presión interna (presión pleural e intraabdominal respectivamente) por efecto de la gravedad, así como de la forma y posición del diafragma, partiendo de que toda variación de la presión intraabdominal repercute directamente en el compartimento torácico.34
Pese a la modificación en la ventilación pulmonar efectiva y la redistribución del gradiente de presión transpulmonar, la perfusión tras posicionarse en prono sólo se modifica en 13 a 25% con un predominio de perfusión en regiones dorsales debido a una mayor producción endotelial de óxido nítrico y mayor disponibilidad de lechos vasculares en dichas regiones, siendo así la disregulación en los fenómenos de vasoconstricción pulmonar un objetivo terapéutico de relevancia.35
Desde sus primeras descripciones, la ventilación en prono ha demostrado ser responsable de una importante mejoría en la oxigenación; sin embargo, ésta depende directamente de la causa directa del SIRA (neumonía, trauma, obesidad) o del grado de afección pulmonar.27
Esta mejoría suele ser más evidente cuando se utiliza en etapas tempranas (< 72 horas, durante la fase exudativa) previo al inicio de la fibrosis e hiperplasia de neumocitos II, aunque el beneficio puede obtenerse incluso hasta en los primeros 11 días de evolución.36
El tiempo requerido para lograr una mejoría en la oxigenación suele ser menor a 30 minutos, seguido de un incremento gradual y progresivo en un periodo de tiempo variable, esta respuesta ocurre en 73% de los casos. Veintisiete por ciento de los pacientes que responden puede requerir hasta seis horas para evidenciar el beneficio, así como una duración promedio de cada sesión de 16 a 18 horas para mantener el efecto.37
En retrospectiva, la disregulación en la vasoconstricción pulmonar de los pacientes con SIRA grave asociado a SARS-CoV-2 constituye un papel importante en la patogénesis y en su respuesta, por lo que la intervención mediante el uso de estrategias de rescate como la administración de ONi se constituyó como prioridad.
El óxido nítrico es un gas inocuo, incoloro e inodoro producido por las células endoteliales a partir de la arginina por efecto de tres enzimas: nNOS (sintasa de óxido nítrico neuronal), eNOS (sintasa de óxido nítrico endotelial) e iNOS (sintasa inducible de óxido nítrico).38 Induce vasodilatación al incrementar el nivel de guanosin monofosfato cíclico (GMPc) en el músculo liso. Dependiendo de su concentración, se ha relacionado un significativo número de efectos pro y antiinflamatorios en el marco de un paciente con SIRA39 dentro de los cuales destacan la atenuación de la activación leucocitaria, reducción de la agregación plaquetaria, efecto broncodilatador y un efecto estimulante de producción de surfactante.39
Al inhalarse, el óxido nítrico se difunde en áreas ventiladas donde induce vasodilatación previo a su rápida unión con la hemoglobina al reaccionar con el hierro del grupo hemo. Tras su unión con la oxihemoglobina, el óxido nítrico forma metahemoglobina y nitratos perdiendo su capacidad de vasodilatación. Por último, 70% del ONi inhalado es eliminado en forma de nitratos en la orina.40
La vasodilatación pulmonar selectiva en áreas pulmonares ventiladas permite la mejoría del índice ventilación/perfusión al redistribuir el flujo sanguíneo hacia dichas regiones, permitiendo un incremento significativo en la oxigenación y reducción de cortocircuitos intrapulmonares de derecha a izquierda tras su uso durante 24 horas de acuerdo a Gebistorf y colaboradores.41 Hemodinámicamente reduce de forma efectiva las resistencias vasculares pulmonares y, por tanto, la postcarga del ventrículo derecho.
Dicha mejoría en la oxigenación es transitoria y pocos ensayos clínicos han demostrado que dicho fenómeno persista por más de 96 horas tras su inicio.41 De acuerdo con los trabajos realizados por Gerlach y colaboradores, esta mejoría suele ser mayor cuando coexiste con la presencia de hipertensión arterial pulmonar y suele lograrse con bajas concentraciones de ONi (5-10 ppm), llegando a presentar incluso deterioro en la oxigenación cuando se administra mayor cantidad debido a la difusión del ONi a regiones no ventiladas.42 Se considera así una dosis máxima segura el uso de 40 ppm sin llegar a causar metahemoglobinemia; sin embargo, se recomienda la monitorización estrecha de cifras de metahemoglobina seis horas posteriores a cada ajuste de dosis.43
Se define la respuesta al ONi como el incremento de al menos 20% en la oxigenación (SaO2 o PaO2), ya que no existen variables radiológicas o fisiológicas que permitan medir de forma objetiva dicha mejoría.44 El ajuste de dosis debe realizarse de forma escalonada, con incrementos graduales de acuerdo con la respuesta clínica individual. Es posible cursar con deterioro paradójico en la oxigenación tras incrementos sostenidos mas allá del umbral individual.39 Las cifras normales de metahemoglobina se consideran menores a 2%. Debe evitarse el incremento mayor a 5% en cuyo escenario puede asociarse a hipoperfusión tisular grave y acidosis láctica que suele responder a la perfusión de azul de metileno (1-2 mg/kg).45,46
Al momento existen al menos ocho estudios aleatorizados que incluyeron a pacientes con SIRA en los que se evaluó el impacto del uso de ONi en la mortalidad. Ninguno de ellos encontró mejoría significativa en la supervivencia a 28 días o a largo plazo, no modificó la duración del soporte ventilatorio, la estancia en la UCI, la incidencia de barotrauma. Dichos estudios cuentan con limitaciones importantes durante el desarrollo metodológico, no siguieron protocolos establecidos durante su administración (concentración, duración, evaluación de la respuesta y destete) y existió una variación muy importante entre las unidades a cargo, llegando a incluir pacientes previo a la generalización de las metas de protección pulmonar durante su manejo.33,47-50
De acuerdo a Lotz C y colaboradores, el uso de ONi incrementó la oxigenación arterial en casos con SIRA secundario a SARS-CoV-2 sin modificar el porcentaje de cortocircuitos pulmonares a través de la mejoría en el índice V/Q producto de la vasodilatación pulmonar selectiva.51 No obstante, se ha propuesto que existen mecanismos adicionales asociados como la regulación de receptores de angiotensina II, inhibición de la agregación plaquetaria, efecto surfactante y propiedades inmunomoduladoras.52
Ante la gravedad de presentación en pacientes con hipoxemia refractaria, pese a uso de soporte ventilatorio en metas de protección alveolar, bloqueo neuromuscular y posición prono, es razonable el uso de ONi con la intención de aprovechar los efectos fisiológicos en la relación ventilación/perfusión, mejorar el intercambio gaseoso y la función ventricular derecha, permitiendo mantener el soporte ventilatorio dentro de metas de protección pulmonar.
Material y métodos
Se analizaron los datos de los expedientes de pacientes ingresados a la Unidad de Cuidados Intensivos Respiratorios del Centro Médico ABC con diagnóstico de insuficiencia respiratoria grave secundaria a infección por SARS-CoV-2 que requirieron óxido nítrico inhalado y ventilación mecánica en prono asociada a bloqueo neuromuscular del 01 de abril al 31 de diciembre de 2020.
Se realizó estadística descriptiva que incluyó medidas de tendencia central y de dispersión, las variables categóricas expresadas como medidas de frecuencia absoluta y relativa y las variables lineales como media y desviación estándar (DE).
La estadística inferencial incluyó el uso de pruebas de hipótesis para evaluar variables lineales con la prueba t de Student para muestras independientes para la comparación entre dos grupos.
Las variables categóricas fueron analizadas con prueba de χ2 o prueba exacta de Fisher. La paquetería estadística utilizada fue SPSS v 21.0 IBM.
Resultados
Características demográficas. Se incluyeron 108 pacientes de los cuales 88 fueron hombres (81.5%) y 20 mujeres (18.5%). De la población total, 54 recibieron ONi (50%), de éstos 48 son hombres (88.9%). La media de edad en el grupo ONi fue de 61.6 años ± 12.39 años vs 57.3 años ± 14.1 años en el grupo control. Veintitrés pacientes fueron hipertensos (42.6%) en el grupo ONi vs 26 (48.1%) en el grupo control. Cuarenta y tres pacientes fueron diabéticos (79.6%) en el grupo ONi vs 13 (24.1%) en el grupo control. Sólo dos pacientes (1.9%) presentaron enfermedad renal crónica y en su totalidad pertenecieron al grupo control. Siete pacientes (13%) contaban con neoplasia oncológica en el grupo ONi vs tres (5.6%) en el grupo control. Dieciocho pacientes (33.3%) del grupo ONi presentaron obesidad con una mediana en el IMC de 29.5 ± 5.4 kg/m2 vs 23 pacientes (42.6%) con un IMC de 30.5 ± 6.3 kg/m2 en el grupo control (Tabla 1).
Tabla 1: Características demográficas.
| Óxido nítrico (N = 54) | Control (N = 54) | Total (N = 108) | ||
|---|---|---|---|---|
| n (%) | n (%) | n (%) | p*** | |
| Hombre | 48 (88.9) | 40 (74.1) | 88 (81.5) | 0.048 |
| Mujer | 6 (11.1) | 14 (25.9) | 20 (18.5) | 0.048 |
| Edad (años)* | 61.6 ± 12.3 | 57.3 ± 14.1 | 59.4 ± 13.4 | 0.092 |
| Peso (kg)* | 85.8 ± 18.1 | 87.2 ± 21.1 | 86.2 ± 19.6 | 0.708 |
| Talla (m)* | 1.7 ±; 0.08 | 1.69 ± 0.09 | 1.78 ± 80.4 | 0.435 |
| Índice masa corporal (kg/m2)* | 29.5 ± 5.4 | 30.5 ± 6.3 | 1.69 ± 0.08 | 0.402 |
| Hipertensión** | 23 (42.6) | 26 (48.1) | 49 (45.4) | 0.562 |
| Diabetes mellitus 2** | 43 (79.6) | 13 (24.1) | 56 (51.9) | 0.001 |
| Cáncer** | 7 (13.0) | 3 (5.6) | 10 (9.3) | 0.184 |
| Enfermedad renal crónica** | 0 (0) | 2 (3.7) | 2 (1.9) | 0.495 |
| Obesidad** | 18 (33.3) | 23 (42.6) | 41 (38.0) | 0.321 |
* Media ± desviación estándar.
** Prueba exacta de Fisher.
*** p ≤ 0.005.
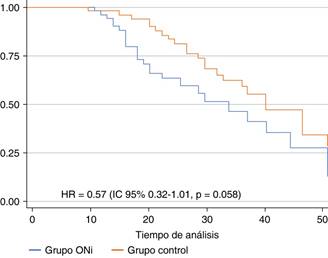
Desenlaces. La mortalidad global fue de 45.3% (n = 49), siendo en el grupo ONi de 44.4% (n = 24) vs 46.2% (n = 25) en el grupo control (RR 1.03, IC 95%: 0.70-1.51, p = 0.846). Los días de ventilación mecánica (VM) en el grupo ONi fueron de 25.4 ± 14.8 y de 13.5 ± 8 en el grupo control (p = 0.001). Los días de estancia en la UCI fueron 29.8 ± 21 en el grupo ONi y 18.7 ± 11.3 en el grupo control (p = 0.001) (Figura 1).
La media de la PaO2/FiO2 al ingreso en el grupo ONI fue de 80.4 ± 22.9 y de 102 ± 29 mmHg en el grupo control. La media de la PaO2/FiO2 posterior a la intervención en el grupo ONi fue de 124.2 ± 55.4 y de 231.9 ± 63.9 mmHg en el grupo control. La media del delta de PaO2/FiO2 en el grupo ONi fue de 31.5 ± 15.2 vs 52.9 ± 16.7 mmHg en el grupo control (p = 0.001).
La mediana de presión meseta (Pmes) al ingreso en el grupo ONi fue de 27.5 ± 2.39 y 25.8 ± 2.47 cmH2O en el grupo control. Después de la intervención, la mediana de Pmes en el grupo ONi fue de 26.3 ± 3 y de 24.5 ± 1.9 cmH2O en el grupo control. La mediana de presión de conducción (PC) al ingreso en el grupo ONi fue de 17.2 ± 3.9 y de 13.4 ± 2.8 cmH2O en el grupo control. Después de la intervención, la mediana de PC en el grupo ONi fue de 13.1 ± 1.29 y de 12 ± 1.92 cmH2O en el grupo control (p = 0.001). En el grupo ONi se encontró reducción de la Pmes en 64.8% (n = 35) vs 68.5% (n = 37) en el grupo control posterior a la intervención (Tabla 2).
Tabla 2: Mortalidad y desenlaces secundarios.
| Óxido nítrico (N = 54) | Control (N = 54) | Total (N = 108) | p** | |
|---|---|---|---|---|
| Mortalidad, n (%)* | 24 (44.4) | 25 (46.2) | 49 (45.3) | RR 1.03 (IC 95%: 0.7-1.5)*** 0.846 |
| Días VM (días)* | 25.4 ± 14.8 | 13.5 ± 8 | 19.4 ± 13.2 | 0.001 |
| Días en la UCI (días)* | 29.8 ± 21 | 18. 7 ± 11.3 | 24.2 ± 17.7 | 0.001 |
| PaO2/FiO2 ingreso (mmHg)* | 80.4 ± 22.9 | 102 ± 29.3 | 91.2 ± 28.3 | |
| PaO2/FiO2 post (mmHg)* | 124.2 ± 55.4 | 231.9 ± 63.9 | 178 ± 80.4 | |
| Delta PaO2/FiO2 (mmHg)* | 31.5 ± 15.2 | 52.9 ± 16.7 | 42.6 ± 19.1 | 0.001 |
| Presión meseta ingreso (cmH2O)* | 27.5 ± 2.3 | 25.8 ± 2.4 | 26.6 ± 2.5 | |
| Presión meseta posterior (cmH2O)* | 26.3 ± 3 | 24.5 ± 1.9 | 25.4 ± 2.6 | |
| Delta presión meseta (cmH2O)* | 9.2 ± 7.3 | 8.8 ± 4.9 | 9 ± 6.1 | 0.001 |
| Presión conducción ingreso (cmH2O)* | 17.2 ± 3.9 | 13.4 ± 2.8 | 15.3 ± 3.9 | |
| Presión conducción posterior (cmH2O)* | 13.1 ± 1.2 | 12 ± 1.9 | 12.5 ± 1.7 | |
| Delta presión conducción (cmH2O)* | 24.6 ± 13.6 | 13.9 ± 7.2 | 19.6 ± 12.2 | 0.001 |
VM = ventilación mecánica; UCI = Unidad de Cuidados Intensivos.
* Media ± desviación estándar.
** p ≤ 0.005.
*** Prueba χ2.
Discusión
La mortalidad asociada a la hipoxemia grave refractaria en pacientes que presentan SIRA secundario a la infección por SARS-CoV-2 continúa siendo elevada. Si bien nuestro estudio no demostró un impacto significativo en la mortalidad de esta población en comparación con la registrada en pacientes con estrategias convencionales de rescate (ventilación protectora en prono y bloqueo neuromuscular) mostró una reducción importante en la mortalidad general en comparación con las cifras reportadas globalmente. Permitió identificar a la diabetes mellitus como una comorbilidad con impacto significativo, llegando a asociarse como un factor de riesgo para desarrollar hipoxemia grave refractaria. Nuestra población de mayor riesgo se concentró en el adulto de 60 a 70 años.
De los pacientes sometidos a ONi, todos presentaron respuesta clínica favorable (con un aumento mayor a 20% de acuerdo con la literatura internacional); sin embargo, no tuvo un impacto estadísticamente significativo en la mortalidad.
No hubo cambios estadísticamente significativos en la presión meseta entre ambos grupos, lo cual está relacionado a que en todos los casos la programación de la ventilación se mantuvo dentro de metas de protección alveolar. Sin embargo, la presión de conducción, la cual es influenciada directamente por la elastancia y distensibilidad individual, presentó mejoría significativa tras el inicio de ONi. Esto se debe a que la mejoría en el intercambio gaseoso permitió realizar ajustes a la programación de la ventilación, logrando así mantener una presión de conducción debajo de 15 cmH2O, obteniendo un beneficio indirecto en la mortalidad.
Por último, consideramos que el incremento en la duración del soporte ventilatorio y la estancia en Cuidados Intensivos en el grupo de ONi se relaciona de forma directa con un estado de mayor gravedad de los pacientes previo al inicio del ONi.
Nuestro estudio posee múltiples limitaciones: 1) al tratarse de un estudio retrospectivo y descriptivo donde la decisión del inicio de ONi fue a criterio del médico tratante, no es posible observar de forma directa los efectos de dichas intervenciones con una distribución aleatoria como sería posible en un ensayo clínico aleatorizado; 2) el tamaño limitado de la muestra; 3) es posible que los pacientes que recibieron ONi tuvieran un mayor compromiso en la oxigenación producto de comorbilidades asociadas.
Nuestro centro hospitalario es una de las pocas sedes en el país que cuenta con la infraestructura física y de personal capacitado para el uso seguro del ONi.
Los resultados obtenidos permiten apreciar el efecto del ONi en el intercambio gaseoso que permitió optimizar el soporte ventilatorio para lograr metas de protección alveolar, las cuales poseen un efecto directo en la supervivencia de estos pacientes.
Conclusiones
El efecto del óxido nítrico inhalado en la mecánica ventilatoria y oxigenación de pacientes con hipoxemia grave refractaria a prono prolongado y bloqueo neuromuscular secundaria a infección por SARS-CoV-2 no se asoció a reducción en la mortalidad ni mejoría en la oxigenación con significancia estadística; sin embargo, la población incluyó pacientes con mayor gravedad y se evidenció una tendencia a la reducción de la mortalidad general, situación que pudo verse influenciada por el tamaño de muestra.
El uso de óxido nítrico inhalado permitió la reprogramación del soporte ventilatorio para lograr metas de protección alveolar, particularmente la presión de conducción menor a 15 cmH2O, meta que ha demostrado reducir la mortalidad en pacientes con SIRA.
La mayor duración en la Unidad de Cuidados Intensivos, así como del soporte ventilatorio se encuentra influenciada por un estado de gravedad mayor previo al inicio del Oni, por comorbilidades (diabetes mellitus, obesidad, neumopatía) y la presencia de fases avanzadas de afección pulmonar.
Consideramos que nuestro estudio da pauta a la posibilidad de desarrollar ensayos clínicos bajo protocolos bien definidos, que permitan evaluar de forma objetiva las potenciales ventajas terapéuticas del óxido nítrico inhalado en pacientes con hipoxemia grave refractaria secundaria a infección por SARS-CoV-2.











 nueva página del texto (beta)
nueva página del texto (beta)