Introducción
Choque es una breve pausa en el acto de morir y lo que el médico haga durante esa pausa es lo que lo definirá como tal. De acuerdo a la definición del Consenso de Choque Circulatorio y Monitoreo Hemodinámico del grupo de trabajo de la Sociedad Europea de Medicina Crítica, es también una forma generalizada de falla circulatoria aguda asociada con inadecuada utilización de oxígeno (O2) por las células que pone en riesgo la vida.1
De acuerdo con su presentación clínica y sus etiologías, se identifican varios escenarios del estado de choque (EC):2
Choque hipovolémico: disminución del retorno venoso secundario a pérdida del volumen circulante. Es la causa de 16% de todos los choques.
Choque cardiogénico: falla de la función de bomba del corazón por disminución de la contractilidad o por arritmia: es la causa de 17% de todos los choques.
Choque obstructivo: falla circulatoria por obstrucción al llenado de las cámaras de la bomba cardiaca o a la salida del flujo circulatorio. Es la causa de 5% de todos los choques, si bien es el menos frecuente, también es uno de los que requieren una mayor destreza para llegar al diagnóstico.
Choque distributivo: pérdida del tono vascular que condiciona mal aporte del flujo sanguíneo a los tejidos y disminución del retorno venoso,1 este grupo en particular puede diferenciarse en tres subgrupos: choque neurogénico, choque anafiláctico y choque séptico (CS), siendo este último el más frecuente en la terapia intensiva con 62%,3-6 ver características comparativas de los distintos escenarios en la Tabla 1.
Tabla 1: Tipos de choque.
| Tipo de choque | Hallazgos clínicos | Pletismografía | GC | PoAP | RVS | SvcO2 (%) | Hallazgos de laboratorio |
|---|---|---|---|---|---|---|---|
| Distributivo | Extremidades calientes, febril | Onda tipo 5, 6 | Disminuido | Disminuido | Disminuido | > 70 | Lactato elevado, cultivos positivos, leucocitosis |
| Hipovolémico | Extremidades frías, mucosas secas | Onda tipo 1, 2, 3 | Disminuido | Disminuido | Incrementado | < 70 | Lactato elevado |
| Cardiogénico | Extremidades frías, edema distal, ingurgitación yugular | Variabilidad pletismográfica ausente | Disminuido | Incrementado | Incrementado | < 70 | Lactato, troponinas, BNP elevados |
| Obstructivo | Extremidades frías, ausencia de sonidos respiratorios, ingurgitación yugular | Variabilidad pletismográfica muy marcada | Disminuido | Variable | Incrementado | < 70 | Lactato elevado |
GC = gasto cardiaco, PoAP = presión de oclusión de arteria pulmonar, RVS = resistencias vasculares sistémicas, SvO2 = saturación venosa de oxígeno, BNP = péptido natriurético cerebral.
¿Con qué herramientas contamos?
Tiempo de llenado capilar (TLC)
Un TLC > 3 segundos identifica a pacientes con compromiso hemodinámico, pero el clínico debe determinar si el compromiso es a nivel de la circulación local (aterosclerosis, estenosis, etcétera) o sistémico (bajo gasto cardiaco).7 La combinación de sospecha de infección y/o aumento de temperatura > 38 oC más el hallazgo de llenado capilar < 2 segundos debe incluir en nuestros diagnósticos diferenciales la presencia de sepsis.
Autocontrol de la temperatura
Mientras usted lee este artículo, quizá está tomando café o una bebida fría, prácticamente nada de lo que esté a su alrededor tiene su misma temperatura, que estará alrededor de 36 oC, todo a su alrededor está tratando de aumentar o disminuir su temperatura; mientras el ambiente no sea muy extremo y sus mecanismos de autorregulación funcionen, usted conservará su temperatura, lo anterior es el triunfo hemodinámico más grande de la fisiología, por lo que si alguien presenta hipotermia que no se deba a extremos de temperatura ambiental, debemos dar por hecho que la autorregulación del paciente ha fracasado en el mantenimiento de la homeostasis. En resumen, si usted toca al paciente y percibe la piel fría, está ante un caso que ha fracasado en la tarea más importante de la fisiología hemodinámica: producir energía y mantener la temperatura corporal adecuada para el mantenimiento de las funciones del organismo. Ninguna acción fisiológica del organismo funciona adecuadamente en presencia de fiebre o hipotermia. La fiebre le indica al clínico que el organismo está defendiéndose de una probable agresión,8-10 la hipotermia debe alertar al clínico que el caso ha perdido la capacidad de defenderse ante cualquier agresión y está ante uno de los pacientes más graves que atenderá durante su guardia.
Índice de piel marmórea
El primero en señalar que la piel marmórea identificaba a los pacientes con mayor riesgo de mortalidad fue Hipócrates. En la actualidad, la identificación de la piel marmórea más allá de las rodillas es un indicador de mortalidad más exacto que cualquier parámetro de monitoreo hemodinámico invasivo o medición de niveles de lactato. Observar detenidamente al paciente siempre nos da una muy valiosa información.
Índice de choque sistólico (IS = FC/TAS)
Cuando es > 1 es un indicador de hipovolemia, aun cuando la frecuencia cardiaca (FC) y tensión arterial sistólica (TAS) por separado estén en valores que no parecieran de alarma.11,12 Incluso no se necesita una calculadora: si la FC es mayor que la TAS, el paciente tiene algún grado de deterioro hemodinámico.
Índice de choque diastólico (ISD = FC/TAD)
Es la relación entre la FC y la tensión arterial diastólica (TAD), cuando es > 2 traduce estados de hipoperfusión especialmente en órganos que dependen principalmente de perfusión diastólica como el cerebro, riñón y circulación coronaria.13
Saturación venosa central de O2 (SvcO2)
Si se cuenta con catéter venoso central (CVC) se puede medir la saturación de O2 en la sangre justo por encima de la aurícula derecha, lo que conocemos como SvcO2. Nosotros recomendamos el siguiente algoritmo para el análisis de los componentes de la saturación venosa central (Figura 1).
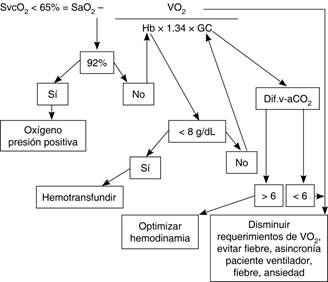
Figura 1: Algoritmo de abordaje ante SvcO2 baja. SvcO2 = Saturación venosa central de oxígeno, SaO2 = Saturación arterial de oxígeno, Hb = Hemoglobina, VO2 = Consumo de oxígeno, GC= Gasto cardiaco, Dif.v-aCO2 = Diferencia venosa arterial de dióxido de carbono.
Diferencia venosa-arterial de dióxido de carbono (Dif.v-aCO2) o GapvaCO2.
La Dif.v-aCO2 puede ser empleada para determinar si el gasto cardiaco es suficiente para cumplir los requerimientos metabólicos del paciente o no.14 Si la Dif.v-aCO2 es < 6 milímetros de mercurio (mmHg) no sabemos cuánto gasto cardiaco tiene el paciente, pero sabemos que ese gasto es suficiente para cumplir con las demandas metabólicas que tiene el paciente en ese momento. Si la Dif.v-aCO2 es > 6 mmHg no sabemos cuánto gasto cardiaco tiene el paciente pero sabemos que ese gasto cardiaco es insuficiente para satisfacer las demandas metabólicas que el caso necesita. En palabras del Dr. Michael Pinsky «no existe tal cosa como un gasto cardiaco normal», existe un gasto que cumple con los requerimientos energéticos del paciente o no y la Dif.v-aCO2 nos sirve para saber ante cuál de estas posibilidades estamos.
Medición de lactato
Un nivel de lactato elevado debe indicarnos dos posibilidades, o existe algún nivel de compromiso hemodinámico que impida que el lactato se mantenga por debajo de 2 miliosmoles/litro (mmol/L) o algún proceso de la vía de depuración del lactato no es suficiente para corregir los niveles de lactato. Debemos saber ante cuál de las dos situaciones nos enfrentamos. Guiar la reanimación por los niveles de lactato no es una buena idea, ya que el tiempo de depuración no se corresponde con la corrección de la estabilidad hemodinámica del paciente.15
Onda pletismográfica
En la onda de pletismografía (PTG) de la oximetría de pulso se analizan los cambios en la amplitud y la posición de la muesca dicrótica, se definieron seis clases tomando la clase III como tono vascular normal con una muesca colocada entre 20 y 50% de la amplitud de PTG. La clase I a II representó vasoconstricción con una muesca colocada > 50% en una PTG pequeña, mientras que la clase IV a VI describió una vasodilatación con una muesca colocada < 20% en una onda PTG alta (Figura 2), la onda PTG clasificó con buena precisión (98.4 y 97.8%), sensibilidad (100 y 94.9%) y especificidad (97.9 y 99.2%) para detectar episodios de hipotensión e hipertensión, respectivamente.16
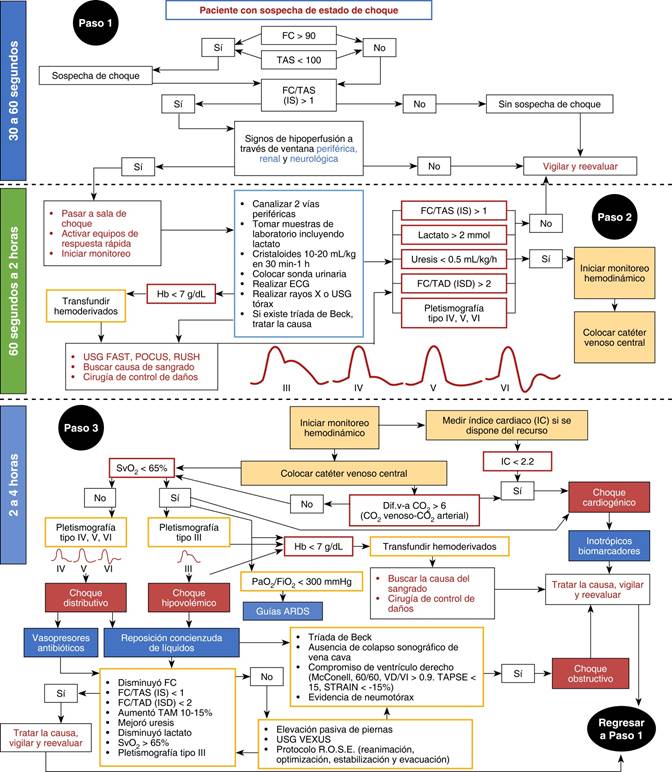
Figura 2: Algoritmo emergencias médicas de Chiapas para pacientes en estado de choque. T = temperatura, oC = grados centígrados, s = segundos, FC = frecuencia cardiaca, TAS = tensión arterial sistólica, ISD = índice de choque diastólico, ECG = electrocardiograma, Rx = radiografía, USG = ultrasonido, Hb = hemoglobina, FAST = ultrasonido abdominal enfocado a trauma, RUSH = ultrasonido rápido para choque e hipotensión, POCUS = ultrasonido en el foco de atención, VEXUS = ultrasonido para congestión venosa, IC = índice cardiaco, SvO2 = saturación venosa central de oxígeno, CO2 = dióxido de carbono, Dif.v-aCO2 = diferencia venoarterial de dióxido de carbono, PaO2/FiO2 = presión arterial de oxígeno/fracción inspirada de oxígeno, TAM = tensión arterial media, TAPSE = exclusión sistólica del plano anterior de la tricúspide, VD/VI = relación entre el tamaño del ventrículo derecho en relación al izquierdo, STRAIN = deformación de las fibras miocárdicas, ROSE = reanimación inicial (R), optimización (O), estabilización (S), evacuación (E).
Ultrasonido
Una herramienta indispensable con la que a veces no se cuenta, el ultrasonido (US) tiene un rol fundamental en la diferenciación de los diversos tipos de EC.17 Los protocolos sonográficos con mejores resultados son: ultrasonido FAST (ultrasonido abdominal enfocado a trauma), RUSH (ultrasonido rápido para choque e hipotensión), POCUS (ultrasonido en el foco de atención), VEXUS (ultrasonido para congestión venosa). Un telescopio ampliará nuestra visión del mundo, pero si no sabemos que estamos buscando encontraremos cualquier otra cosa. El ultrasonido es una herramienta muy valiosa, pero si la mano y el ojo no están entrenando a la cabeza y viceversa, ninguna herramienta funciona.
Considerando todo esto, se propuso un algoritmo diagnóstico y terapéutico para identificar y tratar a pacientes con EC (Figura 2) llenando una lista de verificación complementaria para agilizar el proceso (Tabla 2).
Tabla 2: Lista de verificación del algoritmo EMC para pacientes en estado de choque.
| Instrucciones: Responde las preguntas con sí o no colocando una "X" en sólo uno de los cuadros que siguen a la lista. | |||
|---|---|---|---|
| Acción esencial | |||
| Estado clínico | Sí | No | (En caso de responder SI) |
| Signos de hipoperfusión Respuesta motora de Glasgow < 4, Piel marmórea > 3, Llenado capilar > 2.5 seg, T < 35oC |
Entrar a protocolo | ||
| Activar equipos de respuesta inmediata Pasar a sala de choque y/o reanimación Iniciar monitoreo básico |
• Canalizar 2 vías periféricas • Tomar muestras de laboratorio incluyendo lactato, Hemoglobina y pruebas cruzadas, hemocultivo de 2 sitios • Realizar ECG (descartar supradesnivel ST) • Realizar RX/USG FAST, POCUS, RUSH (Manejo inmediato en caso de choque obstructivo) • Colocar sonda urinaria |
||
| Hemoglobina < 7 g/dL | Transfundir hemoderivados | ||
| Sospecha de hipovolemia o trauma | Detener hemorragia, Hartman 1,000 mL en bolo | ||
| Sospecha de sepsis abdominal | Hartman 500 mL en bolo | ||
| Sospecha de sepsis pulmonar | Hartman 250 mL en bolo | ||
| Sospecha de falla cardiaca, PVC > 12 mmHg, S3 | No dar bolo, tratar la falla cardiaca | ||
| Desnivel ST en electrocardiograma | Protocolo infarto agudo al miocardio | ||
| Índice de choque > 1, lactato > 2 mmol/L, uresis < 0.5 mL/kg/h, índice de choque diastólico > 2, llenado capilar > 3 seg | Monitoreo avanzado | ||
| Evaluación subjetiva de resistencias periféricas (ondas de pletismografía tipo IV, V, VI) | • Vasopresores por vía periférica si tensión arterial sistólica < 100 mmHg • Colocar catéter venoso central guiado por ultrasonido de forma no urgente |
||
| SvO2 > 65% | Iniciar vasopresores y antibióticos | ||
| Dif.v-a.CO2 > 6 | Buscar datos de bajo gasto cardiaco, iniciar inotrópicos | ||
| Evaluación y descarte de diferentes tipos de choque | Evaluar pleura, pericardio, bomba, tanque con ultrasonido | ||
¿En qué consiste cada paso del flujograma?
En el paso 1 (que tarda entre 30 a 60 segundos) se identifica rápidamente a los pacientes con sospecha de EC con sus características clínicas y signos vitales, si tiene FC > 90 latidos por minuto (lpm) y TAS < 100 mmHg, se calcula el IS dividiendo la FC/TAS, si es > 1 acompañado de signos de hipoperfusión como TLC > 2.5 segundos, índice de piel marmórea > 3, alteraciones del estado de despierto y deterioro del estado de coma de Glasgow, temperatura < 35 o > 37.6 oC, oliguria o anuria; se activan equipos de respuesta inmediata, se pasa a sala de reanimación o de choque y se inicia monitoreo básico.
En el paso 2 (que va de los 60 segundos a dos horas) se hace abordaje diagnóstico y terapéutico, se canalizan dos vías periféricas y al mismo tiempo se toman muestras de laboratorio que incluyan hemoglobina (Hb), lactato, pruebas cruzadas y hemocultivo de dos sitios, se indican cristaloides (de preferencia Hartman o Ringer Lactato) en dosis de 10-20 mililitros/kilogramo (mL/kg) en 30 minutos a una hora y evaluando su respuesta, se usan auxiliares diagnósticos de rápido acceso como US, electrocardiograma (ECG), radiografías portátiles y se instala sonda urinaria con técnica estéril, si se identifica la causa del sangrado se hace cirugía de control de daños, si tiene Hb < 7 gramos/decilitro (g/dL) se transfunden hemoderivados, en la lista de verificación en caso de sospecha de hipovolemia o trauma se detiene la hemorragia y se administran 1,000 mL de Hartman en bolo, en caso de sospecha de sepsis abdominal se administran 500 mL de Hartman en bolo, sospecha de sepsis pulmonar 250 mL de Hartman en bolo, sospecha de falla cardiaca no dar bolo de cristaloides y tratar la causa, en caso de desnivel del segmento ST del ECG activar el protocolo de infarto agudo al miocardio, en caso de triada de Beck tratar la causa desencadenante. Si después de lo anterior hay mejoría, se le considera fuera ya del protocolo y se le mantiene en vigilancia y revaluación constante, pero si el IS continúa > 1, lactato > 2 mmol/L, uresis < 0.5 mililitros/kilogramo/hora (mL/kg/h), TLC > 3 seg, ISD > 2, onda PTG tipo IV, V o VI y persisten datos de hipoperfusión, entonces se continúa al siguiente paso y se inicia monitoreo hemodinámico avanzado.
En el paso 3 se coloca CVC con técnica estéril guiado por US de forma no urgente, se pueden usar vasopresores por vía periférica en caso de sospecha de choque séptico, se inicia monitoreo avanzado, si se dispone del recurso (ecocardiografía o dispositivos de medición de gasto cardiaco) se mide índice cardiaco (IC), si es < 2.2 se trata de choque cardiogénico, si no hay cómo medir IC, medir SvcO2, si es < 65% con Hb > 7 g/dL y la Dif.v-aCO2 es > 6 mmHg se le considera choque cardiogénico y requiere inotrópicos, medición de biomarcadores y tratar la causa desencadenante ya sea falla cardiaca, infarto agudo al miocardio, disfunción miocárdica por sepsis o miocardiopatía dilatada.
Si clínicamente hay tríada de Beck, ausencia de colapso sonográfico de vena cava, compromiso del ventrículo derecho y evidencia de neumotórax, se trata de choque obstructivo y amerita de forma urgente tratar la causa y reevaluar.
Si tiene SvO2 > 65%, con ondas PTG tipo IV, V, VI con sospecha o evidencia de sepsis, se trata de choque distributivo en su variedad de choque séptico, se inician antibióticos y vasopresores y se trata la causa desencadenante, si la causa desencadenante es por choque neurogénico amerita vasopresores y tratar la causa, si es por choque anafiláctico amerita vasopresores, adrenalina, antihistamínicos y tratar la causa.
Si tiene SvcO2 < 65% con Hb < 7 g/dL con ondas PTG tipo I, II, III se trata de choque hipovolémico y requiere reposición de líquidos evaluando la respuesta a fluidos y los parámetros clínicos y bioquímicos de resolución, se puede usar el protocolo ROSE (Figura 1), apoyarse con US, usando predictores de respuesta a volumen y reevaluación constante de estado clínico hasta tener criterios de resolución.18,19 Si tiene SvcO2 < 65% con Hb normal o baja pero con saturación periférica de O2 (SpO2) < 92% requiere O2 y presión positiva.
Conclusión
Para manejar pacientes con estado de choque se requiere evaluación clínica, actuación rápida con pasos estructurados sustentados en evidencia, diferenciando los diversos tipos de choque ayudándose con auxiliares diagnósticos y dando tratamiento, limitando el daño de las lesiones primarias y secundarias, no hacer daño con el manejo y revaluando la respuesta constantemente, siguiendo esta propuesta de algoritmo y lista de verificación se pueden lograr esos objetivos.











 nueva página del texto (beta)
nueva página del texto (beta)


