Introducción
El síndrome respiratorio agudo severo por coronavirus 2 (SARS-CoV-2) ha surgido como una nueva patología humana, causando una pandemia mundial en 2020, con más de 61 millones de infecciones confirmadas y más de un millón de muertes hasta la fecha; en México actualmente se han reportado 104.242 defunciones.1 El 30 de enero de 2020, la Organización Mundial de la Salud declaró que la epidemia de SARS-CoV-2 era una emergencia de salud pública de importancia internacional.2 La enfermedad grave ocurre en aproximadamente 14% de los pacientes con COVID-19 y alrededor de 6% requiere cuidados intensivos; la tasa de mortalidad de los pacientes que requieren de terapia intensiva se acerca a 50%.3 Los pacientes críticos tienen un alto riesgo de desarrollar enfermedad tromboembólica venosa (ETEV) con incidencias que varían de 13 a 30% sin profilaxis antitrombótica4 y de 5.8 a 15.5% cuando reciben tromboprofilaxis.5
La entrada del coronavirus en las células huésped está mediada por la glicoproteína de pico transmembrana (S) que forma homotrímeros que sobresalen de la superficie viral.6 La glicoproteína S comprende dos subunidades funcionales responsables de la unión al receptor de la célula huésped (subunidad S1) y la fusión de las membranas viral y celular (subunidad S2). Para muchos CoV, la glicoproteína S se escinde en el límite entre las subunidades S1 y S2, que permanecen unidas de forma no covalente en la conformación de prefusión.7
La tromboinflamación es la formación patológica de trombos en respuesta a estímulos inflamatorios. Se sospecha que desempeña un papel fundamental en el desarrollo de la CID (coagulación intravascular diseminada), así como en la trombosis arterial y venosa.8 Se ha especulado que la tromboinflamación resultante de la activación inmunitaria patológica por monocitos y otras células inmunitarias podría ser el mecanismo por el cual se produce la hipercoagulabilidad relacionada con COVID-19.9
Al pensar en que la infección por COVID-19 es un estado trombofílico con gran daño endotelial, resulta interesante verificar cuál es el comportamiento de los pacientes en diferentes fases del sistema hemostático.
Objetivo: describir las alteraciones a nivel hemostático mediante la técnica de tromboelastografía en pacientes con SARS-CoV-2.
Material y métodos
El tromboelastograma es el método de laboratorio por el cual se miden los siguientes parámetros:
Tiempo de coagulación o tiempo de reacción (R): es el tiempo transcurrido desde el comienzo de la prueba en el que se agrega el activador de la coagulación hasta el momento que se logra una amplitud de 2 mm. Describe la rapidez en la formación de fibrina que es una medida de la velocidad de generación de trombina. Depende de los factores de coagulación y la presencia de anticoagulantes.10
Tiempo de formación del coágulo o tiempo de apertura (K): es el tiempo transcurrido entre 2 y 20 mm de amplitud de la señal de coagulación. Describe la cinética de la formación de un coágulo estable por la acción de la trombina generada. Los factores influyentes principales son la cantidad de trombina generada, la cantidad de plaquetas y su contribución a la firmeza del coágulo, el nivel de fibrinógeno y su capacidad de polimerizar.10
Ángulo Alfa (α). Se define como el ángulo entre el eje medio y la tangente de la curva de coagulación que atraviesa el punto de amplitud de 2 mm. Describe la cinética de la coagulación. Es un parámetro relacionado al K. 10
Firmeza máxima del coágulo o máxima amplitud (MA). Es la medida de la firmeza del coágulo y, por lo tanto, de la calidad del mismo. Los factores que influyen sobre este parámetro son cantidad de plaquetas, fibrinógeno (concentración y capacidad de polimerizar), factor XIII y presencia de fibrinólisis.10
Valores A (mm). Representa la firmeza del coágulo a un cierto tiempo x después del R, los factores que influyen son los mismos que en la firmeza máxima del coágulo.10
Parámetros de lisis. Índice de lisis a 30 min (Ly30) (%) representa la fibrinólisis 30 minutos después del TR. La lisis máxima (ML) (%) describe el grado de fibrinólisis en relación con la MA lograda durante la medición (Figura 1).10
Presentación del caso
Se recabaron las características clínicas de 11 pacientes que ingresaron a la Unidad de Terapia Intensiva (UTI) de marzo de 2020 a agosto de 2020 (Tabla 1), con prueba positiva para SARS-CoV-2 a los que se les determinó tromboelastografía en las primeras 24 horas de ingreso a la UTI, de los cuales nueve fueron del género masculino y dos del género femenino, con un promedio de edad de 61.8 años y un rango de 37 a 86 años, tres de ellos tenían diabetes mellitus tipo 2 e hipertensión arterial sistémica, uno diabetes mellitus tipo 2, uno con artritis gotosa, uno con hipertensión arterial sistémica y enfermedad renal crónica y cinco sin enfermedades crónicas. Ocho (72.7%) de los pacientes desarrollaron choque séptico y ameritaron ventilación mecánica invasiva (VMI) por SARS-CoV-2, siete (63.6%) fallecieron y cuato (36.6%) se egresaron de UTI, tres únicamente requirieron apoyo con puntas nasales de alto flujo (PNAF) sin requerir aminas vasopresoras. Todos los pacientes estaban bajo tratamiento con heparina de bajo peso molecular (enoxaparina) a dosis de 1 mg/kg/12 horas. El comportamiento de los tromboelastogramas se observa en las Figuras 2 y 3 y el resultado de su interpretación se observa en la Tabla 2. Sólo un paciente presentó sangrado de tubo digestivo alto, al cual se le identificó una tumoración en duodeno al realizar la endoscopia.
Tabla 1: Características clínicas de los pacientes ingresados a Unidad de Terapia Intensiva.
| Paciente | Edad (años) | Género | Comorbilidades | SpO2/FiO2 | SARS-CoV-2 | Estado clínico | Fallecimiento |
|---|---|---|---|---|---|---|---|
| 1 | 37 | Femenino | Ninguna | 100 | Positivo | Choque séptico, VMI, Staphylococcus hominis | Sí |
| 2 | 78 | Femenino | DM, HAS | 70 | Positivo | Choque séptico, VMI, cultivos negativos | Sí |
| 3 | 56 | Masculino | Ninguna | 52 | Positivo | Choque séptico, VMI, E. coli BLEE + | Sí |
| 4 | 42 | Masculino | Ninguna | 70 | Positivo | Choque séptico, VMI, cultivos negativos | No |
| 5 | 64 | Masculino | DM, HAS | 70 | Positivo | PNAF, sin cultivos | No |
| 6 | 57 | Masculino | DM | 88 | Positivo | Choque séptico, VMI, P. aeruginosa MDR, Klebsiella BLEE + | Sí |
| 7 | 58 | Masculino | Ninguna | 75 | Positivo | Choque séptico, VMI, E. coli BLEE, P. aeruginosa | Sí |
| 8 | 86 | Masculino | DM, HAS | 89 | Positivo | Choque séptico. PNAF,VMI, sin cultivos | Sí |
| 9 | 75 | Masculino | Artritis gotosa | 153 | Positivo | PNAF, sin cultivos | No |
| 10 | 52 | Masculino | HAS, ERC | 102 | Positivo | PNAF, sin cultivos | No |
| 11 | 75 | Masculino | Ninguna | 85 | Positivo | Choque séptico, VMI, cultivos negativos | Sí |
DM = diabetes mellitus, HAS = hipertensión arterial sistémica, ERC = enfermedad renal crónica, VMI = ventilación mecánica invasiva, PNAF = puntas nasales de alto flujo, MDR = multidrogo resistente.
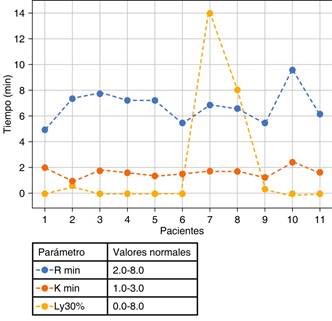
Figura 2: Tiempo de reacción, tiempo de formación de coágulo e índice de lisis a los 30 minutos. R = tiempo de reacción (línea azul), K = tiempo de formación de coágulo (línea naranja), Ly30% = lisis a los 30 minutos (línea amarilla).
Tabla 2: Características de tromboelastograma y estudios de laboratorio.
| Paciente | R | K | MA | LY | TP | TTPa | Plaquetas | Dímero D | Fibrinógeno | Dosis de HBPM mg/kg/12 horas | |||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| min | min | mm | 30% | seg | seg. | INR | × 109/L | mg/L | mg/dL | Interpretación | Sangrado | ||
| 1 | 4.9 | 2.0 | 48.4 | 0.0 | 11.2 | 26.0 | 1.3 | 439 | 538 | 742 | Anormal* | 1.0 | No |
| 2 | 7.1 | 0.9 | 71.1 | 0.7 | 14.3 | 18.2 | 1.4 | 219 | 1,971 | 935 | Anormal/hipercoagulabilidad | 1.0 | No |
| 3 | 7.7 | 1.8 | 68.9 | 0.0 | 16.7 | 15.5 | 1.17 | 214 | 1,165 | 865 | Normal | 1.3 | No |
| 4 | 7.0 | 1.5 | 64.3 | 0.0 | 14.4 | 28.0 | 1.11 | 108 | 2,280 | 1,150 | Anormal, hipercoagulabilidad | 1.0 | STDA |
| 5 | 7.0 | 1.3 | 72.1 | 0.0 | 14.8 | 14.8 | 1.08 | 203 | 819 | 832 | Anormal, hipercoagulabilidad | 1.0 | No |
| 6 | 4.9 | 1.3 | 70.7 | 0.1 | 14.5 | 15.2 | 1.12 | 157 | 5,030 | 626 | Normal | 1.0 | No |
| 7 | 6.5 | 1.7 | 54.6 | 14.0 | 13.4 | 19.3 | 1.16 | 158 | 9,755 | 620 | Anormal, hiperfibrinólisis | 1.0 | No |
| 8 | 6.2 | 1.7 | 66.2 | 7.9 | 16.8 | 20.5 | 1.10 | 393 | 3,294 | 725 | Anormal, hiperfibrinólisis, hipercoagulabilidad | 1.1 | No |
| 9 | 4.9 | 1.3 | 70.7 | 0.3 | 14.7 | 14.6 | 1.25 | 234 | 1,456 | 638 | Normal | 1.0 | No |
| 10 | 9.4 | 2.4 | 67.8 | 0.0 | 16.4 | 15.0 | 1.20 | 387 | 752 | 594 | Anormal, anticoagulado | 1.2 | No |
| 11 | 5.9 | 1.5 | 63.0 | 0.1 | 15.0 | 16.7 | 1.28 | 220 | 754 | 450 | Normal | 1.2 | No |
HBPM = heparinas de bajo peso molecular, * Muestra disminución de la firmeza del coágulo; sin embargo, no era suficiente para incrementar la lisis del coágulo, STDA = sangrado de tubo digestivo alto, R = tiempo de coagulación, K = tiempo de formación del coágulo, MA = máxima amplitud, LY30% = fibrinólisis a los 30 minutos de R, TP = tiempo de protombina, TTPa = tiempo de tromboplastina parcial activado, INR = índice internacional normalizado.
Los cultivos reportaron infección agregada por: Staphylococcus hominis uno, Escheriquia coli betalactamasas de espectro extendido (BLEE) (+) dos, Pseudomonas multidrogo resistente uno, Klebsiella BLEE (+) uno, Pseudomonas aeruginosa no multidrogo resistente uno. Pacientes con cultivos negativos cuatro (36.3%).
Discusión
La tromboelastometría (TEM) y tromboelastografía (TEG) son técnicas que describen la interacción entre distintos componentes del sistema hemostático, como son los factores de la coagulación, fibrinógeno, plaquetas y sistema fibrinolítico, ya que trabaja en sangre total y se evalúan en tiempo real las características cinéticas y viscoelásticas del coágulo (Figura 3).10
La utilización de diferentes pruebas que utilizan diferentes activadores para evaluar las vías de activación de la coagulación in vitro (factor tisular, ácido elágico, caolín en presencia de calcio) así como diferentes inhibidores de algún componente fundamental en el proceso de formación del coágulo, o para erradicar la presencia de anticoagulantes (citocalasina D, ácido tranéxamico, heparinasa I entre otros), permite mediante la adecuada interpretación visualizar las alteraciones hemostáticas específicas de sangrado.10 Dentro de los pacientes analizados se corrieron pruebas con caolín, un activador del factor XII, y otras con citrato nativo, ambas con heparinasas. Observando que las pruebas con citrato nativo, más tardado y sensible a factores externos en su totalidad, son las que se asocian a tener mayores datos de anormalidad encontrando hipercoagulabilidad.
En el presente registro analizamos el momento de la toma del TEG, correlacionando con la situación clínica del paciente basándonos en el registro de los parámetros obtenidos del TEG, observamos dentro de las características de los pacientes de esta serie de casos que no hubo presencia de trombocitopenia, tampoco elevación del índice internacional normalizado (INR por sus siglas en inglés) y los valores de protrombina (TP) y tiempo de tromboplastina parcial activado (TTPa) fueron muy variables. Se ha observado que las anomalías hemostáticas más consistentes con COVID-19 incluyen trombocitopenia leve11 y niveles elevados de dímero D12, que se asocian con un mayor riesgo, asistencia de ventilación mecánica invasiva, ingreso en la Unidad de Terapia Intensiva o muerte. La gravedad de la enfermedad es variable, asociada con la prolongación del tiempo de TP, el INR13 y el tiempo de trombina (TT),14 y de forma variable por una tendencia a la reducción del TTPa.15 Sin embargo, aún se desconoce si estos cambios hemostáticos son un efecto específico del SARS-CoV-2 o son una consecuencia de la tormenta de citocinas que precipita la aparición del síndrome de respuesta inflamatoria sistémica (SIRS), como se observa en otras enfermedades virales.16
Un estudio reciente de 64 pacientes críticamente enfermos con síndrome de insuficiencia respiratoria aguda por COVID-19 mostró que 50% tenía un perfil de hipercoagulabilidad, el predominante se relaciona con la función plaquetaria y el fibrinógeno, como lo demuestra la máxima amplitud (MA) elevada. Tampoco observaron elevaciones significativas del INR, ni recuentos bajos de fibrinógeno o plaquetas. Sin lograr demostrar una asociación entre las variables de tromboelastografía y los eventos de ETEV o el resultado combinado de ETEV y mortalidad.17 El perfil de coagulación fue muy variable entre los casos analizados, observándose patrones de hipercoagulabilidad 36.3%, hiperfibrinólisis 9.0% y normales 36.3%, también valores elevados de fibrinógeno 100%.
Otro de los posibles factores implicados en la coagulopatía asociada a COVID-19 es la hipoxia, característica de los casos de neumonía grave. Durante la respuesta celular a la hipoxia se activan factores transcripcionales tales como el complejo activador de proteína-1 (AP-1), factor de crecimiento de respuesta temprana-1 (Egr-1), NF-B y factores inducidos por hipoxia (HIF). El más estudiado es el HIF-1, que bajo condiciones de hipoxia, es responsable de la activación de una serie de proteínas implicadas en el mantenimiento de la homeostasis vascular.18 En nuestra serie de casos observamos que los pacientes presentaban SARS-CoV-2, lo cual los predisponía a estado hipercoagulable.
En los casos en los que no existen contraindicaciones, la anticoagulación terapéutica empírica ha sido propuesta por la Sociedad Americana de Hematología en los siguientes casos: pacientes intubados que desarrollan hallazgos clínicos y de laboratorio repentinos altamente compatibles con EP (embolia pulmonar); pacientes con hallazgos físicos compatibles con trombosis (tromboflebitis superficial, isquemia periférica o cianosis, trombosis de filtros de diálisis, tubos o catéteres); pacientes con insuficiencia respiratoria, particularmente cuando los niveles de dímero D y/o fibrinógeno son muy altos, en los que se sospecha mucho de EP o trombosis microvascular y no se identifican otras causas (por ejemplo SIRA, sobrecarga de líquidos).19 Sin embargo, aún se desconoce cuál es la manera adecuada de identificar a las personas con mayor riesgo de complicaciones trombóticas y definir quiénes pueden beneficiarse de un tratamiento más agresivo, más allá de la tromboprofilaxis estándar, ya que observamos que a pesar de mantener en dosis terapéuticas la heparina de bajo peso molecular, algunos pacientes continuaban con tendencia a la hipercoagulabilidad.
Conclusiones
En este reporte de 11 pacientes en estado crítico por SARS-CoV-2 se observó que a pesar de contar con anticoagulación a dosis terapéutica de heparina de bajo peso molecular, 36.36% de los pacientes permanecía en estado de hipercoagulabilidad en la tromboelastografía. Las tromboelastografias con citrato nativo probablemente sean más sensibles para detectar el perfil de hipercoagulabilidad. El perfil predominante hipercoagulable no se asoció a la función plaquetaria, ya que la MA se mantuvo dentro de límites normales, no existe correlación entre las pruebas convencionales de coagulación (TP, TTPa, fibrinógeo y dímero D). La dosis terapéutica de HBPM (heparinas de bajo peso molecular) no garantiza mantener a los pacientes con SARS-CoV-2 en perfil de anticoagulación.











 nueva página del texto (beta)
nueva página del texto (beta)




