Introducción
En diciembre de 2019, un nuevo coronavirus, llamado coronavirus 2 (SARS-CoV-2) que genera síndrome respiratorio agudo severo, dio lugar a una epidemia en Wuhan, China. La Organización Mundial de la Salud (OMS) denominó a esta enfermedad «Enfermedad por Coronavirus 2019» (COVID-19).1
Éste se fue extendiendo a diversas regiones del mundo, por lo que el 16 de abril del 2020 la OMS informó un total de 1,995.983 casos a nivel mundial, con una mortalidad media de 6.57%. El COVID-19 se había convertido en una pandemia y había afectado a más de 120,000 personas en más de 80 países y resultó en más de 5,000 muertes en todo el mundo.
Tan sólo en este año, para el 04 de febrero de 2021 ya se habían reportado 105,333.798 casos. El 27 de febrero de 2020, la Ciudad de México reportó el primer caso de COVID-19, seguido de un gran aumento en contagios. El número total de casos hasta hoy es de 2,728,164 con 39,889 casos activos estimados. El 18.77% de los pacientes ha requerido hospitalización. El número total de muertes es de 246,006.2-6
Las presentaciones clínicas de COVID-19 pueden ir desde una infección asintomática, síntomas autolimitados parecidos a los de la gripe, neumonía aguda hasta insuficiencia respiratoria grave que requiere ventilación mecánica invasiva.7
Alrededor de 5 a 15% de los pacientes con infección por COVID-19 (enfermedad por coronavirus) requieren vigilancia de cuidados intensivos y soporte ventilatorio.
Aunque los datos de incidencia son limitados, una gran serie de casos de 1,300 pacientes con COVID-19 de Italia encontró que 88% de los pacientes críticamente enfermos requirieron ventilación mecánica.8
La enfermedad por COVID-19 severa se caracteriza por una intensa inflamación pulmonar y sistémica. Con ocupación alveolar/intersticial por edema no cardiogénico, vasoplejía del sistema capilar pulmonar por daño endotelial e incremento del espacio muerto, esto se debe a la pérdida de la vasoconstricción por hipoxia, debido a la pérdida de autorregulación, secundario al daño endotelial por el virus. Como evolución de la enfermedad, el daño del parénquima pulmonar incrementa hasta generar aumento del peso pulmonar por ocupación alveolo/intersticial y limitar el flujo en la ventilación por colapso (atelectrauma) reduciendo su tamaño ventilable. De igual forma, se ha mostrado evidencia de citopatía viral directa que implica un daño directo inducido por el virus mayor que la respuesta inflamatoria generalizada.9
En casos graves de infección, puede producirse una combinación de desregulación inflamatoria sistémica, lesión multiorgánica y afectación microangiopática diseminada, lo que da lugar a una evolución imprevisible de la enfermedad.10
Estos efectos sistémicos, junto con el uso de ventilación mecánica y la posible exposición a agentes nefrotóxicos (cuya exposición se ha relacionado con la LRA en entornos no relacionados con la COVID-19), han dado lugar a que la LRA sea una característica comúnmente reconocida en el paciente crítico con enfermedad grave por COVID-19.11
Además, el desarrollo de la LRA se reconoce ahora como un factor de riesgo independiente de muerte por todas las causas en los pacientes hospitalizados por COVID-19 y es la lesión orgánica extrapulmonar más común en aquellos con COVID-19.12
La LRA se encontró en 28% de los pacientes hospitalizados y en 46% de los pacientes en estado crítico, contribuyendo a una mortalidad significativamente mayor. En recientes estudios, se ha encontrado una incidencia acumulativa de LRA en el COVID-19, que oscila entre 0.9 y 29%, siendo los pacientes en estado crítico los más propensos a desarrollar LRA.
Un metaanálisis reciente mostró que 20% de los pacientes con COVID-19 pueden necesitar terapia de reemplazo renal (con tasas que varían entre 5 y 60%), por lo que su efecto sobre los resultados es de especial interés.13
La identificación de los factores de riesgo es relevante para orientar la toma de decisiones tempranas en la clasificación de los pacientes para una monitorización más intensiva y prevenir el aumento de la mortalidad.14,15
Factores de riesgo para lesión renal
El primer estudio en China reportó una incidencia baja de lesión renal agua (0.5-3%) y reportaron que estos pacientes estaban relativamente sanos al inicio, únicamente 7% tenía antecedentes de diabetes mellitus (DM), 15% hipertensión arterial y sólo 1% enfermedad renal crónica.11
En Estados Unidos, se realizaron dos cohortes, donde se obtuvo una incidencia de LRA de 36.6%. En este estudio, la LRA se presentó en una fase temprana de la enfermedad y más de 30% de los pacientes con LRA ingresaron a la Unidad de Terapia Intensiva o la desarrollaron en las primeras 24 horas.11
La LRA se observó en los pacientes con insuficiencia respiratoria (23.2% con ventilación mecánica invasiva [VMI] vs 0.2% en los que no se encontraban con VMI).
De los pacientes en ventilación mecánica, 52.2% tuvieron el inicio de la lesión renal aguda (LRA) en las 24 horas siguientes a la intubación y 14.3% recibió terapia de reemplazo renal (TRR) y 96.8% se encontraban con VMI.16
Los factores de riesgo reportados fueron: edad avanzada, diabetes mellitus, enfermedades cardiovasculares, raza negra, hipertensión arterial sistémica y necesidad de ventilación mecánica y vasopresores.16
En otra cohorte en Estados Unidos, encontraron que la LRA se presentó en 46% de los pacientes y 20% requirió TRR, y la proporción en los estadios de lesión renal 1, 2 y 3 fue de 35, 20 y 45%, respectivamente. En los que necesitaron cuidados intensivos, las proporciones respectivas fueron de 20, 17 y 63%, lo que sugiere una asociación entre la IRA grave y la enfermedad grave.17
En otro estudio, Mohamed y su grupo encontraron que tanto el índice de masa corporal aumentado y sexo masculino se asocian también a desarrollo de LRA, así como los factores previamente descritos: diabetes mellitus, hipertensión arterial, enfermedades cardiovasculares, edad avanzada y lesión renal previa.18
Pei y colegas, en el 2020, reportaron en su estudio que la presencia de niveles elevados de biomarcadores de inflamación sistémica, como la proteína C reactiva, la ferritina y lactato deshidrogenasa, se asocia con el desarrollo de LRA, al igual que la gravedad de la enfermedad y la progresión a la ventilación mecánica. También se reportó que el uso de agentes nefrotóxicos, así como la adopción de una política de reanimación restrictiva de líquidos, también puede preceder al desarrollo de LRA en pacientes con COVID-19.19
Fisiopatología
La literatura hasta ahora reporta que es poco probable que un único mecanismo sea el responsable del deterioro renal, se sugiere que es consecuencia de varios que ocurren de forma aislada o al mismo tiempo. En un estudio, Hirsch observó que más de 40% de los pacientes presentaban proteinuria y hematuria y esto se puede deber sin un cambio funcional significativo y, por lo tanto, la evaluación de la lesión renal sólo a través de los marcadores clásicos de lesión renal aguda puede pasar por alto algunos casos de nueva lesión significativa.16,20
Hipoperfusión tisular
Se ha descrito que la lesión más común es necrosis tubular aguda, esto secundario a la mala perfusión renal por depleción de volumen relacionado a procesos infecciosos, además de la infección viral citopática directa, la inflamación grave y la tormenta de citocinas resultante de la infección por SARS-CoV-2, en esta última etiología se ha descrito mayormente patología glomerular. Se cree que el desequilibrio entre los vasoconstrictores, los vasodilatadores y el estrés oxidativo a nivel endotelial contribuye en gran medida al desarrollo de la LRA.
Estado de hipercoagulabilidad
Está ampliamente escrito que la infección por COVID-19 provoca lesión endotelial y se asocia a un estado de hipercoagulabilidad, se han observado trombos de fibrina en las asas capilares glomerulares con daño endotelial asociado, por lo que la microangiopatía trombótica renal (MAT) o la trombosis microvascular también pueden contribuir al desarrollo de lesión renal aguda.21-25
Lesión directa citopática
La lesión citopática directa se debe al tropismo que tiene la proteína S del SARS-CoV-2, se une al receptor de la enzima convertidora de angiotensina 2 en las células diana para la invasión directa. El riñón, el pulmón y el tracto gastrointestinal expresan en gran medida la angiotensina 2, pero Pan y su equipo demostraron que la angiotensina 2 se expresaba de forma significativa en los podocitos y los túbulos proximales renales, y que los niveles de expresión eran superiores a los del tejido pulmonar y el tracto gastrointestinal, convirtiendo así el riñón en un posible órgano diana.26
Tormenta de citocinas y estado inflamatorio
La respuesta inflamatoria está asociada a lesión renal aguda por la expresión de altos niveles de citocinas (principalmente interleucina [IL-6, IL-10] y el factor inhibidor de la migración de macrófagos).19
El virus es capaz de interactuar con el receptor de enzima convertidora de angiotensina 2 e introducirse en las células de huésped, iniciando así una respuesta inflamatoria, con liberación masiva de citocinas, principalmente interleucina-6, interleucina-1 y factor de necrosis tumoral alfa, generando disfunción endotelial, trombosis y disfunción orgánica.27
Ventilación mecánica invasiva
En una corte retrospectiva donde se estudió un total de 244 pacientes (68.3%) que desarrollaron LRA posterior al inicio del síndrome de insuficiencia respiratoria aguda, 60 (24.6%) desarrollaron LRA en estadio I, 66 (27%) LRA en estadio II y 118 (48.4%) en estadio III. La mediana del tiempo de aparición de la LRA en el estadio I fue de dos días, mientras que la de los estadios II y III fue de cuatro días.28
Se han propuesto tres mecanismos por los cuales se produce lesión renal aguda:
Hipoxemia severa por activación de factores vasoactivos como el óxido nítrico, la angiotensina II, la endotelina y la bradicinina, así como un reflejo simpático mediado por quimiorreceptores e hipercapnia por vasoconstricción de arteria renal y la estimulación de la liberación de noradrenalina actuando sobre el sistema nervioso simpático.
Efecto sobre el flujo sanguíneo sistémico y renal por disminución de gasto cardiaco, redistribución del flujo sanguíneo intrarrenal y estimulación de las vías hormonales y simpáticas.
Reacción inflamatoria pulmonar por biotrauma y la liberación sistémica de mediadores.29
Es indiscutible que el síndrome de insuficiencia respiratoria aguda es un factor de riesgo para lesión renal aguda, aunque existe gran controversia en cuanto a la ventilación mecánica y presión positiva al final de la espiración (PEEP) elevada como factor de riesgo para desarrollar LRA.30,31
La asociación entre la PEEP y la LRA se ha sugerido en estudios fisiológicos,31,32 pero recientemente Panitchone y su grupo han sugerido una asociación entre la presión máxima de las vías respiratorias y la IRA.28
Mientras que Johannes PC, en una revisión sistemática, describe que PEEP y volumen tidal no modifican riesgo de desarrollar lesión renal aguda. Incluso el estudio EXPRESS no mostró diferencias entre los pacientes tratados con PEEP baja o alta en cuanto a los días libres de lesión renal.16,33,34
Mientras Sharkey describe que el flujo sanguíneo renal depende tanto de la presión de perfusión como de la resistencia vascular renal, y ambas pueden verse alteradas por la PEEP alta, describiendo una PEEP mayor de 7.5 cmH2O. Un aumento de la presión intratorácica provoca caída del retorno venoso que causa un aumento de la presión venosa renal, lo que conduce a un aumento de la resistencia vascular renal y una posterior caída del flujo sanguíneo renal. Asimismo, la disminución del retorno venoso secundaria a un aumento de la presión intratorácica provoca una baja del gasto cardiaco que da lugar a un aumento de la resistencia vascular renal y, por lo tanto, a una disminución del flujo sanguíneo renal.35
Beurton et al, describe en su estudio que limitar el uso de PEEP < 12 cmH2O en pacientes con VMI con SARS-CoV-2 se asoció a una menor necesidad de TRR y una menor proporción de pacientes con LRA KDIGO 3.36,37
Nuttha y colegas encontraron que tanto la ventilación mecánica como el balance de líquidos positivo en las primeras 48 horas de ingreso en la Unidad de Cuidados Intensivos (UCI) se asoció con desarrollo de LRA. Reportaron además que 31.9% requirió TRR y los pacientes que desarrollaron LRA tuvieron una mayor mortalidad a los 90 días en comparación con los que no desarrollaron LRA y únicamente 5% requirieron continuar con TRR una vez egresados del hospital. La recuperación de la función renal se identificó en 81.6% de los pacientes egresados y en 90.9% a los 90 días.38
El desarrollo de lesión renal aguda está directamente relacionado a la presencia de biomarcadores inflamatorios sistémicos que traducen en daño directo. Los mecanismos no específicos incluyen alteraciones hemodinámicas, insuficiencia cardiaca derecha, niveles de PEEP elevados, hipovolemia, administración de fármacos nefrotóxicos y sepsis. No existe un tratamiento específico para la LRA inducida por COVID-19, por ello es imperativo implementar estrategias de ajuste de PEEP, manejo hemodinámico y sistémico para disminuir el riesgo de LRA y así evitar el uso de terapia de reemplazo renal. El desarrollo de LRA es un factor de mal pronóstico y al continuar la progresión y requerir TRR, el aumento de la mortalidad en terapia intensiva es casi inevitable.33,39
Material y métodos
Se realizó un estudio observacional, transversal y retrolectivo en pacientes con ventilación mecánica con SARS-CoV-2 que presentaron lesión renal aguda y necesidad de terapia ingresados en la Unidad de Cuidados Intensivos Respiratorios del Centro Médico ABC. Se incluyeron 210 pacientes con ventilación mecánica por SARS CoV-2. Se tomaron como criterios de inclusión pacientes con expediente electrónico completo mayores de 18 años de edad positivos por la prueba de reacción en cadena de la polimerasa de una muestra nasofaríngea para COVID-19 y que requirieron ventilación mecánica y presentaron lesión renal aguda y terapia de reemplazo renal. Se excluyeron pacientes con antecedente de enfermedad renal crónica, antecedente de trasplante renal, pacientes al ingreso con tasa de filtración glomerular < 30 mL/min/1.73 m2 o niveles de creatinina sérica > 2 mg/dL y pacientes trasladados de otro hospital al no ser posible recabar datos.
Se realizó análisis estadístico de medidas de tendencia central, descriptivo y para la identificación de la variable con mayor impacto para el desarrollo de LRA y terapia dialítica se realizó factor predictivo positivo, prueba Spearman para correlacionar con terapia de reemplazo renal.
El estudio se aprobó por el Comité de Ética del Centro Médico ABC, Ciudad de México (Folio: ABC TAEABC-22-117).
Resultados
Se analizaron variables cualitativas mostradas como frecuencias y proporciones. Se analizó la distribución de variables cuantitativas, evaluando la asimetría y curtosis con un punto crítico de ± 0.5 y ± 1, respectivamente. Aquellas variables con distribución normal se presentaron a través de media y desviación estándar. Las variables con libre distribución se presentaron como mediana y rango intercuartilar.
Se analizaron en total 210 pacientes con ventilación mecánica por SARS-CoV-2 en la Unidad de Cuidados Intensivos Respiratorios del Centro Médico ABC, de los cuales 66 (31.4%) desarrollaron lesión renal aguda y 21 requirieron terapia de reemplazo renal (Tabla 1).
Tabla 1: Características demográficas de la población estudiada. Factores de riesgo para presentar lesión renal aguda.
| No | Sí | 3.00 | Total | ||||
|---|---|---|---|---|---|---|---|
| % | Media | % | Media | % | Media | % | |
| Género | |||||||
| Mujer | 76.9 | 90.9 | 100.0 | 81.4 | |||
| Hombre | 23.1 | 9.1 | 0.0 | 18.6 | |||
| SAPSII | 31.90 | 33.76 | 84.00 | ||||
| APACHE II | 13.15 | 13.98 | 23.00 | ||||
| SOFA | 6.71 | 6.55 | 8.00 | ||||
| Nutric | 2.75 | 3.08 | 7.00 | ||||
| DM2 | |||||||
| No | 74.1 | 78.8 | 0.0 | 75.2 | |||
| Sí | 25.9 | 21.2 | 100.0 | 24.8 | |||
| IAM | |||||||
| No | 94.4 | 95.5 | 100.0 | 94.8 | |||
| Sí | 5.6 | 4.5 | 0.0 | 5.2 | |||
| ICC | |||||||
| No | 96.5 | 97.0 | 100.0 | 96.7 | |||
| Sí | 3.5 | 3.0 | 0.0 | 3.3 | |||
| HAS | |||||||
| No | 58.0 | 28.8 | 0.0 | 48.6 | |||
| Sí | 42.0 | 71.2 | 100.0 | 51.4 | |||
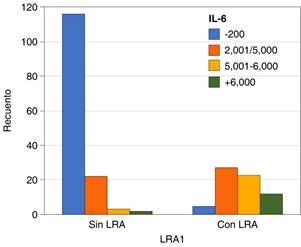
En nuestro estudio, se encontró 78% hombres, 22% mujeres con una media de edad de 60 años, 25% padecían diabetes mellitus tipo 2 y 51% hipertensión arterial sistémica. Se realizó una curva ROC para predecir el factor de riesgo para presentar lesión renal aguda encontrando diferencias significativas en IL-6 con un área bajo la curva ROC de 0.909(CI: 0.86-0.95) (Tabla 2). Se encontró que IL-6 al ingreso de terapia intensiva por arriba de 3,000 ng/mL presentaba mayor riesgo de LRA (Figuras 1 y 2).
Tabla 2: Factores de riesgo mayormente asociados a lesión renal aguda y terapia de reemplazo renal.
| IC 95% asintótico | |||||
|---|---|---|---|---|---|
| Variables de resultado de prueba | Área | Desviación errora | Significación asintóticab | Límite inferior | Límite superior |
| IL-6 | 0.909 | 0.023 | 0.000 | 0.864 | 0.954 |
| PEEP | 0.715 | 0.037 | 0.000 | 0.641 | 0.788 |
| DD | 0.593 | 0.043 | 0.031 | 0.508 | 0.678 |
| PCR | 0.577 | 0.042 | 0.073 | 0.495 | 0.659 |
| FERRITINA | 0.642 | 0.041 | 0.001 | 0.563 | 0.722 |
Las variables de resultado de prueba: IL6, PEEP, DD, PCR, FERRITINA tienen mínima diferencia estadística entre el grupo de estado real positivo y el grupo de estado real negativo.
aBajo el supuesto no paramétrico;
bHipótesis nula: área verdadera = 0.5.
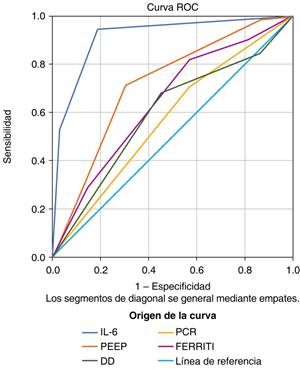
Figura 1: Sensibilidad de factores de riesgo para LRA y TRR. IL-6 mostró mayor sensibilidad al asociarlo a lesión renal aguda y terapia de reemplazo renal.
Al igual, se encontró una correlación con PEEP > 13cmH2O y lesión renal aguda en 71% de los pacientes.
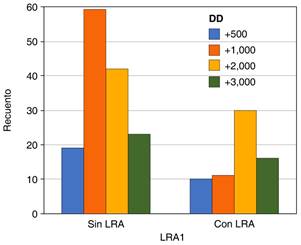
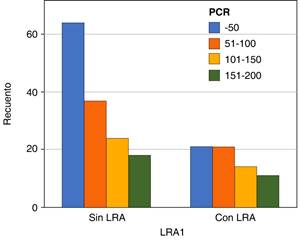
Se realizó un análisis bivariado utilizando χ2 y coeficiente Phi para demostrar la relación entre los niveles de IL-6, dímero D, ferritina y PEEP encontrando relación con lesión renal aguda. Encontrando una p significativa de 0.000, 0.004, 0.002, 0.000, respectivamente (Tablas 3 a 7).
Tabla 3: χ2 con coeficiente Phi relación IL-6 con lesión renal aguda, N = 210.LRA = Lesión renal aguda.
| LRA1 * IL6 | ||
|---|---|---|
| Pruebas de χ2 | ||
| Valor | Significación asintótica (bilateral) | |
| χ2 de Pearson | 112.033 | 0.000 |
| Razón de verosimilitud | 123.832 | 0.000 |
| Asociación lineal por lineal | 101.306 | 0.000 |
| N de casos válidos | 210 | |
| Medidas simétricas | ||
| Valor | Significación aproximada | |
| Nominal por nominal | ||
| Phi | 0.730 | 0.000 |
| V de Cramer | 0.730 | 0.000 |
Tabla 4: χ2 con coeficiente Phi relación PEEP con lesión renal aguda, N = 210.
| LRA1 * PEEP | |||
|---|---|---|---|
| Pruebas de χ2 | |||
| Valor | df | Significación asintótica (bilateral) | |
| χ2 de Pearson | 31.429 | 2 | 0.000 |
| Razón de verosimilitud | 33.209 | 2 | 0.000 |
| Asociación lineal por lineal | 29.606 | 1 | 0.000 |
| Medidas simétricas | |||
| Valor | Significación aproximada | ||
| Phi | 0.387 | 0.000 | |
| V de Cramer | 0.387 | 0.000 | |
Tabla 5: χ2 con coeficiente Phi relación dímero D con lesión renal aguda, N = 210.
| LRA1 * DD | |||
|---|---|---|---|
| Pruebas de χ2 | |||
| Valor | df | Significación asintótica (bilateral) | |
| χ2 de Pearson | 13.186 | 3 | 0.004 |
| Razón de verosimilitud | 14.128 | 3 | 0.003 |
| Asociación lineal por lineal | 4.389 | 1 | 0.036 |
| Medidas simétricas | |||
| Valor | Significación aproximada | ||
| Phi | 0.251 | 0.004 | |
| V de Cramer | 0.251 | 0.004 | |
Tabla 6: χ2 con coeficiente Phi relación ferritina con lesión renal aguda, N = 210.
| LRA1 * FERRITI | |||
|---|---|---|---|
| Pruebas de χ2 | |||
| Valor | df | Significación asintótica (bilateral) | |
| χ2 de Pearson | 14.581 | 3 | 0.002 |
| Razón de verosimilitud | 15.551 | 3 | 0.001 |
| Asociación lineal por lineal | 11.501 | 1 | 0.001 |
| Medidas simétricas | |||
| Valor | Significación aproximada | ||
| Phi | 0.264 | 0.002 | |
| V de Cramer | 0.264 | 0.002 | |
Tabla 7: χ2 con coeficiente Phi relación PCR con lesión renal aguda, N = 210.
| LRA1 * PCR | |||
|---|---|---|---|
| Pruebas de χ2 | |||
| Valor | df | Significación asintótica (bilateral) | |
| χ2 de Pearson | 3.433 | 3 | 0.330 |
| Razón de verosimilitud | 3.493 | 3 | 0.322 |
| Asociación lineal por lineal | 2.537 | 1 | 0.111 |
| Medidas simétricas | |||
| Valor | Significación aproximada | ||
| Phi | 0.128 | 0.330 | |
| V de Cramer | 0.128 | 0. 330 | |
Discusión
Se buscó encontrar la asociación entre la LRA y los factores de riesgo en los pacientes graves y clínicos con COVID-19, con el fin de tratarlos tempranamente y prevenir peores resultados clínicos. La incidencia de LRA en nuestro estudio se encontró en 24%; de éstos, 60% presentó lesión renal KDIGO estadio 1, 32% KDIGO estadio 2 y 28% KDIGO estadio 3.
Tanto en lesión renal aguda como en el síndrome de insuficiencia respiratoria aguda, la respuesta inflamatoria es un estado descrito en el que existe un incremento en la liberación de niveles de citocinas (principalmente IL-6, IL-10 y el factor inhibidor de la migración de macrófagos) aunado a esto, se ha descrito que el virus es capaz de interactuar con el receptor de enzima convertidora de angiotensina 2 e introducirse en las células de huésped, iniciando así una respuesta inflamatoria, con liberación masiva de citocinas, principalmente IL-6, IL-1 y factor de necrosis tumoral alfa, generando disfunción endotelial, trombosis y disfunción orgánica, por lo tanto, es importante medir niveles de marcadores inflamatorios, en este caso IL-6, principalmente al ingreso de terapia intensiva, ya que se puede prever posibles complicaciones durante el desarrollo de la enfermedad.19,27
El SARS-CoV-2 se une al receptor de la enzima convertidora de angiotensina 2, altamente expresado en el riñón, proporcionando una vía para la infección citopática directa, la inflamación grave y la tormenta de citocinas. El desarrollo de la coagulopatía es un mecanismo bien estudiado en los pacientes con COVID-19, por lo tanto, un desequilibrio entre los vasoconstrictores, los vasodilatadores y el estrés oxidativo en el endotelio puede llevar a comprometer la perfusión microvascular en los riñones. En nuestro estudio, encontramos que el aumento de IL-6 y dímero D son factores de riesgo para el desarrollo de LRA y, específicamente, cuanto más alto es el nivel IL-6 peor es el pronóstico de requerir terapia de reemplazo renal (Figuras 2 y 3).
La ventilación mecánica invasiva se ha relacionado con lesión renal aguda, aunque su mecanismo de lesión no está del todo descrito, se han documentado diversas hipótesis y hasta ahora no hay una definitiva. Sharkey describe que una PEEP mayor de 7.5 cmH2O repercute en el flujo sanguíneo renal; mientras que Beurton y su equipo describen en su estudio que al limitar el uso de PEEP < 12 cmH2O en pacientes con VMI con SARS-CoV-2 se asoció a una menor necesidad de terapia de reemplazo renal y una menor proporción de pacientes con lesión renal KDIGO 3.36,38
En nuestro estudio, se encontró significancia estadística en LRA a partir de PEEP por arriba de 13 cmH2O y terapia de reemplazo renal con PEEP > 15 cmH2O (Figura 4).
Conclusión
En el presente estudio se encontró la incidencia de lesión renal aguda en paciente con choque séptico, como se describe en la literatura (28%). Existen estudios donde se demuestra que niveles elevados de PEEP predisponen al desarrollo de lesión renal aguda. En nuestro estudio, en 71% de pacientes que presentaron lesión renal aguda, se emplearon niveles elevados de PEEP (mayores de 13 cmH2O).
Al realizar el análisis estadístico, se encontró que niveles elevados de interleucina-6 por arriba de 3,000 U/dL al ingreso a Terapia Intensiva es un predictor de lesión renal aguda, otros marcadores inflamatorios como dímero D y ferritina también deben ser tomados en cuenta (Figuras 5 y 6).
Se vivió una pandemia donde la respuesta de los sectores de salud fue sobrepasada por la alta demanda de los pacientes, ante la falta de recursos, la lesión renal y necesidad de terapia de reemplazo renal representa un aumento en la morbimortalidad, por lo que una identificación temprana puede ayudar a prevenir complicaciones, además de ser considerado un adecuado parámetro para guiar el tratamiento, y a la vez es de utilidad para orientar a un pronóstico.
La identificación de factores de riesgo para generar lesión renal aguda en pacientes con la COVID-19 puede ayudar al diagnóstico temprano de la misma y a llevar a cabo maniobras periféricas que nos ayuden a disminuir su incidencia y/o progresión a mayor disfunción o uso de terapias de sustitución renal. Aplicar el seguimiento de estos factores en sitios en vías de desarrollo o con un nivel de infraestructura bajo, podría tener un impacto directo en el pronóstico de los pacientes complicados con lesión renal aguda en COVID-19.
Limitaciones del estudio: fue un número pequeño de pacientes, en un solo centro hospitalario, los hallazgos carecen de verificación externa, por lo que se requiere una mayor confirmación en estudios multicéntricos a gran escala.











 nueva página del texto (beta)
nueva página del texto (beta)