Introducción
A nivel mundial, la sepsis es la primera causa de ingreso en la unidad de cuidados intensivos (UCI), con larga estancia intrahospitalaria, y a pesar de los avances en este campo aún existe alta mortalidad (cerca de 40%).1 Los primeros pasos para el origen de la sepsis es la activación de la respuesta inmunitaria innata: la presencia de patrones moleculares asociados a patógenos (PAMPS) y la unión de éstos con los receptores de patrones moleculares asociados a patógeno (receptores tipo Toll y NOD); la unión de este complejo desencadena fosforilación y liberación del factor kappa beta,2 lo que va a provocar la liberación del factor de necrosis tumoral alfa e interleucinas 1 y 2, y posterior activación de la cascada de complemento, iniciando así la cascada inflamatoria y daño endotelial secundario.3,4 La definición actual dada en 2016 es el resultado de las correcciones en las debilidades del consenso previo, «sepsis se define como disfunción orgánica (escala de SOFA más de dos puntos) que pone en peligro la vida y es causada por una desregulación en la respuesta del huésped a una infección».5
La lesión renal aguda (LRA) es un diagnóstico frecuente dentro de la UCI, la incidencia de la LRA en los pacientes críticos varía entre 35 y 50%,6 y la mortalidad relacionada con esta patología en México es de 13.6% en las etapas tempranas, y de 32.6% en etapas de mayor severidad.7 El diagnóstico de la lesión renal aguda se hace con las directrices de las Guías Kidney Disease: Improving Global Outcomes (KDIGO), cuyo diagnóstico se basa en dos pilares: incremento en la creatinina sérica a las 48 horas del insulto inicial (más de 0.3 mg/dL) o a los siete días (más de 1.5 veces la basal), índice urinario (menor de 0.5 mL/kg/hora en seis horas), y se clasifica en tres estadios (KDIGO I, KDIGO II, KDIGO III).8 La sepsis es la principal causa etiológica de la LRA en la UCI (50% en los pacientes críticos), por lo tanto la LRA inducida por la sepsis (S-LRA) es una entidad etiopatológica diferente de los otros tipos de presentación de LRA en la UCI.9 Se ha definido la S-LRA como una disfunción en presencia de sepsis sin otro factor desencadenante que explique la disfunción a nivel renal.10 Existe una teoría fisiopatológica de la S-LRA que engloba tres principales mecanismos: inflamación (inicio e extensión de la lesión), disfunción en la microcirculación (mecanismo por el que surge la disfunción aun en estabilización macrohemodinámica), y reprogramación metabólica.11,12
Durante la pandemia de COVID-19, las infecciones graves por SARS-CoV-2 fueron la principal causa de ingreso en la UCI, y se debe plantear que las infecciones graves cursan con sepsis de origen viral, ya que hay un desbalance en la respuesta inflamatoria del huésped en presencia de un agente viral,13,14 además de que se han descrito mecanismos inmunológicos similares a los mecanismos en la sepsis típica, como el rol que desempeñan los receptores tipo Toll en la patogenia del COVID-19: reconocimiento de partículas virales y activación del sistema inmunológico innato; secreción de las citosinas proinflamatorias y posterior a la tormenta de citosinas;15 por lo tanto usar la palabra sepsis para pacientes con COVID-19 explica la respuesta desregulada del paciente, y las alteraciones en la coagulación que se observan en estos pacientes.16
Se ha encontrado evidencia de que la LRA es una condición incidente en los pacientes con COVID-19 (de 36.6 a 75.4%), es más frecuente la presentación en los estadios de mayor severidad (AKIN III 48.4%); los posibles factores de riesgo que se han detectado fueron: altos puntajes en escala de SOFA (Acute Organ System Failure), diabetes mellitus 2 (DM2) y acidosis metabólica.17,18 Los mecanismos fisiopatológicos aún no son reconocidos (posible lesión viral directa, respuesta de células inflamatorias no reguladas y cambios en la agregación plaquetaria),19 además se han demostrado cambios en el flujo renal (grandes y pequeños vasos) similares tanto en pacientes con COVID-19 y con sepsis bacteriana, y esto puede explicarse por la disfunción microvascular asociada a la respuesta inflamatoria descrita en la sepsis típica.20
El grupo de trabajo de la iniciativa de calidad de enfermedades agudas (ADQI, Acute Dialysis Quality Initiative) para la LRA en COVID-19 recomienda que el diagnóstico se haga conforme a la definición dada en las guías KDIGO.21 De acuerdo a la fisiopatología previamente descrita, la inflamación tiene un rol clave en el inicio y en la extensión del daño a este órgano, por lo que es importante evaluar los parámetros de las células inflamatorias como posibles marcadores relacionados con la LRA.
Los niveles de las células inflamatorias se han evaluado de forma separada como marcadores pronóstico o de disfunción en la sepsis, pero se ha demostrado que al relacionar las células inflamatorias como la relación neutrófilos/linfocitos (la relación más estudiada) pueden tener utilidad en diferentes aspectos como mortalidad, pronóstico y disfunción orgánica (tanto sepsis como otras enfermedades).22
La relación neutrófilos/linfocitos (RNL) al ser un marcador directo de inflamación tiene una utilidad demostrada por múltiples investigaciones en sepsis para predecir pronóstico, y también se ha descrito que es un factor asociado con la presencia de LRA en pacientes con sepsis típica.24 En la actual pandemia se ha encontrado utilidad de la RNL en diferentes aspectos, uno de ellos es que es un factor predictor de una presentación de mayor severidad en la neumonía por COVID-19.23 Sin embargo, hasta el momento se había dejado a un lado el rol importante de las plaquetas en la disfunción orgánica tanto en sepsis como en COVID-19.
En 2018 nació la relación neutrófilos, linfocitos y plaquetas (RNLP), un cálculo matemático simple que sólo requiere el número absoluto de plaquetas, linfocitos y neutrófilos de una biometría hemática; en dos estudios retrospectivos (en cirugía cardiaca y cirugía abdominal mayor) se describió que es un factor único asociado con la presencia de LRA, además en uno de los estudios, en el análisis multivariado se observó que la RNLP, en comparación de la RNL, fue un factor asociado con al LRA con un punto de corte de 3.0.24,25 En otro estudio retrospectivo en 2020 la RNLP fue un factor asociado en mortalidad en pacientes con S-LRA.26
Sin embargo, no se han realizado estudios prospectivos para valorar el incremento en el riesgo y asociación de la LRA en un evento de respuesta inflamatoria sistémica severa (en sepsis secundaria a COVID-19), para realmente poder evaluar su utilidad clínica que nos ayude a predecir qué pacientes tienen más riesgo de presentar esta complicación, ya que es una prueba barata, reproducible (no es operador dependiente), y que se tiene en todos los hospitales de segundo y tercer nivel, además de que en nuestro medio no se ha descrito la incidencia de lesión renal aguda en pacientes con sepsis por SARS-CoV-2. Por lo tanto, el objetivo principal del estudio es «determinar si la relación neutrófilos, linfocitos y plaquetas es un predictor de lesión renal aguda en sepsis secundaria a COVID-19 en la UCI adultos».
Material y métodos
Este estudio es de cohorte prospectiva, unicéntrico; es parte de una cohorte ambiespectiva con título «Relación neutrófilos, linfocitos y plaquetas como predictor de lesión renal aguda inducida por sepsis en la UCI adultos». Para el presente estudio se siguen los lineamientos de la declaración de STROBE (Strengthening the Reporting of Observational studies in Epidemiology).
El universo del estudio son todos los pacientes mayores de 18 años ambos sexos que ingresaban a la Unidad de Cuidados Intensivos (UCI) de la Unidad Médica de Alta Especialidad T1, Centro Médico del Bajío, del Instituto Mexicano del Seguro Social (IMSS) en León, Guanajuato, México que cumplían con el diagnóstico de sepsis (criterios sepsis 3) secundaria a COVID-19. El estudio fue aprobado por el comité de investigación local y el comité de ética local (en apego a la Ley General de Salud en Investigación en Humanos y Declaración de Helsinki).
Se realizó un muestreo no probabilístico por casos consecutivos, el tamaño de la muestra se calculó de acuerdo con datos de estudio previo, donde la proporción de daño renal en pacientes sometidos a cirugía cardiaca fue de 0.32 en aquéllos con RNLP menor de tres y del 0.61 mayor de tres. Se realizó una fórmula de dos proporciones asumiendo una hipótesis de una cola, un poder de 90%, confianza de 95%, con 20% de pérdidas; la muestra fue de 60 pacientes para cada grupo (120 para la cohorte prospectiva).
Los criterios de inclusión fueron pacientes mayores de 18 años y menores de 80 que presentaran diagnóstico de LRA de acuerdo a las guías KDIGO posterior al diagnóstico de sepsis, que contaran con las determinaciones de biometría hemática (BH) desde el día uno y de forma diaria hasta el día siete. Se excluyeron pacientes embarazadas, con falla renal crónica (con o sin tratamiento sustitutivo), aquéllos que se administraron fármacos nefrotóxicos, y en caso de que presentaran LRA secundario a otras causas (reumatológicas, síndrome cardiorrenal, hepatorrenal, obstructivas, medio de contraste, rabdomiólisis y/o hemorragias), además se eliminaron los que tuvieron más de 72 horas fuera de la UCI, y los que tuvieron menos de tres días de estancia en la UCI.
Una vez que ingresan a la UCI y cumplan los criterios de inclusión, el tratamiento en todos los pacientes es estandarizado y es de acuerdo al criterio del médico tratante con apego a las recomendaciones en COVID-19 (no se realiza ninguna intervención por parte de los investigadores).
Se hizo el cálculo de la RNLP desde el día de su ingreso1 hasta el día séptimo con la siguiente fórmula matemática (se usa el conteo absoluto proporcionado por una biometría hemática).
Se toma punto de corte de tres de acuerdo a la evidencia previa, con base en esto se dividió a los pacientes en dos grupos: RNLP mayor de tres, y RNLP igual o menor de tres para su seguimiento (se evalúa presencia de LRA, evolución y desenlace).
Análisis estadístico
Para la estadística inferencial del objetivo principal, al ser dos variables dicotómicas, se hizo prueba de χ2, se realizó medida de asociación univariable representada con OR (IC95%) para valorar el riesgo de presentar LRA con el incremento de la RNLP, y al ser también de carácter continuo se efectúa una prueba U de Mann-Whitney para ver la diferencia en los niveles en la RNLP en los pacientes que tuvieron o no lesión renal aguda inducida por sepsis. Se realizó un análisis multivariable con la prueba de regresión logística binaria para valorar la asociación de las distintas variables, la presencia de S-LRA representado con OR (IC95%).
Para los objetivos secundarios: 1) Se identificó la incidencia de LRA en pacientes con sepsis secundaria a COVID-19 en nuestro medio (se representará en porcentaje con intervalos de confianza al 95%). 2) Se hicieron pruebas estadísticas de acuerdo al tipo de variables para los demás objetivos secundarios (U de Mann-Whitney o t de Student para muestras independientes para variables cuantitativas, y prueba de χ2 para variables dicotómicas), toda la significancia estadística se tomará con una p ≤ 0.05.
Para comparar la supervivencia entre los grupos (RNLP mayor de tres o RNLP igual o menor de tres), se realiza una curva de Kaplan-Meier con prueba de Log-Rank.
Y ya que el punto de corte que usamos para dicotomizar la variable en RNLP fue tomado de un estudio en cirugía cardiaca, realizaremos un análisis por curva ROC para poder identificar el punto de corte para la RNLP que mejor discrimine el resultado de la LRA en pacientes con sepsis secundaria a COVID-19.
Resultados
Se han recabado en el periodo de mayo de 2020 a marzo de 2021, 149 pacientes con diagnóstico de sepsis secundario a COVID-19, de los cuales se han excluido 30 pacientes; por lo tanto, para el análisis estadístico se tiene una muestra final de 119 pacientes.
De los 119 pacientes 64.7% fue del género masculino (n = 77), la media (± desviación estándar) de edad fue de 53 ± 13 años, al ingreso en la UCI se tuvo una mediana de escala de SOFA de 6 puntos (4-10), y escala de APACHE II de 14 puntos (9-19); una incidencia de lesión renal aguda (LRA) en los pacientes con sepsis secundario a COVID-19 de 53.8% (IC al 95% 44 - 62%), de los pacientes con LRA 53.1% presentaron KDIGO I, y 14.1% ameritaron tratamiento sustitutivo renal (TSR). La mediana en los días de estancia en la UCI fue de 11 días (7-15) y se tuvo una mortalidad de 35.3% (Tabla 1).
Tabla 1: Comparación de la población divida en dos grupos: relación neutrófilos, linfocitos y plaquetas menor de tres y relación neutrófilos, linfocitos y plaquetas menor de tres.
| Cohorte total, (N = 119) | RNLP > 3, (N = 76) | RNLP = O < 3, (N = 43) | p | |
|---|---|---|---|---|
| Género, N (%) | 0.020* | |||
| Femenino | 42 (35.3) | 21 (27.7) | 21 (49.0) | |
| Masculino | 77 (64.7) | 55 (72.4) | 22 (51.0) | |
| Edad, años | 53 ± 13 | 55 ± 11.7 | 51 ± 15.1 | 0.164‡ |
| Peso, kg | 86.5 ± 17.7 | 86.2 ± 16.0 | 87.1 ± 20.6 | 0.784‡ |
| Talla, metros | 1.67 (1.6-1.7) | 1.7 (1.6-1.74) | 1.62 (1.56-1.69) | 0.010§ |
| IMC, kg/m2 | 31.42 ± 5.7 | 30.8 ± 5.2 | 32.6 ± 0.6.5 | 0.102‡ |
| Escala SOFA ingreso | 6 (4-10) | 7 (4-10) | 6 (4-9) | 0.336§ |
| Escala APACHE II ingreso | 14 (9-19) | 14 (9-19) | 14 (11-19) | 0.892§ |
| Choque, n (%) | 72 (60.5) | 53 (70.0) | 19 (44.2) | 0.006* |
| Lesión renal aguda, n (%) | 76 (63.9) | 52 (68.4) | 12 (28.0) | ≤ 0.001* |
| Escala KDIGO, n (%) | ||||
| KDIGO I | 34 (53.1) | 26 (50.0) | 8 (66.6) | 0.581* |
| KDIGO II | 15 (24.2) | 13 (25.0) | 2 (16.7) | |
| KDIGO III | 15 (24.2) | 13 (25.0) | 2 (16.7) | |
| Tratamiento sustitutivo renal, n (%) | 9 (14.1) | 8 (15.4) | 1 (8.33) | 0.461* |
| Días de estancia UCI | 11 (7-15) | 12 (8-15) | 10 (6-13.5) | 0.018§ |
| Días de ventilación mecánica | 10 (6-14) | 11 (7-15) | 8 (3.5-12.0) | 0.003§ |
| Desenlace, n (%) | 0.095* | |||
| Defunciones | 42 (35.3) | 31 (40.78) | 11 (25.58) | |
| Género | ||||
| Femenino, (N = 42) | N = 21 | N = 21 | ||
| Lesión renal aguda (N = 15), n (%) | 12 (57.1) | 3 (14.3) | 0.004¶ | |
| Masculino, (N = 77) | N = 55 | N = 22 | ||
| Lesión renal aguda (N = 49), n (%) | 40 (72.7) | 9 (40.9) | 0.009* |
Se describe como mediana (rangos intercuartiles).
IMC = índice de masa corporal), RNLP = relación neutrófilos, linfocitos y plaquetas, UCI = unidad de cuidados intensivos,
* = χ2,
‡ = t de Student,
§ = U de Mann-Whitney,
¶ = prueba exacta de Fisher.
Se divide la muestra en dos grupos: RNLP mayor de 3 (n = 76) y RNLP igual o menor a 3 (n = 43), fue más prevalente el género masculino que en comparación con el grupo igual o menor a 3 (72.4 vs 51%, p = 0.020), de las variables antropométricas sólo en la media de la talla fue superior en el grupo de RNLP mayor de 3 (1.7 vs 1.62 metros, p = 0.010). Al ingreso no se presentaron diferencias en las escalas SOFA (7 vs 6, p = 0.336) y APACHE II (14 vs 14, p = 0.89). En el grupo de RNLP mayor de 3 se presentó una incidencia de estado de choque de 70% (p = 0.006) (Tabla 1).
Para poner a prueba la hipótesis del estudio, se encontró una incidencia de LRA en los pacientes con RNLP mayor de 3 de 68.4%, y en el grupo de RNLP igual o menor a 3 una incidencia de 28% (prueba chi cuadrada 18.134, p = 0.0001).
Ya que el género fue una variable confusoria se hace una división para analizarlos de forma separada: en el género masculino 72.7% con RNLP mayor de 3 presentó LRA contra 40.9% que presentó LRA con una RNLP menor de 3 (chi cuadrado 6.875, p = 0.009, RR 1.787, IC al 95% 1.049-3.013), y para el género femenino 57.1% con RNLP mayor de 3 presentó LRA en comparación con 14.3% del grupo de RNLP igual o menor a 3 (prueba de Fisher p = 0.004, RR 4.0 IC al 95% 1.317-12.52).
La mediana total de los niveles de la RNLP en los pacientes con LRA fue de 4.56 (2.95-7.4) y en los pacientes que no presentaron LRA fue de 2.53 (1.77-5.17, prueba de U de Mann-Whitney p = 0.0001); y se analizan las diferencias desde el día 1 hasta el día 7 en las medianas de la RNLP de acuerdo a la presencia o no de LRA encontrando que a partir del tercer día hay una diferencia entre las medianas de la RNLP (4.62 vs 2.80, p = 0.020), y su mayor diferencia fue en el sexto día (4.69 vs 1.92, p = 0.001) (Figura 1).
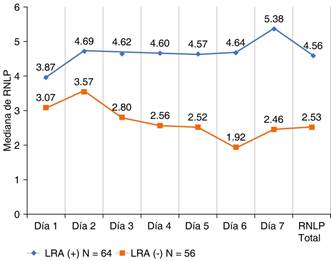
Figura 1: Comparación de los niveles de la relación neutrófilos, linfocitos y plaquetas del primer al séptimo día de acuerdo a la presencia o no de lesión renal aguda inducida por sepsis. Gráfica de líneas continuas que compara los grupos con lesión renal aguda y sin lesión renal aguda, los cambios en los niveles de relación neutrófilos, linfocitos y plaquetas del día cero al día siete se observan a partir del día tres con diferencia en los grupos, hasta el día seis que fue el de mayor diferencia (4.64, RIQ 2.8-9.12 versus 1.92, RIQ 1.40-4.19).
Para valorar la asociación de las diferentes variables con el desenlace (S-LRA), se realiza una prueba de regresión logística binaria multivariable encontrando que la RNLP > 3 se asoció de forma independiente con la presencia de S-LRA con un OR 4.255 (IC al 95% 1.782-10.161) (Tabla 2).
Tabla 2: Estimación de asociación de la relación neutrófilos, linfocitos y plaquetas, choque, género, SOFA > seis y APACHE II > 14, para el desenlace de la lesión renal aguda (análisis univariable y análisis multivariable por regresión logista binaria).
| Análisis univariable | Análisis multivariable | |||||
|---|---|---|---|---|---|---|
| OR | IC95% | p | OR | IC95% | p | |
| RNLP > 3 | 5.597 | 2.457-12.7 | ≤ 0.0001 | 4.255 | 1.782-10.161 | 0.001 |
| Choque | 3.875 | 1.781-8.43 | ≤ 0.0001 | 2.76 | 1.182-6.463 | 0.019 |
| SOFA > 6 pts. | 1.712 | 0.817-3.584 | 0.153 | 1.275 | 0.491-3.307 | 0.618 |
| APACHE II > 14 pts. | 1.153 | 0.559-2.38 | 0.700 | 1.025 | 0.403-2.610 | 0.959 |
| Género | 1.762 | 1.219-2.564 | 0.004 | 2.246 | 0.937-5.38 | 0.070 |
Se describe como número (porcentaje), RNLP = relación neutrófilos, linfocitos y plaquetas, LRA = lesión renal aguda, OR = Odds Ratio, IC95% = intervalo de confianza 95%.
Se presentó un mayor tiempo de estancia en la UCI en el grupo de RNLP mayor de 3 (12 vs 10 días, p = 0.018), y mayor tiempo de ventilación mecánica en el grupo de RNLP mayor a 3 (11 vs 8 días, p = 0.003).
Se observó una mortalidad del 40.78% en el grupo de RNLP mayor de 3, y 25.6% en el grupo de RNLP igual o menor de 3 (p = 0.095), se realiza prueba de Kaplan-Meier para evaluar las curvas de supervivencia entre los dos grupos con una prueba de log Rank de p = 0.955. Sin embargo, la diferencia en las medianas de RNLP en los pacientes que fallecieron y los que egresaron en la UCI de forma general fue de 4.77 vs 3.30 (p = 0.035), encontrando que la mayor diferencia fue para el día 7 con una mediana de 6.67 vs 2.79 (p = 0.035) (Figura 2).
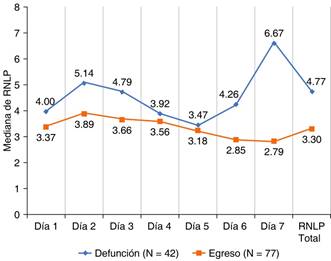
Figura 2: Comparación en las medianas de la relación neutrófilos, linfocitos y plaquetas entre los pacientes que fallecieron y los que se egresaron en la unidad de cuidados intensivos. Gráfica de líneas continuas que compara las medidas de la RNLP (relación neutrófilos, linfocitos y plaquetas), desde el día uno hasta el día siete en los pacientes que egresaron y fallecieron, encontrando una diferencia marcada en el séptimo día (6.67 versus 2.79, p = 0.035).
Ya que no se conoce el punto de corte óptimo en pacientes con sepsis secundaria a COVID-19, se hace curva ROC con los datos del sexto día ya que fue donde se presentó una mayor diferencia en las medianas de RNLP en los pacientes que presentaron LRA, encontrando que el mejor punto de corte para discriminar la presencia de LRA fue 2 (AUC 7.19, IC al 95% 0.615- 0.804, índice de Youden 0.36079).
Discusión
Éste es el primer estudio que se realiza de forma prospectiva para la evaluación de la relación neutrófilos, linfocitos y plaquetas (RNLP) en una patología inflamatoria aguda severa. Los resultados que se han mostrado pertenecen a la parte prospectiva de una cohorte ambiespectiva que intenta poner a prueba la RNLP tanto sepsis típica (cohorte retrospectiva) como en sepsis secundaria COVID-19.
Es la primera ocasión que se describe la incidencia de lesión renal aguda en pacientes con COVID-19 dentro de la UCI en población mexicana: 53.8% (IC95% 44-62%), con una distribución de 53.1% KDIGO I, 24.2% KDIGO II y 24.2% KDIGO III, y de estos pacientes, 14.4% ameritó tratamiento sustitutivo renal. Esta incidencia fue mayor que la descrita en el metaanálisis de Samuel A. Silver y colaboradores,27 el cual tuvo una población de 30,657 pacientes (50 estudios), y de la población que ingresó a la UCI por COVID-19 se detectó una prevalencia acumulada de LRA de 46%, y la distribución de severidad fue de 44% KDIGO I, 19% KDIGO II y 34% KDIGO III, además se describió que 19% ameritó sustitución renal. Se observa un requerimiento similar de terapias de sustitución renal comparado con nuestros datos, y sólo una distribución mayor en los pacientes con estadios III en la LRA. Una de las posibles explicaciones de la diferencia entre las incidencias es que de los 50 estudios sólo dos de ellos son de población y sistemas de salud parecidos a los nuestros (India y Bahrein), 48 estudios fueron en su mayor parte de pacientes chinos y europeos, que es población con menor prevalencia de obesidad, y demás enfermedades crónico degenerativas, factores de menor presencia de LRA en el paciente crítico por COVID-19, además en el mismo metaanálisis comentan que una de sus debilidades es la heterogenecidad en los estudios descritos que puede llevar a reportes inadecuados en la prevalencia de la LRA.
En nuestro estudio se describe que la RNLP mayor de tres es un factor de riesgo de presentar LRA en sepsis secundaria a COVID-19 en la UCI (RR de 2.452), mayor que el estado de choque o el género masculino; estos resultados corroboran lo encontrado en el estudio de Joana Gameiro,25 donde el incremento de más de cuatro de la RNLP mostraba una asociación con la presencia de LRA posterior a cirugía abdominal mayor con un OR no ajustado de 1.1 (IC95% de 1.04 a 1.16) y el análisis multivariado un OR 1.05 (IC95% de 1.00 a 1.10), además, en el estudio de Chang Koo y colaboradores24 se demostró que la RNLP mayor de tres se asociaba con la presencia de LRA posterior a la cirugía cardiaca con un OR de 1.80 (IC95% de 1.05 a 3.07) y el incremento de más de 20 puntos de la RNLP basal tiene una mayor asociación con LRA en el análisis multivariable con un OR 2.18 (IC95% de 1.20 a 3.98); sin embargo, en nuestro estudio al ser de cohorte prospectiva podemos determinar de mejor forma la causalidad en el incremento de la RNLP mayor de tres con la presencia de RNLP en sepsis secundaria a COVID-19. A pesar de que el incremento de esta relación se asocia con la LRA, no se plasmó que este incremento se vincule con un mayor grado de severidad en la lesión renal aguda, o en los requerimientos de tratamiento sustitutivo renal; además, al encontrar que fue diferente la población en el género entre los grupos, se describe de forma independiente que tanto en el género masculino como en el femenino es un factor de riesgo de LRA en caso de sepsis secundaria a COVID-19. Llama la atención que en el sexo femenino tuvo un riesgo relativo mayor que en el género masculino (RR de 4.0 versus RR de 1.787), al momento sin estudios que puedan comparar estos resultados dados por los géneros.
Dentro de los hallazgos interesantes en los primeros dos días de ingreso a la UCI no hubo diferencia en los niveles en la RNLP entre los pacientes con o sin LRA, pero a partir del día tres empezó a apreciarse una diferencia estadísticamente significativa (4.62 versus 2.8, p = 0.22), y para el día seis se tiene la mayor diferencia entre los niveles de RNLP (4.64 versus 1.92, p ≥ 0.0001), esto constituye una fortaleza para el estudio, ya que en los reportes previos sólo se hacía una medición única y al azar de la RNLP, y en nuestro estudio podemos recomendar que la mejor medición de la RNLP para establecer el riesgo de presentar LRA es en el sexto día (rango del tercer-séptimo día).
En nuestro análisis se establece una diferencia en el tiempo de estancia en la UCI y el tiempo de ventilación mecánica, que es mayor en el grupo con RNLP > tres, al no contar con estudios previos de la RNLP en la UCI no podemos comparar estos resultados. Sin embargo, a pesar del mayor tiempo no hubo una diferencia en la mortalidad entre los pacientes con incremento de más de tres en la RNLP, estos resultados se contrastan con los encontrados por Joana Gameiro,26 donde se estudia pacientes con S-LRA; la elevación de la RNLP se asoció con mayor mortalidad con un OR de 1.79 (1.13-2.83); sin embargo, el punto de corte que se estable en este estudio fue de 14, y la diferencia en la RNLP entre los pacientes que fallecieron y los que sobrevivieron fue de 13.66 versus 31.59. Aunque no fue el objetivo principal en nuestro estudio, observamos que en el séptimo día hubo mayor diferencia entre los niveles de la RNLP en los pacientes que se egresaron en comparación con los que fallecieron, con una significancia estadística. Posiblemente la causa por la que no encontramos una asociación entre la RNLP y mortalidad fue por el punto de corte que establecimos de tres, y se requiera un punto de corte más alto en la RNLP para predecir mortalidad. Otra explicación en esta diferencia es que en el estudio de Joana Gameiro tuvo una prevalencia mayor de estadios KDIGO 3 y en nuestro estudio fue más incidente el estadio KDIGO I.
Las debilidades del presente estudio son varias: 1) La fisiopatología en la LRA en pacientes con COVID-19 no es conocida, se establece que puede ser similar a los mecanismos en la sepsis típica, por lo tanto hay múltiples factores que pueden actuar de sesgo en nuestro estudio para la presencia de la LRA (comorbilidades, grado de severidad en la enfermedad COVID-19, la presencia de SDRA que promueve la interacción pulmón - riñón, el estado de hipercoagulabilidad propia en el COVID-19). 2) El no tener directrices de tratamiento estandarizadas como en la sepsis típica, lo que provoca el uso de fármacos inmunomoduladores (se usaron en caso de casos COVID-19 crítico) y no conocemos cómo puede afectar la cuenta de las diferentes células inflamatorias que se usaron para el cálculo de la RNLP y la función renal. 3) Fue un estudio unicéntrico y aunque fueron 119 pacientes, aún es un tamaño pequeño de muestra para generalizar al resto de la población mexicana con sepsis secundaria a COVID-19 en la UCI. 4) Sabemos que la linfopenia es una presentación bioquímica típica que tomamos como factor de mal pronóstico en el paciente con COVID-19, y puede que esta misma linfopenia pueda ser lo que provoque cambios en la RNLP.
Pero las fortalezas que podemos destacar de este estudio son: 1) es la primera ocasión que se establece la incidencia de la LRA en los pacientes con COVID-19 en la UCI, 2) es el primer estudio prospectivo para poner a prueba esta relación de células inflamatorias para evaluarla como factor de riesgo de LRA, 3) se propone que el punto de corte de la RNLP mayor de tres es un factor de riesgo de presentar LRA, pero este punto de corte se tomó de la evidencia previa, por lo tanto por medio de una curva ROC, establecemos que ciertos niveles mayores de dos pueden ser mejor para discriminar la aparición de LRA, y 4) establecemos que el sexto día es el mejor momento para la medición de la RNLP, ya que es cuando hay una mayor diferencia entre los pacientes que tienen LRA y los que no.
Se puede partir de los resultados del presente trabajo para realizar nuevos estudios, ya sea para poner a prueba el punto de corte de dos en la RNLP, corroborar nuestros hallazgos en otra población dentro de otra UCI, definir cuál es el punto de corte que mejor puede predecir mortalidad en los pacientes con sepsis secundaria a COVID-19, y además da pauta para comparar la RNLP con otros marcadores inflamatorios como RNL, presencia de linfopenia, velocidad de sedimentación globular (VSG), proteína C reactiva (PCR) y establecer su utilidad dentro del escenario clínico.
Conclusión
El incremento de la relación neutrófilos, linfocitos y plaquetas es un factor de riesgo y puede predecir la presencia de lesión renal aguda en pacientes con sepsis secundaria a COVID-19 en la UCI adultos. Se recomienda la medición de la relación en el sexto día de ingreso a la UCI, además de que el incremento de la relación neutrófilos, linfocitos se asocia con tiempos más prolongados en la UCI y de ventilación mecánica en los pacientes críticos, pero no se asocia con la diferencia en la mortalidad en los pacientes con sepsis secundaria a COVID-19.











 nueva página del texto (beta)
nueva página del texto (beta)


