Introducción
El aumento de la presión intracraneal (PIC) es una causa importante de daño cerebral y su asociación con un pronóstico desfavorable ha sido ampliamente demostrada. El neuromonitoreo y el tratamiento oportuno del aumento de la presión intracraneal son la piedra angular en el manejo de pacientes neurocríticos. Desde hace muchos años la medición de la PIC por medios invasivos se considera el estándar de oro. Sin embargo, el monitoreo de la presión intracraneal por métodos invasivos se encuentra lejos de ser seguro, las complicaciones como las hemorragias y las infecciones alcanzan de 1 al 7% de los casos, llevando a la búsqueda y desarrollo de alternativas no invasivas.1 El riesgo de infecciones se incrementa con el tiempo de permanencia de los dispositivos. Además, la colocación de los dispositivos de monitorización invasiva debe realizarse por neurocirujanos o equipo médico de terapia intensiva especialmente entrenado, lo cual es una limitante para su uso.2 Varios métodos no invasivos de monitorización de la PIC se encuentran en proceso de investigación, aún no disponibles para su aplicación clínica.1
Trauma craneoencefálico
El trauma craneoencefálico (TCE) es cualquier lesión estructural o funcional del cráneo y/o su contenido secundario a un intercambio brusco de energía mecánica, y al menos alguno de los siguientes elementos: alteración de la conciencia y/o amnesia debida al trauma, cambios neurológicos o neurofisiológicos, o diagnóstico de fractura de cráneo o lesiones intracraneales atribuibles al trauma o la ocurrencia de muerte resultante del trauma que incluya los diagnósticos de lesión de la cabeza y/o lesión cerebral traumática entre las causas que produjeron la muerte.3,4
El trauma craneoencefálico es el tipo más común de trauma que se atiende en los servicios de emergencia de los Estados Unidos, con casi un millón de casos tratados anualmente. Muchos pacientes con trauma craneoencefálico grave mueren antes de llegar al hospital, y por lo menos 90% de las muertes prehospitalarias relacionadas al trauma involucran al trauma craneoencefálico.5 En Iberoamérica la incidencia de trauma craneoencefálico es de 200 a 400 por cada 100,000 habitantes por año, y es más frecuente en el sexo masculino, con una relación 2:1 a 3:1, afectando a la población joven económicamente activa. La mortalidad ronda 30% en los centros especializados en trauma.6 En México, el TCE ocupa la cuarta causa de muerte, los accidentes de tráfico contribuyen con 75% y el resto es debido a muertes violentas, caídas y lesiones deportivas.7
El TCE grave representa 10% de todos los traumatismos craneoencefálicos, pero es el que contribuye en mayor proporción a los casos de fallecimientos, secuelas y el que incrementa los costos de la atención. Entre estos pacientes la causa principal de fallecimiento es la hipertensión intracraneal (HIC).8
Fisiopatológicamente el trauma craneoencefálico cursa con dos fases. La primera debida al impacto directo: fractura, contusión, hemorragia puntiforme y hemorragia subaracnoidea; y la segunda debida a edema, hipoxia y hemorragia subsecuente. El trauma directo produce contusión del parénquima cerebral y lesión axonal difusa en la sustancia blanca cerebral y del tronco encefálico. La lesión primaria desencadena una serie de alteraciones en el metabolismo cerebral que comprometen la hemodinamia intracraneal y la homeostasis iónica. El daño al parénquima cerebral se acompaña de isquemia e hipoxia.4
Existen diferentes formas de clasificar al trauma craneoencefálico. Puede ser por mecanismo del trauma, por severidad o por la morfología de las lesiones.
Con base en el mecanismo del trauma, el TCE se clasifica en abierto y cerrado. El trauma abierto se define por la penetración de la duramadre, causada comúnmente por proyectiles y esquirlas. El trauma abierto se asocia a mayor mortalidad comparado con el TCE cerrado (88 vs. 32%).9 El trauma cerrado es aquél en el que no existe penetración de la duramadre, y su causa más frecuente son los accidentes de vehículo automotor. Otras menos frecuentes son caídas y trauma directo con objeto contundente.4
Para clasificar el trauma craneoencefálico por severidad de la lesión se usa la escala de coma de Glasgow (GCS) como una medida clínica objetiva de lesión cerebral. Una GCS con puntaje de ocho o menos se ha convertido en la definición generalmente aceptada de coma o lesión cerebral grave. Los pacientes con trauma cerebral y con una GCS de 9 a 12 se clasifican como «moderados» y aquéllos con un puntaje de 13 a 15 se clasifican como «leves».5 Se estima que aproximadamente 80% de los traumatismos craneoencefálicos son de intensidad leve y el restante 20% se divide entre traumatismos moderados y graves.7,8
La clasificación por morfología se relaciona con las lesiones que se pueden incluir, ya sean fracturas de cráneo y/o lesiones intracraneales como contusiones, hematomas, hemorragias, lesiones difusas y el edema resultante.5
Presión intracraneal
La presión intracraneal (PIC) es la presión requerida para desplazar un volumen determinado en la caja craneal. Su aumento representa un cambio de presión en respuesta a los cambios del volumen. El aumento de volumen intracraneal puede producirse por:
Presencia de un hematoma intraaxial o extraaxial.
Aumento del volumen del líquido cerebro espinal (LCE).
Edema citotóxico, edema neurotóxico o edema vasogénico.
Aumento del volumen sanguíneo cerebral (VSC).
Patología vascular arterial o venosa.10
La presión de perfusión cerebral (PPC) está determinada por la diferencia entre la presión arterial media (PAM) y la presión intracraneal (PIC): PPC = PAM-PIC. Cuando está conservado el mecanismo de autorregulación, la PPC puede oscilar entre 50 y 150 mmHg sin generar variaciones significativas en el flujo sanguíneo cerebral (FSC). El cráneo es un continente rígido, no distensible y la presión en su interior está regida por las variaciones del volumen de su contenido. El volumen de la cavidad intracraneal es de 1,200 a 1,400 mL. En condiciones normales la PIC es inferior a 10 mmHg y está determinada por el volumen cerebral (85% = 1,020-1,190 mL), líquido cefalorraquídeo (LCR) (10% = 120-140 mL) y volumen sanguíneo (5% = 60-70 mL, de éste 70% venoso, 15% linfático y 15% arterial).9-11
La ley de Monro-Kellie expresa que la PIC depende de las variaciones del volumen de los elementos intracraneales, y que dentro de este espacio cerrado no distensible la variación de uno de los volúmenes genera cambios en sentido opuesto en los restantes. El aumento del volumen cerebral producirá reducción del volumen sanguíneo venoso y del LCR con el fin de mantener la PIC.4,5,11,12 Inicialmente se reduce el volumen venoso, pero su capacidad de adaptarse se agota mucho antes que la del LCR ante el aumento progresivo y sostenido de la PIC, mientras que el volumen arterial es el menos complaciente, e incluso puede generar aumento de la PIC. En estas condiciones, la reducción de la PPC induce vasodilatación arterial que incrementa el FSC y por tanto, del volumen sanguíneo cerebral (VSC) provocando la elevación de la PIC.4
El aumento de la PIC somete al tallo encefálico a hipoperfusión e isquemia, lo cual desencadena un aumento paralelo de la actividad del sistema nervioso autónomo simpático y parasimpático, que trata de aumentar el volumen latido y la presión arterial a niveles que superen la presión ejercida sobre el tallo encefálico en aras de vencer la resistencia vascular al FSC generada por el aumento de la PIC. Esta respuesta fisiológica ante la elevación de la PIC conocida como fenómeno o ley de Cushing se caracteriza clínicamente por hipertensión arterial sistémica y bradicardia.4
El aumento de la presión intracraneal (PIC) puede reducir la perfusión cerebral y causar o exacerbar la isquemia. Las presiones por arriba de 20 mmHg, particularmente si son prolongadas y refractarias al tratamiento, están asociadas con un mal pronóstico.5
Hipertensión intracraneal
Se refiere al aumento de la presión intracraneal por arriba de 15 mmHg de forma sostenida o mayor de 20 mmHg, dependiendo de la bibliografía que se consulte. En las guías actuales se considera una presión intracraneal por arriba de 22 mmHg para el inicio del tratamiento. Existen diversas condiciones que pueden llevar a una elevación de la presión intracraneal dependiendo del padecimiento, ya sea agudo o crónico.13
La hipertensión intracraneal traumática es una complicación frecuente y dañina del trauma cerebral que contribuye de forma importante al daño cerebral secundario, su severidad y duración se han correlacionado con un pronóstico fatal.14-16 Las causas principales de aumento de la presión intracraneal se pueden resumir en traumatismo craneoencefálico, hemorragia subaracnoidea, trombosis venosa cerebral, encefalopatía anoxicoisquémica, tumores cerebrales, hematomas, hipertensión intracraneal idiopática, encefalopatía hepática aguda, síndrome hiperosmolar agudo, encefalopatía hipertensiva, síndrome de Reye y craneosinostosis.
La relación entre el volumen intracraneal y la presión intracraneal es exponencial. De forma inicial la presión aumenta discretamente con incrementos de volumen, pero cuando los mecanismos de autorregulación del sistema se exceden, la presión intracraneal aumenta abruptamente. Esto explica el rápido deterioro que con frecuencia se observa en pacientes con un hematoma intracraneal postraumático.13
Los eventos intracraneales y sistémicos contribuyen de forma conjunta a elevar la presión intracraneal después de un trauma craneoencefálico. En las primeras horas posteriores al trauma la expansión de hematomas es la principal amenaza; en los días siguientes, otros mecanismos que incluyen la acumulación de agua, expansión de contusiones, pérdida de autorregulación e isquemia llevan a elevaciones en la presión intracraneal. Las consecuencias directas de la elevación de la presión intracraneal en el tejido cerebral pueden ser diferenciadas en general como mecánicas y vasculares. Cuando una lesión ocupante de espacio se desarrolla, se origina un gradiente de presión desde esta área y causará daño en el tejido cerebral, desviación de la línea media, y desplazamiento del tejido cerebral en dirección medial o caudal (herniación). La herniación del tejido cerebral es una verdadera emergencia que requiere tratamiento inmediato para prevenir daño irreversible y a menudo fatal del tronco cerebral.13
Por otro lado, los efectos vasculares de una presión intracraneal elevada son causados por una presión de perfusión cerebral dañada. La presión de perfusión cerebral es la fuerza motriz detrás del flujo sanguíneo cerebral, pero los niveles que se requieren para mantener un flujo adecuado varían entre pacientes. Conforme la presión de perfusión cerebral desciende, el flujo sanguíneo cerebral puede volverse insuficiente para mantener una adecuada perfusión del tejido cerebral y oxigenación.17
La isquemia promueve la aparición de edema citotóxico, y resulta en presiones intracraneales aún más elevadas. Los efectos adversos de la presión intracraneal incrementada y la poca presión de perfusión cerebral en la mortalidad y en el pronóstico a largo plazo se han documentado en diversos estudios.18,19
Monitorización de la presión intracraneal
La práctica de monitorizar la presión intracraneal fue iniciada por el trabajo de Guillaume y Janni en Francia y Lundberg en Suecia.20,21 En 1951 en una revista francesa Guillaume y Janni reportaron su experiencia con mediciones continuas de la presión intracraneal. En 1960 el neurocirujano sueco Nils Lundberg reportó una serie de casos de pacientes con tumores cerebrales en quienes monitorizó la presión intracraneal a través de derivaciones ventriculares externas. Más tarde, en 1965 se aplicó la experiencia de Lundberg en medir la presión intracraneal en pacientes con trauma craneoencefálico severo y se describió una serie de 30 casos de pacientes, los cuales fueron exitosamente monitorizados.22,23
Desde 1960 con Lundberg, la derivación ventricular externa se considera el estándar de oro para el monitoreo de la presión intracraneal.13
La elevación de la PIC es un fenómeno frecuente en los pacientes con trauma craneoencefálico, en el TCE grave se reporta entre 50 y 75% de los pacientes.10
La decisión de monitorizar la PIC se basa en evaluar las probabilidades de que el paciente en algún momento evolutivo pudiera presentar hemorragia intracerebral (HIC) determinada por la evolución del daño inicial, o por otras lesiones cerebrales o extracerebrales. La evaluación del riesgo de padecer HIC puede basarse en una combinación de características clínicas (coma, TCE grave) y de hallazgos en la tomografía computarizada (TC) inicial (desvío de la línea media, lesiones ocupantes de espacio > 25 cm3, compresión o ausencia de las cisternas perimesencefálicas, signos compatibles con hidrocefalia, entre otros).24 Las indicaciones para iniciar la monitorización de la presión intracraneal se resumen en la Tabla 1.
Tabla 1: Indicaciones para monitorización de la presión intracraneal en pacientes con trauma craneoencefálico.24
| TCE grave | TCE moderado | TCE otros casos |
|---|---|---|
| Con TAC normal y dos o más de los siguientes criterios: | Considerar cada caso | • GCS > 8 y disminución de 2 puntos en las primeras 24 horas y no obedece órdenes |
| • Edad > 40 años | • Lesión encefálica difusa grado III* | • GCS > 8 y hemorragia subdural no evacuada |
| • Postura motora anormal | • Lesión ocupante de espacio no evacuada | • GCS > 8 en cirugía por lesión ocupante de espacio con hallazgos intraoperatorios sugestivos de hemorragia intracraneal |
| • Hipotensión arterial (presión arterial media < 90 mmHg) | • Con requerimientos de opioides, sedación o relajantes musculares | • Politraumatismo en cirugía prolongada con riesgo de deterioro neurológico |
| Todos con TAC anormal |
* Según la clasificación de las lesiones cerebrales por TAC.
Los objetivos generales del neuromonitoreo son: 1) identificar el agravamiento de las funciones neurológicas y daño cerebral secundario que se beneficiaría de un tratamiento específico; 2) mejorar la comprensión de los mecanismos fisiopatológicos de las enfermedades neurológicas en los pacientes críticos; 3) proveer de datos fisiopatológicos claros que guíen las metas terapéuticas; 4) asistir en el pronóstico de los pacientes.24
Es importante recordar que no es el monitoreo per se lo que mejora el resultado de los pacientes, sino el uso de la información que se obtiene del monitoreo en el tratamiento. El tratamiento guiado por los resultados del monitoreo es mejor que un tratamiento guiado sólo por la evaluación clínica.25
Para el monitoreo de la presión intracraneal existen métodos invasivos y no invasivos. Entre los métodos invasivos están las derivaciones ventriculares externas y los catéteres para medición que se colocan directamente en el parénquima cerebral. De los métodos no invasivos existen la medición por ultrasonografía Doppler de los índices de pulsatilidad de las arterias cerebrales y la medición por ultrasonido de la vaina del nervio óptico.
Medición del diámetro de la vaina del nervio óptico
El nervio óptico es el segundo de los nervios craneales. Un tracto de fibras con aproximadamente 1.2 millones de axones, rodeado de vainas meníngeas que transportan las sensaciones visuales al sistema nervioso central. Está formado por los axones de las células ganglionares y por glía.
Se desprende del globo ocular 3 mm medialmente y 1 mm inferiormente al polo posterior del mismo. Se dirige posteromedialmente, atraviesa la cavidad craneal y termina en el ángulo anterolateral correspondiente al quiasma óptico. Su longitud total es de alrededor de 5 cm.
Consta de cuatro tramos o segmentos:
Consta de fibras mielinizadas rodeadas de vainas meníngeas (leptomeninges, duramadre y espacio subaracnoideo). Así, el nervio queda comprendido en un cono formado por los músculos rectos del ojo (cono muscular) y se sumerge en la grasa retroocular. En este segmento el nervio se relaciona con la arteria oftálmica, las venas oftálmicas superior e inferior, los nervios nasociliar, oculomotor y abducens, el ganglio ciliar, los vasos y nervios ciliares. Su trayecto es ligeramente sinuoso en «S» itálica, lo que le permite adaptarse a los movimientos del ojo sin sufrir tensiones. Esta porción que forma una «S» es la que interesa para la evaluación del DVNO.
• Tercer segmento: intracanalicular.
El nervio atraviesa el foramen óptico acompañado de la arteria oftálmica (cara inferior).
• Cuarto segmento: intracraneal (1 cm).
Está comprendido entre el foramen óptico y el quiasma óptico. Se relaciona inferiormente con la tienda de la hipófisis y el canal óptico del esfenoides; superiormente con la arteria cerebral anterior y la estría olfatoria medial y lateralmente con la carótida interna.26
La vaina del nervio óptico (VNO) se encuentra en continuidad con la duramadre del cerebro. La vaina del nervio óptico envuelve el segmento intraorbitario del nervio óptico y se encuentra separado de él por una capa de líquido cerebroespinal (LCE) y trabécula aracnoidea. Este espacio subaracnoideo está conectado con la capa interna de la aracnoides, y los estudios en cadáver han demostrado una relación lineal entre la PIC y la presión perióptica del LCE. Una elevación de la PIC causa distensión de la vaina del nervio óptico, principalmente en la porción retrobulbar, dado que ésta posee una red trabecular menos densa. A medida que la PIC se eleva, el LCR se distribuye por la duramadre hacia la VNO, la cual ocasiona aumento en su diámetro.27
Algunas condiciones médicas pueden bloquear la circulación de LCE impidiendo la transmisión de la presión intracraneal a la vaina del nervio óptico como tumores cerebrales, edema cerebral con efecto de masa, tumores de la vaina del nervio óptico, anomalías vasculares, traumatismo ocular y orbital.28
La aplicación del ultrasonido a la práctica clínica cotidiana y a la cabecera del enfermo se ha venido posicionando como una excelente herramienta en diferentes escenarios de la medicina intensiva. Su implementación en el enfermo neurológico grave es parte integral del abordaje, destacando la medición ultrasonográfica del diámetro de la vaina del nervio óptico (DVNO), que en poco tiempo ha venido consolidándose como una nueva herramienta del neuromonitoreo.29,30
Tenon describió en 1806 la vaina de nervio óptico (VNO) como un recubrimiento conformado de LCR y meninges que envuelve al nervio óptico y a la esclera del globo ocular, pero fue hasta 1867 cuando Luschka demostró que la capa fibrosa que recubre al nervio óptico es una comunicación de la porción interna de la duramadre.31
En 1997 Hansen y Helmke reportaron por primera vez el uso de la ultrasonografía en modo B para medir el diámetro de la vaina del nervio óptico con el fin de evaluar a los pacientes con hipertensión intracraneal. Compararon el diámetro de la vaina del nervio óptico medido en 16 pacientes con traumatismo craneoencefálico severo agudo contra controles sanos y encontraron diferencia significativa en la media del diámetro de la vaina del nervio óptico. Descubrieron que un diámetro de la vaina del nervio óptico mayor de 5 mm tenía sensibilidad de 100% para detectar hipertensión intracraneal en su cohorte. Observaron además que el diámetro de la vaina del nervio óptico aumenta su tamaño rápidamente cuatro horas posteriores al trauma. Concluyeron que la medición de la vaina del nervio óptico tiene un alto grado de precisión para detectar hipertensión intracraneal.30,32
Se ha demostrado que la medición del DVNO con ultrasonografía tiene una curva de aprendizaje pequeña, y un adiestramiento sencillo del uso del equipo, lo que puede ser suficiente para un monitoreo dinámico. Ballantyne y asociados corroboran lo anterior en su estudio, en el cual un experto radiólogo en ultrasonografía midió la vaina en 76 pacientes sanos, luego la compararon con personas que iniciaban el adiestramiento, demostrando una variación en la medición de 0.2 milímetros, lo que confirma que esta técnica de monitoreo es fácilmente reproducible y que puede aplicarse en una UTI o en un servicio de urgencias.29,33
La medición se realiza con un transductor lineal (onda de 5-10 MHz) que se coloca sobre el párpado del paciente. Se recomienda no hacer presión directa sobre el globo ocular para evitar que se presente desprendimiento de retina o incremento de la presión intraocular. Con esta recomendación, se hace la búsqueda del nervio óptico (NO); una vez encontrado, se realiza la primera medición en la unión de la retina y el NO, contándose 0.3 cm de forma transversal; subsecuentemente se traza una línea perpendicular y se hace la medición de la vaina (Figura 1). Tiene una sensibilidad y especificidad para la detección de hipertensión intracraneal de 88 y 93%, respectivamente, tomando como punto de corte mayor o igual a 0.5 cm (5 mm), lo que se traduce como una PIC > 20 mmHg.34-38
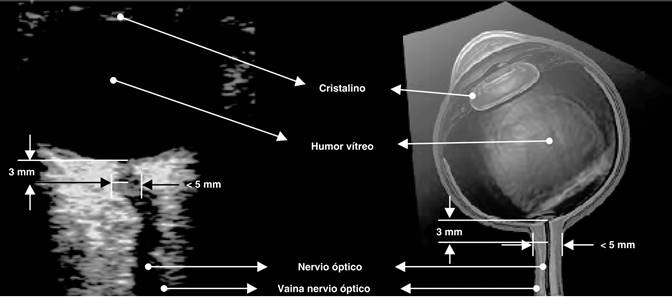
Figura 1: Imagen en la que se observa la técnica de medición del diámetro de la vaina del nervio óptico.
El aumento del diámetro de la vaina del nervio óptico por tomografía simple de cráneo se ha validado en diversos estudios. En un estudio de 2014 se demostró una asociación lineal entre la medición por tomografía de la vaina del nervio óptico y la presión intracraneal medida por un método invasivo en pacientes con trauma craneoencefálico severo. El diámetro de la VNO mostró una asociación excelente para el mismo paciente, además de habilidad para discriminar entre los pacientes con hipertensión intracraneal. Por último, en este estudio se demostró que la medición del diámetro de la vaina del nervio óptico es un predictor del aumento de la presión intracraneal mucho más fuerte que las características que comúnmente se buscan en las tomografías de cráneo (borramiento de las cisternas, herniación cerebral, ocupación ventricular, etcétera).39
Recientemente se han calculado las variaciones interobservador e intraobservador de las mediciones por ultrasonido del diámetro de la VNO en 0.5 y 0.2 mm respectivamente, estos resultados son muy similares a los reportados para las mediciones por tomografía simple de cráneo de la vaina del nervio óptico.40
Material y métodos
El objetivo de nuestro estudio fue comparar las mediciones del diámetro de la vaina del nervio óptico a 3, 6 y 9 mm mediante ultrasonografía contra las medidas obtenidas a las mismas distancias por tomografía simple de cráneo y así encontrar en cuál de las tres distancias se presenta menor diferencia entre ambas mediciones en pacientes con trauma craneoencefálico grave.
Debido a la trayectoria relativamente larga del nervio óptico se pretende determinar el mejor sitio para realizar la medición de la vaina del nervio óptico, dado que éste presenta durante su trayecto varios acodamientos o curvas que pueden sesgar la medición correcta del diámetro de la vaina del nervio óptico.
Se realizó un estudio de tipo observacional, prospectivo, transversal y comparativo en pacientes con diagnóstico de trauma craneoencefálico grave que ingresaron a la unidad de cuidados intensivos de nuestro hospital. Los pacientes fueron seleccionados con base en los siguientes criterios. Todos los pacientes que ingresaron al servicio de terapia intensiva neurológica con diagnóstico de trauma craneoencefálico grave definido por el puntaje de la escala de coma de Glasgow (menor de ocho puntos) asignado por el servicio de urgencias a su ingreso, con tiempo transcurrido entre la medición por tomografía simple de cráneo y por ultrasonido menor de una hora. Todos los pacientes debían contar con ambos globos oculares íntegros, sin antecedentes conocidos de glaucoma, con integridad de huesos del cráneo y pacientes cuyos familiares firmaron el formato de consentimiento informado de ingreso a terapia intensiva. Fueron descartados aquellos pacientes en los que no se encontró una adecuada ventana para realizar el estudio por ultrasonografía de la vaina del nervio óptico, los pacientes cuyo reporte de medición de la vaina del nervio óptico por tomografía simple de cráneo no se recibió por parte del servicio de radiología.
La medición por ultrasonografía del diámetro de la vaina del nervio óptico se llevó a cabo en modo bidimensional a 3 mm detrás de la retina, una vez localizado este punto se trazó una línea horizontal de borde a borde de la vaina del nervio óptico, es decir, del borde externo hiperecogénico de la duramadre al borde externo hiperecogénico del otro lado de la duramadre, la cual se midió en milímetros, encontrando en medio una estructura hipoecoica de trayecto regular posterior al globo ocular, realizándose el mismo procedimiento a las distancias de 6 y 9 mm. El paciente se colocó en posición supina con elevación de la cabeza a 20-30o con el transductor en posición horizontal. Se consideró adecuada una vaina del nervio óptico si se lograba una visualización a 9 mm por detrás del globo ocular y la órbita no estaba oscurecida por estructuras cercanas. Cabe señalar que de forma tradicional la medición del diámetro de la vaina del nervio óptico es un promedio de la medición en plano horizontal y en plano vertical; sin embargo, ya que por tomografía simple de cráneo sólo se obtiene la medición en el plano horizontal, de igual forma sólo se realizó la medición por ultrasonido en el plano horizontal.
Por parte del servicio de radiología se obtuvieron mediciones por tomografía simple de cráneo de los nervios ópticos a 3, 6 y 9 mm de la unión con la retina en cortes transversales de todos los pacientes.
Con base en las variables del estudio y previa codificación, se diseñó la base de datos en el paquete SPSS® y en el Software Excel,® para obtener las frecuencias se elaboraron cuadros de presentación así como gráficos en función del tipo de escala y variable. Se calcularon las medidas de tendencia central y las de dispersión para las variables cuantitativas, y para las cualitativas se utilizaron porcentajes y cifras absolutas, comparando los resultados de las mediciones obtenidas a través de ultrasonido (mediciones de nervio óptico) y de tomografía en ojo derecho e izquierdo para determinar la existencia o no existencia de «significancia estadística de las diferencias», aplicando la prueba «T» de Student, adoptando p < 0.05.
Resultados
La mayor cifra de pacientes estudiados se presentó en el grupo de 30 a 34 años de edad, significando 20.83% sobre el total de los 24 analizados; por otra parte, el grupo de 20 a 24 años de edad representó 12.50%; y en tercer lugar el grupo de 45 a 49 años de edad con 8.33%; sin embargo, 62.50% de los pacientes con trauma craneoencefálico fueron menores de 50 años de edad. Se observó en el sexo masculino un promedio o media menor con respecto al promedio de las mujeres; 35.39 vs. 39.83; lo anterior se refleja en mayor dispersión también en las mujeres, lo cual se observa en la cifra de desviación estándar, el resultado de la diferencia es «no significativo» con p > 0.05; sin embargo, con respecto al coeficiente de variación (desviación estándar/ media o promedio) la cifra es mayor en los hombres. El intervalo estimado para un nivel de 95% de confianza fue el siguiente: hombres 17-64.51 y mujeres 19-71.81. De los pacientes estudiados 75% correspondieron al sexo masculino, y 25% al femenino.
Del lado derecho a 3 mm se observó un promedio o media menor con ultrasonografía respecto al promedio de tomografía computarizada; 5.15 vs. 5.19; lo anterior se refleja en mayor dispersión también en el resultado obtenido con la tomografía, lo cual se observa en la cifra de desviación estándar, el resultado de la diferencia es «no significativo» con p > 0.05; sin embargo, con respecto al coeficiente de variación (desviación estándar/media o promedio) la cifra también es mayor en el resultado obtenido con tomografía computarizada. El intervalo estimado para un nivel de 95% de confianza fue el siguiente: ultrasonografía 3.57-6.73 y tomografía computarizada 3.43-6.95 (Tablas 2 y 3).
Tabla 2: Indicadores del resumen de la medida del diámetro de la vaina del nervio óptico por ultrasonografía y por tomografía computarizada a 3, 6 y 9 mm de la retina en pacientes con traumatismo craneoencefálico.
| Ojo derecho | Ojo izquierdo | |||
|---|---|---|---|---|
| Indicadores | Ultrasonografía | Tomografía computarizada | Ultrasonografía | Tomografía computarizada |
| Medición a 3 mm | ||||
| Media | 5.15 | 5.19 | 5.38 | 5.57 |
| Mediana | 5.25 | 5.30 | 5.15 | 5.75 |
| Moda | 5.40 | 6.20 | 4.90 | 6.20 |
| DE | 0.79 | 0.88 | 0.87 | 1.21 |
| Cifra mínima | 3.80 | 3.70 | 3.50 | 3.30 |
| Cifra máxima | 6.50 | 6.40 | 6.80 | 7.50 |
| CV | 15.34 | 16.96 | 16.17 | 21.72 |
| IC | 3.57-6.73 | 3.43-6.95 | 3.64-7.12 | 3.15-7.99 |
| Medición a 6 mm | ||||
| Media | 5.30 | 5.01 | 5.76 | 5.10 |
| Mediana | 5.30 | 5.10 | 5.75 | 5.05 |
| Moda | 6.10 | 6.20 | 6.70 | 4.20 |
| DE | 0.88 | 0.95 | 0.94 | 1.05 |
| Cifra mínima | 4 | 3.40 | 3.80 | 3.30 |
| Cifra máxima | 7 | 6.70 | 7.30 | 6.90 |
| CV | 16.60 | 18.96 | 16.32 | 20.59 |
| IC | 3.54-7.06 | 3.11-6.91 | 3.88-7.64 | 3.00-7.20 |
| Medición a 9 mm | ||||
| Media | 4.67 | 4.60 | 5.65 | 4.85 |
| Mediana | 5.35 | 4.60 | 5.80 | 4.60 |
| Moda | 6.70 | 5.80 | 6.20 | 5 |
| DE | 0.76 | 0.87 | 0.98 | 1.11 |
| Cifra mínima | 4.10 | 3 | 3.60 | 3.10 |
| Cifra máxima | 6.70 | 6.20 | 7.10 | 7 |
| CV | 16.27 | 18.91 | 17.35 | 22.89 |
| IC | 3.15-6.19 | 2.86-6.34 | 3.69-7.61 | 2.63-7.07 |
DE = desviación estándar; CV = coeficiente de variación; IC = intervalo de confianza.
Tabla 3: Promedios del nervio óptico con ultrasonido y tomografía en pacientes con trauma craneoencefálico.
| Indicadores | Ultrasonido | Tomografía axial computarizada | Diferencias |
|---|---|---|---|
| Ojo derecho (mm) | |||
| 3 | 5.15 | 5.19 | 0.04 |
| 6 | 5.30 | 5.01 | 0.30 |
| 9 | 4.67 | 4.60 | 0.07 |
| Ojo izquierdo (mm) | |||
| 3 | 5.38 | 5.57 | 0.19 |
| 6 | 5.76 | 5.10 | 0.66 |
| 9 | 5.65 | 4.85 | 0.80 |
Del mismo lado, pero a 6 mm, se observó un promedio o media mayor con ultrasonografía respecto al promedio de tomografía computarizada; 5.30 vs. 5.01; se refleja mayor dispersión en el resultado con tomografía computarizada, lo cual se observa en la cifra de desviación estándar, el resultado de la diferencia es «no significativa» con p > 0.05; sin embargo, con respecto al coeficiente de variación (desviación estándar/media o promedio) la cifra también es mayor en el resultado obtenido con tomografía computarizada. El intervalo estimado para un nivel de 95% de confianza fue el siguiente: ultrasonografía 3.54-7.06 y tomografía computarizada 3.11-6.91 (Tablas 2 y 3).
Por último, a 9 mm se observó un promedio o media mayor con ultrasonografía respecto al promedio de tomografía computarizada; 4.67 vs. 4.60; se refleja mayor dispersión en el resultado con tomografía computarizada, lo cual se observa en la cifra de desviación estándar, el resultado de la diferencia es «no significativa» con p > 0.05; sin embargo, con respecto al coeficiente de variación (desviación estándar/media o promedio) la cifra también es mayor en el resultado obtenido con tomografía computarizada. El intervalo estimado para un nivel de 95% de confianza fue el siguiente: ultrasonografía 3.15-6.19 y tomografía computarizada 2.86-6.34 (Tablas 2 y 3).
De la misma forma, del lado izquierdo a 3 mm se observó un promedio o media mayor con tomografía computarizada respecto al promedio de ultrasonografía; 5.57 vs. 5.38; se refleja mayor dispersión en el resultado con tomografía computarizada, lo cual se observa en la cifra de desviación estándar, el resultado de la diferencia es «no significativa» con p > 0.05; sin embargo, con respecto al coeficiente de variación (desviación estándar/media o promedio) la cifra también es mayor en el resultado obtenido con tomografía computarizada. El intervalo estimado para un nivel de 95% de confianza fue el siguiente: ultrasonografía 3.64-7.12 y tomografía computarizada 3.15-7.99 (Tablas 2 y 3).
A 6 mm del lado izquierdo se observó un promedio o media mayor con ultrasonografía respecto al promedio de tomografía computarizada; 5.76 vs. 5.10; se refleja mayor dispersión en el resultado con tomografía computarizada, lo cual se observa en la cifra de desviación estándar, el resultado de la diferencia es «no significativa» con p > 0.05; sin embargo, con respecto al coeficiente de variación (desviación estándar/media o promedio) la cifra también es mayor en el resultado obtenido con tomografía computarizada. El intervalo estimado para un nivel de 95% de confianza fue el siguiente: ultrasonografía 3.88-7.64 y tomografía computarizada 3.00-7.20 (Tablas 2 y 3).
Por último, a 9 mm se observó un promedio o media mayor con ultrasonografía respecto al promedio de tomografía computarizada; 5.65 vs. 4.85; se refleja mayor dispersión en el resultado con tomografía computarizada, lo cual se observa en la cifra de desviación estándar, el resultado de la diferencia es «no significativa» con p > 0.05; sin embargo, con respecto al coeficiente de variación (desviación estándar/media o promedio) la cifra también es mayor en el resultado obtenido con tomografía computarizada. El intervalo estimado para un nivel de 95% de confianza fue el siguiente: ultrasonografía 3.69-7.61 y tomografía computarizada 2.63-7.07 (Tablas 2 y 3).
El principal hallazgo obtenido a partir de la tomografía fue la hemorragia subaracnoidea, representando 50% en relación al total de 24 pacientes que integraron la muestra estudiada y en segundo sitio, el hematoma subdural con 37.50%.
Discusión
La medición por ultrasonido del diámetro de la vaina del nervio óptico es un método de neuromonitoreo con una curva de aprendizaje relativamente pequeña para los profesionales de medicina del enfermo en estado crítico. Tiene una buena relación costo-beneficio en comparación con el monitoreo que utiliza la tomografía. El ultrasonido tiene además la ventaja de poderse llevar a cabo a la cabecera del paciente con pocas contraindicaciones y efectos adversos.
La validación de este método de neuromonitoreo se ha llevado a cabo mediante grandes metaanálisis. Sin embargo, al revisar la literatura sobre el tema no se encontraron antecedentes de estudios que comparen la medición por ultrasonido de la vaina del nervio óptico a diferentes distancias vs. validación con tomografía simple de cráneo.
Además, la medición de la vaina del nervio óptico como método de neuromonitoreo es un recurso fácilmente asequible, lo que lo convierte en una excelente herramienta para el control de los pacientes críticos neurológicos que tengan riesgo de desarrollar hipertensión intracraneal. Los estudios que existen sobre la técnica reportan que el sitio para la medición debe realizarse a 3 mm por detrás del globo ocular. Sin embargo, es en este mismo punto anatómico donde el nervio óptico tiene un acodamiento y podría llegar a realizarse la medición en forma oblicua a su eje vertical, por lo que este error podría ser una causa de sesgo en la medición.
El nervio óptico en su porción infraorbitaria mide aproximadamente 30 mm, y el aumento de la presión intracraneal se transmite de forma uniforme a toda su extensión.
La aplicación del ultrasonido a la práctica clínica cotidiana y a la cabecera del enfermo se ha posicionado como una excelente herramienta en diferentes escenarios de la medicina intensiva. Su implementación en el manejo del enfermo neurológico grave puede considerarse como parte integral del abordaje, destacando la medición ultrasonográfica del diámetro de la vaina del nervio óptico, que en poco tiempo se ha consolidado como una sólida herramienta del neuromonitoreo.28,29
A pesar de que los resultados de la investigación realizada son fundamentales para el manejo clínico de los pacientes con traumatismo craneoencefálico, se considera necesario que se desarrollen acciones de prevención con el objetivo de disminuir su frecuencia, debido a que se le considera un problema de salud pública, sobre todo en población económicamente activa con las repercusiones que ello implica. Las acciones preventivas deben enfocarse en la detección de los factores de riesgo, esto unido al manejo clínico adecuado y a la accesibilidad a la rehabilitación puede mejorar el pronóstico del traumatismo craneoencefálico.
Conclusiones
De acuerdo con lo planeado para llevar a la práctica la investigación y obtención de los datos se determinaron, por parte del servicio de radiología, mediciones a través de tomografía simple de cráneo de los nervios ópticos a 3, 6 y 9 mm de la unión con la retina en cortes transversales de los 24 pacientes que integraron la muestra. Para su medición las imágenes de las tomografías simples de cráneo fueron desplegadas en un visualizador digital. Las imágenes se amplificaron donde aparece el nervio óptico en su eje más largo y con el diámetro más amplio. Se utilizó la ventana para abdomen (unidades Hounsfield en un rango de 25 a 40), la cual demostró la vaina del nervio óptico en mejor detalle.
Concretamente, se obtuvieron las cifras a partir de las mediciones del diámetro de la vaina del nervio óptico a 3, 6 y 9 mm mediante ultrasonido, se compararon con los resultados a las mismas distancias mediante la tomografía simple de cráneo en pacientes con traumatismo craneoencefálico grave atendidos en la unidad de cuidados neurointensivos. En ningún caso se registró «diferencia estadísticamente significativa» a favor de alguna de las técnicas e instrumentos utilizados.
Se obtuvo información de la edad, género, diagnóstico por tomografía simple de cráneo y Glasgow de ingreso, estos datos se presentan en tablas y gráficos que ilustran objetivamente las cifras absolutas y relativas. Con respecto a Glasgow, los 24 pacientes que tuvieron cifras ≤ 8 se clasificaron como «graves». Por otra parte, el principal hallazgo obtenido por tomografía fue la hemorragia subaracnoidea presentada en la mitad de los pacientes analizados.











 nueva página del texto (beta)
nueva página del texto (beta)


