Antecedentes
El 31 de diciembre de 2019 se reportaron en Wuhan, China los primeros casos de neumonía de origen desconocido, más tarde identificado como nuevo coronavirus (2019-nCoV o COVID-19), genéticamente distinto de otros coronavirus como SARS-CoV y MERS-CoV, oficialmente identificado como SARS-CoV-2.
Los informes documentaron que muchos de los pacientes, en un inicio notificados en el conglomerado identificado, tenían como vínculo un mercado de alimentos, principalmente mariscos y otros animales en Wuhan, China; sin embargo, en otros pacientes no se pudo establecer este vínculo, lo que evidenció la posibilidad de propagación ilimitada de una persona a otra.
De acuerdo con datos epidemiológicos, los virus se esparcen de un país a otro de la siguiente manera:1,2
Es transmitido a pequeños grupos de personas que han estado en contacto con otros individuos infectados en lugares donde el virus ya ha brotado;
El virus ahora se transmite al núcleo familiar una vez que estas personas contagiadas regresan a su país de residencia;
Ese núcleo familiar retransmite la enfermedad a otros pequeños grupos de contacto (escuelas, trabajos, transporte público, etcétera);
El virus ahora puede expandirse en el nuevo país de forma rápida e indiscriminada a partir de iniciar el ciclo de interacciones nuevamente:
Individuo → núcleo familiar → pequeños grupos → individuo
Las autoridades de salud mexicanas han hablado de tres escenarios de dispersión del virus y las medidas que se tomarán en cada caso.
El escenario 1, que comprende los puntos 1 y 2 antes descritos, consiste en aplicar estrategias de focalización para contener el virus; en el escenario 2 y 3 se conforman brigadas de aislamiento por parte de la autoridad para contener lugares de infección con un radio más amplio de dispersión; finalmente, en el escenario 2 y 4 se cierran eventos masivos, escuelas, lugares públicos, etcétera, para contener aún más la expansión del virus, misma que para ese momento ya se habría convertido en una epidemia nacional.
En México, de acuerdo con las autoridades sanitarias, se ha mantenido en el escenario 1 desde el pasado 28 de febrero, aunque las autoridades estiman que en 50 días a partir de esa fecha se podría llegar a un escenario 2; sin embargo, es posible que la evolución viral salte al segundo escenario y con el tiempo aparezcan en México muchos casos de personas contagiadas directamente en el escenario 3, estimado por las autoridades entre 600,000 y 1,200,000 infectados, de los cuales 10,500 serían casos graves que podrían ameritar ingreso a sala de urgencias y unidades de cuidados intensivos.
El Comité de Emergencias de la OMS determinó el 30 de enero de 2020 que el brote en China y los casos confirmados notificados por los países fuera de China, representan una Emergencia de Salud Pública de Importancia Internacional (ESPII), la cual se define como un evento extraordinario que constituye un riesgo para la salud pública de otros estados a causa de la propagación internacional de una enfermedad, y podría exigir una respuesta internacional coordinada.
Cuando el virus causante de una pandemia aparece, puede haber varias olas de brotes con un intervalo de tres a nueve meses entre ellas. Esto sugiere que deben implementarse programas de prevención que involucran vacunas o drogas antivirales más extensamente para la segunda ola; sin embargo, las acciones de prevención, la identificación de forma oportuna del brote inicial y el reforzamiento de la vigilancia epidemiológica en los puntos de entrada y salida del país permitirán tener una respuesta oportuna. Aun cuando se considera imposible detener la propagación de un virus pandémico, debe ser necesario minimizar las consecuencias, estando preparados para el desafío con anterioridad.
Esta enfermedad es causante de un aumento en la incidencia de neumonías y enfermedades respiratorias bajas que pueden llegar a ser graves, como se ha observado en los registros hospitalarios, que pueden incrementar de forma súbita el número de hospitalizaciones o muertes. Los ancianos o quienes padecen enfermedades crónicas pulmonares están más expuestos a experimentar complicaciones. Ante una posible pandemia de COVID-19, es necesario que las autoridades sanitarias lleven a cabo acciones permanentes que contribuyan a limitar los daños a la salud de la población y evitar que se supere la capacidad de respuesta.
El impacto de la epidemia por COVID-19 en el sector salud, social, económico y en la estabilidad del estado es muy alto, pudiendo llegar a provocar en corto tiempo una crisis económica de grandes proporciones con las siguientes consecuencias:
Servicios de salud superados en su capacidad de respuesta por la gran cantidad de personas conforme vayan pasando los días y aumenten los casos de contagiados y muertes en poco tiempo, provocando también un desorden social.
Aumento y pérdidas económicas enormes que superarán la capacidad gubernamental.
Estas dos situaciones traerían como consecuencia la escasez de productos de la canasta básica, así como otros.
Esto a su vez podría provocar problemas de índole social, tales como descontento y brotes de violencia que aumentarían al paso del tiempo, al igual que escasez de alimentos.
Habrá que recordar que los cuerpos de seguridad podrían estar afectados por la infección, lo que mermaría su capacidad de control.
Los cuerpos de sanidad deben esperar que a los 10 días inicien también con un periodo de contagio.
Con estas pérdidas en la capacidad económica y productiva de la población, los gastos aumentan sin haber recuperación, seguramente la crisis económica se incrementaría debido a la actividad económica nacional e internacional detenida por la falta de personas y países que quieran comerciar.
Los tres poderes del gobierno estarán afectados también por la falta de prevención, por lo que se espera una falta de gobernabilidad en corto plazo (dos meses).
La falta de protocolos de continuidad gubernamental asertivos provocará una crisis gubernamental.
Con todo esto en aproximadamente un mes o dos nos podríamos estar enfrentando a un problema de seguridad nacional.
Las medidas preventivas recomendadas por la Secretaría de Salud al miércoles 18 de marzo de 2020 son de fase 2, incluyen distanciamiento social, higiene de manos, aislamiento en casa en caso de presentar síntomas de catarro común, no acudir a eventos masivos y reprogramación de los mismos, suspensión temporal de actividades no esenciales, etiqueta respiratoria y cuidados de adultos mayores.3,4
Manejo del paciente grave con COVID-19 en la unidad de cuidados intensivos
La gravedad de COVID-19 está estrechamente relacionada con el pronóstico, por ello se deben gestionar estrategias básicas y esenciales para la detección temprana de pacientes con alto riesgo y tener una respuesta médica temprana.
Con los datos generados en poblados de China ante COVID-19 se implementaron intervenciones médicas con el objetivo de prevenir la progresión de la enfermedad, se describieron intervenciones con evidencia para limitar la insuficiencia respiratoria y evitar la intubación endotraqueal (Figura 1).

Figura 1: Esquema para el inicio de manejo en el paciente crítico. Adaptado de: Sun Q, Qiu H, Huang M, Yang Y . Lower mortality of COVID-19 by early recognition and intervention: experience from Jiangsu Province. Ann Intensive Care. 2020;10(1):33.5
Se reportaron tres principales intervenciones para el manejo de neumonía por COVID-19:5
Oxigenoterapia
Los pacientes que ingresen a un área crítica con datos de dificultad respiratoria, hipoxemia o inestabilidad hemodinámica deben recibir oxigenoterapia durante la reanimación para mantener la saturación de oxígeno (SatO2) objetivo > 94%. Se recomienda iniciar con cánulas nasales a 5 L/min y ajustarlas para mantener una saturación meta o el uso de mascarilla facial con bolsa reservorio a 10 L/min. Una vez estabilizado el paciente se debe mantener SatO2 > 90% en adultos. En pacientes embarazadas se recomienda un objetivo de SatO2 > 92-95%.6
Se debe mantener una monitorización constante de los pacientes con COVID-19 para reconocer de forma temprana la insuficiencia respiratoria o hipoxemia grave y datos que orienten que el paciente no está respondiendo al oxígeno estándar para iniciar soporte ventilatorio avanzado.
En pacientes con insuficiencia respiratoria hipercápnica, inestabilidad hemodinámica, falla orgánica múltiple o deterioro neurológico se debe realizar manejo avanzado de la vía aérea de forma temprana, un retraso en la intubación y ventilación mecánica invasiva se asocia con peor pronóstico en pacientes con SDRA.
Síndrome de distrés respiratorio agudo por COVID-19
El síndrome de distrés respiratorio agudo (SDRA) es una causa frecuente de insuficiencia respiratoria en el paciente crítico, la etiología viral destaca por su elevada mortalidad cercana al 50% de los casos, este síndrome se caracteriza por edema pulmonar de origen no cardiogénico causante de hipoxemia, que en la mayoría de los casos requerirá apoyo ventilatorio invasivo.
El SDRA se encuentra hasta en 10% de todos los pacientes en unidades de cuidados intensivos en todo el mundo, al día de hoy se han reportado casos de SDRA por COVID-19 en países como China, Italia y España, condicionando una alta mortalidad que predomina en pacientes adultos mayores y con presencia de comorbilidades crónico-degenerativas cardiovasculares y respiratorias y diabetes mellitus. Se estima que 5% de pacientes infectados por COVID-19 ameritarán intubación orotraqueal y manejo ventilatorio invasivo.
La definición actual del SDRA fue establecida en el año 2012 en el panel de expertos de la Sociedad Europea de Medicina de Cuidado Intensivo, conocida como definición de Berlín, la cual propone un inicio agudo en los primeros siete días, radiográficamente presencia de opacidades bilaterales no explicadas por derrame pleural, atelectasias o nódulos, insuficiencia respiratoria no atribuible a falla cardiaca o sobrecarga hídrica e índice P/F (PaO2/FiO2) de 300-200 mmHg para SDRA leve, 200-100 mmHg moderado y menor de 100 mmHg severo con PEEP mayor o igual a 5 cmH2O (Berlín 2012).7 Actualmente lo podemos definir de forma simplificada de la siguiente manera (Tabla 1).
Tabla 1: Criterios de Berlín para el SDRA.7
| Infiltrados pulmonares bilaterales en estudio de imagen (radiografía de tórax, tomografía computarizada o ultrasonido pulmonar) |
| Edema pulmonar no justificado principalmente por falla cardiaca (evidenciado de forma objetiva, ej. ecocardiografía) |
| PaO2/FiO2 < 300 (con PEEP ≥ 5 cmH2O) |
| Afección pulmonar de inicio menor de siete días |
Existe una modificación de Kigali desde 20168 que puede utilizarse en situaciones catastróficas o de recursos limitados con incapacidad para obtener estudios gasométricos o radiográficos, la cual menciona que los infiltrados pulmonares bilaterales no deben ser necesariamente evidenciados mediante radiografía (Figura 2) o tomografía pulmonar (Figura 3), sino mediante la presencia del patrón B pulmonar bilateral en el ultrasonido pulmonar (Figura 4).9-11 La evaluación para descartar edema pulmonar de origen cardiaco se puede realizar mediante la insonación cardiaca observando una adecuada función sistólica y diastólica del ventrículo izquierdo (Figura 4);12,13 medir el propéptido natriurético cerebral (pro-BNP) podría ser de utilidad para descartar insuficiencia cardiaca.14,15 En cuanto a la PaO2/FiO2 puede sustituirse por SaO2/FiO2 con implicaciones clínicas que se mencionarán posteriormente.

Figura 2: Radiografía postero-anterior simple de tórax que muestra opacidad bilateral correspondiente a neumonía por COVID-19.
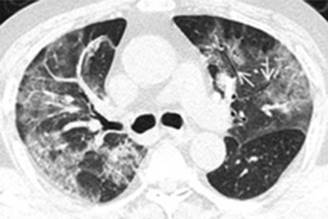
Figura 3: Tomografía axial computarizada de tórax en ventana pulmonar que muestra imagen en vidrio deslustrado bilateral con broncograma aéreo y derrame pleural izquierdo, correspondiente a neumonía por COVID-19.
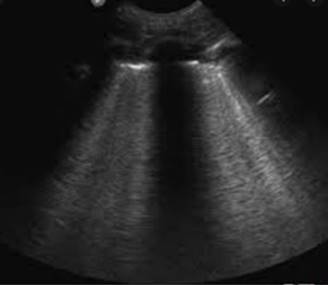
Figura 4: Ultrasonido pulmonar donde se observan líneas B confluentes que ocupan más de 50 a 75% de los campos intercostales, correspondientes a edema pulmonar por COVID-19.
La ventilación mecánica es hasta el día de hoy la piedra angular en el tratamiento, y el impacto en la sobrevida ha sido mediante la estrategia de protección alveolar. El desarrollo de estudios clínicos y experimentales ha permitido el avance en la comprensión de los mecanismos responsables de la patogénesis y la resolución de la lesión, por lo tanto, resumimos en la Figura 5 un algoritmo de manejo de la VMI; sin embargo, siempre deberá individualizarse en cada paciente con base en su presentación clínica, características demográficas y condiciones hemodinámicas.
Ventilación mecánica no invasiva (VMNI) y cánulas nasales de alto flujo
Los sistemas de ventilación mecánica no invasiva (VMNI) y las cánulas nasales de alto flujo no se recomiendan para tratar un SDRA por COVID-19. Se ha demostrado que su uso en SDRA moderado-grave retrasa la ventilación protectora, además representa un riesgo de contagio para los profesionales de la salud, ya que puede generar gran cantidad de aerosoles y su dispersión a varios metros de distancia.6,16-20
La tasa de mortalidad en la UCI entre quienes se usó ventilación no invasiva fue de 23 (79%) de 29 pacientes y entre quienes requirieron ventilación mecánica invasiva fue de 19 (86%) de 22 pacientes.21 El uso de VMNI no ha reducido la mortalidad en los pacientes con COVID-19 y un alto porcentaje (> 85%) requiere intubación orotraqueal,22,23 por lo que no existe suficiente evidencia para recomendar VMNI y cánulas nasales de alto flujo en pacientes con insuficiencia respiratoria por COVID-19.24-26
Ventilación mecánica invasiva (VMI)
Las recomendaciones de la OMS mencionan que los pacientes con SDRA por COVID-19 se manejen con metas de protección pulmonar siguiendo las guías de manejo internacionales dentro de las que se encuentran.27
Volumen corriente (Vt, volumen tidal) de 4 a 8 mL/kg de peso predicho, este último se obtiene mediante la siguiente fórmula:
Peso predicho = (talla en cm - 152.4) x 0.91 + 50 para hombres y (talla en cm - 152.4) x 0.91 + 45.5 para mujeres.
Se recomienda iniciar con un Vt de 6 mL/kg y realizar una pausa inspiratoria para medir la presión meseta, si ésta rebasa 30 cmH2O se debe disminuir el Vt hasta que sea menor que dicha cifra. No se recomienda bajar el Vt a cifras menores de 4 mL/kg.
La presión de distensión alveolar (DP, driving pressure) se mide fácilmente restando la PEEP a la presión meseta, cifras mayores de 13 cmH2O se han asociado a mayor mortalidad; sin embargo, hoy en día no existen estudios prospectivos que avalen la DP como una meta de protección alveolar.
El único modo ventilatorio objetivo que otorga un Vt con mayor exactitud y en el cual pueden monitorearse la presión meseta y la DP es el modo controlado por volumen (CMV), asimismo mediante dicho modo se han manejado los pacientes del estudio ARMA sobre Vt bajo contra Vt alto en SDRA, por lo que se recomienda este modo para ventilar a este tipo de pacientes.
La presión positiva al final de la espiración (PEEP) mínima debe ser de 5 cmH2O para la mayoría de pacientes bajo VMI, en pacientes con SDRA grave se recomiendan niveles altos hasta 15 cmH2O de PEEP basados en la Tabla de PEEP/FiO2 del grupo ARDSNet para mantener una SaO2 meta de 88 a 94% combinándose con la menor FiO2 necesaria para alcanzar este objetivo.
Las maniobras de reclutamiento alveolar no deben usarse de forma rutinaria, podrían considerarse en el caso de hipoxemia refractaria al manejo ventilatorio convencional; sin embargo, estudios recientes demuestran incremento en la mortalidad al utilizarse en pacientes con SDRA en comparación con la aplicación de la Tabla de PEEP/FiO2 baja de la estrategia ARDSNet.28,29
El modo ventilatorio APRV (ventilación con liberación de presión de la vía aérea), aunque ha demostrado beneficio en los niveles de oxigenación arterial de los pacientes con SDRA, no ha demostrado ser superior al modo CMV en mortalidad, además de presentar mayor complejidad para su programación.30 No se recomienda utilizar este modo ventilatorio junto con bloqueadores neuromusculares, mismos que sí han demostrado disminuir la mortalidad en recientes metaanálisis.31-33 No existe suficiente evidencia para recomendar APRV en SDRA por COVID-19.
Manejo ventilatorio en pacientes con obesidad
En México 70% de las personas padece sobrepeso y casi una tercera parte sufre de obesidad, en una pandemia como la actual es prácticamente imposible pensar que no veremos casos graves que requieran ventilación mecánica invasiva, para esto se deberán considerar las alteraciones que sufre la caja torácica con el incremento de la presión transtorácica y la reducción del volumen pulmonar.34-36
El concepto de ventilación mecánica protectora históricamente ha excluido a los pacientes obesos, de tal suerte que las metas de protección alveolar «clásicas» NO son aplicables a este subgrupo poblacional tan importante en nuestro país.
La DP, según estudios, es una meta para reducir la mortalidad sólo en pacientes no obesos37 y realmente existen pocos estudios que analicen el comportamiento de la presión de conducción en los pacientes que sobreviven al ARDS, siendo éste un tópico de particular interés. Trasladando los estudios de Amato y colaboradores,37 optamos por una DP < 15 en pacientes obesos; sin embargo, recomendamos un análisis cuidadoso del resto de las metas de protección pulmonar (Figura 6).
El ajuste de presión meseta objetivo para estos pacientes se recomienda con base en su nivel de presión abdominal según la fórmula siguiente: 27 + (PIA-13) /2 recomendada por Ball y Pelosi.38 En esta editorial también se sugiere tratar de mantener un poder mecánico < 20 J/min. En lo que respecta a las controvertidas maniobras de reclutamiento y la PEEP ideal, un estudio reciente retrospectivo en obesos grado 3 fue superior a la Tabla ARDSNet en cuanto a mortalidad, siguiendo una estrategia con equipo de rescate, este equipo se ayuda de la ecografía y el balón esofágico para decidir el nivel de PEEP.39
Posición prona
Se debe considerar la posición prona por al menos 16 horas al día de forma temprana en pacientes que presenten SDRA moderado-severo con una relación PaO2/FiO2 < 150. En escenarios de recursos limitados o catastróficos, la PaO2/FiO2 puede ser sustituida por SaO2/FiO2, tomando el valor de 190 de SaO2/FiO2 como equivalente a 150 de PaO2/FiO2.40-43 Después de la maniobra, corroborar si el paciente responde a la posición prona o no, si el paciente persiste con hipoxemia se sugiere activar un Código ECMO, al menos como posible candidato, añadiendo los criterios que comentaremos más adelante.
Se requiere personal capacitado para realizar la posición prona de un paciente bajo ventilación mecánica, que pueda identificar los riesgos y complicaciones de la misma. El retraso mayor de tres días a la pronación de un paciente con SDRA no le confiere beneficio, por lo que deberá usarse esta técnica antes de 12 a 72 horas de la VMI, siempre basándose en sus indicaciones (Tabla 2).
Tabla 2: Contraindicaciones y complicaciones de ventilación mecánica en posición prona.51
| Absolutas: hipertensión intracraneal |
| Relativas: inestabilidad vertebral, quemaduras, choque, cirugía traqueal reciente |
| Complicaciones: desaturación transitoria, retiro de catéteres y tubo orotraqueal, vómitos, edema facial y ocular, neuropatía isquémica y úlceras en cara, rodillas y hombros |
Oxigenación por membrana extracorpórea (ECMO)
La oxigenación por membrana extracorpórea (ECMO) se reserva para hipoxemia refractaria sin respuesta a la posición prona o con contraindicación de la misma, actualmente hay un debate en cuanto a si el soporte debe ser venoarterial o venovenoso. No se puede emitir una recomendación hasta el día de hoy sobre la terapéutica extracorpórea específica y su beneficio para la supervivencia en este tipo de pacientes.44-46
Falla multiorgánica
La falla circulatoria es común en las infecciones tanto bacterianas como virales, se desconoce la prevalencia de sepsis viral, los mecanismos fisiopatológicos difieren de la clásica fisiopatología mediada por lipopolisacáridos.47 La sepsis por coronavirus tiene dos órganos blanco identificados: pulmón (ARDS) y corazón (miocarditis).48-50 La proteína S (spike) se une a los receptores de la enzima convertidora de angiotensina que están presentes a nivel pulmonar, intestino delgado, colon y tracto biliar, ésta es la explicación fisiopatológica del cuadro clínico inespecífico y las manifestaciones extrapulmonares.
Restricción hídrica y respuesta a volumen intravenoso
Si bien el porcentaje de pacientes en estado de choque es fluctuante, la respuesta a volumen por técnicas invasivas en contexto de alta contagiosidad a personal de salud no debería considerarse en primera instancia, además de que no se ha demostrado que las técnicas de monitoreo hemodinámico invasivo generen beneficio significativo en los pacientes en estado de choque. En su lugar se ha propuesto regresar a lo básico, poniendo especial énfasis en monitorizar las ventanas clínicas de perfusión tisular: estado neurológico, color y temperatura de la piel y uresis). El doctor Glenn Hernández demostró que en ambientes de escasos recursos el llenado capilar es una herramienta adecuada para guiar la terapéutica hemodinámica y lo asoció a una reducción de la mortalidad en el ANDROMEDA-SHOCK trial (RR 0.75, 95% CI 0.55-1.02).52,53
Conociendo las implicaciones de exponerse al contagio por COVID-19 al utilizar técnicas de monitoreo invasivo de forma innecesaria, consideramos de vital importancia el monitoreo clínico rápido, eficaz y de mínima invasión que incluya la vigilancia del índice de choque, la curva pletismográfica y su variabilidad, el llenado capilar y el puntaje de moteado de la piel.54
Manejo coadyuvante
Se debe buscar una presión de perfusión orgánica adecuada por datos clínicos: llenado capilar, coloración cutánea, niveles séricos de lactato, uresis, temperatura corporal, etcétera. La presión arterial media objetivo para estos fines deberá ser cercana a 65 mmHg, para lo cual se deben usar vasopresores o inotrópicos en caso necesario.55
Se recomienda restricción hídrica para pacientes con SDRA por COVID-19 que no se encuentren en estado de choque. Iniciar antibióticos empíricos de manera temprana ante la sospecha de coinfección bacteriana hasta que se realice el diagnóstico específico, posteriormente guiar la antibioticoterapia por cultivo y antibiograma (Tablas 3 y 4).
Tabla 3: Manejo integral del SDRA por COVID-19.40
| • Monitoreo hemodinámico continuo (TAM > 65 mmHg, uresis > 0.5 mL/kg/h, lactato < 2 mmol/L, llenado capilar, color de la piel, temperatura corporal, etc.) |
| • Balances neutros a negativos |
| • Sedoanalgesia óptima |
| • Aporte nutricional temprano |
| • Profilaxis de úlceras por presión |
| • Tromboprofilaxis |
| • Cabecera central a 40o (en caso de posición supina) |
| • Evitar variabilidad glucémica, mantener glicemia entre 110 y 180 mg/dL |
| • Mantener electrolitos séricos en rangos cercanos a normalidad |
| • Cuidados de los dispositivos invasivos (sondas y catéteres) |
| • Neumotaponamiento del tubo orotraqueal 20 a 30 cmH2O |
| • Prevención de infecciones intrahospitalarias |
Tratamiento farmacológico
Con el surgimiento de la pandemia por COVID-19 se han registrado propuestas farmacológicas que han generado evidencia sobre su uso, dentro de las que se encuentran corticoesteroides, antivirales y antirreumáticos.
Corticoesteroides
El uso sistemático de corticoesteroides en pacientes con neumonía por virus como influenza y MERS-CoV se ha asociado con mayor mortalidad, infecciones secundarias y descontrol metabólico (hiperglicemias, hipernatremia). Estudios en los que se han utilizado corticoesteroides en pacientes con COVID-19 y sepsis, se ha observado como desventaja que prolongan la salida del virus de la vía respiratoria. El uso de corticoesteroides no se recomienda en pacientes con neumonía viral, con excepción de exacerbación de enfermedad pulmonar obstructiva crónica o asma.6,56-59 No se recomienda el uso de corticoesteroides en neumonía asociada a SARS-CoV-2.
Remdesivir
El remdesivir es un antiviral análogo de nucleótidos, el cual inhibe la ARN polimerasa viral evitando la replicación en las células. Se encontró que presenta actividad contra SARS-CoV-2 in vitro con los antecedentes de uso en SARS y MERS-CoV,55,60 con la evidencia previa de datos in vitro y en animales, los cuales otorgaron evidencia que puede respaldar el potencial clínico de remdesivir para infecciones humanas causadas por coronavirus. En Estados Unidos, el primer caso por COVID-2 fue tratado con remdesivir en infusión intravenosa, el cual curiosamente mejoró la condición y sin evidencia de efectos adversos, también se observó disminución de la carga viral a partir del día cuatro de su uso, pero es demasiado pronto para concluir el efecto antiviral directo contra SARS-CoV-2. Un régimen de 10 días de remdesivir con dosis de carga de 200 mg (día uno), seguido de dosis de mantenimiento 100 mg cada 24 horas (nueve días).61,62 Sin embargo, hasta el momento se desconoce el impacto clínico del remdesivir en COVID-19, por lo que se requieren más estudios aleatorizados para evaluar la eficacia de remdesivir en COVID-19.63,64 El remdesivir ha mostrado mejoría en pacientes con COVID-19; sin embargo, se requieren más estudios para evaluar su eficacia y seguridad.
Hidroxicloroquina/cloroquina
La hidroxicloroquina a diferencia de la cloroquina tiene un grupo hidroxilo, la hidroxicloroquina es menos tóxica que la cloroquina; ambos son fármacos antimaláricos utilizados en patologías autoinmunes, se ha estudiado su potencial acción antiviral que aumenta el pH endosómico requerido para el virus, además interfiere con la glicosilación de células receptoras de SARS-CoV.65
En ensayos aleatorizados en fase temprana con cloroquina en pacientes con COVID-19 en China mostraron eficacia significativa en comparación con el grupo control, la recomendación es utilizarlos en pacientes con diagnóstico de neumonía por COVID-19 a una dosis de 500 mg vía oral dos veces al día por 10 días. La hidroxicloroquina tiene mejor perfil de seguridad y permite una dosis diaria más alta; estudios preliminares sugieren un efecto sinérgico de la combinación de hidroxicloroquina (200 mg tres veces/día por 10 días) y azitromicina (dosis de carga 500 mg y 250 mg/día por cuatro días), a expensas de ser estudios de muestras pequeñas mostraron una reducción y desaparición de carga viral en pacientes con COVID-19 y su efecto es reforzado por azitromicina. Sin embargo, se requieren más estudios para saber si su combinación es más efectiva en casos severos.
La hidroxicloroquina y la cloroquina carecen aún de evidencia de ser eficaces ante COVID-2.66
Debido a la disponibilidad de la cloroquina se cree que puede ser el fármaco de elección para uso a gran escala a un costo relativamente bajo comparado con remdesivir. Hasta el momento, estudios tempranos sugieren el uso de hidroxicloroquina en pacientes con SARS-CoV-2; sin embargo, no se puede emitir una recomendación específica sobre su uso como tratamiento para el COVID-19.
Lopinovir-ritonavir
Es un antiviral inhibidor de la proteasa que se ha encontrado actividad in vitro contra SARS-CoV y MERS-CoV. En la actual pandemia de COVID-19 se ha descrito el uso el lopinovir-ritonavir a una dosis de 400 mg y 100 mg, respectivamente dos veces al día por 14 días, sin mostrar ningún beneficio en mejoría clínica ni en mortalidad. Estudios a futuro pueden ayudar a confirmar o excluir la posibilidad de un beneficio.67 No se ha demostrado beneficio del uso de lopinovir-ritovir en pacientes con COVID-19.
Tocilizumab
Tocilizumab es un anticuerpo monoclonal humanizado que se une al receptor celular de la interleucina-6 (IL-6) que impide la transducción de señales, ha sido estudiado en un ensayo clínico; sin embargo, sólo en un pequeño grupo mostró mejoría, pero en otro grupo mostró empeoramiento de los síntomas, progresión de hipoxemia y mortalidad.68 No se recomienda el uso de tocilizumab en pacientes con COVID-19.
Interferón
Los interferones son citocinas que median la actividad antiviral, antiproliferativa e inmunomoduladora en respuesta a infecciones virales y otros inductores biológicos. Se ha estudiado la aplicación de interferón para infección por COVID-19 sin presentar resultados alentadores en vivo, sin reducción en carga viral ni disminución de mortalidad en comparación con estudios in vitro, por lo que no se recomienda su uso para esta patología.69
Nota importante: los ensayos clínicos generados desde el inicio de la pandemia por COVID-19 no han presentado significancia estadística suficiente que respalde su uso rutinario; sin embargo, en situaciones de desastre podrían considerarse los resultados clínicos sobre los estadísticos. Siempre debe ponderarse la evidencia científica y aspirar a intervenciones costo-efectivas y seguras.
Conclusión
Ante la pandemia generada por COVID-19, el personal que labora en las unidades de cuidados intensivos de México debe estar familiarizado con los puntos clave del manejo médico, ventilatorio y farmacológico, tomando como base los lineamientos internacionales con suficiente evidencia para reproducirlo en la práctica diaria y tener impacto en la supervivencia de este tipo de pacientes.











 nueva página del texto (beta)
nueva página del texto (beta)




