Introducción
La ventilación mecánica (VM) se ha consolidado como una herramienta imprescindible en el manejo del paciente con falla respiratoria; sin embargo, desde sus inicios se han reconocido diferentes complicaciones asociadas, incluyendo mayor riesgo de infecciones, atrofia diafragmática, neuromiopatía e incluso daño pulmonar directo secundario a las presiones de la vía aérea, volúmenes tidales y a la apertura y cierre alveolar de manera cíclica.1 El impacto de estas complicaciones es tan importante que inicialmente se llegó a considerar el uso profiláctico de tubos pleurales, debido a la alta incidencia de neumotórax derivado del uso de presiones positivas altas en el paciente bajo ventilación mecánica invasiva (VMI).2
Hoy en día, existe mucho mayor interés por establecer estrategias para disminuir este daño al tejido pulmonar, y bajo conceptos de fisiología respiratoria se han planteado los diferentes mecanismos que favorecen la lesión pulmonar secundaria a la ventilación mecánica, denominada VILI en la literatura anglosajona (ventilator-induced lung injury). Este tipo de lesión es resultado del volutrauma, barotrauma, atelectrauma, biotrauma y recientemente se añadió el término ergotrauma.3 El actual concepto de VILI es el resultado de una evolución de las estrategias de protección pulmonar, las cuales iniciaron con el Dr. Amato con la disminución de los volúmenes tidales, posteriormente con la limitación de la presión meseta, más adelante con maniobras de reclutamiento y titulación de la presión positiva al final de la espiración (PEEP) para intentar mantener el «pulmón abierto», hasta finalmente acuñarse el concepto de presión de conducción alveolar.4
La tendencia actual apunta a considerar que la presión transpulmonar es mucho más importante que la presión localizada en la vía aérea, puesto que esta presión es la que realmente rodea al alvéolo y es la que ayuda a disminuir la heterogeneidad de las áreas pulmonares mal ventiladas, incrementando la capacidad pulmonar residual. Limitar su magnitud evita transmitir una energía excesiva al parénquima pulmonar ya previamente lesionado.5
El equivalente clínico de la presión transpulmonar es el estrés pulmonar, definido como la fuerza por unidad de área que reacciona contraria a una carga externa sobre el pulmón. Por otro lado, la deformación (strain) es el cambio de volumen que se produce al distenderse el pulmón en relación con su estado basal; es decir, en relación con la capacidad residual funcional (ΔV/CRF).6 Ambos están relacionados entre sí mediante la fórmula Stress = k * Strain, en la cual la constante k hace referencia a la elastancia específica. De esta fórmula podemos deducir que la presión transpulmonar aumentará al incrementarse el volumen tidal o al disminuir la distensibilidad, y que un mismo volumen tidal puede generar diferentes niveles de estrés, dependiendo tanto de las características físicas del pulmón como de la pared torácica.5
Un subrogado para el cálculo de la presión transpulmonar es la presión de conducción de la vía aérea (presión meseta-PEEP), pues aunque no toma en cuenta las propiedades elásticas de la pared torácica, varios estudios experimentales han encontrado una correlación aceptable entre la presión de conducción de la vía aérea con respecto al estrés pulmonar.5,7
La presión de conducción y la distensibilidad son elementos de la ecuación del movimiento respiratorio en el componente elástico; sin embargo, es necesario considerar también el componente resistivo de la fórmula y el nivel de PEEP para constituir la cantidad de energía administrada al sistema.8 Si a estos elementos se les asocia el factor de la frecuencia respiratoria, el concepto se denomina poder mecánico; es decir, la cantidad de energía por unidad de tiempo que se aplica a través de la VMI.9
Estos conceptos teóricos sobre las variables que se asocian con VILI han sido planteados a través de fórmulas como las propuestas por los Dres. Gattinoni y Marini;9,10 sin embargo, se desconoce cuál de estas fórmulas es la mejor para predecir mortalidad y la evolución del paciente crítico.
Material y métodos
El estudio fue aprobado por los comités de investigación y de ética en investigación del hospital sede.
Se trata de un estudio observacional, se incluyeron pacientes en ventilación mecánica, con menos de seis horas de inicio de la misma, los cuales tuvieran relación PaO2/FiO2 menor de 200 con al menos 5 cmH2O de PEEP. Los pacientes fueron ventilados considerando las metas de protección alveolar, volúmenes tidales 6-7 mL/kg de peso ideal y se incluyeron pacientes con causas pulmonares como extrapulmonares. Los criterios de exclusión se aplicaron a aquellos pacientes con diagnóstico de choque cardiogénico o evidencia objetiva de falla cardiaca. Se eliminaron los pacientes que egresaron de la unidad de terapia intensiva en los primeros tres días, por diferentes causas.
Se realizaron los registros de las siguientes variables estáticas: volumen tidal (Vt), nivel de PEEP, presión pico (Ppico), frecuencia respiratoria (FR), relación inspiración:espiración (I:E), tiempo inspiratorio (Ti), y durante una pausa inspiratoria de dos segundos fue registrada la presión meseta de la vía aérea (Pplat). Las variables secundarias fueron calculadas de la siguiente forma:11
Distensibilidad (C) = Vt/(Pplat-PEEP)
Elastancia (E) = 1/C
Presión de conducción de la vía aérea (ΔPaw) = Pplat-PEEP = Vt/C = E Vt
Para el cálculo del poder mecánico se utilizaron las siguientes fórmulas:9),(10
Los registros fueron realizados con los parámetros iniciales, los cuales se mantuvieron en las primeras horas y posteriormente se obtuvieron registros de las configuraciones de los ventiladores al tercer día de VMI para comparar el impacto de las variables medidas y calculadas sobre la evolución del paciente.
Para el análisis del estudio, en la estadística descriptiva se incluyeron medidas de tendencia central y de dispersión, las variables categóricas expresadas como medidas de frecuencia absoluta y relativa, y las variables lineales como media y desviación estándar (DE) o medianas y rangos intercuartilares (RIQ). En la estadística inferencial las variables categóricas fueron analizadas con prueba de χ2. Las variables numéricas fueron comparadas mediante prueba de t de Student. El análisis de sobrevida incluyó la construcción de curvas de Kaplan-Meier y el cálculo de razón de riesgo (RR) con intervalos de confianza de 95%. El análisis de sensibilidad y especificidad incluye la construcción de curvas de característica operativa del receptor (ROC) para identificación del mejor punto de corte y la comparación de las áreas bajo la curva (AUC). El error alfa ajustado menor de 5% a dos colas fue considerado significativo. La paquetería estadística empleada fue Stata SE v. 11.0.
Resultados
Un total de 67 pacientes, 58.21% mujeres y 41.79% varones con edad de 60.65 ± 17.17 años, con criterios de síndrome de insuficiencia respiratoria aguda (SDRA) moderado y grave. La mediana de tiempo de estancia intrahospitalaria fue de 19 días (RIQ 11-27) y la mediana de días de VMI fue de ocho días (RIQ 5-13). La Tabla 1 muestra el resto de las variables demográficas de la población en el día uno.
Tabla 1: Variables demográficas de la población en el día 1.
| Media | DE | Mediana | Percentil 25 | Percentil 75 | |
|---|---|---|---|---|---|
| Peso ideal | 64.231 | 8.792 | 63.786 | 57.416 | 71.066 |
| Volumen tidal | 423 | 94 | 400 | 350 | 500 |
| Volumen minuto | 10.4 | 2.1 | 10.0 | 9.0 | 12.0 |
| PEEP | 12 | 4 | 10 | 10 | 16 |
| Presión meseta | 25 | 5 | 26 | 22 | 29 |
| Presión pico | 30 | 5 | 30 | 28 | 32 |
| Frecuencia respiratoria | 25.35 | 5.68 | 24.86 | 21.14 | 29.44 |
| Tiempo inspiratorio | 0.83 | 0.20 | 0.80 | 0.68 | 0.95 |
| Distensibilidad | 0.04 | 0.04 | 0.03 | 0.02 | 0.05 |
El PM calculado por la fórmula de Gattinoni ≥ 22.4 J/min se asoció con mayor mortalidad al tercer día, con un RR = 1.64 (IC 95% 0.64-4.1, p = 0.02). La diferencia fue estadísticamente significativa y se refleja en la gráfica de Kaplan-Meier de la Figura 1. Por la fórmula del Dr. Marini, al tercer día, un poder mecánico ≥ 12 J/min se asoció con mayor mortalidad, con un RR = 1.65 (IC 95% 0.67-4.08, p = 0.2) como se observa en el caso de la Figura 2.
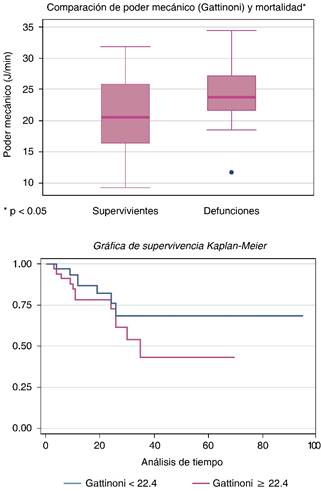
Figura 1: Asociación de mayor mortalidad en los pacientes ventilados con PM mayor de 22.4 J/min por fórmula de Gattinoni al tercer día.
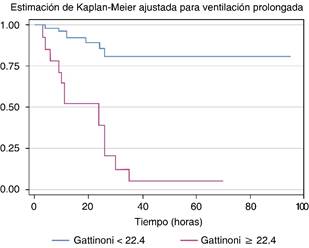
Al subdividir a los pacientes con VMI prolongada (> 7 días) el poder estadístico se incrementó en el caso de la fórmula de Gattinoni, y se observó un riesgo aumentado de mortalidad con PM ≥ 22.4 J/min, RR = 5.89 (IC 95% 0.96-36.22, p = 0.055). Esto se puede observar en la gráfica de Kaplan-Meier de la Figura 3.
Finalmente, el análisis de regresión logística binaria reveló que el PM al tercer día tuvo capacidad para discriminar mortalidad, tanto con la fórmula de Gattinoni como con la de Marini, con sus respectivos puntos de corte, con área bajo la curva ROC de 0.66 (IC 95% 0.52-0.79) y 0.63 (IC 95% 0.47-0.79), respectivamente (p = 0.7) (Figura 4).
Discusión y conclusiones
La mortalidad global de la población estudiada con criterios de SDRA moderado y grave fue de 28%, la cual es ligeramente menor que la referida en la literatura anglosajona (30-45%) informada en su registro nacional de incidencia entre 2006 y 2014.12 Este hallazgo podría relacionarse con las variables demográficas de nuestra población; la Tabla 1 muestra que se respetaron las metas de protección pulmonar estándar al inicio de la VM, con un PEEP medio de 12 cmH2O (RIQ 10-16), presión meseta de 25 cmH2O (RIQ 22-29), presión de conducción media de 13 cmH2O y media de presión pico de 30 cmH2O (RIQ 28-32). Probablemente, por ello no encontramos diferencias significativas en mortalidad respecto a los parámetros iniciales de PM (día 1), dado que es un cálculo directo de estas variables.
El concepto del volumen tidal como la principal causa de VILI ha quedado obsoleto si se considera como el único factor.13 Posteriormente, se consideró la presión de conducción de la vía aérea como un factor más relevante como detonante de la cascada inflamatoria que lleva el barotrauma y el VILI; sin embargo, un mismo nivel de ΔPaw puede originar diferente grado de estrés pulmonar dependiendo de la elastancia pulmonar y la elastancia total (incluyendo la pared torácica). Además, dentro de la ecuación se omite el papel del flujo, el cual aparece en la ecuación del movimiento respiratorio.14
Existen estudios experimentales que han desarrollado el concepto de PM para predecir el desarrollo de VILI a través de diferentes fórmulas y cálculos mediante programas computacionales del análisis del área bajo la curva de presión/volumen;15-19 sin embargo, existen dos principales fórmulas, la primera descrita por el Dr. Gattinoni que toma en cuenta el flujo y por ello aparece el factor de la presión pico,9 mientras que en la fórmula descrita por el Dr. Marini se elimina este factor.10 En ambos casos se considera la frecuencia respiratoria para convertir la cantidad de energía en potencia administrada al sistema.
La diferencia entre estas dos fórmulas no ha sido evaluada a la par en un estudio clínico. El presente trabajo se enfocó en comparar el pronóstico del paciente crítico en VMI sometido a diferentes niveles de PM con ambos métodos.
Se debe considerar, en primer lugar, que los puntos de corte son distintos en cada una de las fórmulas, como se ha demostrado en estudios previos.
En nuestro estudio observacional, la magnitud del PM de acuerdo con los parámetros iniciales no fue capaz de predecir el desenlace de mortalidad, pero al tercer día ambas fórmulas demostraron capacidad predictiva; ambas con una razón de riesgo (RR) muy similar que se puede interpretar como una probabilidad de fallecer 0.65 veces más que quienes se mantuvieron por debajo del punto de corte de 22.4 J/min y de 12 J/min de las fórmulas del Dr. Gattinoni y del Dr. Marini, respectivamente. La significancia estadística se presentó con la fórmula del Dr. Gattinoni con p = 0.02.
Revisando la literatura sobre otros estudios clínicos, únicamente la validación del Dr. Guerin de la fórmula de Marini ha sido publicada con 805 pacientes de forma retrospectiva, en la cual ni el nivel de PEEP ni el volumen tidal estuvieron asociados con mortalidad como variables aisladas; sin embargo, un PM de 14.3 J/min estuvo asociado con mortalidad a 90 días, contra 13 J/min de promedio de PM en el grupo de sobrevivientes (p < 0.001). En el análisis de regresión, la presión de conducción de la vía aérea se asoció a una RR muy modesta de 1.05 (1.02-1.08, p = 0.005). No existe evidencia clínica de ningún otro estudio aleatorizado que analice directamente la propensión de riesgo y determine las curvas ROC para una población con SDRA, dependiendo de la magnitud del PM.
En nuestro estudio, el poder predictivo de la fórmula original propuesta por el Dr. Gattinoni adquiere mucho mayor valor cuando se aplica de forma exclusiva en la población que estuvo más de siete días en VMI, pues en ellos un PM elevado se asoció con una mortalidad casi seis veces mayor con diferencia estadística.
Las áreas bajo la curva ROC fueron muy similares en ambas fórmulas, con un rendimiento discretamente mejor en el caso de la fórmula del Dr. Gattinoni. Lo anterior nos lleva a pensar que la teoría inicial de considerar en la fórmula la presión pico como reflejo del flujo, parece tener un impacto significativo, aunque de pequeña magnitud. Se había estimado que el flujo, parte del componente resistivo de la ecuación del movimiento respiratorio, se disipa sólo en la vía aérea y no afecta al parénquima pulmonar; sin embargo, al parecer su efecto in vivo no es completamente despreciable.
Nuestro análisis nos permite concluir que el volumen tidal y las presiones de la vía aérea no son suficientes para establecer metas de protección pulmonar. Mantener una estrategia protectora basada en el concepto teórico de energía transmitida al pulmón mediante un cálculo que pueda realizarse a la cabecera del paciente es prometedor. En este estudio observacional, mantener un PM por debajo de los puntos de corte demostró asociarse con una tendencia a menor mortalidad, y su impacto es mayor en los pacientes con ventilación prolongada. El PM también podría asociarse con mayores días de VMI y mayor dificultad para la extubación, pero se requieren nuevos estudios.











 nova página do texto(beta)
nova página do texto(beta)