Introducción
El delirium es una entidad clínica que se caracteriza por una disfunción aguda en el estado de consciencia por alteraciones de la cognición y la atención con un curso fluctuante.1-3 Se trata de una enfermedad con alta prevalencia en pacientes críticamente enfermos, pero con frecuencia pasa desapercibida.4-8 El desarrollo de delirium durante la enfermedad crítica tiene implicaciones de pronóstico importantes, pues se asocia a mayor mortalidad y a un deterioro cognitivo en los sobrevivientes.9-12 Ésta es la razón por la cual es necesario desarrollar estrategias con el objetivo de identificar de manera oportuna el desarrollo de delirium en la UCI.13 Sin embargo, ha sido difícil establecer estrategias para la prevención del delirium y su detección representa un reto en la UCI.2 Una razón por la que el delirium es una enfermedad tan prevalente, representa un reto diagnóstico y un reto mayor de prevención nace del hecho de que se conoce muy poco acerca de su fisiopatología y su relación con la enfermedad crítica.14-18 Dentro de la búsqueda de la fisiopatología del delirium, se ha descubierto que existe un enlace entre la inflamación y el desarrollo del delirium, donde niveles elevados de interleucinas proinflamatorias se asocian a mayor desarrollo de delirium en la UCI.19-21 La procalcitonina es un marcador de sepsis y tiene un uso bien fundamentado en la práctica clínica actual. Es una herramienta diagnóstica de gran utilidad como guía de la terapia antimicrobiana y marcador pronóstico.22-35 Los cambios en los niveles de procalcitonina en el curso de la enfermedad reflejan la respuesta al tratamiento, mientras que el aumento de los niveles séricos de procalcitonina indica un mal pronóstico.34-38 Existe escasa evidencia de que dicho marcador se encuentre elevado en pacientes con respuesta inflamatoria sistémica que desarrollan delirium, independientemente de la presencia de infección.39,40 A pesar de que una procalcitonina elevada al principio de la enfermedad crítica se asocia al desarrollo de delirium, se desconoce si los cambios a través del tiempo también resultarían útiles para identificar a los pacientes con alto riesgo de desarrollar delirium durante su estancia hospitalaria y mejorar la detección temprana del delirium.
Material y métodos
Se trata de un estudio descriptivo, observacional y retrospectivo, no aleatorizado ni probabilístico. No se realizó ninguna intervención. Se realizó en pacientes con síndrome de respuesta inflamatoria sistémica en la UCI de un hospital privado de la ciudad de Monterrey, N.L. Se trata de una UCI de 14 camas, privada, abierta, con población mixta de pacientes. Se incluyeron pacientes de ambos sexos mayores de 18 años con criterios diagnósticos de síndrome de respuesta inflamatoria sistémica41 que ingresaron a la UCI entre el periodo del 01 de junio de 2014 y el 01 de junio de 2016 y que hubieran cursado más de 72 horas. Se excluyeron pacientes embarazadas o en puerperio inmediato, que hubieran sufrido una patología neurológica en los últimos tres meses, pacientes con diagnóstico probable o confirmado de muerte encefálica, síndrome de postparo cardiorrespiratorio, postoperados de cirugía cardiaca con uso de circulación extracorpórea, SOFA menor de un punto o APACHE II menor de ocho puntos al ingreso y pacientes con un reingreso a UCIA dentro de los últimos tres meses.
Previa aprobación del comité de ética e investigación del hospital, se revisó la base de datos del expediente clínico del hospital en busca de pacientes que cumplieran con los criterios de inclusión ya mencionados y que hubieran ingresado a la UCIA en el periodo especificado. Al ingreso de los pacientes en la UCIA se registran los datos demográficos, tipo de internamiento, así como antecedentes médicos relevantes, deterioro cognitivo preexistente y uso previo de fármacos asociados a delirium. De manera rutinaria, se registran el SOFA y APACHE II al momento del ingreso de todos los pacientes. Los valores de procalcitonina se obtienen al ingreso y a las 24, 48 y 72 horas posteriores. Con base en estos datos, se calcula la depuración de procalcitonina de la siguiente manera:
Procalcitonina inicial-procalcitonina final/procalcitonina inicial × 10036,37
También se determinan los niveles de proteína C reactiva dentro de las primeras 24 horas de ingreso. La medición de procalcitonina y proteína C reactiva se lleva a cabo en el laboratorio del hospital por método de ensayo de electroinmunoluminicencia automatizado. Se valora diariamente el grado de sedación con la escala de RASS y la presencia de delirium o coma detectado por la herramienta CAM-ICU.13 Estas variables se miden hasta el egreso de la UCIA o a los 30 días de estancia en dicha unidad. Asimismo, se registra el tipo de sedación, opioides y antipsicóticos, así como su tiempo de uso. Se estudiaron los «días libres de coma o delirium» durante el periodo del estudio, pues de esta manera se refleja el periodo de días en el que el paciente se encontró vivo y libre de disfunción cerebral (delirium o coma); por lo tanto, este parámetro representa los días que el paciente se mantuvo en un estado neurológico «normal» al ser evaluado por el CAM-ICU.42 Del mismo modo, se registran los días de ventilación mecánica, los días de estancia en la UCIA, los días de estancia hospitalaria y la mortalidad.
Las variables de estudio de cada paciente se vaciaron en una base de datos del programa JMP V12.1. De primera intención, se analizó la distribución de las variables utilizando cuentas y porcentajes para la descripción de variables cualitativas, y medias y desviaciones estándar para la descripción de las variables continuas. Para analizar las diferencias entre las variables nominales se utilizó la Prueba de Chi Cuadrada (χ2). Para efectuar el análisis entre las diferencias de medias de variables numéricas se empleó la prueba de T para las variables continuas, asumiendo una distribución normal. En caso de que la distribución de las variables fuera asimétrica, se usó la prueba de los rangos con signo de Wilcoxon (U de Mann-Whitney). Asimismo, se utilizó el modelo de los riesgos proporcionales de Cox para detectar alguna relación entre el riesgo de días libres de delirium/coma, los días de ventilación mecánica, de estancia hospitalaria en la UCI y las variables independientes. Esta prueba reportó las razones de riesgo con un intervalo de confianza de 95% para estimar la probabilidad de más o menos días libres de disfunción entre los pacientes en el percentil de 75% de los niveles de los biomarcadores, comparado con los pacientes en el percentil de 25% de los niveles de los biomarcadores en la población estudiada. Se analizó si hubo relación lineal o no lineal entre las diferentes variables numéricas y, en su caso, se eliminaron del modelo. Finalmente, se realizó un ajuste de bondad de modelo por regresión logística de las variables continuas en relación con la presencia de delirium y, a partir de esto, se evaluó la habilidad pronóstica de las variables continuas como el área bajo la curva característica operativa del receptor (AUROC). Esta curva ilustra el desempeño de una variable según cambia el umbral de discriminación al representar la razón de verdaderos positivos frente a la razón de falsos positivos (sensibilidad frente a 1-especificidad) de una prueba. Para los objetivos de este estudio se consideró una p ≤ 0.05 como estadísticamente significativa.
Resultados
Se estudiaron 314 pacientes de ambos sexos mayores de 18 años que ingresaron a la UCI entre el periodo del 01 de junio de 2014 y el 01 de junio de 2016, con criterios diagnósticos de síndrome de respuesta inflamatoria sistémica y que hayan cursado con una estancia mayor de 72 horas en la UCI. De éstos, se excluyeron del análisis 188 pacientes para un total de 126 pacientes. Las características demográficas de los 126 pacientes analizados se resumen en la Tabla 1. De manera global, se presentó delirium por al menos un día en 55% de los pacientes, de éstos, 48% recibieron ventilación mecánica invasiva y la mortalidad hospitalaria fue de 23.01%. El promedio de días de estancia en la UCIA fue de 8.1 días, en los pacientes que recibieron ventilación mecánica el promedio de días de ventilación mecánica fue de 6.4 días y el promedio de estancia hospitalaria fue de 8.6 días. Los niveles promedio de proteína C reactiva al ingreso fueron de 15.87 (± 11.16) µg/L y los niveles promedio de procalcitonina al ingreso fue de 26.96 (± 74.69) ng/mL. Los niveles de procalcitonina disminuyeron en todos los pacientes del momento del ingreso a las 72 horas.
Tabla 1: Características de la población.
| Variable | Promedio o cuenta (desviación estándar o porcentaje) |
|---|---|
| Edad | 63.61 años (18.24) |
| Género masculino | 69 (55.2) |
| Género femenino | 57 (45.2) |
| Comorbilidades | |
| Ninguna | 18 (14.3) |
| Hipertensión arterial sistémica | 58 (46.0) |
| Diabetes mellitus | 52 (41.3) |
| Insuficiencia renal crónica | 26 (20.6) |
| Oncológico | 20 (15.9) |
| Cirrosis hepática | 11 (8.7) |
| Cardiopatía isquémica | 10 (7.9) |
| Deterioro cognitivo previo | 24 (19) |
| Medicamentos asociados a delirium | 38 (29.4) |
| Tipo de ingreso | |
| Sepsis y choque séptico | 57 (45.2) |
| Cirugía mayor | 26 (20.6) |
| Policontindido | 2 (1.5) |
| Pancreatitis | 3 (2.3) |
| Quemaduras | 1 (0.8) |
| Falla respiratoria | 21 (0.16) |
| Falla cardiaca | 10 (7.9) |
| Sangrado | 4 (3.1) |
| Otro | 2 (1.5) |
| APACHE II | 17.75 (7.27) |
| SOFA | 7.32 (3.43) |
| Ventilación mecánica | 61 (48.41) |
| Delirium | 69 (55.2) |
| Mortalidad | 29 (23.01) |
| Días de estancia en UCIA | 8.10 (5.56) |
| Días de estancia hospitalaria | 17.87 (8.58) |
| Días de ventilación mecánica | 6.4 (5.4) |
| Días libres de coma o delirium | 4.57 (3.87) |
| Tipo de sedación | |
| No | 52 (41.3) |
| Propofol | 31 (24.6) |
| Dexmedetomidina | 61 (48.4) |
| Benzodiacepinas | 24 (19.0) |
| Días de sedación | 3.47 (5.3) |
| Uso de opioides | 84 (66.6) |
| Uso de antipsicóticos | 32 (25.39) |
En los pacientes que presentaron delirium se observaron mayores niveles séricos de procalcitonina al ingreso, a las 24, 48 y 72 horas frente a quienes no lo presentaron. No hubo una diferencia entre los niveles de proteína C reactiva, ni diferencias significativas en el porcentaje de depuración de procalcitonina entre los pacientes que presentaron delirium y aquéllos que no (Tabla 2 y Figura 1). Sólo los niveles de proteína C reactiva y el aclaramiento de procalcitonina a las 48 horas se asociaron a mayor riesgo de tener menos días libres de delirium o coma por el análisis de riesgos proporcionales de Cox. Se observó un cociente de riesgo de 0.97 (IC 0.96-0.99; p = 0.0154) por unidad de proteína C reactiva y un cociente de riesgo de 1.17 (IC 1.02-1.35; p = 0.0261) por unidad de aclaramiento de procalcitonina a las 48 horas. Esto significa que cada aumento de unidad con respecto a la unidad previa (por ejemplo de 0 µg/L a 1 µg/L) en los niveles séricos de proteína C reactiva confiere menos posibilidades de tener días libres de delirium o coma. En el caso del aclaramiento de procalcitonina a las 48 horas, un aumento de la unidad con respecto a la unidad previa (por ejemplo de 0% al 100%) confiere más posibilidades de tener días libres de delirium o coma, recordando que los días libres de delirium o coma representan días «normales» a nivel neurológico. Finalmente, por un modelo de regresión logística, las variables con mejor discriminación para predecir la presencia de delirium fueron la depuración de procalcitonina a 72 horas y el puntaje APACHE II. La depuración de procalcitonina a 72 horas presentó un área bajo la curva ROC de 0.56988 con una p = 0.0177, demostrando un punto de corte de -91.36% de depuración. El puntaje APACHE II reveló un área bajo la curva ROC de 0.65463 con una p = 0.0065, demostrando un punto de corte de 18 puntos (Figura 2).
Tabla 2: Marcadores de inflamación en pacientes con delirium.
| Variable | Sin delirium | Delirium | p |
|---|---|---|---|
| Proteína C reactiva al ingreso (µg/L) | 15.83 ± 12.87 | 16.04 ± 9.67 | 0.9195 |
| Procalcitonina al ingreso (ng/mL) | 13.95 ± 46.90 | 37.88 ± 90.58 | 0.0368 |
| Procalcitonina a las 24 horas (ng/mL) | 12.28 ± 44.18 | 41.26 ± 93.97 | 0.0087 |
| Procalcitonina a las 48 horas (ng/mL) | 12.05 ± 42.82 | 31.87 ± 78.60 | 0.0092 |
| Procalcitonina a las 72 horas (ng/mL) | 7.41 ± 23.00 | 19.41 ± 49.76 | 0.0007 |
| Depuración de procalcitonina a las 24 horas (%) | -20.6 ± 142.0 | -83.2 ± 248.6 | 0.0972 |
| Depuración de procalcitonina a las 48 horas (%) | -8.7 ± 130.8 | -53.7 ± 188.6 | 0.2090 |
| Depuración de procalcitonina a las 72 horas (%) | 30.7 ± 53.2 | -55.1 ± 249.3 | 0.1799 |
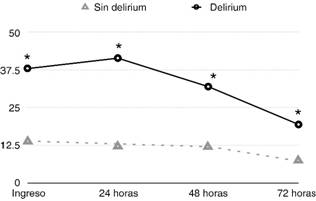
Se grafican las medias de procalcitonina en ng/mL.
* p < 0.05 pacientes que presentaron delirium frente a quienes no lo presentaron.
Figura 1: Niveles de procalcitonina a través del tiempo en delirium.
Análisis y conclusiones
Analizando específicamente la asociación entre la proteína C reactiva y la presencia de delirium, este estudio difiere en algunos puntos con el resto de la literatura que aborda el tema. Como tal, en la población estudiada no se demostraron niveles séricos de procalcitonina más altos al ingreso en los pacientes que presentaron delirium, frente a quienes no lo presentaron.43,44 Este hallazgo contrasta con estudios previos que sí han demostrado una diferencia en los niveles séricos de proteína C reactiva al ingreso, por ejemplo, Zhang y cols. efectivamente detectaron una diferencia en los niveles de proteína C reactiva de ingreso en los pacientes que desarrollaron delirium (120.5 versus 57.5 mg/L; p = 0.0001), independiente de otras variables de severidad.43 Esto puede deberse a la naturaleza del estudio, pues fue un análisis prospectivo, mientras que el presente análisis fue retrospectivo y, como tal, no hubo un protocolo para la recolección de las variables. Por su parte, Macdonald y cols. no observaron una diferencia en niveles al ingreso de proteína C reactiva en los niveles en pacientes que ya presentaban delirium al ingreso frente a quienes no lo presentaban, aunque los niveles de proteína C reactiva que se encontraban elevados se asociaron a la recuperación de un episodio de delirium previo o a la incidencia de delirium.45 Sin embargo, este estudio se enfocó más en los niveles de proteína C reactiva y su asociación de riesgo de tener días libres de coma o delirium; en este aspecto, el análisis fue similar al estudio de McGrane y cols,42 en el que evaluaron la probabilidad de tener un día libre de delírum o coma con base en los niveles al ingreso de proteína C reactiva; esto es, la probabilidad de tener días neurológicos «normales», encontrando que niveles más altos de proteína C reactiva reducían significativamente la probabilidad de tener días libres de delirium o coma (OR de 0.6; IC 95% , 0.3 a 1.1; P = 0.08). De esta manera, los hallazgos son similares a los del presente estudio, pues se demostró un cociente de riesgo (OR) de 0.97 (IC 0.96-0.99; p = 0.0154) por unidad de proteína C reactiva. Esto significa que cada aumento de unidad con respecto a la unidad previa (por ejemplo de 0 µg/L frente a 1 µg/L o de 1 µg/L frente a 2 µg/L) en los niveles séricos de proteína C reactiva confiere menos posibilidades de tener días libres de delirium o coma. Dicho de una manera más simple, un mayor nivel de proteína C reactiva al ingreso disminuye las posibilidades de que los pacientes tengan días neurológicamente normales. Es probable que la diferencia en el cociente de riesgo entre este estudio y el trabajo de McGrane se deba a que dicho trabajo evaluó los cambios por cambio en cuantiles de los niveles de proteína C reactiva y no los cambios en las unidades absolutas, como este estudio.
En relación con las determinaciones individuales de procalcitonina, se observó una diferencia significativa en los niveles séricos entre cada una de ellas en los pacientes que desarrollaron delirium frente a quienes no lo desarrollaron. Fue similar a la investigación de van den Boogard y cols., en la que se detectaron diferencias entre los niveles séricos de procalcitonina al ingreso en pacientes que desarrollaron delirium y quienes no lo desarrollaron (0.35 ng/mL versus 0.14 ng/mL; p < 0.001), aunque en una proporción mayor en el presente estudio.40 Probablemente, esto se deba a una proporción más alta de pacientes sépticos y a mayor gravedad de la enfermedad aguda. Cabe mencionar que el estudio que nos ocupa ha evaluado los niveles de procalcitonina a través del tiempo y no se observaron diferencias importantes en la tasa de depuración de procalcitonina entre los pacientes que desarrollaron delirium y aquéllos que no. Los niveles individuales de procalcitonina o los cálculos de depuración de procalcitonina tampoco resultaron útiles para la predicción de desarrollo del delirium; sólo la depuración de procalcitonina a 72 horas presentó una área bajo la curva ROC de 0.56988 con una p = 0.0177, demostrando un punto de corte de -91.36% de depuración, lo cual fue significativamente menor que el puntaje APACHE II. Pese a ello, en el análisis de riesgos proporcionales, la depuración de procalcitonina a las 48 horas demostró un cociente de riesgo (OR) de 1.17 (IC 1.02 - 1.35; p=0.0261) por cada 100% de aclaramiento de procalcitonina. Esto significa que un aumento de aclaramiento de procalcitonina de 0 a 100% confiere un 17% más posibilidades de presentar días libres de delirium o coma. En otras palabras, un mayor porcentaje de aclaramiento de procalcitonina a las 48 horas aumenta las posibilidades de que los pacientes tengan días neurológicamente normales. Contrario al estudio de McGrane y cols., previamente mencionado, en los niveles de procalcitonina al ingreso no se observó un cociente menor de riesgo de tener días libres de coma o delirium. La razón de dichos hallazgos podría tener varias explicaciones, es posible que el aclaramiento de procalcitonina tenga mejor relación con los días libres de delirium o coma y, por lo tanto, los niveles individuales de procalcitonina no hayan resultado significativos. Como se señaló anteriormente, los niveles de procalcitonina en este estudio fueron significativamente mayores que en otras investigaciones similares y es probable que se deba a la naturaleza retrospectiva del estudio, comparado con el trabajo de McGrane, que recolectó sus datos de manera prospectiva dentro de un ensayo clínico controlado.46
Finalmente, cabe mencionar los hallazgos respecto a la mortalidad del estudio, donde sólo se observó una diferencia entre los porcentajes de depuración de procalcitonina a las 72 horas entre los pacientes que sobrevivieron y los que fallecieron dentro del hospital, similar a lo demostrado en investigaciones previas, aunque por análisis de regresión logística todas las variables asociadas a la procalcitonina no demostraron discriminación en la predicción de mortalidad en la población estudiada de pacientes críticamente enfermos.35-37 Estas diferencias se atribuyen nuevamente a la naturaleza retrospectiva del estudio y es probable que el médico tratante no haya tomado determinaciones de procalcitonina en pacientes con menor gravedad de la enfermedad o cuando no haya existido una incertidumbre diagnóstica y, por lo tanto, esto haya sesgado de alguna manera las mediciones del biomarcador en el presente estudio. También se considera que la posibilidad de dichos hallazgos se deba a que estos resultados han sido derivados de pacientes exclusivamente con choque séptico y no de poblaciones de pacientes que no han sido sometidos a una selección más rigurosa, como en el estudio que nos ocupa, cuyos objetivos se enfocaron en pacientes con estados proinflamatorios más variados y en excluir los factores confusos en la fisiopatología y en la detección de delirium.
Como se ha mencionado, este estudio tiene varías limitaciones debido al diseño descriptivo y recolección retrospectiva de los datos. La recolección de los datos está a expensas de lo que se ha registrado previamente en el expediente clínico y es posible que los datos relevantes para el estudio no hayan sido registrados. Desafortunadamente, tampoco es posible obtener o corroborar los datos faltantes. También existe la posibilidad de que los datos registrados no sean los correctos o no correspondan al paciente. Además de los problemas inherentes del registro adecuado de datos, las decisiones clínicas no seguían un protocolo específico predeterminado, estaban sujetas al escenario clínico del momento en el que se presentaron, a la interpretación clínica de los datos por los médicos, así como a las preferencias de los tratantes. Por lo tanto, el estudio sólo se limita a describir las asociaciones y no puede evaluar de manera adecuada las intervenciones realizadas ni su efecto en los niveles de procalcitonina. Hubiera sido deseable, también, dar seguimiento a los pacientes por más tiempo, como ha sido en estudios previos, hasta el año del egreso hospitalario, para evaluar el grado de discapacidad neurológica o incluso mortalidad a largo plazo.
Por el momento, con base en la evidencia científica actual y los resultados del presente trabajo, puede concluirse que la inflamación sistémica representa un factor de riesgo de padecer delirium en la UCI. No es posible definir si existe una relación causa-efecto entre los niveles elevados de biomarcadores y el desarrollo del delirium o si sólo representan un marcador de severidad. Aún faltan estudios que aclaren si esta asociación tendrá alguna utilidad clínica en el desarrollo de estrategias para la prevención, detección o tratamiento del delirium.











 nova página do texto(beta)
nova página do texto(beta)



