Introducción
Las infecciones nosocomiales (IN) son complicaciones directamente imputables a procedimientos diagnósticos y terapéuticos intrahospitalarios que han existido desde los orígenes de la atención médica. Si bien se reconoce que la IN es consecuencia del ingreso hospitalario y es susceptible de prevenirse en la mayoría de los casos, debe hacerse hincapié en la existencia de casos en los que sobreviene por las condiciones inherentes del huésped.1 La mayor frecuencia de IN se observa en los enfermos críticos, quienes tienen mayor mortalidad comparados con los pacientes hospitalizados en otras áreas del hospital.2 El impacto económico que genera esta condición representa hospitalización prolongada y duplicación en el costo del tratamiento tanto en países desarrollados como en los no desarrollados.3
En específico, Acinetobacter baumannii es un patógeno nosocomial cuya incidencia ha incrementado en aislamientos y ha sido asociado a una alta tasa de morbilidad y mortalidad; la bacteremia en hospitalizados genera una mortandad de 25 a 54%.4 Ballouz y sus colaboradores, en un estudio realizado en un hospital de tercer nivel entre 2010 y 2015, documentaron 90 bacteremias por Acinetobacter baumannii; una mortalidad cruda de 63.5% y 70.3% de las muertes se atribuyeron a la bacteremia, por lo que concluyeron que es una enfermedad infecciosa con alta tasa de mortalidad y limitadas opciones terapéuticas, al no evitarse la muerte en los pacientes en quienes se inició el tratamiento con alto índice de sospecha.5
En México existe poca información acerca de este microorganismo; hay registro de un brote de IN de vías respiratorias por Acinetobacter baumannii que surgió en el servicio de medicina interna de un hospital general de zona, con 45% de casos que cumplieron la definición operacional.1
Las fuentes de infección por Acinetobacter baumannii incluyen piel y membranas mucosas, quemaduras, heridas, catéteres intravasculares y urinarios, así como los tractos gastrointestinal, urinario y respiratorio; también se han descrito fuentes hospitalarias como muebles, equipos de infusión y reanimación; sin embargo, a veces no es posible identificar la fuente.6 La bacteria alberga una amplia gama de factores patogénicos: 1) adherencia y persistencia en superficies sólidas y secas, 2) capacidad para obtener nutrientes como hierro, 3) adhesión y posterior destrucción de células epiteliales, 4) capacidad de algunas cepas para producir gelatinasas y proteinasas, 5) capacidad de colonizar la piel de enfermos y sanos, y 6) formación de biofilme.5 Entre los factores de riesgo de generar la infección destacan: 1) severidad de la enfermedad subyacente, particularmente malignidad hematológica, 2) enfermos críticos con intubación orotraqueal y alto puntaje APACHE II, 3) prolongada terapia con carbapenémicos, fluoroquinolonas, aminoglucósidos y cefalosporinas de tercera generación, 4) infección o colonización respiratoria, urinaria y de tracto gastrointestinal, 5) quemaduras y heridas quirúrgicas, 6) transfusión de productos sanguíneos, 7) enfermedad pulmonar crónica, 8) diabetes mellitus, 9) alimentación enteral y contaminación de soluciones parenterales, 10) circunstancias de la hospitalización: larga estancia, alta carga de trabajo y admisión en salas con alta densidad de enfermos colonizados o infectados, 11) prematurez, y 12) falta de apego a las técnicas de aislamiento específico.5 Las manifestaciones clínicas y complicaciones de las infecciones por Acinetobacter baumannii son muy variadas.4
Otra condición prevalente en los enfermos críticos asociada a mayor morbilidad es la anemia.7 Alrededor de 60% de los pacientes que ingresan a la unidad de cuidados intensivos (UCI) tienen un nivel basal de hemoglobina < 12 g/dL, y 30% < 9 g/dL, lo que se traduce en disminución de la capacidad de suministro de oxígeno tisular, con la subsecuente hipoxia y asociación con malos resultados.8 En este contexto, la transfusión de eritrocitos ha sido uno de los tratamientos predominantes en la práctica médica.7 Por otra parte, en las últimas décadas se ha acumulado un conjunto de pruebas que mencionan varios efectos adversos relacionados con la transfusión, particularmente tras la exposición alogénica -llámese inmunosupresión, riesgo de infección, reacciones transfusionales y afecciones como ALI y TRALI-; incluso, puede estar asociada a mayor mortalidad, aunque en general, el riesgo de morbimortalidad es bajo y ha disminuido en años recientes.7,8
A propósito del riesgo de infección, desde 1986 existe evidencia de dicha asociación; sin embargo, gran parte de la literatura se ha enfocado en unidades de trauma y quirúrgicas, aunque también se encuentra en unidades médicas. La transmisión directa de agentes infecciosos con la transfusión alogénica de glóbulos rojos es bastante baja en países desarrollados, por lo que se ha propuesto que la inmunomodulación puede estar involucrada en dicho riesgo.9-11 Un reciente metaanálisis desarrollado por Rohde y su grupo reportó marcadas tasas de IN: 16.9% con una estrategia de transfusión liberal (rango límite de Hb: 9 a 11 g/dL) y 11.8% con estrategia restrictiva (rango límite de Hb: 6.4 a 9.7 g/dL). El OR para las complicaciones infecciosas seguidas de transfusión fue de 1.88, lo que contrasta con el crecimiento bacteriano encontrado en menos de 0.1% de las unidades de sangre convencionales.10 En la actualidad, no existe información que explique la discrepancia entre las tasas de infección postransfusión y la contaminación bacteriana.12 También se ha reportado el riesgo de infección con la transfusión de plaquetas en postquirúrgicos de corazón y en fase de recuperación de sepsis; al respecto, se ha visto que las plaquetas ejercen efectos inmunosupresores tras alterar la expresión de moléculas del CMH I.13 El plasma también se ha relacionado con complicaciones infecciosas en UCI quirúrgicas.14
El componente exacto de la transfusión alogénica que media la inmunomodulación no se conoce por completo y no todo puede explicarse por la reducción de leucocitos.10 Los mecanismos inmunomoduladores conocidos incluyen la regulación negativa de la función inmune de receptores de leucocitos y la liberación de mediadores solubles durante el almacenamiento de productos sanguíneos. Además, la transfusión de eritrocitos altera la actividad de los linfocitos T supresores y la función de las células natural killer, condicionando presentación defectuosa de antígenos o la inhibición de la proliferación de linfocitos ante un estímulo.2 El riesgo de infección se ha relacionado también con la cantidad de sangre transfundida y con la duración de su almacenamiento.15,16 Rachoin y sus colegas mencionan la asociación entre la edad del eritrocito, el grado de inflamación y la actividad de los glóbulos blancos en el periodo postransfusión inmediato.9 Estudios controlados en modelos animales han demostrado el impacto perjudicial que se produce sobre la perfusión microvascular tras documentar modificación en la forma celular y en la membrana, aumento de la adhesividad, disminución de la flexibilidad; además, la transfusión de hematíes con daño por almacenamiento se elimina rápidamente de la circulación por fagocitos mononucleares, la hemoglobina se cataboliza de manera pronta y el hierro se libera en el plasma a un ritmo que puede exceder la velocidad de fijación por la transferrina, generando hierro libre circulante.17-19 Los tejidos humanos están restringidos en hierro, y en condiciones normales, hay una competencia entre el huésped y microorganismos por este nutriente esencial, de manera que las bacterias tienen múltiples mecanismos para adquirir hierro y estimular con ello el crecimiento bacteriano; este efecto varía de un organismo a otro dependiendo de su ferrofilia.20 También, el medio de almacenamiento pudiese ser deletéreo al generar superóxidos y mediadores inflamatorios que resulten en daño oxidativo. Lo anterior predispone a disfunción vascular, infección y trombosis, traduciéndose en hospitalización, insuficiencia orgánica y muerte.12,13,19
Dada la relación descrita entre el incremento de riesgo de IN con la transfusión de productos sanguíneos y ante la mayor incidencia de Acinetobacter baumannii en enfermos críticos, en este estudio se determinó la incidencia del aislamiento de Acinetobacter baumannii en pacientes hospitalizados en la Unidad de Terapia Intensiva Central 310-E del Hospital General de México «Dr. Eduardo Liceaga» que recibieron transfusión de productos sanguíneos.
Material y métodos
Se hizo un estudio de cohorte retrospectivo en población de la Unidad de Terapia Intensiva Central 310-E del Hospital General de México «Dr. Eduardo Liceaga» en el periodo comprendido entre enero de 2016 y enero de 2017; la muestra fue secuencial.
Se incluyeron para el estudio los expedientes de pacientes ingresados a la unidad con edad mayor a 15 años, mujeres y hombres; se excluyeron expedientes incompletos y condición de embarazo.
Las variables independientes fueron edad, género, diagnóstico de ingreso, estado ventilatorio al ingreso, número de cama ocupada durante la hospitalización, días de estancia, motivo de egreso, requerimiento de transfusión, grupo y Rh, hemocomponente transfundido, número de unidades transfundidas, periodo entre el ingreso y la primera transfusión, sitio de aislamiento Acinetobacter baumannii y periodo entre el ingreso y el aislamiento.
La variable dependiente fue el aislamiento de Acinetobacter baumannii.
Se utilizó un instrumento de recolección de datos para el registro de variables obtenidas a partir de los expedientes clínicos, del registro local de transfusiones y del reporte de resultados de cultivos del Laboratorio Central del Hospital. Los datos recabados se organizaron en los siguientes grupos: demográficos, estado transfusional y variables microbiológicas. La decisión de transfusión se hizo independientemente y a criterio del médico tratante, sin registrarse en el estudio. La población se dividió en dos cohortes retrospectivas por el estado transfusional para la identificación de la incidencia del aislamiento de Acinetobacter baumannii en los transfundidos.
Se realizó estadística descriptiva de las variables cuantitativas con medidas de tendencia central de las variables demográficas.
Los datos correspondientes al aislamiento de Acinetobacter baumannii, diagnóstico de ingreso, estado ventilatorio al ingreso, motivo de egreso y estado transfusional se analizaron como variables categóricas y se expresaron con valor porcentual.
La variable de requerimiento transfusional se tabuló por frecuencias y valor porcentual para cada hemocomponente y para grupo y Rh.
Se determinó IC95% para los días de estancia por cama, motivo de egreso y el estado ventilatorio de ingreso.
Se hicieron comparaciones con Chi cuadrada en las variables diagnóstico de ingreso, estado ventilatorio al ingreso, motivo de egreso por cama, tomando como significancia p ≤ 0.005.
La incidencia de pacientes con aislamiento de Acinetobacter baumannii se tabuló por tipo de aislamiento y frecuencia.
Se determinaron las correlaciones con la prueba de Pearson entre el aislamiento de Acinetobacter baumannii y la transfusión de hemocomponentes, género y asistencia ventilatoria.
Se analizaron todos los datos utilizando el paquete estadístico para ciencias sociales versión 23, SPSS.
El estudio fue aprobado por el Comité Local de Investigación (DIR/17/310E/3/020) y el consentimiento individual no se realizó por la naturaleza de no intervención y porque la información se extrajo de datos preexistentes.
Resultados
En el periodo comprendido entre enero de 2016 y enero de 2017 se estudió de forma retrospectiva una cohorte de 415 enfermos hospitalizados en TMI 310-E del Hospital General de México «Dr. Eduardo Liceaga».
Se incluyeron pacientes de 15 a 98 años de edad, con promedio de 48 años (Figura 1).
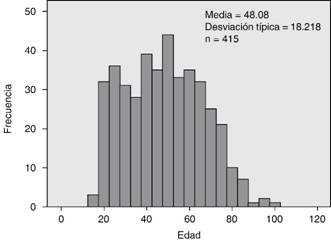
Figura 1: Edad promedio de los enfermos hospitalizados en TMI 310-E en el periodo de enero de 2016 a enero de 2017.
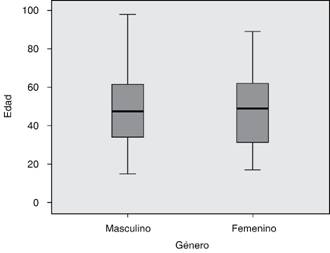
En la distribución por edad y género de los enfermos hospitalizados en el servicio se observó en las mujeres un comportamiento más heterogéneo respecto a los hombres, correspondiendo al 44.1 y 55.9%, respectivamente (Figura 2).
Las características demográficas de la población arrojaron un rango amplio de estancia hospitalaria, con media de 6.9 días, sin diferencia en cuanto a los diagnósticos de ingreso; la mayoría contó con ventilación mecánica al ingreso (Tabla 1).
Tabla 1: Características de los enfermos hospitalizados en TMI 310-E en el periodo de enero de 2016 a enero de 2017.
| n | % | χ2 | |
|---|---|---|---|
| Género | |||
| ;Femenino | 183 | 44.1 | |
| Masculino | 232 | 55.9 | |
| Diagnóstico de ingreso | |||
| Séptico-quirúrgico | 63 | 15.2 | -6.2 |
| Séptico-no quirúrgico | 125 | 30.1 | 55.8 |
| No séptico-quirúrgico | 81 | 19.5 | 11.8 |
| No séptico-no quirúrgico | 135 | 32.5 | 65.8 |
| No especificado | 11 | 2.6 | -59.2 |
| Asistencia ventilatoria al ingreso | |||
| Ventilación mecánica | 234 | 56.4 | 0.0001 |
| Sin ventilación mecánica | 130 | 31.3 | 130.3 |
| Ventilación mecánica no invasiva | 4 | 1.0 | 26.3 |
| Sin especificar | 47 | 11.3 | -99.8 |
| Motivo de egreso | |||
| Mejoría | 258 | 62.2 | |
| Defunción | 150 | 36.1 | |
| Voluntario | 7 | 1.7 |
n = Número, χ2 = Chi cuadrada (p < 0.005).
También se determinaron los días de estancia por cama (Figura 3).
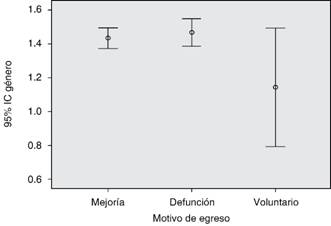
Los egresos en cuanto a distribución por género no tuvieron diferencias, mientras que los pacientes que cursaron con mayor estancia hospitalaria presentaron mayor mortalidad (Figuras 4 y 5).
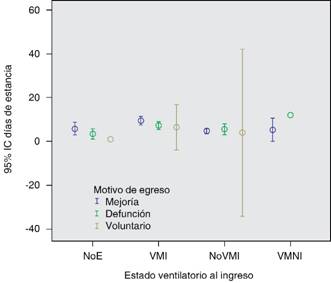
NoE = No especificado, VMI = Ventilación mecánica invasiva, No VMI = Sin ventilación mecánica invasiva, VMNI = Ventilación mecánica no invasiva.
Figura 5: Motivo de egreso y días de estancia en relación con el requerimiento de ventilación mecánica al ingreso en TMI 310-E.
En lo referente al requerimiento transfusional, se observó que del total de pacientes internados, 122 (29.4%) requirieron transfusión de algún hemocomponente. La distribución por frecuencia de requerimiento transfusional fue: eritrocitos, en total, 108 casos (26%); plasma, 39 pacientes (9.4%); plaquetas, 19 (4.5%), y crioprecipitados, seis (1.3%) (Tabla 2).
Tabla 2: Características del requerimiento transfusional en enfermos hospitalizados en TMI 310-E en el periodo comprendido entre enero de 2016 y enero de 2017.
| n | % | |
|---|---|---|
| Requerimiento de transfusión | ||
| Sí | 122 | 29.4 |
| No | 281 | 67.7 |
| Indeterminado | 12 | 2.9 |
| Hemocomponente | ||
| Eritrocitos | 108 | 26.0 |
| Número de unidades | ||
| 1 | 51 | |
| 2 | 25 | |
| 3 | 15 | |
| 4 | 11 | |
| 5 | 3 | |
| 7 | 2 | |
| 12 | 1 | |
| Plasma | 39 | 9.4 |
| Número de unidades | ||
| 1 | 2 | |
| 2 | 4 | |
| 3 | 4 | |
| 4 | 2 | |
| 5 | 6 | |
| 6 | 9 | |
| 7 | 3 | |
| 8 | 2 | |
| 9 | 1 | |
| 12 | 1 | |
| 13 | 2 | |
| 17 | 1 | |
| 20 | 1 | |
| 26 | 1 | |
| Plaquetas | 19 | 4.5 |
| Número de unidades | ||
| 1 | 3 | |
| 2 | 2 | |
| 4 | 3 | |
| 5 | 3 | |
| 6 | 3 | |
| 8 | 1 | |
| 9 | 1 | |
| 11 | 1 | |
| 16 | 1 | |
| 28 | 1 | |
| Crioprecipitados | 6 | 1.3 |
| Número de unidades | ||
| 1 | 1 | |
| 2 | 1 | |
| 3 | 2 | |
| 5 | 1 | |
| 6 | 1 |
n = Número.
La población estudiada fue predominantemente de grupo y Rh O+, con 93 casos (76.4%), seguido de A+, con 21 (17.2%), mientras que fue menor para B+, con cuatro pacientes, y O-, solo uno; no se documentó esta variable en tres de ellos.
La relación existente entre el ingreso y el día en que el paciente requirió la primera transfusión de algún hemocomponente predominó entre los días uno a cuatro, siendo transfundidos 90 pacientes, que correspondieron a 74% de los transfundidos y 22% del total de la población (Tabla 3).
Tabla 3: Distribución de los rangos correspondientes al periodo entre el ingreso y la primera transfusión de algún hemocomponente.
| Días | n | % de transfundidos | % absoluto |
|---|---|---|---|
| 1 – 4 | 90 | 74.0 | 22.0 |
| 5 – 8 | 16 | 13.0 | 3.8 |
| 9 – 12 | 11 | 9.0 | 2.6 |
| 13 – 16 | 2 | 1.6 | 0.4 |
| 17 – 20 | 2 | 1.6 | 0.4 |
| NoE | 1 | 0.8 | 0.2 |
| Total | 122 | 100.0 | 29.4 |
NoE = No especificado, n = Número.
También el rango para la indicación del primer concentrado eritrocitario predominó entre el día uno a cuatro, con 76 pacientes, que representaron 70% de los transfundidos y 18% del total de la población (Tabla 4).
Tabla 4: Distribución de los rangos correspondientes al periodo entre el ingreso y la primera transfusión de eritrocitos.
| Días | n | % de transfundidos | % absoluto |
|---|---|---|---|
| 1 – 4 | 76 | 70.0 | 18.0 |
| 5 – 8 | 13 | 12.0 | 3.0 |
| 9 – 12 | 9 | 8.3 | 2.0 |
| 13 – 16 | 2 | 2.0 | 0.5 |
| 16 – 20 | 3 | 2.7 | 1.0 |
| NoE | 5 | 5.0 | 1.5 |
| Total | 108 | 100.0 | 26.0 |
NoE = No especificado, n = Número.
Se documentaron 41 aislamientos de Acinetobacter baumannii, que representaron una incidencia de 9.8% en la población estudiada.
La relación observada entre el número de días de internamiento y el aislamiento de Acinetobacter baumannii se presenta en la Tabla 5.
Tabla 5: Distribución de los rangos correspondientes al periodo comprendido entre el ingreso y el aislamiento de Acinetobacter baumannii.
| Días | n | % |
|---|---|---|
| 1 – 4 | 7 | 1.6 |
| 5 – 8 | 12 | 3.0 |
| 9 – 12 | 9 | 2.1 |
| 13 – 16 | 6 | 1.5 |
| 17 – 20 | 3 | 0.8 |
| 21 – 24 | 0 | 0.0 |
| 25 – 28 | 1 | 0.2 |
| 29 – 32 | 1 | 0.2 |
| NoE | 2 | 0.4 |
| Total | 41 | 9.8 |
NoE = No especificado, n = Número.
El aislamiento de Acinetobacter baumannii de acuerdo al diagnóstico de ingreso se muestra en la Tabla 6.
Tabla 6: Aislamiento de Acinetobacter baumannii de acuerdo al diagnóstico de ingreso en enfermos hospitalizados en TMI 310-E.
| Diagnóstico ingreso | n | % |
|---|---|---|
| Séptico-quirúrgico | 11 | 2.6 |
| Séptico-no quirúrgico | 13 | 3.1 |
| No séptico-quirúrgico | 7 | 1.6 |
| No séptico-no quirúrgico | 9 | 2.2 |
| NoE | 1 | 0.3 |
| Total | 41 | 9.8 |
NoE: No especificado, n: Número.
El sitio de aislamiento de Acinetobacter baumannii fue de la siguiente manera: bronquial, 17 (41%); herida y hemocultivo, siete (17%); otros cultivos, cinco (12%); indeterminado, cuatro (10%), y urocultivo, uno (3%).
La correlación que existió entre el aislamiento de Acinetobacter baumannii en enfermos hospitalizados que requirieron transfusión de eritrocitos fue significativo (p = 0.001), a diferencia del resto de hemocomponentes, y los que requirieron de asistencia ventilatoria mecánica presentaron significancia a partir del día 15 de asistencia ventilatoria mecánica (Tabla 7).
Tabla 7: Correlación con el aislamiento de Acinetobacter baumannii en enfermos hospitalizados en TMI 310-E.
| Parámetro | IC | Pearson |
|---|---|---|
| Eritrocitos | 1.235-1.965 | 0.001 |
| Plasma | 0.904-1.133 | 0.192 |
| Plaquetas | 0.803-1.175 | 0.577 |
| Crioprecipitados | 0.463-2.039 | 0.866 |
| Género | 0.647-2.661 | 0.591 |
| Asistencia ventilatoria | 0.053 | |
| Día 15 | 1.061-1.154 | 0.0001 |
IC = Intervalo de confianza 95%.
De acuerdo a la distribución de internamiento de pacientes por cama, tras el aislamiento de Acinetobacter baumannii, en las camas 201, 202 y 207 se observó mayor probabilidad de egreso con supervivencia (Tabla 8).
Tabla 8: Distribución del aislamiento de Acinetobacter baumannii por cama y motivo de egreso en enfermos hospitalizados en TMI 310-E.
| Cama | Total ingresos (%) | Aislamiento/egreso por mejoría (p) | Aislamiento/egreso por defunción (p) |
|---|---|---|---|
| 1 | 37 (8.9) | 0.0001 | – |
| 2 | 38 (9.2) | 0.0001 | – |
| 3 | 41 (9.9) | 0.682 | 0.704 |
| 4 | 38 (9.2) | 0.996 | 0.997 |
| 5 | 33 (8) | 0.904 | 0.703 |
| 6 | 43 (10.4) | 0.649 | 0.703 |
| 7 | 25 (6) | 0.0001 | – |
| 8 | 37 (8.9) | 0.880 | 0.585 |
| 9 | 28 (6.7) | 0.997 | 0.997 |
| 10 | 50 (12) | 0.0000 | 0.000 |
| No especificado | 45 (10.8) | 0.066 | 0.583 |
% = Porcentaje, χ2 = Chi cuadrada (p ≤ 0.005).
Discusión y conclusiones
Los pacientes en unidades de cuidados intensivos son un subgrupo importante de todos los enfermos hospitalizados que representa alrededor de 25% de todas las infecciones hospitalarias. Se ha visto que la prevalencia de infecciones adquiridas en la UCI es significativamente mayor en países en desarrollo respecto a los industrializados; las cifras varían entre 4.4 y 88.9%, mientras que la tasa de mortalidad llega a duplicarse en enfermos críticos infectados respecto a los no infectados.21 En este trabajo se estudió una cohorte de enfermos que ingresaron a una UCI polivalente de un hospital de tercer nivel en un país considerado en vías de desarrollo, y se identificó una incidencia en el aislamiento de 9.8% de Acinetobacter baumannii y una tasa de mortalidad en general de 36.1%.
De acuerdo al Consorcio Internacional para el Control de Infecciones Nosocomiales (INICC), los sitios de infección reportados de manera más común son el sistema respiratorio (64%), el abdominal (20%), el torrente sanguíneo (15%) y el sistema genitourinario (14%).22 Lo anterior es similar a nuestros resultados, ya que el aislamiento más frecuente fue a nivel bronquial (41%), mientras que entre heridas y torrente sanguíneo no hubo diferencia, en tanto que el aislamiento urinario fue prácticamente nulo.
Según INICC, los agentes causales fueron Gram positivos en 47% de los casos, Gram negativos en 62% y 19%.22 Esta cohorte se centró en el aislamiento de Acinetobacter baumannii; al respecto, llama la atención un estudio de Turquía que informó el cambio en la prevalencia y susceptibilidad antibiótica de patógenos en la UCI, donde Acinetobacter baumannii fue el patógeno Gram negativo más común (con 21.8% de los casos) y mostró resistencia creciente a carbapenémicos.23 En sus antecedentes, Acinetobacter baumannii se ha catalogado como agente multidrogorresistente cuyas alternativas terapéuticas han disminuido debido al estancamiento de nuevos agentes antimicrobianos; es miembro de un grupo asociado con mayor morbilidad, mortalidad y costos financieros, y protagonista de brotes graves en la UCI, especialmente de la neumonía asociada a ventilador de inicio tardío.21
En este trabajo se identificó una correlación positiva entre el aislamiento de Acinetobacter baumannii y la transfusión de eritrocitos. Es importante este dato, ya que la transfusión de eritrocitos continúa siendo una estrategia terapéutica vital en enfermos críticos y pudiera corresponder a uno de los efectos adversos relacionados con el procedimiento, como es la probabilidad de desarrollar complicaciones e infecciones; ya se ha descrito para ello un OR de 1.88.2),(12
En nuestro centro, la práctica transfusional durante el periodo de estudio se documentó en 122 enfermos (29.4%), con la siguiente distribución por frecuencia: eritrocitos, 108 pacientes (26%); plasma, 39 (9.4%); plaquetas, 19 (4.5%), y crioprecipitados, seis casos (1.3%). En la población estudiada predominó el hemotipo O+ y se vio que el concentrado eritrocitario es el que se transfunde primero (entre los días uno y cuatro) y con mayor frecuencia respecto a los otros hemocomponentes.
En lo referente al aislamiento de Acinetobacter baumannii, la mayor frecuencia ocurrió entre los días cinco y ocho en 12 enfermos (3% de los aislamientos) y se observó la mayor frecuencia en los pacientes sépticos no quirúrgicos, con 13 casos, comparados con los sépticos quirúrgicos, con 11 aislamientos; una situación similar se dio en los pacientes no sépticos quirúrgicos y no quirúrgicos, con siete y nueve casos, respectivamente.
La disminución en el umbral de transfusión puede reducir su volumen en los pacientes y puede resultar beneficioso; de hecho, la estrategia transfusional restrictiva se ha recomendado en pacientes sépticos, pero no está del todo establecida en pacientes de la UCI.24
Por su parte, Engele y sus colaboradores, al investigar el riesgo de IN tras la transfusión en enfermos críticos, reportaron el mayor número de transfusiones en el primer día de hospitalización, con mediana del tiempo de infección de seis días (IQR 3-10); 56% de las infecciones fueron tempranas (día cero a seis); el sitio de infección más frecuente fue el tracto respiratorio (con 51% de los casos); 35% de los pacientes se transfundieron con unidades globulares, 17% recibieron plasma fresco congelado y 18% plaquetas. Es importante destacar que los pacientes transfundidos tuvieron un mayor puntaje APACHE IV y los infectados recibieron más transfusiones, incluyendo más unidades con tiempo de almacenamiento prolongado (mediana 20 días); sin embargo, al hacer la corrección en cuanto al tiempo, no se encontró relación significativa, lo que sugiere que tanto la transfusión como la infección son condiciones resultantes de la estancia en la UCI, aunque el índice de riesgo fue mayor en los que recibieron plaquetas, un efecto independiente de los otros productos de transfusión.11
El riesgo de infección después de la transfusión de glóbulos rojos relacionado con la cantidad de sangre transfundida también se ha descrito por Claridge, Horvath y Weinber y su grupo, pero los resultados en cuanto a la duración del almacenamiento son contradictorios.18
Es importante entender cómo el uso de glóbulos rojos almacenados por menos tiempo puede afectar la disponibilidad de sangre para ciertos grupos de pacientes mediante un modelo stock-and-flow para el uso de sangre más reciente con preferencia en un subgrupo de enfermos de alto riesgo, lo que permite una distribución relativamente eficiente de la sangre; sin embargo, no se comprobó la disminución en el suministro.25
Karkhane y sus colegas, en su estudio prospectivo de 217 pacientes admitidos a UCI, encontraron una tasa transfusional de 64.1% y reportaron 26.6% de IN en los transfundidos, siendo más común a nivel respiratorio, con 6.5% de los casos. A pesar de la frecuencia de transfusiones, no hubo relación estadísticamente significativa (p = 0.268) con las IN.2
Alexander y su equipo revisaron 12 ensayos controlados con poblaciones de edades diferentes y un rango de condiciones médicas y quirúrgicas. No se encontró beneficio con la transfusión de glóbulos rojos de menor tiempo de almacenamiento, sin olvidar la limitante condicionada por la variabilidad de las poblaciones, el procesamiento de la sangre y métodos de estudio.17 Damgaard y sus colaboradores hipotetizaron que la alta frecuencia de infecciones postransfusionales se debe a que no se detecta contaminación de la sangre en el donante, y a través de un estudio transversal identificaron a las bacterias viables en unidades de sangre, con un enfoque en las bacterias de la cavidad oral, y encontraron Acinetobacter lwoffii como la segunda más abundante (3%). Esta bacteria habita en el periodonto, lo que abre la posibilidad de que esté presente en el flujo sanguíneo de los donantes; también se ha aislado del antebrazo de hasta 48% de los donantes sanos, por lo que es posible su introducción en la sangre en la etapa de recolección.12
Este trabajo tiene limitaciones; para empezar, la causalidad entre la transfusión de eritrocitos y la infección o el aislamiento no puede ser establecida, ya que esto solo puede determinarse por medio de un ensayo clínico aleatorizado. El cumplimiento con la definición estricta de infección puede conducir a un sesgo de selección por la cantidad de cultivos que son negativos en los pacientes infectados; esto motivó el aislamiento como objetivo. Otro punto es que la posibilidad de recibir la sangre con mayor edad de almacenamiento aumenta conforme se incrementa la cantidad de transfusiones, por lo que determinar si el aumento en los aislamientos se debe a una u otra condición se convierte en un desafío. Otros factores de confusión que pueden influir en el resultado son alguna admisión hospitalaria previa, uso de antibiótico, estado de gravedad, métodos de almacenamiento y procesamiento de los hemocomponentes; dichos datos no se recabaron en este trabajo.
Uno de los problemas mayores a los que se enfrentan países en desarrollo respecto al aumento en infecciones nosocomiales es la falta de recolección de datos, así como la ausencia de políticas y directrices en el control de infecciones como principales inconvenientes para estimar el impacto de las infecciones en la UCI y la adherencia a medidas de control; en lo anterior influye la higiene de manos, el exceso de pacientes y la carga de trabajo, así como personal inadecuado y carencia de equipo de protección personal, y el establecimiento tardío de programas para el control de la infección.
Actualmente, no hay literatura suficiente para explicar la discrepancia entre la alta frecuencia de infecciones relacionadas con la transfusión y las bajas tasas de contaminación bacteriana en los hemocomponentes.
En esta cohorte retrospectiva se identificó la correlación positiva entre el aislamiento de Acinetobacter baumannii y la transfusión de eritrocitos y con el requerimiento de ventilación mecánica a partir del día 15, con las limitaciones ya descritas.
Se requieren nuevos estudios sobre los mecanismos de asociación y posibles intervenciones que puedan modular el riesgo. Se considera necesario abordar la pregunta de estudio con ensayos aleatorizados.











 nueva página del texto (beta)
nueva página del texto (beta)