Introducción
La sepsis es un gran problema de asistencia sanitaria que afecta a millones de personas en todo el mundo cada año. Una de cada cuatro personas muere por esta causa y la incidencia es cada vez más alta.1,2
El síndrome de fuga capilar es una entidad que poco se ha estudiado directamente en la sepsis. Éste consiste en el incremento de la permeabilidad tisular, caracterizada por hipotensión, edema e hipovolemia que conducen a falla orgánica múltiple.3
En 2012 Cordermans y cols. definieron este síndrome como el incremento de la permeabilidad capilar causado por la inflamación sistémica asociado a niveles elevados de proteína C reactiva e hipoalbuminemia.4
El síndrome de fuga capilar podría considerarse un estadio temprano de choque y disfunción orgánica múltiple, el cual al ser detectado de forma precoz podría ser tratado y, en su caso detenido, evitando así su elevada morbimortalidad.5,6
Una forma de predecir la presencia y el grado de fuga capilar es la creación de un índice objetivo que refleje el estado de integridad y funcionalidad de la barrera endotelial, por lo que el índice de fuga capilar toma relevancia trascendental. Este índice es determinado con el cociente de proteína C reactiva (mg/dL) entre la albúmina multiplicada por 100, considerando de 2.5 a 25 como normal, siendo reportada una alta mortalidad con valores mayores de 61.7,8
En nuestra institución ingresan en promedio ocho casos con sepsis al mes, cifra que se ha incrementado en los últimos años; por tal motivo, contar con una nueva herramienta para la valoración de la gravedad y pronóstico de la sepsis ayudaría a evidenciar a los pacientes que presentan altas posibilidades de complicaciones y desenlace fatal.
La validación del IFC nos daría la posibilidad de prevenir el peor desenlace en los pacientes con sepsis severa, individualizar la terapia, buscar nuevas metas que nos permitan mejor control en la reanimación e incidir de forma positiva en el pronóstico, en días de hospitalización, en utilización de insumos y días libres de enfermedad.9
Otra razón importante para la validación de este índice es que los valores necesarios para su realización (PCR y albúmina) están disponibles en la mayoría de los centros médicos en comparación con otros, que por su alto costo y complejidad sólo se encuentran en centros médicos de tercer nivel (Picco, ultrasonografía transpulmonar, etc.), lo que hace del índice de fuga capilar una herramienta práctica, de bajo costo y accesible.10-12
Este índice aún no se ha tomado en cuenta por las guías internacionales del manejo para la sepsis, por lo que aportar mayor evidencia científica y reforzarla, aumentaría su utilidad y podría dar pauta a ser considerado por éstas.
Material y métodos
Se trata de un estudio prospectivo, observacional, comparativo y longitudinal llevado a cabo en el departamento de medicina interna y medicina crítica de dos hospitales de tercer nivel y segundo nivel respectivamente de la Ciudad de México.
Se incluyeron 116 pacientes mayores de 18 años con diagnóstico de sepsis severa y choque séptico, de acuerdo con los criterios diagnósticos del Colegio Americano de Médicos del Tórax y la Sociedad de Medicina Crítica de Estados Unidos,13-16 que ingresaron a los departamentos de medicina interna y medicina crítica en los periodos de 01 de marzo de 2014 al 31 de marzo de 2015 y de 01 de junio de 2016 al 01 de junio de 2017. Antes de ser incluidos en el estudio se obtuvo consentimiento informado por escrito de los pacientes o de sus responsables legales cuando fue pertinente.
Excluimos a los pacientes con diagnóstico de sepsis sin datos de gravedad, desnutrición proteica previa, embarazadas, preeclampsia o eclampsia, insuficiencia hepática crónica, enfermedad renal crónica, inmunocomprometidos, enfermedades autoinmunes, en tratamiento con inmunosupresores, corticoesteroides, quimioterapia citotóxica, patología hematológica conocida previamente y pacientes que rechazaron ser incluidos en el estudio.
El estudio se llevó a cabo en dos fases, una de generación y la segunda de validación. Durante la primera fase se captó a los pacientes, se realizó historia clínica y nota de ingreso a hospitalización. Se efectuó valoración mediante sistema APACHE II, SOFA e índice de fuga capilar (PCR/albúmina × 100).
Durante la estancia hospitalaria se identificaron diariamente el número de complicaciones con las que cursaron los pacientes, las cuales se registraron en un formato específico. Al egreso del paciente se realizó revisión del expediente para recolectar el número de días de estancia intrahospitalaria, motivo del alta (defunción o mejoría).
La información correspondiente se documentó en el formato específico para la recolección de datos. Los datos recolectados se capturaron en una hoja de cálculo electrónica. Posterior al procesamiento estadístico de los datos se elaboró un primer informe por escrito en relación con los resultados, selección de material gráfico y cuadros de resumen. En el informe también se registraron conclusiones emitidas de acuerdo con las implicaciones de los resultados y limitaciones del estudio.
Durante la segunda fase se realizó el mismo procedimiento para ingreso de pacientes, recolección y análisis de datos.
Análisis estadístico
La muestra se calculó por conveniencia, siendo ésta el total de pacientes que cumplieron los criterios de inclusión y fueron ingresados al estudio.
La información recolectada se analizará con estadística descriptiva de acuerdo con métodos convencionales. Los datos evaluados en escala numérica (observaciones cuantitativas) se describirán en términos de porcentajes o proporciones, media aritmética (promedio), mediana y rango intercuartil cuando fue apropiado. La información se resumirá en Tablas de frecuencia y se representó visualmente con gráficos de líneas.
Se compararán dos grupos (generación y validación), en los que se buscará cotejar la capacidad de detección de desenlace comparando punto de corte y variables generales que se comparten en ambos grupos.
Se aplicará prueba de Kolmorogov-Smirnov para determinar el tipo de distribución de las variables cuantitativas.
Las pruebas de contraste estadístico se realizarán con t de Student, U de Mann Whitney así como prueba de χ2 en caso de variables cuantitativas y curvas de ROC para analizar sensibilidad y especificidad de índice de fuga capilar y su comparación con herramientas estándares (APACHE y SOFA).
En la primera fase en el grupo de generación se hará una curva de característica operativa del receptor (ROC) con el fin de obtener un punto de corte para su posterior validación en la segunda fase.
En la segunda fase se dividirá el segundo grupo acorde al punto de corte generado en la primera fase, se calculará la sensibilidad, especificidad y valores predictivos con respecto a la tabla 4 × 4 contra mortalidad y el punto de corte previamente generado, dicha Tabla se analizará mediante prueba de χ2 o exacta de Fisher según el caso.
Como análisis secundarios se realizarán curvas ROC de las demás variables en ambas fases con el fin de observar su desempeño para detectar mortalidad, así como un análisis con curva de Kaplan-Meier y prueba de Log Rank en el segundo grupo comparando mortalidad a 28 días según el punto de corte de IFC.
Se presentarán las variables normales como media y desviación estándar, no normales como mediana y percentil 25, percentil 75 y cuantitativas como frecuencia y porcentaje. Se estimarán intervalos de confianza al 95% tanto para proporciones como para razones de momios. Un valor de p menor o igual a 0.05.
Para el análisis estadístico se utilizará el programa IBM SPSS Statistics 21.
Resultados
Se analizó un total de 116 pacientes, de los cuales 62 fueron del grupo de generación y 54 del grupo de validación.
Se aplicó la prueba de Kolmorogov-Smirnov para determinar los tipos de distribución de las variables cuantitativas, para posteriormente compararlos mediante prueba de t de Student y Mann-Whitney según distribución normal y no normal respectivamente. Para las variables cualitativas se realizaron las comparaciones según la prueba de χ2.
En la primera fase en el grupo de generación se realizó curva ROC con el fin de obtener un punto de corte para su posterior validación en la segunda fase.
En la segunda fase se dividió el segundo grupo de acuerdo con el punto de corte generado en la primera fase, se calculó la sensibilidad, especificidad y valores predictivos con respecto a la tabla 4 × 4 contra mortalidad y el punto de corte previamente generado, dicha Tabla se analizó mediante prueba de χ2 o exacta de Fisher según el caso.
Como análisis secundarios se realizaron curvas ROC de las demás variables en ambas fases con el fin de observar su desempeño para detectar mortalidad, así como un análisis con curva de Kaplan-Meier y prueba de Log Rank en el segundo grupo comparando mortalidad a 28 días según el punto de corte de IFC.
Se presentan las variables normales como media y desviación estándar, no normal como mediana y percentil 25-percentil 75 y cualitativas como frecuencia y porcentaje. Se consideró significancia estadística p < 0.05.
En este estudio se registraron características generales de los pacientes en ambos grupos. La distribución por sexo reportó que 45 fueron hombres y 17 mujeres, esto en el grupo de generación, así como 32 y 22 respectivamente en el grupo de validación (p = 0.130). Se obtuvieron medias de todas las variables en cada uno de los grupos en las que se observó que la media de edad para el grupo de generación fue de 58 años y 73 años para el grupo de validación (p = 0.001); la PCR de 22.6 versus 14.5 respectivamente (p < 0.001); IFC de 63.55 versus 44.55 (p < 0.001); albúmina de 3.0 y 3.3; el SOFA fue de 9 versus 8 (p = 0.147); APACHE II 20 versus 15 (< 0.001); estancia 10 versus 6 días (p = 0.007); la mortalidad comparada en ambos grupos fue de 22 en el grupo de generación contra 15 del grupo de validación (p = 0.065) (Tabla 1).
Tabla 1: Las características generales de los grupos.
| Variables | Generación | Validación | p |
|---|---|---|---|
| Edad* | 58 (50-69) | 73 (55-81) | 0.001 |
| Género | |||
| Masculino | 45 (72.6) | 32 (59.3) | 0.130 |
| Femenino | 17 (27.4) | 22 (40.7) | 0.087 |
| PCR* | 22.6 (15.0-28.9) | 14.5 (6.1-22.8) | < 0.001 |
| Albúmina | 3.0 (0.8) | 3.3 (0.7) | 0.054 |
| IFC* | 63.55 (55.40-100.00) | 44.55 (18.50-71.00) | < 0.001 |
| SOFA | 9 (6-13) | 8 (6-10) | 0.147 |
| APACHE II* | 20 (13-25) | 15 (10-18) | < 0.001 |
| Días de estancia* | 10 (6-20) | 6 (4-10) | 0.007 |
| Mortalidad | |||
| No | 40 (64.5) | 39 (72.2) | 0.374 |
| Sí | 22 (35.5) | 15 (27.8) | 0.065 |
PCR = Proteína C reactiva, IFC = Índice de fuga capilar, SOFA = Sequential organ failure assessment, APACHE II = Acute Physiology and Chronic Health Evaluation II * = p < 0.05 entre grupos.
Se observó que en el grupo de generación la edad es significativamente menor, así como la PCR, IFC, APACHE II y estancia hospitalaria. Sin diferencia en variables como sexo, mortalidad, albúmina y SOFA (Tabla 1).
Se realizó análisis con curva ROC en la fase de generación (n = 62), de la que se obtuvo el punto de corte (85.55), área bajo la curva (0.88), sensibilidad (90%) y especificidad (87%) (Figura 1).

Figura 1: Curva ROC: IFC, SOFA, APACHE II, PCR versus mortalidad (grupo de generación). PCR = Proteína C reactiva, IFC = Índice de fuga capilar, SOFA = Sequential Organ Failure Assessment, APACHE II = Acute Physiology and Chronic Health Evaluation II.
Se construyeron curvas ROC en el grupo de generación de las que se obtuvieron áreas bajo la curva para IFC (0.88), SOFA (0.90), APACHE II (0.86), PCR (0.80) y albúmina (0.66) versus mortalidad. Se advirtió que el SOFA brindó mayor área bajo la curva, seguido del IFC y APACHE II respectivamente. Se reportaron valores de PCR y albúmina menores que cuando se usaron en conjunto en el IFC (Figura 1).
En la segunda fase se dividió el segundo grupo acorde al punto de corte generado en la primera fase, se calculó la sensibilidad, especificidad y valores predictivos, se construyó tabla 4 ×4 contra mortalidad y el punto de corte previamente generado, dicha Tabla se analizó mediante prueba de χ2 o exacta de Fisher según el caso. Se obtuvo una sensibilidad de 100%, especificidad de 89%, valor predictivo positivo de 67% y valor predictivo negativo de 100%.
Se realizó análisis con curva de ROC, donde se comparó el punto de corte previamente generado contra mortalidad. Se obtuvieron áreas bajo la curva para IFC (0.95), SOFA (0.94), APACHE II (0.98), PCR (0.87) y albúmina (0.87). Se observa que todas las variables predijeron de forma importante la mortalidad, siendo el APACHE II el que mayor área bajo la curva registró, seguido de IFC y SOFA respectivamente, observándose mínima diferencia entre éstas (Figura 2).

Figura 2: Curva ROC: IFC, SOFA, APACHE II, PCR versus mortalidad (grupo de validación). PCR = Proteína C reactiva, IFC = Índice de fuga capilar, SOFA = Sequential Organ Failure Assessment, APACHE II = Acute Physiology and Chronic Health Evaluation II.
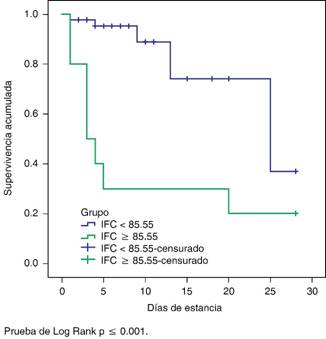
Se realizó análisis con curva de Kaplan-Meier y prueba de Log Rank en el segundo grupo comparando mortalidad a 28 días según el punto de corte de IFC < 85.55, el cual mostró una supervivencia de 88.6%, respecto a su contra parte de 20.0%, con una significancia estadística entre grupos (p < 0.001) (Figura 3).
Discusión
En los adultos la incidencia de sepsis y su asociación con el síndrome de fuga capilar aumenta en forma directamente proporcional con la edad, los varones tienen 30% más riesgo de padecer sepsis que las mujeres,17,18 tal como se reportó en el estudio de Florian B. Mayr y cols. siendo la causa aún desconocida, se mencionan como factores influyentes las enfermedades subyacentes, predisposición genética y medio ambiente.19
En nuestro caso se describió que la incidencia fue mayor en edades avanzadas y en el sexo masculino. En ambos grupos se registraron medias, puntaje mínimo y máximo, el grupo de generación tuvo puntajes APACHE más altos, índice de fuga capilar y mortalidad. Lo anterior muestra el estado de salud más precario en el grupo de generación respecto al de validación.
Concerniente a los días de estancia intrahospitalaria la relación entre grupos mostró diferencia significativa a favor del grupo de generación con un promedio de 10 días con respecto al de validación con seis días. Esto secundario a las diferencias con relación a la gravedad en el grupo de generación, lo cual se evidencia con las escalas pronósticas y herramientas paraclínicas (IFC, SOFA, APACHE II, albúmina y PCR).
En cuanto a la albúmina se observa que no hubo diferencia entre los grupos; sin embargo, ésta presentó disminución en el grupo de defunciones respecto al de mejoría, dato que también es ampliamente estudiado y referido en la literatura especializada.20,21
Se realizó análisis con curva ROC en la fase de generación (n = 62), del cual se obtuvo el punto de corte (85.55) con área bajo la curva de 0.88, sensibilidad 90% y especificidad 87%, lo que contrasta con lo descrito en el estudio de Cordermans y cols. en el cual se reportó un punto de corte de 61 con área bajo la curva de 65.8, sensibilidad de 62% y especificidad de 68% con valor predictivo positivo de 80%.
En el análisis de IFC, PCR, APACHE II, SOFA y albúmina contra mortalidad para ambos grupos se reportaron áreas bajo la curva significativa que determinan buena sensibilidad y especificidad para establecer un mal desenlace en los pacientes con sepsis severa y choque séptico; lo que coincide y valida en nuestra población lo reportado en el estudio de Cordermans y cols. en el cual se observó una relación directamente proporcional entre el grado de IFC y la mortalidad.
En el caso del SOFA y el APACHE II ambas han sido validadas en múltiples artículos a nivel mundial y son consideradas las mejores herramientas predictivas de mortalidad. En el caso del IFC la evidencia científica acerca de su valor predictor de mortalidad es aún escasa, al compararla con estos puntajes ampliamente estudiados su desempeño no es inferior.
En la fase de validación se calculó la sensibilidad, especificidad y valores predictivos con el punto de corte que se obtuvo en la fase de generación. Nuevamente el punto de corte mayor o igual de 85.55, obtuvo una sensibilidad de 100%, especificidad de 89%, valor predictivo positivo de 67% y negativo de 100%. Lo que traduce la máxima capacidad de la prueba para detectar sujetos verdaderamente enfermos y la capacidad de dar como negativos los casos realmente sanos.
Asimismo, permite descartar a los pacientes con alto riesgo de fallecer. Lo anterior mejora lo descubierto en el estudio de Cordermars y cols. así como en el grupo de generación cuyos números, aunque significativos se mostraron menos eficaces.
En la construcción de la curva de Kapplan-Meier se denota que tomando en cuenta el punto de corte mayor o igual a 85.55, se predice de forma significativa qué pacientes tienen más mortalidad.
Como un hallazgo se destaca que aunque la PCR y la albúmina fueron significativas de forma aislada para predecir mal pronóstico en pacientes con choque séptico y sepsis severa, utilizar ambos parámetros obteniendo el IFC aumenta su rendimiento clínico, esto se evidencia al observar una mayor área bajo la curva (0.95 respecto a 0.87 y 0.89).
La falta de cálculo de la muestra es la principal limitación de este estudio, pues fue tomada a conveniencia para ingresar al mayor número de pacientes posibles en el periodo programado para llevar a cabo dicho estudio, por lo que realizar estudios que incluyan más centros hospitalarios con cálculo de muestra adecuada permitirá generar un conocimiento absoluto y así generalizar el conocimiento de los hallazgos aquí mencionados.
Un hallazgo fue la diferencia de edades entre el grupo de generación y validación, siendo el grupo de generación más joven (58 versus 73 años), aspecto que puede tomarse como limitación a la hora de comparar los grupos. Sin embargo, al aplicar el punto de corte establecido para el IFC el rendimiento fue igual de significativo y mantuvo su poder predictivo.
Conclusiones
En el presente estudio se concluye que el IFC es una herramienta adecuada para predecir mala evolución en pacientes con sepsis severa y choque séptico. El punto de corte de 85.55 para el IFC es el que mejor sensibilidad y especificidad brinda. La validación en la segunda fase demostró que el estudio es reproducible y que puede aplicarse a otras poblaciones con diferente estado de gravedad y edad.
Es un índice que puede evaluarse a la cabecera del paciente y, de forma indirecta, estimar el estado microvascular en pacientes sépticos. Tiene la particularidad de ser una prueba sencilla de obtener al únicamente requerir PCR y albúmina con alta disponibilidad en múltiples centros, siendo esta prueba de bajo costo, sencilla y accesible.
El IFC podría utilizarse junto con APACHE II y SOFA como herramienta de evaluación inicial en pacientes con sepsis y brindar mejor valor predictivo pronóstico.
En este estudio se coloca de manifiesto el IFC como una herramienta que comprobó no ser inferior con respecto a las demás herramientas pronósticas y que a la postre nos ayudará a prevenir un mal resultado en los pacientes con sepsis severa y choque séptico, a individualizar la terapia y a buscar nuevas metas que nos permitan mejor control en la reanimación hídrica, incidiendo de forma positiva en el pronóstico, en los días de hospitalización, de utilización de insumos y en días libres de enfermedad.











 nueva página del texto (beta)
nueva página del texto (beta)