Introducción
En los albores de las soluciones intravenosas el Dr. Latta describió su uso por primera vez en 1832 en la epidemia del cólera en Gran Bretaña. Su detallado relato fue el parteaguas y directriz para el empleo de líquidos por vía intravenosa, la cita textual de su tratamiento es la siguiente:
«La solución inyectada se compone de 258 dracmas de muriato de sosa y dos escrúpulos de subcarbonato de sodio en tres litros de agua» (equivalente a aproximadamente ½ de Ringer lactato). Introdujo un tubo en la vena basílica e inyectó una onza (30 mililitros), después observó de cerca a la paciente «Comenzó a respirar con menos dificultad y pronto su apariencia característicamente pálida y fría, sus ojos hundidos y su mandíbula caída con la inscripción manifiesta del sello de la muerte empezaron a desaparecer; el pulso volvió a la muñeca después de que se le inyectaron seis pintas (2.8 litros) de fluido. Al no tener precedente que me guiara inyecté onza tras onza observando de cerca la respuesta de la paciente».1
La técnica de reanimación descrita por el Dr. Latta hace casi 200 años ha resistido la prueba del tiempo; es la única forma de reanimar a los pacientes: dar un pequeño volumen de líquidos y observar al paciente. En 1911 el Dr. George Evans advirtió contra el uso imprudente e indiscriminado de este recurso. «Debe disiparse la creencia errónea de que la administración de soluciones de cloruro de sodio es inofensiva sólo porque la sal está presente en todos los productos alimenticios, en los fluidos corporales y pensar que se excreta fácilmente por los riñones, su uso debe restringirse a condiciones en las que los cambios cuantitativos o cualitativos en la sangre o el plasma presenten indicios lógicos para su aplicación y no existan contraindicaciones circulatorias o renales».2
El fundamento básico de la terapia hídrica es aumentar el gasto cardiaco, mejorar la perfusión y la oxigenación tisular para garantizar el adecuado funcionamiento de órganos; la cantidad de líquidos administrada es fundamental para el pronóstico y la misma controversia surgida por el Dr. Evans contra la solución empleada por Dr. Latta persiste hasta nuestros días en torno a cuál solución es la mejor.
La prescripción de fluidos intravenosos varía considerablemente a nivel mundial, la elección parece estar basada en las costumbres locales, comercialización, costos y disponibilidad de las soluciones. Los registros globales de atención médica demuestran el uso indiscriminado de este recurso terapéutico de forma empírica, principalmente en la población adulta, incluso llegó a considerarse que muchas patologías se curaban únicamente con el empleo de dichas soluciones. Hoy en día se conocen, por múltiples estudios, los efectos adversos atribuidos a la sobrecarga hídrica, a las soluciones ricas en cloro y al impacto que esto ocasiona en costos hospitalarios, morbilidad y mortalidad global.3
Sobrecarga hídrica
La conducta terapéutica en tiempos recientes había sugerido que la reanimación hídrica agresiva era el mejor abordaje inicial en pacientes con inestabilidad hemodinámica, la fuente de dicho enfoque es difícil de ubicar.4 La terapia dirigida por metas tempranas (EGDT) de Rivers parece haberla establecido como la verdad irrefutable. Durante la última década se ha puesto de manifiesto que la reanimación hídrica agresiva se asocia a mayor morbilidad y mortalidad en grupos diversos de pacientes, incluso las directrices de la campaña «Sobrevivir a la sepsis» tomaron esto como uno de los pilares del tratamiento, considerando que a las primeras seis horas del inicio de la reanimación guiada por metas tempranas los pacientes deberían tener presión venosa central (PVC) de 8 a 12 mmHg y si estaban en ventilación mecánica invasiva la PVC debería estar entre 12 y 15 mmHg, la presión arterial media (TAM) de > 65 mmHg, con gasto urinario > 0.5 ml/kg/h y saturación venosa central (SvO2) de 70 y 65 mmHg si se trataba de saturación venosa mixta. En la mayoría de los casos se intentó como recurso terapéutico alcanzar este objetivo únicamente con el aporte hídrico agresivo en pacientes sépticos.5
Los resultados de múltiples estudios a través de diversas poblaciones de pacientes han demostrado claramente que la reanimación hídrica agresiva se asocia a mayor riesgo de complicaciones y muerte, aun en pacientes con trauma, tras la administración de 1.5 litros de soluciones se ha observado invariablemente un aumento significativo en la mortalidad en adultos jóvenes o de edad avanzada.6 Lo anterior también fue corroborado en un metaanálisis que confirmó la asociación estadísticamente significativa de muerte en pacientes traumatizados manejados con altos volúmenes de soluciones intravenosas.7
«Hemos evolucionado para hacer frente a la hipovolemia, pero no a la hipervolemia», afirmación tajante e inequívoca a la que llegó el Dr. Marik en sus modelos de estudio de pacientes sépticos, el argumento ahora es «sólo la cantidad correcta de líquido». Esto no es una determinación fácil y requiere una detallada evaluación hemodinámica del funcionamiento de órganos, de la función cardiaca y de «la capacidad de respuesta a fluidos», lo que incluye una precisa evaluación clínica (frecuencia cardiaca, TAM, PVC, uresis, estado mental, llenado capilar, temperatura). Reto de líquidos (incremento de 10 a 15% de volumen sistólico posterior a administración de 250 a 500 mL de líquido), elevación pasiva de piernas, colapso sonográfico de vena cava, monitoreo hemodinámico resaltando no tomar decisiones terapéuticas con presión de oclusión de arteria pulmonar (PoAP) ni PVC.8
Sobrecargar de volumen de líquidos a los pacientes incrementa la PVC; sin embargo el aumento de la PVC se sabe perjudicial para el riñón desde 1931.9 La PVC es el único parámetro hemodinámico con relación lineal en lesión renal aguda (AKI).10 Múltiples autores alrededor del mundo han documentado, en series bien diseñadas de estudio, que los pacientes con falla cardiaca congestiva con altas presiones de llenado venosas desarrollan cierto grado de AKI mediante mecanismos de interacción intrínsecamente relacionados, por lo que se acuñó el término falla renal congestiva.11
Se consideraba que la PVC alta, ya sea por patologías cardiovasculares o por sobrecarga de volumen, tenía un impacto negativo en el funcionamiento de los órganos en general, no únicamente el riñón sino también el hígado, los pulmones, el sistema circulatorio y en la respuesta inmunológica; provocaba coagulopatía y aumentaba la mortalidad en general. DoReMIFA12 es un estudio multicéntrico, abarcó 1,734 pacientes en 21 unidades de cuidados intensivos (UCI) de nueve países, con una mortalidad de 22.3% en pacientes con AKI y 5.6% sin AKI (p < 0.0001) fuertemente relacionada con la velocidad de sobrecarga. Verter litros de líquidos y «ver qué pasa» ya no es una práctica aceptable.
Al cabo de tres horas sólo 15% de un bolo de cristaloides permanece intravascular en voluntarios sanos, en modelos experimentales de sepsis casi 100% del líquido se filtra al intersticio, por lo tanto conociendo la fisiopatología de lo que ocurre en el glucocálix de la matriz endotelial, al verter fluidos intravenosos a velocidades y volúmenes altos el glucocálix se pierde lentamente, lo que propicia un aumento en el flujo transvascular hacia el intersticio y ocasiona la fuga capilar. Considerando que dicho glucocálix ya está comprometido en pacientes sépticos, el porcentaje de líquido intravenoso fugado se incrementa considerablemente, propicia edema intersticial en todos los órganos del cuerpo y disminuye sus funciones básicas, lo que condiciona apoptosis y muerte celular.13
Diferencias entre los diferentes tipos de soluciones intravenosas
Solución salina (NaCl) 0.9%
Mencionada por primera vez por Jakob Hamburguer en la década de 1890, no se sabe cómo llegó a ser conocida como solución fisiológica; sin embargo, el uso del término «fisiológica» pudo haber contribuido a la aceptación generalizada en la práctica clínica.
No es fisiológicamente normal, tiene una concentración de cloruro (Cl) más alta que el plasma (154 versus 100-108 miliequivalentes (mEq)), con diferencia de iones fuertes (SID) distintos al plasma (SID del plasma 40 mEq/L, SID de NaCl 0.9% 0 mEq/L), lo que ocasionará invariablemente acidosis hiperclorémica.
Es considerada relativamente hipertónica porque la suma de sus componentes osmóticamente activos da una osmolalidad teórica in vitro de 308 mosm/kg H2O (154 mmol/L, sodio [Na] + 154 mmol/L de Cl). Con más precisión es isotónica, pues Na y Cl son sólo parcialmente activos con un coeficiente osmótico de 0.926. La osmolalidad calculada in vivo (tonicidad) es de 285 mosm/kg H2O, la misma que la plasmática.14
Muchos estudios han documentado la asociación de lesión renal aguda tras la administración de NaCl 0.9%, la mayor carga de Cl suministrada en la mácula densa renal condiciona vasoconstricción de la arteriola aferente,15 reduce considerablemente el flujo sanguíneo en la arteria renal y en los tejidos renales dependientes de cortisol.16 Recientemente se demostró que tratar pacientes con solución NaCl 0.9% se asoció a incidencia mucho mayor de lesión renal en pacientes críticamente enfermos en comparación con los pacientes reanimados con líquidos restringidos en Cl, ya sea Ringer Lactato (RL) o Plasmalyte.17
Diversas series de estudios han confirmado el desarrollo de acidosis metabólica hiperclorémica en voluntarios sanos y en pacientes reanimados con solución NaCl 0.9%. La pérdida adicional de bicarbonato (HCO3) en el escenario de la ya disminuida capacidad de amortiguamiento renal sólo agrava el estado de acidosis metabólica.18-20
En modelos de estudios clínicos y experimentales de pancreatitis, la acidosis hiperclorémica demostró que incrementa la liberación de mediadores de inflamación20,21 y se ha corroborado en estudios prospectivos que es un predictor independiente de muerte.22
Un estudio retrospectivo de Shaw y cols. que abarcó 109,836 pacientes, reveló que con cargas de NaCl 0.9% durante la reanimación con cristaloides la mortalidad hospitalaria era mayor, cabe hacer notar que dicho efecto era independiente del volumen de líquidos administrado; sin embargo, no fue posible determinar la causalidad directa, sólo la asociación estadística.23
Solución Ringer lactato (RL)
Sydney Ringer en 1880, a través de estudios in vitro sobre la influencia de la composición de cristaloides en la contractilidad cardiaca, condujo al reconocimiento de un beneficio potencial al añadir otros constituyentes inorgánicos a las soluciones salinas. Alexis Hartmann modificó la solución de Ringer adicionando lactato de sodio para que actuara como agente tampón. En reanimación inicial y en la mayoría de los escenarios clínicos es recomendable (SID 29 mEq/L, hipotónica 254 mOsm/L), pues los efectos adversos relacionados son leves, la mayoría asociados a sobrecarga de volumen.14
Cabe señalar que el lactato (en RL) se convierte en glucosa (principalmente en el hígado); esta reacción consume iones de hidrógeno, generando HCO3, normalmente cerca de 30% de lactato se oxida a dióxido de carbono (CO2) y agua. Aun cuando durante el estrés el lactato se convierte en el combustible preferencial del corazón y de otros órganos, esta reacción consume iones de hidrógeno, generando HCO3.24
Se ha asegurado que RL puede empeorar o causar acidosis láctica, esto es imposible, puesto que el lactato (la base) ya ha donado iones H+ y RL genera HCO3 en el hígado y el riñón. Aunque la concentración de lactato (base) puede aumentar con RL, este incremento se asocia a un aumento en HCO3 y en el pH (incluso con enfermedad hepática). Esta observación fue demostrada por Phillips y cols., quienes en un modelo de choque hemorrágico porcino compararon el estado ácido-base de los animales reanimados con RL y NaCl 0.9%.25
Es un clamor popular en el ambiente médico que RL produce hiperkalemia y que no debe administrarse en pacientes con falla renal, pero existe un estudio que comparó el estado ácido base de pacientes trasplantados de riñón aleatorizados para recibir RL o NaCl 0.9%. El potasio fue +0.5 ± 0.6 mEq/L en el grupo NaCl 0.9% y -0.5 ± 0.9 mEq/L en el grupo RL (p < 0.001). Los cambios medios de pH fueron -0.06 ± 0.05 en el grupo NaCl 0.9% y -0.005 ± 0.07 en el grupo RL (p < 0.001).26
Cho y cols. compararon el uso de RL y NaCl 0.9% en pacientes con rabdomiólisis. Se observó que el pH sérico y urinario era significativamente mayor en el grupo RL, no hubo diferencias significativas en el nivel de potasio sérico ni en el tiempo de normalización de la creatinfosfoquinasa (CPK). La cantidad de bicarbonato de sodio (NaHCO3) administrado y la frecuencia de administración de diuréticos fue significativamente mayor en el grupo NaCl 0.9%. Además, como se ha demostrado anteriormente, NaCl 0.9% aumenta el riesgo de disfunción renal e insuficiencia renal aguda en comparación con RL.27
Se sabe que RL está contraindicado en pacientes con enfermedad hepática, ya que causará acidosis láctica grave, lo que no es del todo cierto por un motivo esencial: el lactato se da como la base y no como el ácido; se ha informado que RL es seguro en pacientes sometidos a hepatectomía.28 En un modelo de choque hemorrágico, el RL en comparación con NaCl 0.9% se asoció a menor lesión hepática, renal y pulmonar.29 En el Cuadro I se describen las concentraciones de algunas soluciones intravenosas disponibles.
Cuadro I: Contenido y composición de soluciones intravenosas.
| Plasma | NaCl 0.9% |
Ringer Lactato |
Plasma-Lyte | Ionosteril | Sterofundin | |
|---|---|---|---|---|---|---|
| Sodio (mmol/L) | 136-145 | 154 | 130 | 140 | 137 | 145 |
| Potasio (mmol/L) | 3.5-5.0 | 0 | 4 | 5 | 4 | 4 |
| Magnesio (mmol/L) | 0.8-1.0 | 0 | 0 | 1.5 | 1.25 | 1 |
| Calcio (mmol/L) | 2.2-2.6 | 0 | 3 | 0 | 1.65 | 2.5 |
| Cloro (mmol/L) | 98-106 | 154 | 109 | 98 | 110 | 127 |
| Acetato (mmol/L) | 0 | 0 | 0 | 27 | 36.8 | 24 |
| Gluconato (mmol/L) | 0 | 0 | 0 | 23 | 0 | 0 |
| Lactato (mmol/L) | 0 | 0 | 28 | 0 | 0 | 0 |
| Malato (mmol/L) | 0 | 0 | 0 | 0 | 0 | 5 |
| eSID (mEq/L) | 42 | 0 | 28 | 50 | 36.8 | 25.5 |
| Osmolaridad teórica (mosm/L) | 291 | 308 | 273 | 295 | 291 | 309 |
| Osmolalidad medida (mosm/KgH2O) | 287 | 286 | 256 | 271 | 270 | No establecida |
| pH | 7.35-7.45 | 4.5-7 | 5-7 | 4-8 | 6.9-7.9 | 5.1-5.9 |
Ringer Lactato fabricado por Baxter Healthcare Deerfield IL USA.
Plasma-Lyte 148 fabricado por Baxter Healthcare Toongabbie NSW Australia.
Ionosteril fabricado por Fresenius Medical Care, Schweinfurt Germany.
Sterofundin ISO fabricado por B. Braun Melsungen AG, Melsugen Germany.
Un estudio retrospectivo reciente concluyó que RL se asocia a menor mortalidad y lesión renal aguda. Para afirmar lo anterior se incluyeron 10,249 pacientes en el análisis de mortalidad y 8,085 en el análisis de AKI. Se asoció mayor porcentaje de RL administrado durante los primeros dos días de ingreso en la UCI a menor mortalidad hospitalaria e incidencia de AKI de los días tres a siete después de la admisión en la UCI. El efecto protector del RL fue más pronunciado a medida que el volumen total de fluidos infundidos aumentó y no fue evidente en el análisis de subgrupos cuando se infundieron menos de siete litros de líquidos.30
Albúmina
El peso molecular 66 kDa representa aproximadamente 80% de la presión oncótica, es el principal antioxidante extracelular en el plasma y la proteína principal de transporte, disponible en presentaciones 4-5% y 20-25% suspendidas en NaCl, 60% de su concentración se mantiene intravascular dos horas después de haberse administrado, la albúmina al 20-25% expandirá el volumen de plasma en aproximadamente 4-5 veces el volumen infundido. Dado que el fluido no se mueve desde el intersticio hacia el compartimiento vascular, la única manera en que esto pueda suceder es que el fluido se retire del glucocálix, teniendo en cuenta las nuevas pruebas de que la albúmina desempeña un papel importante en la estabilización del glucocálix endotelial y también en condiciones patológicas asociadas a la disrupción del glucocálix como en parientes sépticos, traumatizados y quirúrgicos.13
En el estudio SAFE, Finfer y cols. aleatorizaron 6,997 pacientes críticamente enfermos para recibir albúmina al 4% o NaCl 0.9% y no encontraron diferencias en mortalidad, a los 28 días fue 20.9 y 21.1%, respectivamente con riesgo relativo de muerte de 0.99 (IC 95% 0.91 a 1.09; p = 0.87), el análisis de subgrupos sugirió que la albúmina podría ser perjudicial en pacientes con trauma cráneo encefálico con posible beneficio en pacientes con sepsis grave.31
En el estudio ALBIOS se documentó que la albúmina al 25% redujo la mortalidad de pacientes con shock séptico (estadísticamente no significativa), una vez que se logró la estabilidad hemodinámica se infundió 300 mL de albúmina al 25% (60 g) durante tres horas una vez al día además de cristaloides.32 Múltiples centros alrededor del mundo han venido considerando el papel de este fluido como parte de las estrategias de reanimación inicial y como pieza clave del tratamiento en general.
Hidroxietilstarch (HES)
Se producen mediante la sustitución de hidroxietil de amilopectina obtenido del sorgo, maíz y patatas, se acumula en tejidos retículo endoteliales (piel, bazo, hígado y riñón) durante periodos de más de cuatro años y genera toxicidad directa al glucocálix.33 Los estudios que analizaron el papel del HES fueron los ensayos CHEST, VISEP y el estudio Triple S, a la luz de las pruebas actuales que demuestran mayor riesgo de nefrotoxicidad, mayor riesgo de muerte y mayor costo sin ningún beneficio clínico obvio. Al parecer las soluciones HES estarían contraindicadas en el paciente crítico.
Criterios para decidir cuál fluido intravenoso utilizar
Raghunathan y cols. estudiaron 6,730 pacientes sépticos críticamente enfermos analizando la asociación entre el tipo de cristaloide elegido para reanimación en cuanto a mortalidad. Encontraron que el uso de soluciones balanceadas como RL estaba asociado a menor mortalidad intrahospitalaria en comparación con NaCl 0.9% (19.6 versus 22.8%). No hubo diferencias significativas en la prevalencia de AKI o en los días de estancia hospitalaria.34
En el metaanálisis de Rochwerg que incluyó 18,916 pacientes, se observó mayor mortalidad en pacientes manejados con almidones como HES que con cristaloides (alta evidencia); menor mortalidad con albúmina que con cristaloides o almidones (moderada evidencia) y menor mortalidad con soluciones balanceadas como RL que con solución salina (baja evidencia);35 sin embargo, un año después Paul Young publicó el estudio SPLIT, en el cual comparó los efectos de soluciones balanceadas como RL versus NaCl 0.9% en relación con AKI en pacientes críticamente enfermos, los pacientes del grupo NaCl 0.9% desarrollaron más AKI que los del grupo de soluciones balanceadas, aunque la diferencia no fue estadísticamente significativa.36
En pacientes pediátricos Maristella es tajante: las soluciones son medicamentos, por lo tanto la prescripción debe ser acorde al estado del niño teniendo en cuenta la dosis y la velocidad adecuadas y no debe administrarse sobredosificación iatrógena. Es poco probable que un solo tipo de solución sea adecuada para todos los pacientes pediátricos y dependerá del contexto clínico, pero las soluciones balanceadas deben ser de elección para la reposición de volumen.37
En los diversos escenarios clínicos puede sugerirse con base en las evidencias actuales: en deshidratación hiponatrémica, trauma craneoencefálico (TCE) y en cetoacidosis diabética administrar NaCl 0.9%.
En hemorragia o choque usar de preferencia RL, pero puede utilizarse NaCl 0.9% y/o albúmina, en sepsis RL, en acidosis metabólica severa RL (o glucosa 5% + NaHCO3 para diarrea, acidosis tubular renal) y en quemaduras RL.
Debe tenerse precaución al administrar soluciones salinas, la administración indiscriminada y excesiva de volúmenes de NaCl 0.9%, algo que Marik llamó ahogamiento iatrogénico en agua salada se asocia a aumento en las tasas de morbilidad y mortalidad.38
En pacientes con trauma múltiple hay que considerar la administración temprana de productos sanguíneos si están disponibles, en ausencia de éstos, de preferencia debe usarse una solución balanceada (RL o PlasmaLyte). La administración excesiva de líquidos tiene consecuencias negativas tales como dilución de factores de coagulación, edema intersticial, acidosis metabólica y disfunción orgánica.39
Mantenimiento de la terapia hídrica y desreanimación de volumen
Malbrain y cols. en 2014 establecieron el acrónimo ROSE para definir las fases de la terapia hídrica, reanimación inicial (R), optimización (O), estabilización (S), evacuación (E),40 las cuales pueden apreciarse en el Cuadro II.
Cuadro II: Esquema ROSE, fases dinámicas en la reanimación hídrica.
| R (Reanimación) |
O (Optimización) |
S (Estabilización) |
E (Evacuación) |
||
|---|---|---|---|---|---|
| HIT | Primero | Segundo | Segundo | Tercero | Cuarto |
| Causa | Respuesta inflamatoria (quemadura, sepsis, trauma, etc.) | Isquemia reperfusión | Isquemia reperfusión | Síndrome de permeabilidad global incrementada (GIPS) | Hipoperfusión |
| Fase | Ebb | Flow | Flow/No Flow | No Flow | No Flow |
| Tipo | Choque severo | Inestable | Estable | Recuperándose | Inestable |
| Ejemplo | Choque séptico, quemadura, trauma múltiple, choque hemorrágico | Quemaduras menos graves, cetoacidosis diabética, pérdidas gastrointestinales | Pacientes postquirúrgicos con NPT o NE, Reemplazo de pérdidas en pancreatitis leve | Pacientes con nutrición enteral completa en fase de recuperación de enfermedad crítica, fase poliúrica de la falla renal | Pacientes con cirrosis, anasarca y edema, GIPS, hipoperfusión hepatoesplénica |
| Pregunta | ¿Cuándo iniciar los líquidos? | ¿Cuándo parar los líquidos? | ¿Cuándo parar los líquidos? | ¿Cuándo iniciar la descarga de líquidos? | ¿Cuándo parar la descarga de líquidos? |
| Pregunta alterna | Beneficio de los líquidos | Riesgo de los líquidos | Riesgo de los líquidos | Riesgo de la descarga hídrica | Riesgo de la descarga hídrica |
| Transporte de O2 | Alteraciones convectivas | Euvolemia, difusión normal | Alteraciones de la difusión | Euvolemia, difusión normal | Alteraciones convectivas |
| Fluidos | Mandatorios | Biomarcadores de enfermedad crítica | Biomarcadores de enfermedad crítica | Tóxico | - |
| Fluidoterapia | Bolo rápido (4 mL/kg en 10-15 minutos | Valorar mantenimiento de fluidos, usar bolos de forma conservadora | Mantenimiento mínimo si la ingesta oral es inadecuada, proporcionar líquidos de reemplazo | Ingesta oral si es necesario, evitar líquidos intravenosos innecesarios | Evitar hipoperfusión |
| Balance hídrico | Positivo | Neutro | Neutro/Negativo | Negativo | Neutro |
| Resultado | Vida salvada (rescate, salvamento) | Órganos salvados (mantenimiento) | Soporte orgánico (homeostasis) | Recuperación orgánica (eliminación) | Soporte orgánico |
| Metas | Macrohemodinámicas | Macroperfusión orgánica | Función orgánica | Evolución funcional orgánica | Microperfusión orgánica |
| Objetivos | Corregir estado de choque | Mantenimiento de perfusión tisular | Mantener balance hídrico neutro a negativo | Eliminar la acumulación de líquidos | Mantenimiento de perfusión tisular |
| Tiempo para lograrlo | Minutos | Horas | Días | De días a semanas | Semanas |
Modificación de las guías de la campaña «Sobrevivir a la sepsis » 2016
En 2012 los puntos finales de reanimación guiados por metas a las primeras seis horas establecían alcanzar un aporte hídrico inicial de 30 mL/kg y mantener la velocidad de infusión para lograr dichas metas de acuerdo con el protocolo propuesto por Rivers en 2001;41 sin embargo, el resultado distó mucho de las evidencias. Un año después de publicado ese estudio, Marik postuló en un editorial de la misma revista que dichos hallazgos debieron haber sido interpretados con precaución, pues la PVC es un indicador deficiente de volumen intravascular que al transfundir concentrados eritrocitarios para alcanzar SvO2 y/o SvmO2 producirá más daño e incrementará la mortalidad.42 A pesar de las evidencias fisiológicas se logró asimilar mucho tiempo después de que la PVC alta disminuye el retorno venoso y el flujo microcirculatorio, incrementa el riesgo de AKI, de edema agudo pulmonar y de falla cardiaca congestiva, daña el glucocálix de la matriz endotelial e inhibe el drenaje linfático y que balances positivos se asocian a alta mortalidad. Lo anterior se concluyó después de dos ensayos multicéntricos como los estudios PROMISE y ARISE. Gracias a esto las recomendaciones se modificaron, se eliminó la terapia dirigida por las metas tempranas de Rivers, se ajustó la terapia de reanimación hídrica inicial individualizada de forma científica acorde a las condiciones hemodinámicas y de respuesta a fluidos en cada paciente. En el Cuadro III se detallan las diferencias entre ambos abordajes descritos de 2012 y 2016.43
Cuadro III: Comparación de las recomendaciones en reanimación inicial de la campaña «Sobrevivir a la sepsis» 2012 y 2016.
| Recomendaciones 2012 | Recomendaciones 2016 |
|---|---|
| Reanimación protocolizada y cuantitativa de pacientes con
hipoperfusión tisular inducida por sepsis (definida como
hipotensión persistente después de una carga de líquidos o
concentración de lactato sanguíneo ≥ 4 mmol/L) Metas durante las primeras seis horas de reanimación: a. Presión venosa central 8-12 mmHg b. Presión arterial media ≥ 65 mmHg c. Gasto uniranio ≥ 0.5 mL/kg/h d. Saturación venosa central (vena cava superior) o saturación venosa mixta de oxígeno 70 o 65% respectivamente (grado 1C) En pacientes con lactato elevado dirigir la reanimación para normalizar el lactato (2C) |
La sepsis y el choque séptico son emergencias médicas y se
recomienda que el tratamiento y la reanimación empiecen
inmediatamente (recomendación de buena práctica) Se sugiere que en la reanimación de la hipoperfusión inducida por sepsis se administren por lo menos 30 mL/kg de cristaloides IV dentro de las primeras tres horas (recomendación fuerte, baja calidad de la evidencia) |
| Se recomienda que después de la reanimación inicial del fluido, los líquidos adicionales sean guiados por la reevaluación frecuente del estado hemodinámico (recomendación de buena práctica) | |
| Observaciones: la reevaluación debe incluir un examen clínico exhaustivo y una evaluación de las variables fisiológicas disponibles (frecuencia cardiaca, presión arterial, saturación arterial de oxígeno, frecuencia respiratoria, temperatura, gasto urinario y otras, según se disponga) así como otros monitoreos no invasivos o invasivos según se disponga | |
| Se recomienda una evaluación hemodinámica adicional (como la evaluación de la función cardiaca) para determinar el tipo de shock si el examen clínico no conduce a un diagnóstico claro (recomendación de buena práctica) | |
| Se sugiere que se utilicen variables dinámicas sobre variables estáticas para predecir la capacidad de respuesta a líquidos cuando estén disponibles (recomendación débil, baja calidad de la evidencia) | |
| Se recomienda una presión arterial media inicial de 65 mmHg en pacientes con choque séptico que requieran vasopresores (recomendación fuerte, calidad moderada de la evidencia) | |
| Se sugiere guiar la reanimación para normalizar el lactato en pacientes con niveles elevados de lactato como marcador de hipoperfusión tisular (recomendación débil, baja calidad de la evidencia) |
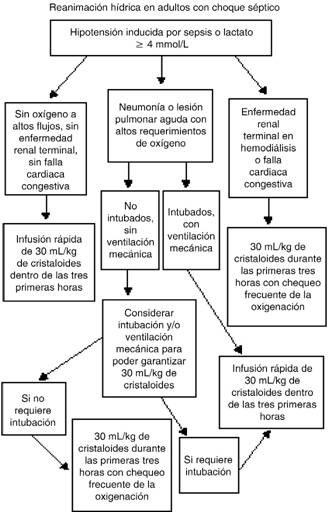
Se propuso entonces el siguiente algoritmo terapéutico para la reanimación hídrica en pacientes con choque séptico (Figura 1).
Conclusión
La complicación principal del manejo de líquidos es la sobrecarga hídrica iatrógena. A pesar de la clara evidencia que mostró fuerte asociación entre el balance hídrico positivo y la mortalidad, en el metaanálisis de Silversides no se encontraron diferencias estadísticamente significativas.
Se necesitan ensayos más amplios que presenten claras diferencias intergrupales para evaluar la eficacia y seguridad de una estrategia conservadora de manejo de líquidos, mientras tanto los médicos que cuidan a pacientes gravemente enfermos deben considerar el uso de una estrategia conservadora de manejo de fluidos,44 las soluciones se consideran medicamentos y debe evitarse sobredosificación innecesaria.
El NaCl 0.9% puede producir hipercloremia, acidosis hiperclorémica y lesión renal aguda; debe entonces individualizarse en cada paciente para decidir la solución a administrar, de preferencia deben usarse soluciones balanceadas.
Pese a los progresos científicos y a las evidencias siempre habrá controversias al respecto. Existe todavía discrepancia sobre qué tipo de solución intravenosa es la mejor dependiendo de las circunstancias. Young afirma que NaCl 0.9% es la solución ideal para la reanimación con cristaloides45 y al mismo tiempo Semler lo refuta;46 incluso autores como Jaehne junto con el mismo Rivers afirman que continuar sobrecargando a los pacientes no es lesivo si se hace concienzudamente y que no debe tenerse «hidrofobia».47 Al final los resultados clínicos documentados en estudios bien controlados a corto, mediano o largo plazo son los que determinarán la conducta terapéutica y las directrices de manejo seguirán modificándose.
Se continuará con el enfoque de individualizar al paciente en su estado patológico y hemodinámico. Muchos resultados clínicos quedan en el terreno de lo inexplicable, para muestra: en un estudio de 798 pacientes 9% nacieron bajo el signo de Piscis, 25 pacientes Piscis murieron a los 90 días versus 348 pacientes no Piscis (35.7 versus 48%). Haber nacido bajo el signo de Piscis se asoció a menor riesgo de muerte al administrarse bolos intravenosos de líquidos.48 ¿Protección divina de Poseidón? el debate y el análisis continuarán.











 nova página do texto(beta)
nova página do texto(beta)