Introducción
La lesión renal aguda (LRA) es un síndrome caracterizado por la rápida pérdida de la función renal (de horas a días). En la mayoría de los casos la corrección de la causa subyacente permite la recuperación; sin embargo, en ocasiones es necesaria la administración de alguna forma de tratamiento de reemplazo renal (TRR).1
Estadísticamente la LRA se presenta hasta en 50% de los pacientes críticamente enfermos, de éstos 6% requerirá TRR durante su estancia en la UCI.2 Su mortalidad se encuentra entre 40-50%.3,4 Con respecto a su etiología dentro de la terapia intensiva el choque séptico representa la causa principal asociada, ya que éste por sí solo como causa más frecuente de choque alcanza una mortalidad alrededor de 50% y adquiere relevancia al asociarse a la LRA. En la literatura los decesos se reportan hasta en 70%.5,6
El riñón es particularmente susceptible a la isquemia y toxinas, dando como resultado vasoconstricción, daño endotelial y activación de procesos inflamatorios. Esta susceptibilidad surge de la relación vascular-tubular en la médula renal donde la presión parcial de oxígeno es baja, incluso en un estado basal, por lo que son más vulnerables a la disminución del flujo sanguíneo renal.7 En presencia de una reducción de la tasa de filtración glomerular (TFG) secundaria a hipoperfusión, la respuesta normal del riñón consiste en concentrar la orina de forma óptima y reabsorber ávidamente el sodio en un esfuerzo por mantener y aumentar el volumen intravascular, así como normalizar la perfusión renal. Fisiopatológicamente la LRA se divide en cinco fases, las cuales son: prerrenal, iniciación, extensión, mantenimiento y recuperación, por lo que una disminución prolongada de la perfusión renal puede dar lugar a un daño isquémico irreversible.8,9
A lo largo del tiempo se ha contado con diversas clasificaciones para estadificar el grado de lesión renal; actualmente la clasificación de Kidney Disease Improving Global Outcomes (KDIGO) es la más utilizada, debido a que ha demostrado mejor sensibilidad diagnóstica para identificar pacientes con LRA al proporcionar criterios con mayor sencillez y unificación.10,11
La terapia de reemplazo renal intermitente (TRRI) fue durante años el tratamiento estándar para el paciente con lesión renal; sin embargo, al manejar flujos sanguíneos más elevados tiende a ocasionar inestabilidad hemodinámica, por esta razón ante el contexto de un paciente en estado de choque se desarrolló la terapia de reemplazo renal lenta continua (TRRLC), definida como una técnica extracorpórea que reemplaza la función renal y purifica la sangre, teniendo como objetivo principal la remoción de solutos y líquidos del compartimento intravascular de manera lenta y continua. En la actualidad es la modalidad preferida en la terapia intensiva, basándose principalmente en cuatro principios: difusión, ultrafiltración, convección y adsorción.12-15 Este método tiene limitaciones como la necesidad de experiencia, la anticoagulación continua, la vigilancia permanente de alarmas y costos mayores.16 Al emplear esta técnica de reemplazo renal se cuenta con diferentes modalidades terapéuticas, tales como la ultrafiltración lenta continua (SCUF), la cual tiene como objetivo principal la remoción de agua plasmática en pacientes con sobrecarga hídrica refractaria al tratamiento diurético, con o sin disfunción renal; la hemofiltración venovenosa continua (HVVC) en la que se utiliza el mecanismo de convección; hemodiálisis venovenosa continua (HDVVC) cuyo mecanismo es el transporte de soluto transmembrana por difusión; hemodiafiltración venovenosa continua (HDFVVC) en la que se combina la modalidad de hemodiálisis y hemofiltración, alcanzando el aclaramiento de solutos a través de la separación difusiva y convectiva; y la hemodiálisis venovenosa continua de alto flujo (HVVCHF) cuyo tratamiento es similar al de la HDFVVC que utiliza membranas de alto flujo.17,18
La decisión en cuanto al momento ideal para detener o cambiar la modalidad de tratamiento se basa principalmente en el empirismo y recursos institucionales locales, con la influencia de una variedad de factores que incluyen características del paciente (estado hemodinámico, uresis, balance hídrico, valor de azoados) y características logísticas (disponibilidad de personal, costos, coagulación del filtro, movilización del paciente fuera de la UCI).19,20 Debido a que no existe un estudio o consenso que defina las pautas para la suspensión de este soporte, establecer criterios para su interrupción es de gran importancia, ya que el fracaso en el retiro de la TRR se asocia a una mortalidad elevada.20,21
Para interrumpir la TRRLC en la práctica actual se considera el incremento en la producción de orina o disminución de la creatinina sérica mientras se mantiene una dosis constante de apoyo renal continuo, ya que en los pacientes con LRA la oliguria es un marcador de resultado desfavorable. La furosemida es un diurético de asa, predominantemente eliminado por los riñones (85%) y secretado activamente en los túbulos proximales. Se han utilizado altas dosis de furosemida intravenosa en un intento por convertir a los pacientes no-oligúricos en oligúricos con el objeto de mejorar el pronóstico.22
Por lo anterior, el apoyo con furosemida en pacientes con LRA ayuda a predecir qué pacientes desarrollarán daño renal permanente, con base en la respuesta a la administración de diurético (prueba de estrés con furosemida). Este concepto también podría usarse para predecir la recuperación exitosa de la función renal después de la TRRLC en pacientes críticamente enfermos.23,24
Justificación: La lesión renal aguda es una patología frecuente a nivel hospitalario que incrementa su incidencia en pacientes críticamente enfermos, la relevancia que adquiere esta identidad es debida al aumento de la mortalidad asociada, la cual puede ser hasta cinco veces mayor en comparación con sujetos que no la presentan. La terapia de reemplazo renal lenta continua adquiere un papel fundamental en el manejo de los pacientes con inestabilidad hemodinámica, pues ha demostrado mejores resultados cuando se aplica de forma oportuna; sin embargo, los criterios de retiro siguen siendo controversiales.
La administración de furosemida es una buena herramienta para evaluar la integridad del funcionamiento renal, por lo que consideramos que la aplicación de la prueba de estrés con furosemida previo al retiro de la terapia de reemplazo renal, nos permitirá predecir qué pacientes requerirán nuevamente terapia de reemplazo renal.
Objetivos. General: Realizar una prueba de estrés con furosemida para predecir el éxito o fracaso del retiro de la terapia de reemplazo renal lenta continua en pacientes con lesión renal aguda.
Específico: Conocer la mortalidad del paciente con lesión renal aguda que requiere terapia de reemplazo renal lenta continua dentro de la terapia intensiva. Determinar las variables asociadas al éxito del retiro de la terapia de reemplazo renal lenta continua.
Hipótesis: La prueba de estrés con furosemida es un predictor del éxito o fracaso del retiro de la terapia de reemplazo renal lenta continua en pacientes con lesión renal aguda.
Material y métodos
Contó con la autorización del Comité Local de Investigación y Ética del hospital. Se requirió consentimiento informado para el inicio de la terapia de reemplazo renal lenta continua y colocación de catéter mahurkar.
Tipo de estudio: Estudio observacional, analítico, prospectivo y transversal.
Universo de trabajo y lugar de desarrollo: Pacientes mayores de 18 años con diagnóstico de lesión renal aguda, según los criterios de KDIGO, sometidos a terapia de reemplazo renal lenta continua que ingresaron a la UCI en el periodo comprendido entre noviembre de 2016 y julio de 2017.
Criterios de selección. Criterios de inclusión: Pacientes que ingresaron a la UCI sometidos a terapia de reemplazo renal lenta continua. Pacientes mayores de 18 años de edad. Pacientes con variables completas.
Criterios de exclusión: Pacientes con insuficiencia renal crónica inscritos en un programa anterior de hemodiálisis. Pacientes menores de 18 años de edad. Pacientes con limitación del esfuerzo terapéutico.
Criterios de eliminación: Pacientes con datos incompletos para su análisis. Pacientes con mortalidad en sus primeras 24 horas de estancia.
Procedimiento
Posterior al ingreso a la UCI y una vez identificado el paciente con LRA, según KDIGO, y con base en los criterios médicos como disminución en la producción de uresis, sobrecarga hídrica, trastornos ácido-base refractarios al manejo, trastornos hidroelectrolíticos refractarios de decidió el inicio y programación de la terapia de reemplazo renal lenta continua (TRRLC) con la máquina PrismaFlex®. La programación de la máquina quedó sujeta a consideración del médico intensivista en turno. Por medio de la herramienta de recolección de datos se registraron variables epidemiológicas, variables para definir escalas de mortalidad SAPS II y SOFA, electrolitos séricos, gasometría arterial y venosa, requerimiento de soporte vasopresor, apoyo mecánico ventilatorio, uresis seis horas previas a colocación de TRRLC y creatinina basal al momento de inicio de la TRRLC. La duración de la TRRLC se basó en la decisión del médico intensivista de acuerdo con variables que influyeron en su inicio. Una vez elegido el paciente para el retiro del soporte renal se indicó la extracción a 0 mL/h, posterior a ello se realizó la prueba de estrés con furosemida a dosis de 1 mg/kg de peso, se recolectaron nuevamente las variables ejecutadas al inicio de la TRRLC. Luego de la desconexión del paciente de la máquina se cuantificó la uresis en las siguientes dos, seis y 24 horas. Se dividió a los pacientes en dos grupos: 1. Grupo de éxito del retiro de la TRRLC: pacientes que no requirieron reinicio de terapia de sustitución de la función renal dentro de los primeros siete días posteriores a la suspensión y prueba de estrés con furosemida. 2. Grupo de fracaso del retiro de la TRRLC: pacientes que requirieron reinicio de terapia de sustitución de la función renal dentro de los primeros siete días posteriores a la suspensión y prueba de estrés con furosemida. Se consideraron respondedores a la prueba de estrés con furosemida: la presencia de uresis de 200 mL o más después de dos horas de la administración. Para fines del estudio se consideró como sobreviviente al individuo que egresó de UCI por mejoría.
Análisis estadístico
Autor para correspondencia: (ROC curves) para determinar la hora de punto de corte óptima para evaluar el volumen urinario posterior a la prueba de estrés con furosemida. El punto de corte óptimo fue a las dos horas. Dicho punto se utilizó para calcular sensibilidad (S), especificidad (E), valor predictivo positivo (VPP), valor predictivo negativo (VPN) y razones de verosimilitud positiva y negativa (RVP y RVN, respectivamente) por medio de tablas de contingencia. Con fines comparativos se calcularon los mismos valores para el punto de corte a las seis y 24 horas. Se utilizó razón de momios (odds ratio, OR) para evaluar los puntos de corte como factor de riesgo relativo de falla del retiro de la terapia de reemplazo renal lenta continua (TRRLC). Se empleó regresión logística binaria para determinar los factores pronóstico de éxito del retiro de la TRRLC. Todos los análisis estadísticos se realizaron con el programa PSSW SPSSTM 22.
Resultados
En el periodo de estudio 31 pacientes ingresados en la UCI requirieron TRRLC, se eliminaron siete pacientes por fallecer dentro de las primeras 24 horas de estancia en el servicio, por tal motivo se incluyeron en el análisis estadístico 24 pacientes, los cuales cumplieron con los criterios de selección planteados, 45.84% fueron mujeres y 54.16% hombres; 21 (87.5%) pacientes presentaron comorbilidades. Se observó con mayor frecuencia hipertensión arterial sistémica en 50% y diabetes mellitus tipo 2 en 33.3%. La etiología más frecuente como causa de la lesión renal aguda fue el choque séptico en 60% de los casos (Cuadro I).
Cuadro I: Características generales de los pacientes con lesión renal aguda sometidos a terapia de reemplazo renal lenta continua.
| Variable | Población total (n = 24) |
Falla del retiro de la TRRLC (n = 13) |
Éxito del retiro de la TRRLC (n = 11) |
p |
|---|---|---|---|---|
| Edad en años (rango) | 61.16 ± 17.60 (17-84) |
54.0 ± 20.3 |
69.63 ± 8.52 | 0.022*
|
| Peso en kg (media) | 80.58 ± 14.55 | 77.38 ± 14.59 | 84.36 ± 14.23 | 0.250* |
| Sexo | ||||
| Masculino | 13 (54.2%) | 7 | 6 | 0.973*** |
| Femenino | 11 (45.8%) | 6 | 5 | |
| Mortalidad | ||||
| Ausente | 12 (50.0%) | 5 | 7 | 0.414+ |
| ±Presente | 12 (50.0%) | 8 | 4 | |
| Comorbilidades | ||||
| ±Ninguna | 3 (12.5%) | 3 | 0 | 0.223+ |
| Una o más | 21 (87.5%) | 10 | 11 | |
| Vasopresor al retiro TRRLC | ||||
| Ausente | 7 (29.2%) | 4 | 3 | 1.000+ |
| Presente | 17 (70.8%) | 9 | 8 | |
| Respondedores a las dos horas | ||||
| Ausente | 13 (54.16%) | 13 | 0 | 0.001+ |
| Presente | 11 (45.84%) | 0 | 11 | |
| Días de estancia hospitalaria | 20.33 ± 9.51 | 18.30 ± 9.80 | 22.72 ± 9.0 | 0.360** |
* t de Student,
** U de Mann-Whitney,
*** Chi cuadrado (χ2), + Exacta de Fisher.
TRRLC = Terapia de reemplazo renal lenta continua. Fuente: Directa.
El retiro de la TRRLC fue exitoso en 11 (45.84%) pacientes y falló en 13 (54.16%). Se observó diferencia significativa en la edad promedio de ambos grupos (éxito del retiro de la TRRLC 69.63 ± 8.52, falla del retiro de la TRRLLC 54.0 ± 20.30; t Student, p = 0.022). La mortalidad fue de 50% (12 pacientes), seis en UCI y seis a nivel hospitalario; en el grupo de falla del retiro cinco pacientes fallecieron en la UCI y tres pacientes en el hospital, principalmente por sobreinfección. Respecto al grupo de éxito del retiro de la TRRLC, un paciente falleció dentro de su estancia en terapia intensiva debido a choque séptico refractario y tres pacientes en piso hospitalario después de su egreso de UCI por mejoría.
En relación con la reconexión a la TRRLC, en el grupo de éxito del retiro ningún paciente fue sometido a modalidad de reemplazo renal posterior a la suspensión y prueba de estrés con furosemida hasta su alta hospitalaria. Por el contrario, en los pacientes con fracaso en el retiro, todos requirieron reinicio de TRRLC durante su estancia en UCI y posteriormente durante su estancia hospitalaria, tres pacientes ameritaron hemodiálisis intermitente y dos pacientes diálisis peritoneal.
La prueba t de Student mostró que hubo diferencias significativas en la concentración de PaO2 y la puntuación de la escala de SOFA al momento del retiro de la TRRLC en pacientes con éxito del retiro en comparación con pacientes con falla del retiro (p < 0.05). El promedio de los volúmenes urinarios a las dos, seis y 24 horas también fue significativamente diferente, siendo menor en pacientes con falla del retiro de la TRRLC. Como los puntajes de estas variables no se distribuyeron normalmente en cada grupo, fueron analizados por medio de la prueba U de Mann-Whitney. El valor de HCO3 no tiene relevancia al momento del retiro de la TRRLC, pues los pacientes con éxito del retiro de la misma presentaron un valor de 21.3 mmol/L en comparación con los que fracasaron 23.04 mmol/L con un valor de p = 0.168. El resto de las variables analizadas no mostraron diferencias estadísticamente significativas en ambos grupos (Cuadro II).
Cuadro II: Valores de las variables de pacientes con lesión renal aguda sometidos a terapia de reemplazo renal lenta continua.
| Variable | Población total (n = 24) |
Falla del retiro de la TRRLC (n = 13) |
Éxito del retiro de la TRRLC (n = 11) |
p |
|---|---|---|---|---|
| Creatinina sérica inicio TRRLC (mg/dL) | 4.35 ± 5.06 | 3.75 ± 2.0 | 5.06 ± 7.28 | 0.685** |
| Creatinina sérica retiro TRRLC (mg/dL) | 1.65 ± 1.36 | 1.64 ± 0.86 | 1.67 ± 1.83 | 0.324** |
| Hb inicio TRRLC (g/dL) | 9.71 ± 2.28 | 9.03 ± 2.18 | 10.5 ± 2.23 | 0.120* |
| Hb retiro TRRLC (g/dL) | 9.39 ± 1.44 | 9.13 ± 1.49 | 9.7 ± 1.39 | 0.346* |
| SaO2 inicio TRRLC | 95.83 ± 5.1 | 96.61 ± 3.4 | 94.90 ± 6.6 | 0.792** |
| SaO2 retiro TRRLC | 97.25 ± 1.7 | 96.61 ± 1.7 | 98.0 ± 1.6 | 0.049** |
| PaO2 inicio TRRLC (mmHg) | 120.0 ± 46.0 | 126.7 ± 49.7 | 112.0 ± 42.3 | 0.582** |
| PaO2 retiro TRRLC (mmHg) | 98.87 ± 27.2 | 88.38 ± 19.4 | 111.27 ± 30.6 | 0.048* |
| pH inicio TRRLC | 7.25 ± 0.15 | 7.26 ± 0.13 | 7.24 ± 0.17 | 0.772** |
| pH retiro TRRLC | 7.40 ± 0.06 | 7.39 ± 0.07 | 7.42 ± 0.04 | 0.130* |
| Uresis seis horas previas al inicio de TRRLC | 273 ± 257 | 219 ± 210 | 336 ± 302 | 0.147** |
| Uresis dos horas después de retiro de TRRLC | 114 ± 133 | 23 ± 27 | 223 ± 126 | 0.000** |
| Uresis seis horas después de retiro de TRRLC | 343 ± 378 | 139 ± 242 | 585 ± 375 | 0.002** |
| Uresis 24 horas después de retiro de TRRLC | 1086 ± 1059 | 476 ± 586 | 1807 ± 1055 | 0.001** |
| SAPS II al inicio de TRRLC | 51.29 ± 15.7 | 50.38 ± 11.4 | 52.36 ± 20.3 | 0.778* |
| SAPS II al retiro de TRRLC | 41.5 ± 14.3 | 41.3 ± 11.1 | 41.7 ± 18.0 | 0.947* |
| SOFA al inicio de TRRLC | 10.83 ± 3.07 | 10.69 ± 3.42 | 11.0 ± 2.75 | 0.810* |
| SOFA al retiro de TRRLC | 9.58 ± 2.91 | 10.92 ± 2.9 | 8.0 ± 2.09 | 0.009* |
* t de Student,
** U de Mann-Whitney.
TRRLC = Terapia de reemplazo renal lenta continua. Fuente: Directa.
Autor para correspondencia: para volumen urinario posterior a la prueba de estrés con furosemida a las dos, seis y 24 horas mostraron que la mejor área bajo la curva (ABC) se obtiene a las dos horas (Figura 1). El punto de corte óptimo a las dos horas es de 150 mL, con esto se obtiene: S, 73%; E, 100%; VPP, 100%; VPN, 81%; RVP, 0%; y RVN, 0.27%. En la respuesta positiva dos horas después de la prueba de estrés con furosemida se estimaron los valores de sensibilidad, especificidad y valores predictivos por los métodos de curvas ROC y por el análisis con tablas de contingencia. Los resultados de los valores fueron los siguientes: S, 64%; E, 100%; VPP, 100%; VPN, 76%; RVP, 0%; y RVN, 0.36%. Para fines comparativos se obtuvieron los valores correspondientes de respuesta positiva seis y 24 horas posteriores a la prueba de estrés con furosemida (Cuadro III).
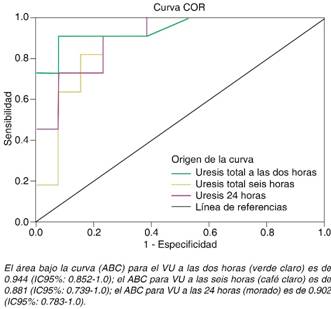
Figura 1: Curvas ROC (COR) de los valores volumen urinario a las dos, seis y 24 horas posteriores a la prueba de estrés con furosemida.
Cuadro III: Valores de sensibilidad, especificidad, valores predictivos y razones de verosimilitud para los criterios analizados.
| Criterio | S (%) | E (%) | VPP (%) | VPN (%) | RVP | RVN |
|---|---|---|---|---|---|---|
| Respuesta positiva dos horas | 64 | 100 | 100 | 76 | 0 | 0.36 |
| Respuesta positiva seis horas | 82 | 77 | 75 | 83 | 3.57 | 0.23 |
| Respuesta positiva 24 horas | 100 | 38 | 58 | 100 | 1.61 | 0 |
S = Sensibilidad; E = Especificidad; VPP = Valor predictivo positivo; VPN = Valor predictivo negativo; RVP = Razón de verosimilitud positiva; RVN = Razón de verosimilitud negativa. Fuente: Directa.
Cuando se mide el nivel urinario después de dos horas del retiro de la TRRLC y su valor es inferior al punto de corte (200 mL) como factor de riesgo de falla del retiro de la TRRLC se obtiene una OR significativa de 4.25 (IC95%: 1.80-10.01; χ2 < 0.001), lo que implica que obtener un volumen urinario a las dos horas de retiro de la TRRLC por debajo del punto de corte incrementa significativamente el riesgo de falla del retiro de la TRRLC.
Discusión
La LRA es una patología común en el paciente críticamente enfermo, se manifiesta hasta en 60% de los casos, la relación con la muerte es de uno de cada dos pacientes dentro de la terapia intensiva. El presente estudio fue acorde a lo reportado en la literatura con una mortalidad de 50%. El choque séptico es la etiología más frecuente asociada, siendo la causa hasta en 60% de los pacientes en la UCI.25-28 En nuestra población el choque séptico de origen pulmonar fue la causa principal.
La TRRLC es un soporte extracorpóreo que se utiliza como terapia puente hasta la recuperación de la función renal, la cual nace como idea en 1960; sin embargo, no es sino hasta 1984 cuando se establece el uso de la hemodiálisis arteriovenosa continua por Geronemus y Schneider.29,30
En nuestros días no existen criterios estandarizados para el retiro de la TRRLC debido a la limitación en los estudios o a la falta de un consenso sobre el éxito en su liberación, por lo que continúa siendo un tema que genera controversia.31 En la escasa literatura que detalla los factores relacionados para predecir la reconexión a la TRRLC se describe la edad, BUN, creatinina (Cr), pH, etiología, SOFA, vasopresor, ventilación mecánica y uresis como principales variables documentadas para evaluar el éxito o fracaso en su interrupción.32,33
La prueba de estrés con furosemida se ha empleado para evaluar la integridad funcional de la nefrona en pacientes con daño renal, debido a que para su efecto requiere cotransportador Na-K-Cl en la superficie luminal del asa de Henle ascendente, flujo sanguíneo renal y secreción de anión orgánico en el túbulo proximal. Existen estudios en pacientes con LRA en los que se ha intentado predecir el pronóstico de la función renal, destacando la uresis como la variable que ha demostrado mayor significancia estadística en todos los trabajos en los que se ha evaluado. Teniendo esto como fundamento Chawla y cols. realizaron una prueba de estrés con furosemida en pacientes con LRA no sometidos a TRR. Administraron un bolo de 1 a 1.5 mg/kg de peso con el objetivo de predecir qué pacientes desarrollarían LRA AKIN III durante su estancia hospitalaria, resultando en una producción de orina menor de 200 cm3 después de dos horas de la prueba diurética en el grupo de pacientes que progresaron a LRA AKIN III o a la muerte 14 días al cabo de dicha prueba, por lo que se estableció como punto de corte ideal 200 cm3 durante las dos horas siguientes a la administración de furosemida, con una sensibilidad de 87.1%, especificidad de 84.1% y un área bajo la curva de 0.87.33
En el año 2009 Peter van der Voort y cols. investigaron mediante la infusión continua de furosemida en pacientes con TRRLC la posibilidad de un efecto beneficioso en la resolución de LRA posterior al soporte renal. Hubo un incremento en el volumen urinario (p ≤ 0.003) en el grupo de pacientes en quienes se administró diurético. Al momento de evaluar una menor duración de la LRA, recuperación renal o variables como urea, estancia en terapia intensiva y mortalidad, no se encontró significancia estadística, concluyendo que aunque la administración de diurético en pacientes con TRRLC produce incremento de la uresis, no influye en menor duración de la insuficiencia renal o en mayor recuperación renal al compararse con el manejo habitual.28
En este estudio se realizó la prueba de estrés con furosemida a una dosis de 1 mg/kg una hora previa al retiro de TRRLC, se cuantificaron los volúmenes urinarios a las dos, seis y 24 horas, obteniendo mayor significancia estadística a las dos horas con una sensibilidad de 64%, especificidad de 100%, con un valor predictivo positivo de 76% y negativo de 100%.
Por tal motivo, la presencia de un volumen urinario por debajo de 200 cm3 después de dos horas de la prueba de estrés con furosemida en pacientes candidatos a retiro de la TRRLC predice la necesidad de reconexión al soporte renal sustitutivo. En nuestra población observamos que el punto de corte de 150 cm3 al cabo de dos horas tiene mejor sensibilidad y especificidad que lo reportado en la literatura; sin embargo, la limitante del tamaño de la muestra podría ser un factor de sesgo.
Uchino y cols. investigaron mediante un estudio observacional y multicéntrico los factores que podrían ayudar a predecir el éxito en la interrupción de la TRRLC, clasificando a los pacientes en dos grupos, el que se asoció al éxito y el que fue reconectado. Los pacientes incluidos en el grupo exitoso mostraron concentraciones más bajas de urea (p ≤ 0.015), creatinina (p ≤ 0.0001) y mayor producción de orina (p ≤ 0.0001) en comparación con los pacientes en el grupo de reconectados. Variables como el pH, aunque tuvieron significancia estadística, no mostraron diferencia clínica; el lactato y la PaO2/FiO2 no resultaron relevantes para el desenlace. Los pacientes del grupo de éxito tuvieron una estancia más corta en UCI (14 versus 21), estancia hospitalaria (33 versus 42), además de una mortalidad menor en UCI (16.7 versus 23.4) y hospitalaria (28.5 versus 42.7). El análisis multivariado de regresión logística mostró que la variable más significativa fue la producción de orina (uresis en las 24 horas antes de suspender la TRRLC: OR: 1,078 por 100 mL/día; aumento en la uresis como parámetro para detener la TRRLC: OR: 3,097, p < 0,0001). Además de la uresis, la disminución de la creatinina fue factor protector significativo (OR: 0,996 por mmol p < 0.0005). El área bajo la curva para predecir el retiro exitoso de TRRLC fue 0.808 en la producción de orina y 0.635 en la creatinina. Con el uso de diurético el gasto urinario fue de 2,330 mL/día con un área bajo la curva de 0.87.34
En comparación con nuestra población estudiada se observó una tendencia a la baja de presión arterial de oxígeno en pacientes con falla del retiro, traduciendo un probable compromiso respiratorio en este grupo de pacientes. Los parámetros que reflejan el estado ácido-base como pH y bicarbonato no influyen en el desenlace de los pacientes sometidos a la prueba de furosemida, manifestando que las alteraciones en el equilibrio ácido-base son el efecto del daño renal. Referente al valor de la creatinina como marcador de éxito del retiro de la TRRLC continúa generando controversia, ya que en algunos estudios la reportan como significativa, mientras que en otros no influye como variable del retiro.31,35 Esto último coincide con nuestros resultados que no demuestran que la creatinina sérica sea una variable a considerar para el retiro ni que prediga el desenlace con un valor de p = 0.32.
Vega y cols. realizaron una prueba de furosemida en pacientes con LRA sin TRR para predecir la progresión a KDIGO 3, la necesidad de TRR y la mortalidad. Administraron una dosis de furosemida de 1 mg/kg en pacientes sin manejo diurético previo y de 1.5 mg/kg en los que recibieron manejo siete días previos, establecieron un punto de corte de 200 cm3 en las siguientes dos horas después de dicha prueba para considerarlos respondedores, destacando en los resultados que 100% de los pacientes no respondedores progresaban a KDIGO 3 (p = 0.003), requerían TRR en 75% (p = 0.03) y reflejaban un puntaje SOFA mayor en comparación con los respondedores (11.5 versus 7.5 p = 0.02). Respecto a la mortalidad no se apreciaron diferencias significativas en ambas poblaciones (p = 0.71).35 En la literatura mundial se observa mayor puntación del SOFA en el grupo de pacientes con fracaso en el retiro del soporte renal (10.2 versus 6.7) con una p = < 0.001.32 En nuestra población la puntuación del SOFA al retiro de la TRRLC fue relativamente mayor en pacientes con fracaso (11 versus 10.6) con un valor de p = 0.009, de lo que se infiere que los pacientes que no obtuvieron éxito se encontraban en mayor gravedad. Respecto a la mortalidad en las UCI no se observó diferencia con relevancia estadística cuando se compararon los dos grupos de estudio (p = 0.414).
Es así que la terapia de reemplazo renal lenta continua es un soporte que modifica el pronóstico del paciente con LRA y falla orgánica múltiple. La respuesta positiva a la acción de la furosemida posterior a la suspensión de la TRRLC augura un resultado clínico y bioquímico favorable para la función renal y la no necesidad de reemplazo renal a mediano plazo. Establecer la prueba de estrés con furosemida positiva (200 mL de uresis posterior al bolo) podría ser un criterio de suspensión de la TRRLC y podría pronosticar la recuperación de la función renal.
Conclusión
La lesión renal aguda es una patología común en el paciente críticamente enfermo que incrementa la mortalidad hasta en 60%. El uso de TRRLC no ha demostrado mejoría en la supervivencia; sin embargo, su uso de manera oportuna podría mejorar el desenlace del enfermo crítico con LRA.
La prueba de estrés con furosemida en el paciente no sometido a TRR es confiable para predecir qué pacientes requerirán reemplazo renal durante su estancia hospitalaria; la administración de 1 mg/kg de peso de furosemida previo al retiro de la TRRLC con uresis de más de 200 cm3 posterior al mismo demostró utilidad como predictor de éxito, con un apropiado poder estadístico.
Deberá establecerse si el punto de corte de 150 cm3 de uresis a las dos horas es mejor que 200 cm3 para predecir el éxito del retiro de la TRRLC.
Una interpretación adecuada de los puntos de corte puede ser una prueba valiosa para identificar a los pacientes que no requieran nuevamente soporte renal y establecerla como criterio de retiro de la TRRLC.











 nueva página del texto (beta)
nueva página del texto (beta)


