Introducción
Los esteroides se han usado desde 1960 y, aunque están asociados a efectos secundarios potenciales, desempeñan un papel decisivo en el tratamiento del edema cerebral asociado con tumores cerebrales de origen primario o secundario. La introducción de la terapia con esteroides a principios de la década de los 60 va de la mano con la disminución en los índices de morbimortalidad.1,2 El tratamiento de los tumores del sistema nervioso central es múltiple y, definitivamente, la cirugía ocupa un lugar primordial. Por otro lado, los esteroides juegan un rol de suma importancia dentro del manejo inicial, considerando que la mayoría de los tumores desencadena edema vasogénico. Está bien documentado que los esteroides controlan el edema que se presenta en torno a las neoplasias cerebrales; por esta razón, mejora la sintomatología, pero en la mayoría de los casos no atacan el tumor.3 En ocasiones, la respuesta terapéutica posterior a la administración de esteroides se produce de manera rápida, pero por lo general - aproximadamente en 75% de los pacientes- ocurre entre 24 y 72 horas después del inicio del fármaco.4 Hace más de 50 años se demostró que la dexametasona disminuye de forma efectiva el edema cerebral condicionado por tumores, lo cual revolucionó el tratamiento en este tipo de pacientes.5 La dexametasona se sintetizó por primera vez en 1958 y hasta la fecha continúa siendo el fármaco que ofrece un beneficio único.6 Posteriormente, otros esteroides (prednisona, prednisolona, metilprednisolona) han demostrado efectos antineoplásicos.7 Este trabajo tiene como objetivo informar la respuesta clínica al uso de la dexametasona y las variedades posológicas en su uso.
Caso clínico
Femenino de 48 años de edad, con antecedente de hipertensión arterial sistémica de un mes de diagnóstico, en tratamiento con losartán 50 mg cada 12 horas. Inició su padecimiento el día 06 de diciembre de 2016, con cefalea continua, holocraneal, intensidad 7/10, que no cedía a la administración de analgésicos, se acompañaba de náusea y vómito; progresó con desviación de la comisura labial, hemiparesia hemicorporal izquierda y somnolencia; por estas razones fue llevada al Servicio de Urgencias a valoración. Se realizó una TAC de cráneo, en la cual se observó a nivel temporal derecho una lesión ovoidea de bordes parcialmente definidos (Figuras 1 y 2), predominio isodenso y con áreas de mayor densidad en su interior (38 a 41 UH), con dimensiones de 42 × 39 mm, la cual reforzó a nivel periférico tras la administración de medio de contraste endovenoso. Alrededor de la lesión se observaba zona irregular, hipodensa, relacionada con edema cerebral; además, desplazamiento de la línea media de 18 mm y compresión del ventrículo lateral derecho. El diagnóstico fue tumoración temporal derecha. Se inició manejo en el Servicio de Urgencias, el cual incluyó uso de esteroides (dexametasona 8 mg IV cada ocho horas), con mejoría de signos y síntomas (reversión de la hemiparesia faciocorporal izquierda y mejoría del estado de conciencia). Ingresó a piso de Neurocirugía; posteriormente, se realizó exéresis completa de la tumoración, con reporte de probable glioblastoma. Ingresó a la Unidad de Cuidados Intensivos (UCI), donde se brindó manejo neurocrítico. Durante su estancia se mantuvo con dexametasona.
Discusión
Se conoce la asociación entre el edema cerebral peritumoral y el comportamiento maligno, principalmente en gliomas, meningiomas y metástasis. Los mecanismos por los cuales ocurre edema cerebral peritumoral aún no son completamente conocidos, principalmente radica en una barrera hematoencefálica (BHE) incompleta, careciendo de uniones fuertes a nivel de la microvasculatura cerebral.8 El edema cerebral no es una entidad clínica como tal, sino un estado clínico-patológico caracterizado por un exceso de acúmulo de agua en el parénquima cerebral, donde los mecanismos de compensación como el líquido cefalorraquídeo y el volumen sanguíneo (teoría de Monro-Kellie) han fallado.9,10 En 1967 Klatzo realizó una clasificación para edema cerebral, donde los dividió en dos grandes grupos: de tipo vasogénico y de tipo citotóxico.11 Diversos estudios12,13 se han enfocado en demostrar la existencia de más tipos de edema basados en la integridad de la BHE, en su localización (intra- o extracelular), lesión directa a la célula, dilatación ventricular o sitio (sustancia gris o blanca); sin embargo, la mejor forma de integrar el entendimiento del edema cerebral es dividiéndolo en dos grandes grupos: intracelular y extracelular, con sus respectivos subtipos. El edema de tipo intracelular es el resultado de una lesión con daño directo a la célula nerviosa (citotóxica), descrita como un fallo de energía celular por interrupción en la función de la bomba iónica; esto se produce por una irrigación disminuida que altera la función de bomba Na-K-ATPasa (movimiento de sodio y potasio a los compartimentos extra- e intracelulares); al no poder movilizarse el sodio al espacio extracelular se acumula en el intracelular, con el consiguiente transporte de agua al intracelular, lo que finaliza en su acumulación y edema; la BHE se mantiene íntegra. En cuanto al edema extracelular, el líquido puede provenir tanto del líquido cefalorraquídeo como del mismo líquido intersticial; se subclasifica en edema vasogénico, hidrocefálico, osmótico, estasis y por proceso hidrodinámico14 (Cuadro I).
Cuadro I: Tipos de edema cerebral.
| Localización | Tipo de edema | Fisiopatología | Ejemplos |
|---|---|---|---|
| Intracelular | Citotóxico | Fallo en la bomba Na-K-ATPasa | Hipoxia/anoxia |
| Extracelular | Vasogénico | Pérdida de integridad de la BHE | Tumores del SNC |
| Hidrocefálico | Obstrucción del LCR, aumentando la presión hidrostática | HSA | |
| Osmótico | Por Osm sérica disminuida u Osm intersticial cerebral aumentada | SIHAD | |
| Estasis | Tumor que comprime el sistema de drenaje, con estasis y edema peritumoral | Compresión vascular por tumoración | |
| Hidrodinámico | Líquido proveniente del propio tumor | Tumores del SNC |
Na-K-ATPasa = Bomba de sodio-potasio-ATPasa; BHE = Barrera hematoencefálica; SNC = Sistema nervioso central; LCR = Líquido cefalorraquídeo; HSA = Hemorragia subaracnoidea; Osm = Osmolaridad; SIHAD = Síndrome de secreción inapropiada de hormona antidiurética.
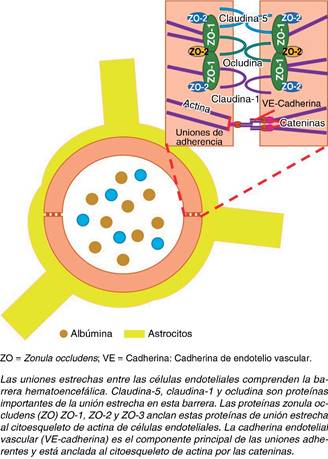
Antaño nos enseñaron a clasificar patologías específicas a algún tipo de edema (por ejemplo, isquemia cerebral aguda con edema citotóxico), hoy en día es un error suponer que no puedan coexistir dos o más tipos de edema en cualquier patología cerebral.15 La BHE es parte fundamental en el tejido nervioso, ya que es un filtro para moléculas tóxicas y permeable a sustancias nutritivas para el sistema nervioso; consta de uniones estrechas para estas acciones, formadas de proteínas transmembrana llamadas claudinas y ocludinas que dan soporte a estas uniones (Figura 3).16
Está descrito que existen moléculas que son las responsables del edema extracelular entre las que destacan factores de permeabilidad vascular, canales de membrana, transportadores y receptores, donde se ha centrado la atención en el uso de medicamentos que los atenúen. Los factores de crecimiento endotelial vascular (VEGF) son factores angiogénicos, que en el sistema nervioso central (SNC) son producidos por neuronas, astrocitos y células endoteliales, cuya función es la proliferación y migración de células endoteliales en los tejidos. En condiciones normales no generan daño a la célula nerviosa; sin embargo, su aumento provoca una lesión directa y altera la homeostasis. Los tumores del SNC producen VEGF; este aumento genera un desbalance que altera la estructura de las claudinas y ocludinas, con lo que ocurre una hiperpermeabilidad de la BHE.17,18 A su vez, los VEGF inducen la síntesis y liberación de óxido nítrico, lo que genera vasodilatación, mayor flujo y edema.19 Las metaloproteinasas de matriz (MMP) son responsables de la degradación de moléculas de la matriz extracelular, ayudando en la reparación de células nerviosas; a niveles altos (observados en tumores cerebrales), dañan la integridad de la BHE y contribuye aún más a la hiperpermeabilidad de dicha barrera.20 Otros mecanismos moleculares implicados en la fisiopatología del edema extracelular están siendo estudiados; entre ellos se encuentran prostaglandinas y leucotrienos.21 Es un hecho que los glucocortidoides disminuyen los niveles de VEGF por parte de las células tumorales, demostrado por una disminución en la expresión de mRNA (RNA mensajero) de VEGF in vitro utilizando dexametasona.22 El uso de glucocorticoides ha demostrado aumentar la expresión de ocludinas y claudinas, aunque de los dos tipos de claudinas (1 y 5), sólo se ve beneficiada la claudina-5 por el uso de glucocorticoides, igualmente ayudado por la disminución de los VEGF.23 Las MMP regresan a su estado basal al inhibir su sobreexpresión por los glucocorticoides tanto endógenos como exógenos (Figura 4).24
Debido a sus propiedades farmacológicas, la dexametasona se considera el esteroide de elección para el tratamiento del edema cerebral peritumoral; tiene un mínimo efecto mineralocorticoide, alta potencia y una vida media más prolongada que el resto, aunque cualquier otro esteroide podría ser eficaz si se administra en dosis equivalentes.25 A pesar de su uso común, ha sido difícil determinar la dosis óptima de la dexametasona en pacientes con edema cerebral peritumoral.26-28 Su principal indicación va en relación con el control de los síntomas y el manejo preoperatorio.29 La respuesta clínica que presente el paciente será el criterio principal para evaluar la respuesta al tratamiento con esteroides. Se ha demostrado que la administración 24 a 48 horas previas al procedimiento quirúrgico tiene efecto potencial sobre el edema cerebral peritumoral y la condición clínica del paciente en el momento de la craneotomía.30 Tras el evento quirúrgico, los esteroides pueden descontinuarse en forma progresiva. En el caso de radiocirugía, el edema cerebral peritumoral puede persistir mayor tiempo y el requerimiento de esteroides puede prolongarse.31 Reducciones en la dosis deben ser consideradas después de siete a 10 días de administración. La interrupción abrupta después de este tiempo puede ser causa de hipocortisolismo, en particular, en escenarios clínicos de estrés (incremento de la demanda de esteroides endógenos), como la fiebre y el estrés físico. En presencia de hipocortisolismo, se debe administrar hidrocortisona (15-25 mg/día).32 Una gran variedad de esteroides sintéticos se encuentran disponibles para su uso terapéutico, en comparación con el cortisol, se caracterizan por diferentes propiedades farmacodinámicas y farmacocinéticas.15,33 A pesar del uso generalizado de la dexametasona para el manejo del edema cerebral peritumoral, no existe acuerdo respecto a la dosis, tiempo de tratamiento y esquema de reducción.34 La administración de 4 mg/día de dexametasona para el tratamiento del edema cerebral peritumoral tiene el mismo grado de mejoría (evaluado por Karnofsky) que la administración de 16 mg/día después de una semana de tratamiento en pacientes sin signos de herniación inminente. Los efectos tóxicos son dependientes de la dosis y, durante un periodo de cuatro semanas, ocurrieron con más frecuencia en pacientes que usaban 16 mg/día p = 0.03.35 La presencia o ausencia de síntomas, el tipo de los mismos, el tipo de déficit neurológico y el grado de edema observado en los estudios de imagen deben ser considerados para la prescripción de la dosis de dexametasona.36 A través de una revisión sistemática se documentó que la dosis de dexametasona empleada para el tratamiento del edema cerebral peritumoral, reportada en los diferentes estudios, varía en un rango de ocho a 16 mg/día.37 Sigue siendo dudoso si dosis superiores a 16 mg/día de dexametasona proporcionan beneficio adicional. La administración de los 16 mg/día se puede dar en dos a cuatro dosis. La dexametasona se puede descontinuar de manera lenta o rápida posteriormente a la cirugía. Esquema de reducción lenta: 4 mg dos veces al día por siete días, 2 mg dos veces al día por siete días, 1 mg dos veces al día por siete días y, finalmente, 1 mg al día por siete días; esquema de reducción rápida: la dexametasona puede ser suspendida tres días después de la cirugía. El criterio médico es importante en la toma de decisiones.38
El uso de dexametasona es probablemente uno de los avances más importantes en el cuidado de pacientes neuroquirúrgicos, y ha mejorado su morbilidad y mortalidad en los últimos 50 años. En una época en que la supervivencia se ha incrementado en la población de pacientes, surgen las incógnitas respecto a dosis, duración y reducción del tratamiento.39 Los efectos secundarios de la dexametasona son comunes, incrementan su gravedad dependiendo de la dosis y el tiempo de tratamiento. La mayoría de los efectos secundarios son manejables, pero algunos pueden ser fatales. La hipertensión arterial secundaria ocurre en 20% de los casos, la osteoporosis acompaña al 50% de los pacientes, la diabetes mellitus inducida por esteroides aparecerá en 50% de la población tratada, la miopatía ha sido descrita en 60% de los pacientes, incluso con una sola dosis, efectos psiquiátricos se han descrito en 60% de los casos, supresión inmunológica y vulnerabilidad frente a infecciones oportunistas son algunas de las complicaciones más temidas.40
Conclusión
Actualmente no se tiene definida la dosis, tiempo de tratamiento y esquema de reducción ideal respecto al uso de dexametasona en los pacientes con edema cerebral peritumoral; las recomendaciones encontradas son dispares, las dosis varían desde los 4 u 8 mg, hasta los 16 mg al día, divididas en dosis múltiples dependiendo de la severidad de los síntomas y el juicio médico. No existe evidencia clara para recomendar dosis superiores a 16 mg/día. La administración previa al evento quirúrgico tiene beneficios potenciales, pero el tiempo que se prolongará la terapia tras la cirugía es tema de controversia.











 nueva página del texto (beta)
nueva página del texto (beta)