Introducción
Las glándulas suprarrenales son órganos endocrinos multifuncionales que secretan diversos esteroides. El cortisol es el principal corticosteroide; se produce en la zona reticular de la corteza suprarrenal, regulando su secreción a través del eje hipotálamo-hipófisis-suprarrenales y liberándose en respuesta al estrés.1,2 El uso de corticosteroides para el tratamiento de pacientes con choque séptico ha llevado a considerar su empleo en otros procesos patológicos, entre ellos, el choque hipovolémico hemorrágico, aunque con resultados controversiales.3 A pesar de los avances en el reconocimiento y manejo oportuno de pacientes con choque hipovolémico hemorrágico en los últimos años (cirugía de control de daños, uso de soluciones balanceadas, protocolos de transfusión masiva, etcétera), esta entidad continúa produciendo gran impacto socioeconómico. El choque hipovolémico hemorrágico alcanza una mortalidad hasta de 40% en las primeras 24 horas posteriores a la lesión.4 Dentro de la fisiopatología se destaca que con pérdidas mayores al 10% del volumen sanguíneo circulante (VSC) existe repercusión hemodinámica evidente, con descenso del volumen minuto cardiaco (VMC) y vasoconstricción periférica mediada por incremento de la actividad simpática; esto ocasionará alteraciones en la macrocirculación (hipotensión arterial sistémica, taquicardia) y alteraciones en la microcirculación (hipoperfusión tisular); incluso con pérdidas superiores al 35% del VSC, el estado de choque puede ser irreversible.5,6 Los pacientes con eje hipotálamo-hipófisis-suprarrenales íntegro desarrollarán incremento en las concentraciones de hormona adrenocorticótropa (ACTH) ante enfermedad grave o estrés; esto, a su vez, aumenta los niveles de cortisol sérico circulante y favorece la liberación de catecolaminas con la finalidad de mantener la homeostasis.7,8
Está documentado que hasta 60% de los pacientes con choque séptico presentan niveles de cortisol disminuidos, lo que condiciona insuficiencia corticoadrenal relativa, lo que contribuye a los malos resultados en estos pacientes.9-11 Desde los años 70 se agregaron los corticosteroides al tratamiento del choque séptico y se ha demostrado reducción de la mortalidad.12 Por otro lado, la asociación entre choque hipovolémico hemorrágico e insuficiencia corticoadrenal relativa es controversial, lo que hace necesario realizar estudios que investiguen su correlación. Ensayos clínicos en modelos animales han demostrado que el choque hipovolémico hemorrágico puede disminuir el flujo sanguíneo hacia las glándulas suprarrenales, lo que conllevaría a isquemia y necrosis de las mismas, pudiendo entonces ocurrir insuficiencia corticoadrenal relativa.13 Los pacientes con choque hipovolémico hemorrágico refractario podrían tener insuficiencia corticoadrenal relativa y la adecuada reanimación hídrica más la corrección de los niveles de corticosteroides normalizarían la presión arterial. Sabemos bien que los pacientes con eje hipotálamo-hipófisis-suprarrenales normal incrementan los niveles de cortisol sérico ante enfermedad grave o estrés, aunque se piensa que la insuficiencia corticoadrenal relativa puede aparecer en pacientes con choque hipovolémico hemorrágico.14-17 El diagnóstico se basa en la sospecha clínica y, sobre todo, en demostrar la presencia de una menor producción de cortisol. El presente estudio fue diseñado para evaluar la correlación que existe entre los niveles de cortisol sérico y la mortalidad en los pacientes postquirúrgicos con choque hipovolémico hemorrágico que ingresan a la Unidad de Cuidados Intensivos.
Justificación: El choque hipovolémico hemorrágico es uno de los principales motivos de ingreso a la Unidad de Cuidados Intensivos (UCI), alcanzando mortalidad de 40% a pesar de los avances en el reconocimiento y manejo oportuno. Las alteraciones en el eje hipotálamo-hipófisis-suprarrenales han demostrado su asociación con los resultados en pacientes críticamente enfermos, por lo que consideramos que identificar de manera temprana esta situación puede influir en la morbimortalidad.
Objetivo general: Utilizar el cortisol sérico para predecir la mortalidad en pacientes postquirúrgicos con choque hipovolémico hemorrágico.
Objetivo específico: Establecer el punto de corte de cortisol sérico al ingreso a la UCI que predice mortalidad en pacientes postquirúrgicos con choque hipovolémico hemorrágico.
Hipótesis: El nivel de cortisol sérico se asocia a mayor mortalidad en pacientes postquirúrgicos con choque hipovolémico hemorrágico.
Material y métodos
El Comité de Investigación y Ética del Hospital autorizó el protocolo de estudio. No se realizó consentimiento informado debido a que se trató de un estudio de riesgo mínimo y de no intervención.
Tipo de estudio: Estudio de cohorte, prospectivo, longitudinal, observacional y analítico.
Universo de trabajo y lugar de desarrollo: Pacientes ingresados a la UCI con diagnóstico de choque hipovolémico hemorrágico secundario a evento quirúrgico en el periodo comprendido entre el 01 de enero y el 31 de julio de 2017.
Criterios de inclusión: Pacientes que ingresaron a la UCI con el diagnóstico de choque hipovolémico hemorrágico secundario a evento quirúrgico. Hemorragia durante el evento quirúrgico igual o mayor al 10% del VSC. Por lo menos un registro de hipotensión durante el evento quirúrgico o dentro de los 30 minutos de su llegada a la UCI (definida por presión arterial sistólica menor de 90 mmHg o presión arterial media menor de 65 mmHg). Muestra de cortisol sérico tomada dentro de los primeros 30 minutos de su llegada a la UCI. Pacientes mayores de 18 años.
Criterios de exclusión: Pacientes con otra causa de choque (distributivo, cardiogénico u obstructivo). Pacientes con hemorragia durante el evento quirúrgico menor al 10% del VSC. Pacientes sin al menos un registro de hipotensión. Pacientes con uso de corticosteroides durante los siete días previos a la cirugía. Muestra de cortisol sérico tomada después de 30 minutos de su llegada a la UCI. Registro de variables incompleto.
Metodología
A los pacientes que cumplieron con los criterios de inclusión se les tomó una muestra de cortisol sérico dentro de los 30 minutos de su llegada a la UCI; la muestra fue procesada de forma cuantitativa en un equipo Architect i1000SR. Al mismo tiempo, se tomaron muestras de paraclínicos complementarios (biometría hemática completa, química sanguínea, electrolitos séricos y gasometría arterial). Se realizó el registro en la base de datos de las variables necesarias para completar el protocolo de estudio. El paciente fue considerado sobreviviente al ser dado de alta de la UCI o al llegar al día 30 de estancia. Se utilizaron las siguientes fórmulas: volumen sanguíneo circulante: peso (kg) × 65 (mujeres) y peso (kg) × 70 (hombres).
Análisis estadístico
Los datos obtenidos se presentan como medidas de tendencia central y dispersión. Las variables cuantitativas se analizaron con χ2 o prueba exacta de Fisher en caso de frecuencias esperadas < 5. Para la comparación de variables cualitativas se utilizó prueba de t de Student en caso de distribución normal y U de Mann Whitney en caso contrario. Se realizó análisis bivariado. Para establecer la relación entre variables cuantitativas se utilizaron diagramas de dispersión y se calcularon los coeficientes de correlación con (r) de Pearson. Se empleó la curva ROC para calcular el punto de corte, así como la sensibilidad y la especificidad de la prueba, área bajo la curva (AUC) y coeficientes de probabilidad. Se reportó IC de 95%. Se consideró un valor significativo de p < 0.05.
Resultados
Durante el periodo de estudio (01 de enero al 31 de julio de 2017) un total de 20 individuos ingresaron a la UCI con choque hipovolémico hemorrágico secundario a evento quirúrgico. En las características basales de la población el promedio de edad fue 53.7 ± 18.4 años; 60% fueron hombres y 40% mujeres, la media del SAPS II fue de 44.2 puntos. El tipo de cirugía que originó el choque hipovolémico hemorrágico con mayor frecuencia fue la oncológica (40%), seguida de la abdominal (25%), torácica (10%), urológica (10%), cardiovascular, neurocirugía, trauma y ortopedia (5%). Sesenta por ciento de las cirugías fueron electivas y 40% urgentes. La norepinefrina se utilizó en 65% del total de los pacientes. Ochenta por ciento de los pacientes utilizó ventilación mecánica y 35% desarrolló lesión renal aguda. La mortalidad en la UCI fue de 30%, con una mediana en los días de estancia de dos (Cuadro I).
Cuadro I: Características basales.
| Edad (media/DE) | 53.7 ± 18.4 |
| Género H (%) | 12 (60) |
| SAPS II (media/DE) | 44.2 ± 20 |
| Tipo de cirugía n (%) | |
| • Abdominal | 5 (25) |
| • Cardiovascular | 1 (5) |
| • Torácica | 2 (10) |
| • Trauma y ortopedia | 1 (5) |
| • Neurocirugía | 1 (5) |
| • Oncología | 8 (40) |
| • Urología | 2 (10) |
| Motivo de Cirugía n (%) | |
| • Urgente | 8 (40) |
| • Electiva | 12 (60) |
| Norepinefrina n (%) | 13 (65) |
| Lesión renal aguda n (%) | 7 (35) |
| Uso de ventilación mecánica n (%) | 16 (80) |
| Días de estancia en la UCI (mediana/RI) | 2 (1-2.5) |
| Mortalidad en la UCI n (%) | 6 (30) |
DE = Desviación estándar, H = Hombres, SAPS II = Simplified Acute Physiology Score II, RI = Rango intercuartil, UCI = Unidad de Cuidados Intensivos.
En el análisis bivariado de supervivencia al ingreso no se encontraron diferencias estadísticamente significativas entre sobrevivientes y no sobrevivientes en las variables edad, género, motivo de la cirugía, días de estancia en la UCI, ventilación mecánica, creatinina y bicarbonato (HCO3 -). La diferencia estadísticamente significativa se observó entre el grupo de sobrevivientes y no sobrevivientes en las variables SAPS II (Simplified Acute Physiology Score II), SOFA (Sequential Organ Failure Assessment), tiempo quirúrgico, sangrado, norepinefrina, lesión renal aguda, volumen sanguíneo circulante, IC (índice de choque) modificado, balance de líquidos, pH y cortisol (Cuadro II).
Cuadro II: Análisis bivariado de supervivencia al ingreso.
| Variable | Sobrevivientes | No sobrevivientes | p |
|---|---|---|---|
| n = 14 | n = 6 | ||
| Edad (media/DE) | 52 ± 19 | 54.9 ± 18 | 0.53 |
| Género H (%) | 8 (57) | 4 (67) | 0.69 |
| SAPS II (media/DE) | 34 ±14 | 68 ± 6.5 | 0.0001 |
| SOFA (media/DE) | 6 ± 4 | 13 ± 3 | 0.0008 |
| Motivo de cirugía (%) | 0.11 | ||
| • Urgente | 4 (29) | 4 (67) | |
| • Electiva | 10 (71) | 2 (73) | |
| Tiempo quirúrgico (h) (media/DE | 6 ± 3 | 4.5 ± 1.3 | 0.04 |
| Sangrado (mL) (mediana/RI) | 2050 (1600-3000) | 4000 (2900-5000) | 0.04 |
| Norepinefrina (%) | 7 (50%) | 6 (100%) | 0.03 |
| Lesión renal aguda (%) | 3 (21) | 4 (67) | 0.05 |
| Días de estancia en la UCI (mediana/RI) | 2 (1-3) | 1.5 (1-2) | 0.6 |
| Ventilación mecánica (%) | 10 (71) | 6 (100) | 0.14 |
| Volumen sanguíneo circulante (media/DE) | 47 ± 12 | 50 ± 5 | 0.02 |
| IC modificado (media/DE) | 1 ± 0.41 | 1.5 ± 0.3 | 0.02 |
| Balance de líquidos (mL) (media/DE) | 4100 ± 2702 | 6078 ± 2587 | 0.014 |
| Cortisol (mediana/RI) | 22.6 (20-26) | 49 (44-61) | 0.0005 |
| Creatinina (mg/dL) (mediana/RI) | 0.8 (0.7-1.2) | 1.6 (1-2.2) | 0.84 |
| pH (mediana/RI) | 7.35 (7.32-7.4) | 7.23 (7.06-7.29) | 0.03 |
| HCO3 - (mEq/L) (media/DE) | 19 ± 3.4 | 16.4 ± 2.4 | 0.14 |
| Déficit de base (mmol/L) (media/DE) | -6.9 ± 4.1 | -11 ± 4.8 | 0.06 |
DE = Desviación estándar, H = Hombres, SAPS II = Simplified Acute Physiology Score II, RI = Rango intercuartil, pH = Potencial de hidrogeniones, HCO3-- = Bicarbonato, DIFa = Diferencia de iones fuertes aparente, DIFe = Diferencia de iones fuertes efectiva, Cr = Creatinina, TRR = Terapia de reemplazo renal, NE = Norepinefrina, VM = Ventilación mecánica, UCI = Unidad de Cuidados Intensivos, Na+ = Sodio, Cl-- = Cloro.
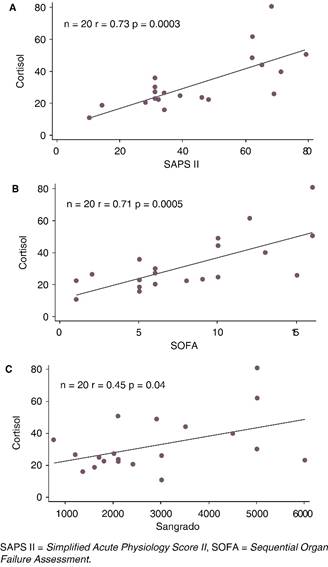
En la Figura 1A se observa la correlación lineal entre cortisol y SAPS II, r = 0.73, p = 0.0003. La Figura 1B muestra la correlación lineal entre cortisol y SOFA, r = 0.71, p = 0.0005. La correlación lineal entre cortisol y sangrado r = 0.45, p = 0.04 aparece en la Figura 1C.
Por medio de la curva ROC se estableció el punto de corte para el cortisol sérico al ingreso a la UCI, estimado en 39.1 µg/dL, con área bajo la curva de 1.00 (IC95% 0.0012-0.2487, p = 0.0001) (Figura 2). La sensibilidad fue de 100%, con especificidad de 100%; los coeficientes de probabilidad positivo y negativo fueron de 14 y cero, respectivamente.
Discusión
Cuando el organismo recibe una agresión responderá con una serie de eventos neuroendocrinos y humorales a fin de mantener la homeostasis. La respuesta se considera universal, pero mantiene relación con la intensidad de la lesión.18 La respuesta metabólica al trauma o la lesión presentará una fase hipodinámica (ebb phase), la cual ocurre de manera inmediata como consecuencia de la pérdida de líquidos corporales y suele durar horas. Se caracteriza por intensa actividad simpática e inestabilidad hemodinámica; de no ser corregida, la muerte ocurrirá inminentemente. Otra es la fase hiperdinámica (flow phase), en la cual resalta el estado hiperdinámico y el estrés metabólico; ésta persistirá semanas. Una tercera fase anabólica ocurre por un periodo prolongado (meses); aquí ocurre recuperación funcional.19 El paciente quirúrgico está expuesto a diferentes tipos de agresión (destrucción tisular, anestesia, hemorragia, dolor, ansiedad, etcétera), suficientes para activar la respuesta metabólica al trauma o a la lesión; la mala adaptación a dicha respuesta conduce a malos resultados. En el análisis bivariado de supervivencia al ingreso, las variables hemodinámicas como el índice de choque modificado (frecuencia cardiaca/presión arterial media) 1 ± 0.41 versus 1.5 ± 0.3, p = 0.02) y la norepinefrina -7 (50%) versus 6 (100%), p = 0.03- fueron mayores en el grupo de no sobrevivientes versus sobrevivientes. En nuestra opinión, una respuesta sistémica inapropiada y una mala adaptación a la fase hipodinámica fueron las condicionantes de los malos resultados, junto con el grado de disfunción orgánica (SOFA 6 ± 4 versus 13 ± 3, p = 0.0008) y la gravedad de los pacientes (SAPS II 34 ± 14 versus 68 ± 6.5, p = 0.0001).
La respuesta metabólica al trauma o la lesión que se presenta luego de una cirugía mayor es una forma «controlada» de trauma, pero adquiere magnitud y se puede convertir en un fenómeno deletéreo por reacciones sistémicas inapropiadas o una mala adaptación a la fase hipodinámica.20 La secreción de cortisol ocurre con la cirugía mayor, incrementándose sus niveles séricos, lo que condiciona un estado de hipercortisolismo transitorio con el propósito de amortiguar la respuesta inflamatoria sistémica.21 Bellal y sus colaboradores evaluaron los niveles de cortisol al ingreso y a las 96 horas en pacientes con choque hemorrágico por trauma. La media de cortisol sérico a su ingreso fue de 20.9 ± 9.8 µg/dL y de 32.2 ± 14 µg/dL, p = 0.001 a las 96 horas, con una mortalidad hospitalaria de 24%. Los pacientes que sobrevivieron incrementaron sus niveles de cortisol sérico a las 96 horas con respecto a su ingreso (21.2 ± 9.9 µg/dL versus 35.5 ± 11.3 µg/dL, p = 0.001), y los pacientes que no sobrevivieron disminuyeron sus niveles de cortisol sérico a las 96 horas con respecto a su ingreso (14.3 ± 7.1 µg/dL versus 6.3 ± 0.6 µg/dL, p = 0.03).22 Bernard y su grupo evaluaron los niveles de cortisol sérico en pacientes con traumatismo craneoencefálico (TCE). La media fue de 25 µg/dL. Se concluyó una incidencia de 25 a 100% de insuficiencia corticoadrenal relativa y peores resultados.23 Weant y sus colegas documentaron insuficiencia corticoadrenal relativa en 69% de sus pacientes con hemorragia subaracnoidea, con una media de cortisol sérico de 22.5 µg/dL; en este estudio también se menciona el probable beneficio de dosis bajas de corticosteroides.24 En pacientes con pancreatitis aguda severa, estudios han documentado insuficiencia corticoadrenal relativa hasta en 27% de los casos, con una media de cortisol de 26.6 μg/dL. Todos aquéllos que presentaron insuficiencia corticoadrenal relativa desarrollaron pancreatitis necrótica y requirieron manejo quirúrgico, con diferencia significativa en la mortalidad (75% versus 5%, p = 0.007).25 Durante la ventilación mecánica se ha documentado mayor éxito en el retiro en aquellos pacientes que presentan función corticoadrenal normal (84% versus 68%, p = 0.035), además de existir diferencia significativa en los días de destete (weaning), 2.9 ± 1.7 versus 6.5 ± 4.7, p = 0.044.26 En quienes tienen choque séptico la incidencia de insuficiencia corticoadrenal relativa es elevada y se asocia con malos resultados. Estudios han demostrado mayor mortalidad en los pacientes con choque séptico que desarrollan insuficiencia corticoadrenal relativa en comparación con aquellos que presentan función corticoadrenal normal, 50% versus 9.1%, con RR 10 (IC95% 105-95; p = 0.02), respectivamente.27 El etomidato ha sido desaconsejado en los pacientes con choque séptico por inhibir la esteroidogénesis suprarrenal, pudiendo aumentar el riesgo de insuficiencia corticoadrenal relativa RR 1.64 (IC 95% 1.52-1.77, p = 0.0001; I2 = 88%) y la mortalidad RR 1.19 (IC 95% 1.1-1.3, p= 0.0001; I2 64%). Aunque hay heterogeneidad entre los estudios, los datos son bastante coherentes entre las publicaciones en sepsis; la conclusión es que no se debería usar etomidato en estos pacientes, habiendo otras alternativas.28
Otra población de pacientes críticamente enfermos donde se ha evaluado el valor pronóstico del cortisol sérico es aquélla que presenta paro cardiorrespiratorio. Se midió el valor sérico basal, con 38.6 µg/dL [19-48] versus 28.4 µg/dL [20.1-40.4], p = 0.30 en los pacientes que presentaron estado de choque después del paro cardiorrespiratorio y aquellos que no lo presentaron, respectivamente. La mortalidad fue mayor en los pacientes con estado de choque (50% versus 12.5%, p = 0.02).29 Todos los estudios mencionados nos dejan claro que los niveles de cortisol sérico influyen directamente en los resultados de las diferentes poblaciones de pacientes críticamente enfermos. Cabe señalar que la literatura hace énfasis en la insuficiencia corticoadrenal relativa o en los niveles bajos de cortisol sérico y su utilidad para predecir malos resultados, pero el incremento «agudo o transitorio» no se pregona como factor de riesgo. Contrariamente a los diferentes estudios clínicos mencionados, en nuestro trabajo, el análisis bivariado de supervivencia al ingreso muestra diferencia significativa de los niveles de cortisol sérico, los cuales son mayores en los no sobrevivientes respecto a los sobrevivientes: 49 µg/dL (44-61) versus 22.6 µg/dL (20-26), p = 0.0005. Establecimos el punto de corte en 39.1 µg/dL de cortisol a través de la curva ROC, con AUC de 1.00 (IC95% 0.0012-0.2487) p = 0.00001, sensibilidad 100%, especificidad 100%, coeficiente de probabilidad positivo 14 y coeficiente de probabilidad negativo cero. Sabemos bien de la asociación entre el incremento crónico de los niveles de cortisol sérico y su efecto negativo sobre diferentes aparatos y sistemas, pero sabemos poco respecto a los incrementos «agudos o transitorios» del cortisol sérico en el paciente críticamente enfermo. La premisa de que el incremento de cortisol sérico en respuesta a la enfermedad grave puede no ser de la magnitud suficiente para la intensidad de la lesión es bien conocida, pero tal vez dicho incremento pueda ser «exagerado» y esto también lleve a malos resultados en los pacientes críticamente enfermos.30 No debemos olvidar que el aumento de las concentraciones de cortisol sérico tradicionalmente se atribuye al incremento de su producción; sin embargo, estudios recientes han sugerido que una reducción en su eliminación puede contribuir, esto por regulación negativa de las enzimas que lo metabolizan en el hígado y el tejido adiposo.31,32
Por otro lado, en nuestro estudio se observa que la correlación lineal entre cortisol y sangrado no es buena (r = 0.45, p = 0.04). Lo anterior es secundario a que la estimación de las pérdidas de sangre intraoperatorias son inexactas y poco confiables, con márgenes de error que oscilan entre el 25 hasta el 85%.33 Donde existe una buena correlación lineal es entre cortisol y SAPS II, SOFA (r = 0.73, p = 0.0003 y r = 0.71, p = 0.0005 respectivamente), lo que sencillamente confirma que la gravedad del paciente desde su ingreso a la UCI siempre se relaciona con buenos o malos resultados.
Dentro de las limitaciones de nuestro estudio clínico podemos resaltar: primero, el tamaño de la muestra; segundo, que al igual que otros trabajos, el cortisol sérico que medimos fue el total y no la fracción libre (parte activa); tercero, no podemos determinar si los niveles altos de cortisol son secundarios a disminución del aclaramiento del mismo y no propiamente a incremento en su producción; por último, no realizamos una segunda muestra, cuando sabemos que una sola determinación podría no ser suficiente. Los resultados son interesantes y debemos seguir trabajando en determinar la «necesidad» de utilizar esteroides en el choque hipovolémico hemorrágico.
Conclusión
Los niveles de cortisol sérico medidos al ingreso a la Unidad de Cuidados Intensivos superiores a 39.1 µg/dL se asocian con mayor mortalidad en los pacientes postquirúrgicos con choque hipovolémico hemorrágico. Debemos tomar en consideración que durante la enfermedad crítica, la secreción de corticosteroides incrementa notablemente, pero dicho aumento resulta cuestionable si sólo se miden las concentraciones de cortisol sérico total y no la fracción libre.











 nueva página del texto (beta)
nueva página del texto (beta)