Introducción
Desde la descripción original del síndrome de insuficiencia respiratoria pulmonar aguda (SIRPA) en 1967,1 la radiología ha Figurado como un importante componente en el diagnóstico y seguimiento del mismo; es típico que los clínicos que atienden estos casos esperen con avidez la información que cada mañana pueda brindarles la placa portátil de tórax y que intentan integrar de inmediato a muchas otras variables clínicas, bioquímicas, fisiológicas y hemodinámicas igualmente cambiantes, para determinar la evolución y definir los siguientes pasos de manejo.
Petty describió el hallazgo de infiltrados alveolares difusos en la radiografía de tórax de los pacientes con SIRPA, pero sobre todo hizo énfasis en el hecho de que la evolución radiológica sigue estrechamente a la clínica, y ofrece hallazgos diferentes en el tiempo dependiendo de la fase en la que se encuentre el síndrome. Es así que señaló que los cambios radiológicos más tempranos consisten en infiltrados alveolares bilaterales en parches, confundidos con frecuencia con insuficiencia cardiaca y edema pulmonar leve. Al evolucionar el SIRPA y hacerse más grave, los infiltrados alveolares tienden a confluir, y en estado terminal suelen adquirir un patrón de consolidación.1
Aunque en esencia esta descripción es correcta, no siempre es apreciable en la práctica clínica debido, por lo menos, a tres distintas razones: los cambios radiológicos del SIRPA son inespecíficos y dependen del momento en que se lleva a cabo la evaluación,2 la rapidez con la que el síndrome puede evolucionar en algunos casos y la amplia variabilidad interobservador para emplear el componente radiológico de la definición del distrés respiratorio agudo.3 La descripción original también establece que la recuperación clínica del SIRPA es coincidente con la radiológica -a veces puede ser dramática- y que las diferentes etiologías de este síndrome ofrecen hallazgos radiológicos consistentes.
Posteriormente, tanto los distintos consensos americanos y europeos4 como los recientes criterios de Berlín5 hicieron una importante mención de los aspectos radiológicos de esta entidad; en esta última definición, uno de los cuatro grandes ejes diagnósticos fue, junto con el factor tiempo, el origen del edema pulmonar y la gravedad del defecto de oxigenación. De manera puntual, este documento hace alusión a que ya sea con radiografía de tórax o con tomografía axial computarizada, es criterio diagnóstico de SIRPA el que existan opacidades bilaterales no explicadas completamente por derrame pleural, colapsos lobares o pulmonares, o bien, nódulos.
Se describe un caso de SIRPA de evolución fulminante, que se deja apreciar a través de los dramáticos cambios radiológicos que experimentó en corto tiempo. Se trató de un hombre de 69 años previamente sano, que llegó referido de otro hospital por dolor abdominal inespecífico, cambios en sus hábitos intestinales y un cuadro de oclusión intestinal que resultó corresponder a un adenocarcinoma del colon moderadamente diferenciado, invasor, ulcerado; en el postoperatorio inmediato de una hemicolectomía izquierda desarrolló un choque séptico severo refractario al manejo convencional en terapia intensiva, que evolucionó adversa y rápidamente hacia la falla orgánica múltiple (FOM). Es particularmente llamativo el SIRPA grave con el que cursó y que a pesar de maniobras de protección pulmonar, titulación del mejor nivel de PEEP, con manejo hemodinámico avanzado y prono, lo condujo precipitadamente a la muerte. La Figura 1 muestra la radiografía de tórax a su llegada a urgencias, prácticamente normal; esto, como se sabe, puede ocurrir en la fase más temprana del SIRPA, aunque rara vez se documente.6 La Figura 2 pertenece a un corte axial a nivel del tercio inferior del tórax; se puede apreciar parénquima pulmonar de características normales al ingreso al hospital. Se descartaron enfermedad por tromboembolismo venoso y otros procesos intratorácicos, que hacen de la tomografía axial computarizada una opción popular en el abordaje diagnóstico por imagen de los pacientes en urgencias.
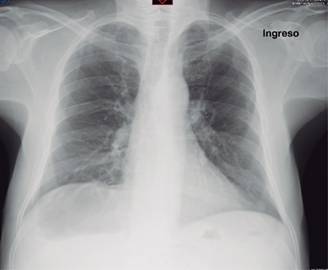
Figura 1: Radiografía AP de tórax al ingreso del paciente. El aspecto radiológico es prácticamente normal, con cierta reducción del volumen pulmonar. PaO2/FiO2 normal.
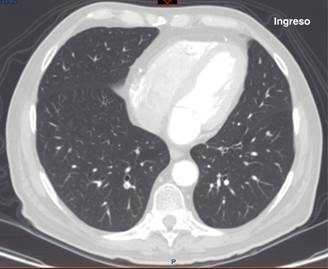
Figura 2: Corte axial a nivel del tercio inferior del tórax al ingreso del paciente. Muestra parénquima pulmonar normal, ausencia de derrame pleural. El septum interventricular está en posición normal y el tamaño del ventrículo derecho es normal. No hay defectos de llenado vascular.
La Figura 3 nos ilustra la adversa evolución respiratoria apenas 12 horas después, con una relación PaO2/FiO2 de tan sólo 84 (SIRPA graveBerlín extrapulmonar), con Apache de 29 (mortalidad asociada del 55%), FOM y SAPS II de 95 puntos. AMV convencional y con relación I:E inversa con prono por hipoxemia grave refractaria, de tipo no respondedor. Su PEEP óptimo osciló entre 16 y 18 cmH2O; requirió monitoreo hemodinámico avanzado y la instalación temprana de un sistema PRISMA ante la progresión de la FOM (fallas respiratoria, renal, hepática, hemodinámica, hematológica y digestiva).
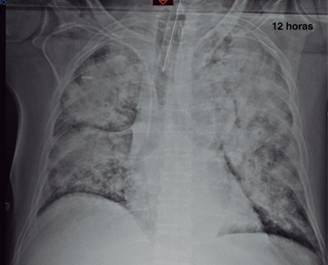
Figura 3: Se muestra la evolución radiográfica del paciente a las 12 horas de su ingreso, ya en el postoperatorio de la cirugía abdominal y estado de choque séptico, con SIRPA grave. Puede observarse la cánula endotraqueal y un catéter central derecho. Es de destacarse el aspecto tan anormal del pulmón, con un amplio proceso de ocupación alveolar que abarca los cuatro cuadrantes, con broncograma aéreo y respetando la periferia. El nivel de PEEP = 12 cmH2O.
Finalmente, la Figura 4 ejemplifica primordialmente el efecto del PEEP sobre el agua intrapulmonar a nivel alveolar, que se redistribuye hacia las esquinas alveolares e induce el reclutamiento de unidades alveolares previamente colapsadas, con disminución del cortocircuito venoarterial intrapulmonar, entre otros importantes efectos fisiológicos. El paciente murió con hipoxemia, pero probablemente no de ella, sino del estado de choque refractario, con fuga capilar masiva y la FOM. Una cepa de Enterococcus faecalis (cubierta apropiadamente con el esquema de antibióticos empíricos utilizados desde su arribo) creció en varios hemocultivos y en un lavado bronquioloalveolar obtenido broncoscópicamente.
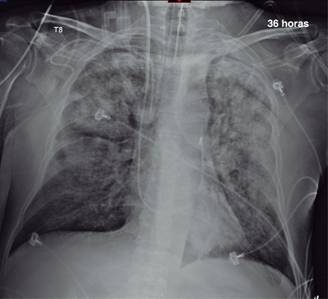
Figura 4: Evolución desfavorable a las 36 horas de su estancia en la unidad de terapia intensiva. El nivel del mejor PEEP se determinó en 18 cmH2O, con lo que hubo una discreta mejoría tanto en la oxigenación como en el aspecto radiológico del tórax de este caso de SIRPA extrapulmonar grave. Comparativamente, el patrón de ocupación alveolar tuvo mejoría con respecto al del día anterior y mejor aeración. Puede observarse un catéter de flotación pulmonar en posición posterior izquierda. El paciente falleció con hipoxemia leve, de FOM.
El presente caso, aunque similar a muchos otros que la mayor parte de los colegas intensivistas han podido manejar, se distingue básicamente por el comportamiento en extremo agudo de la lesión endotelial de la microvasculatura pulmonar, que se expresa de forma magistral en la representación radiográfica del SIRPA (Figura 3).
Un caso tan rápidamente evolutivo como éste no permitió observar la fase inicial con infiltrados intersticiales difusos de patrón reticular incipiente. Por lo general, las primeras imágenes radiográficas dejan ver opacidades homogéneas simétricas, difusas, bilaterales, con o sin broncograma aéreo. Este patrón radiológico refleja el influjo de edema proteináceo y hemorrágico intralveolar, donde las células de revestimiento se han dañado, dejando denudada la membrana basal, y donde existe una exuberante reacción inflamatoria por la activación, entre otros, de los neutrófilos y los macrófagos alveolares.7 En la imagen radiológica, los vasos pulmonares pierden la nitidez de sus márgenes y, a medida que el proceso avanza, estas estructuras se difuminan. A diferencia del edema pulmonar hidrostático, habitualmente en el SIRPA «puro» no se observa engrosamiento septal interlobular (edema intersticial o ingurgitación linfática, líneas A y B de Kerley), aunque hay casos mixtos de edema de permeabilidad e hidrostático, como el mismo documento de los criterios de Berlín acepta.
El edema pulmonar cardiogénico cursa generalmente con cardiomegalia, ingurgitación o redistribución vascular, o derrame pleural, regularmente derecho. A medida que el edema pulmonar empeora, las opacidades radiológicas difusas se tornan más homogéneas en las siguientes 24 a 48 horas y, eventualmente, los hemidiafragmas, así como los márgenes vasculares y cardiaco, se ponen borrosos e indefinidos y el pulmón cada vez más opaco, fase en que la muerte del paciente suele sobrevenir. Estas anormalidades se dan frecuentemente con una distribución anatómica azarosa, sin el patrón simétrico (de orientación perihiliar) que es habitual en el edema pulmonar hidrostático, aunque hay que interpretar con reserva estos patrones de distribución, ya que no son totalmente confiables para sospechar el origen del edema pulmonar.
En el caso de sobrevivir a esta fase del SIRPA, el curso natural es progresión hacia una fase crónica de varios días de duración (y aun semanas), con opacidades homogéneas persistentes y algunas zonas de aeración. Lo anterior correlaciona con inflamación subaguda y crónica, hiperplasia de neumocitos tipo II y llegada progresiva de fibroblastos, con formación de colágena. Aunque en un pequeño grupo de casos (alrededor de 10%) existe fibrosis crónica persistente acompañada en la función de un síndrome restrictivo pulmonar y radiológicamente con pérdida de volumen pulmonar, en la mayoría de ellos (80%) existen grados distintos de resolución, con una fuerte tendencia hacia la normalización total.8 El diagnóstico diferencial con neumonía asociada a la ventilación mecánica es todo un complejo tema, fuera de los objetivos de la presente discusión.
Finalmente, queremos señalar que en la actualidad no solemos ver formas radiológicas puras del SIRPA, dado que la progresión natural del síndrome se ve modificada por todas las intervenciones que se llevan a cabo en la unidad de terapia intensiva, principalmente en lo que se refiere a la ventilación mecánica y al manejo de líquidos.
Creemos que aunque la tomografía axial computarizada se supone en la actualidad el estándar de oro en la imagen del SIRPA, en particular en lo que se refiere a la evaluación del reclutamiento e hiperinflación alveolar, para ajustar el nivel de PEEP y el Vt,9 la placa simple de tórax continúa teniendo por su simpleza, costo y reproducibilidad, un amplio rol en el seguimiento y manejo de estos casos en nuestro medio.
Nuevas técnicas como la ultrasonografía pulmonar, la tomografía por emisión de positrones y la resonancia magnética nuclear están ampliando nuestros horizontes de entendimiento de tan fascinante entidad.











 nueva página del texto (beta)
nueva página del texto (beta)


