Introducción
El Síndrome de Insuficiencia Respiratoria Aguda (SIRA), es una entidad clínica que se ha conocido desde antes de la segunda guerra mundial, pero fue hasta el año de 1967 en que el grupo de los doctores Ashbaugh y Petty describieron las características clínicas e histopatológicas que caracterizan a esta enfermedad (Figuras 1 y 2). Veinticinco años después se desarrolló la primera definición consensada de SIRA, bajo el respaldo de la Sociedad Americana del Tórax y la Sociedad Europea de Medicina Intensiva se creó «El Consenso de la Conferencia Americana-Europea (AECC) de ARDS». Este consenso se inició el 15 de Mayo de 1992 en Miami y concluyó el 26 de Octubre del mismo año, en Barcelona, los criterios derivados de esta reunión fueron adoptados de manera universal, hasta que en el 2011, en el consenso llevado a cabo en Berlín, se realizaron los cambios a las definiciones del AECC, que son los actualmente aceptados y utilizados.1-8

Figura 1: Portada del artículo original en el que se describe el «Acute Respiratory Distress Syndrome in Adults», publicado en la Revista Lancet el 12 de Agosto de 1967.

Figura 2: Los pioneros en la descripción y definición del síndrome de insuficiencia respiratoria aguda, los doctores Thomas L. Petty (saco negro) y David G. Ashbaugh (suéter blanco).
A 50 años de su descripción original se han logrado grandes avances en el conocimiento de la fisiopatología, biología molecular, comportamiento clínico y tratamiento del SIRA. El objetivo de este trabajo es hacer una revisión puntual de los principales avances logrados de manera cronológica al 2017, de esta compleja enfermedad.
Concepto de lesión pulmonar inducida por ventilación mecánica (LPVM) 1970-1980
Se postuló que los mecanismos de aparición de LPVM comparten la base fisiopatológica del SIRA (inflamación local intensa), secundaria primariamente a la activación de la inflamación local con producción excesiva de moléculas proinflamatorias (IL-1, IL-6, IL-8, FNT, etc.), estrés oxidativo entre los bordes de unión de alvéolos colapsados y los no colapsados, fracturas de paredes alveolares por el frotamiento y choque cíclico (atelectrauma), fugas alveolares de gas (barotrauma), así como la baja producción de surfactante, lo que en la actualidad conocemos como biotrauma.9-14
Los estudios del grupo de Vlahakis revelaron que la ventilación controlada por presión causaba liberación de citoquinas y proteasas de los macrófagos alveolares y que el estiramiento cíclico incrementaba la expresión en células bronquiales y alveolares de IL-8, FNT, IL-1β, IL-6, quimioquina-2, ciclooxigenasa-A2, activador del plasminógeno tipo 1, factor tisular y urokinasa (Cuadro I).15-17
Uso de surfactante alveolar, del bovino al recombinante 1970-1980
A raíz de los descubrimientos iniciales de la similitud con la enfermedad por membranas hialinas del recién nacido y de los hallazgos de pérdida de la estructura, síntesis y función del surfactante alveolar, se pensó que la administración de un compuesto similar de origen bovino podría mejorar la disfunción alveolar. En la actualidad el uso terapéutico en SIRA es con surfactante sintético de origen recombinante creado por la ingeniería genética. Sin embargo, la mayoría de los estudios en los que se ha probado, mostraron mejoría en la oxigenación, pero no significancia estadística en la disminución de mortalidad.18,19
Las investigaciones realizadas en las últimas décadas con protocolos de administración en dosis progresivas de compuestos recombinantes y enriquecidos con diferentes proteínas asociadas a surfactante han demostrado mejoría en la oxigenación, disminución en la concentración de IL-6 en lavado broncoalveolar y reducción de los días de ventilación mecánica. Aunque algunas investigaciones han revelado que no existe diferencia en la mortalidad a 28 días, cuando se comparan a largo plazo (180 días) hay incremento de mortalidad (49 versus 39.3%) y aumento de efectos adversos como la hipotensión, por tal motivo en la actualidad no se recomienda para el tratamiento.20-24
El concepto d e Baby Lung 1980-1990
El Baby lung se definió originalmente a través de estudios de tomografía de tórax en casos de SIRA como la fracción del parénquima pulmonar que mantiene una inflación y ventilación normal que simulaban pulmones de niños de cinco a seis años (peso de 300 a 500 g/de parénquima normal). Esta área se consideró similar a los pulmones sanos de un bebé y como la causante de las alteraciones mecánicas descritas en el SIRA; mientras que las áreas colapsadas consolidadas como las causantes de las alteraciones en la oxigenación. Estos conceptos anatómicos, más que funcionales, fueron la base para que por años se estudiaran técnicas de reclutamiento pulmonar, así como la posición en decúbito prono.25,26
Los estudios de tomografía computarizada revelaron que las áreas de afectación pulmonar en el SIRA son heterogéneas. Se describieron zonas de ventilación normal, otras escasamente ventiladas, áreas sobreinfladas o sobredistendidas y áreas completamente consolidadas.27
Mecanismos celulares, neurohumorales, mecano-transducción y respuesta inflamatoria en la fisiopatología del SIRA 1990-2000
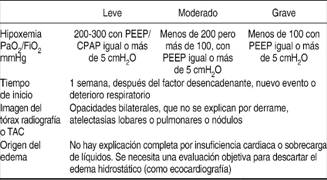
Lo más importante en el estudio histológico y fisiopatológico del SIRA es lo que más comúnmente se describe como daño alveolar difuso que se caracteriza por alteración del endotelio capilar y el epitelio alveolar, que resulta en el aumento de la permeabilidad y subsecuentemente en edema intersticial y alveolar rico en proteínas, atelectasia y daño estructural pulmonar. En este contexto la función de los componentes celulares y humorales de la respuesta inflamatoria como los neutrófilos, macrófagos alveolares, plaquetas, sistema de complemento y mediadores como citosinas desempeña un papel preponderante en perpetuar y amplificar la respuesta, cuando esto sucede la persistencia de la inflamación pulmonar afecta una fase proliferativa que se caracteriza por el inicio de fibrosis pulmonar y trombosis capilar que generalmente van acompañadas de disfunción orgánica múltiple. Se describen dos patrones de presentación clínica de acuerdo con la gravedad de la activación de esta respuesta (Cuadros II y III).28,29
Estudio de biomarcadores 1990-2000
A lo largo de estas décadas se ha intentado describir marcadores clínicos, bioquímicos o ligados a la ventilación mecánica que establezcan un patrón lineal de riesgo de aparición de SIRA, aumento de complicaciones, respuesta al tratamiento y/o mortalidad. Estos marcadores han incluido: estados de coma, disfunción hepática, falla renal, choque profundo, hipoxemia grave con índices de oxigenación bajos menores de 100 mmHg (PaO2/FiO2), acidosis grave, PaCO2 alta, índices de masa corporal en rangos de obesidad o desnutrición, inmunosupresión, días de ventilación mecánica, aumento del espacio muerto pulmonar, falla cardiaca, multitransfusión, etcétera.30,31
Con la descripción de la participación de la inflamación local y sistémica en la fisiopatología del síndrome, los biomarcadores más estudiados fueron los niveles séricos de interleucinas proinflamatorias y antiinflamatorias (IL-6, IL-8, IL-10, FNT), los cuales se utilizaron para medir los efectos inflamatorios de las técnicas de reclutamiento y protección pulmonar con resultados que reflejaron la gravedad del síndrome y la participación en la aparición de disfunción orgánica múltiple y alta morbimortalidad. En la actualidad los estudios de estos biomarcadores se estudian en paneles, de los que se han hecho combinaciones que aumenten el poder predictivo, como la combinación de RAGE y angiopoyetina 2 en pacientes con trauma, los paneles de daño endotelial como RAGE, proteína D de surfactante y proteína 16 celular han facilitado el diagnóstico de sepsis (Cuadro IV).32-35
El avance en la tecnología ha permitido desarrollar investigaciones puntuales en el estudio de biomarcadores para el diagnóstico y estratificar el riesgo en el fenotipo molecular. Actualmente no se conoce un biomarcador, por ejemplo las troponinas, que sea específico de las células epiteliales del pulmón, por el momento sólo marcadores proinflamatorios no específicos como el receptor de productos finales de glicación avanzada (RAGE, por sus siglas en inglés).36
RAGE se expresa de manera proporcional al grado de lesión pulmonar tanto en el epitelio pulmonar como en el suero. En estudios de humanos con SIRA, Jabauudon midió de manera simultánea su aclaramiento en lavado bronquial y demostró que los niveles plasmáticos de RAGE se correlacionan directamente con la gravedad de la lesión pulmonar y la disminución del aclaramiento en el fluido alveolar. Este marcador también ha mostrado ser indicador de mal pronóstico en pacientes tratados con ventilación mecánica y volumen de corrientes elevadas.37,38
Finalmente el estudio de los biomarcadores en SIRA ha permitido distinguir dos fenotipos de pacientes, un endotipo hiperinflamatorio y otro grupo hipoinflamatorio. La diferencia entre estos dos grupos incluye diversos biomarcadores como factor de necrosis tumoral FNT, interleucinas, 1, 8, 6, factor activador de plasminógeno, etcétera. Estas diferencias se manifiestan en la evolución clínica y la respuesta al tratamiento, por ejemplo con el uso de PEEP.39
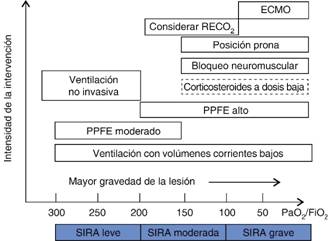
Ventilación mecánica con protección pulmonar, PEEP y técnicas de reclutamiento alveolar. Estudio ARSnet 1990-2000
La ventilación protectora pulmonar (VPP) se utiliza para nombrar las técnicas de ventilación mecánica dirigidas a evitar la progresión del SIRA. Estas técnicas se basan en evitar el colapso, sobredistensión alveolar y barotrauma, por lo que sus principales lineamientos incluyen evitar volúmenes y presiones pulmonares lesivas, así como mejorar el reclutamiento de alvéolos colapsados y mantenerlos abiertos durante todo el ciclo respiratorio.40-42
El estudio ARSDnet comparó los volúmenes corrientes bajos de menos de 7 mL/kg de peso pronosticado para reducir la mortalidad con volúmenes corrientes de 10-15 mL/kg de peso pronosticado en pacientes con SIRA o ALI, a pesar de que la heterogeneidad demostró que los volúmenes corrientes bajos de no más de 7 mL/kg y presiones mesetas menores de 30 cmH2O disminuyeron la mortalidad. Aparte de estas conclusiones, estudios más recientes revelaron que volúmenes corrientes bajos (5-8 mL/kg) pueden reducir el riesgo de lesión pulmonar y muerte, en comparación con volúmenes corrientes altos (9-12 mL/kg) en pacientes que requieren ventilación mecánica, aun cuando no se ha desarrollado SIRA, además con efecto beneficioso protector del desarrollo de infección pulmonar y atelectasias.43
La aplicación de PEEP permite mantener los alvéolos no colapsados abiertos, evitando el cizallamiento de las paredes alveolares y el atelectrauma. También se consideraba que mantener niveles altos de PEEP permitiría el reclutamiento de unidades alveolares colapsadas; no obstante, en la actualidad se ha demostrado que incluso con presiones de PEEP elevadas no se logra vencer la presión de apertura alveolar en las unidades colapsadas y por tanto, el daño es mayor en las unidades alveolares sobredistendidas. Estudios clínicos revelaron que los niveles altos de PEEP no se asocian a disminución de la mortalidad (Cuadro V). Investigaciones más recientes han evidenciado que la titulación de PEEP debe estar basada en la capacidad de reclutamiento, esto es PEEP alta en pacientes con grandes volúmenes pulmonares reclutables y PEEP baja en pacientes con volúmenes menores, a pesar de esto el reclutamiento basado en la mecánica pulmonar no ha mostrado ventaja. Asimismo, en diferentes estudios experimentales en animales se ha demostrado que no existe diferencia en la mortalidad si de manera constante se utilizan niveles de PEEP elevados (> 13 cmH2O) o menores (6-8 cmH2O). El éxito que en un principio se reportó al aplicar las maniobras de reclutamiento dependía de la combinación de PEEP, de la ventilación en control de presión y del tiempo que se aplicaran. En investigaciones subsiguientes se confirmó que las técnicas de reclutamiento requieren aplicación constante para evitar el desreclutamiento y que independientemente de la presión inspiratoria aplicada, la sobredistensión de los alvéolos reclutables es más frecuente y la incidencia de barotrauma es mayor.44-46
Cuadro V: Escala de Murray.
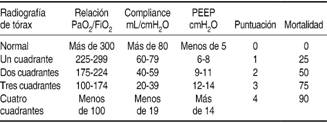
Sin lesión pulmonar = 0 puntos, Lesión pulmonar = 1-2.5 puntos, SIRA = Más de 2.5 puntos. La puntuación de cada variable se debe sumar y dividir entre 4.
Amato y cols. basaron su técnica de reclutamiento en la curva de P-V, en la que monitorizaban los cambios que surgían por la aplicación de presión positiva continua de 40 cmH2O con PEEP de 2 cmH2O por arriba del punto de inflexión superior durante 40 segundos. Su resultado principal fue que detectaron incremento en el índice de oxigenación con respecto al basal después de aplicar las medidas de reclutamiento. Al término de la aplicación de la maniobra y para prevenir el desreclutamiento se mantuvo una PEEP elevada en promedio de 16 cmH2O.47-48
Grasso y cols. emplearon como maniobra de reclutamiento alveolar la presión positiva continua de 40 cmH2O durante 40 segundos. Clasificaron como respondedores a los pacientes que presentaron incremento en el índice de oxigenación de más de 50% posterior a la maniobra. Confirmaron que la respuesta a las técnicas de reclutamiento no dependían completamente de la maniobra en sí, sino de factores como tipo de lesión pulmonar, etapa del SIRA y estabilidad hemodinámica previa (Figura 3).49
Uso controversial de esteroides en SIRA 1990-2000
La justificación teórica de la administración y el posible efecto benéfico de los esteroides es precisamente la capacidad inmunomoduladora que atenúa la respuesta inflamatoria, así como la capacidad de bloquear la síntesis de tejido fibroso cicatrizal. De ahí que se han descrito diferentes protocolos de administración, todos ellos dirigidos a evitar la progresión de la etapa proliferativa a fibrótica.
El primero de ellos basado en la administración de altas dosis por cortos periodos (30 mg/kg/4 dosis) no demostró disminuir la mortalidad significativamente cuando se le comparó con el grupo no tratado o con el grupo al que se le administró dosis bajas, además de que aumentó el riesgo de complicaciones infecciosas y no mejoró los parámetros de ventilación mecánica.50
Otros autores probaron diferentes pautas de tratamiento con esquemas de dosis moderadas y de reducción. Estos esquemas utilizaron metilprednisolona a dosis decrecientes hasta por 30 días, este tratamiento demostró disminución significativa de la mortalidad hospitalaria (12 versus 67%), así como retiro más temprano del ventilador mecánico. Sin embargo, las variaciones subsiguientes de este protocolo de tratamiento evidenciaron reducir los días de soporte ventilatorio mecánico, pero no lograron mostrar disminución en la mortalidad global.51-56
Recientes metaanálisis de todos los estudios en los que se han utilizado esteroides en SIRA, confirman la heterogenicidad, la diversidad de los criterios de inclusión, los errores metodológicos, que no existe beneficio en el uso preventivo, que acorta los días de soporte mecánico ventilatorio, que no aumenta el riesgo de infecciones con dosis moderadas y que presenta discreta disminución de la mortalidad en grupos específicos de pacientes. Por otro lado, la utilización de esteroides en SIRA en pacientes con neumonía por influenza A/H1N1 se asoció a incremento de mortalidad intrahospitalaria (33.7 versus 16.8%), aumento de infecciones dentro de la terapia intensiva (45.58 versus 35.2%), neumonía nosocomial (41 versus 26.4%) y prolongación de los días de ventilación mecánica (17 versus 13%).57,58
Recientes investigaciones en las que se analizó de manera individual el uso prolongado de metiprednisolona y de hidrocortisona administrada de manera temprana, concluyeron que el uso prolongado de metilprednisolona acelera la resolución del SIRA, disminuye la mortalidad hospitalaria, acorta los días de uso de ventilación mecánica y de estancia en terapia intensiva, además de que no aumenta el riesgo de infecciones.59
Estudio genético, proteómico y de genoma extendido 2000-2010
En el SIRA se han descrito patrones genéticos que están ligados a la respuesta inmunológica de las celulas alveolares y su interacción con vías inflamatorias sistémicas. Se han descrito genes expresados en las células alveolares directamente ligados al mecanismo de lesión alveolocapilar (IL-6, acuapurina-1, [AQP-1], inhibidor del activador del plasminógeno-1, [PAI-1], etc.). En particular el gen GADD 45a (gen considerado ontogénico que se expresa después de daño genético y estrés celular) está directamente ligado al daño endotelial, su sobreexpresión acelera la apoptosis celular y actúa de manera negativa en la proliferación de células T y se ha demostrado que facilita el aumento de la permeabilidad de la barrera alveolocapilar.60
Otro de los genes que más se ha estudiado como principal activador del aumento de la permeabilidad de la membrana alveolocapilar es el relacionado con MLCK (Myosin Light Chain Kinase), un componente especial del citoesqueleto celular que a través de la unión a proteínas kinasas y ante estímulos como factores de crecimiento genera señales que modifican las propiedades de permeabilidad de las células endoteliales. Este gen incluye tres isoformas, la isoforma no muscular es componente esencial en el citoesqueleto de diferentes grupos celulares, incluyendo el endotelial. Esta isoforma participa en la función integral del sistema de barrera de la membrana celular, angiogénesis, apoptosis endotelial y en la diapédesis leucocitaria. Estudios recientemente han revelado la asociación del gen de MLCK a la susceptibilidad de desarrollar SIRA en humanos con sepsis, en los que se han encontrado 50 polimorfismos simples. Esta asociación también ha sido confirmada recientemente en pacientes con politrauma que desarrollan SIRA.61-65
Posición en decúbito prono, relajantes neuromusculares 2010-2020
La posición en decúbito se utiliza para mejorar la oxigenación y la capacidad residual funcional pulmonar en pacientes con SIRA grave, aunque inicialmente se utilizaba como medida de rescate en pacientes con hipoxemia refractaria. La mejoría se logra a través de los cambios en la presión hidrostática pulmonar, del flujo sanguíneo pulmonar, del peso del corazón y de la morfología de la pared torácica. La mejoría en la oxigenación se atribuye al incremento del volumen pulmonar y a la redistribución del flujo sanguíneo pulmonar, así como al reclutamiento de las regiones dorsales del parénquima pulmonar con una distribución más homogénea de la ventilación y la perfusión.66
El estudio Prone-Supine II que incluyó 344 pacientes con SIRA aleatorizados para posición prona o supina no mostró diferencias en mortalidad a 28 días y seis meses de seguimiento, pero en la posición prona aumentó la necesidad de sedación, la utilización de relajantes musculares e incrementó las complicaciones como la obstrucción de vía aérea, hipotensión, arritmias, mayor requerimiento de vasopresores y decanulación. Por otro lado en estudios más recientes, la posición prona por 16 horas al día en pacientes con SIRA se asoció a disminución de la mortalidad a 28 días (16 versus 32.8%), 90 días (23.6 versus 41%), con incremento de la tasa de extubación exitosa (80.5 versus 65%) y menos eventos cardiorrespiratorios (6.8 versus 13.5%).67-68
Indudablemente el uso de relajantes neuromusculares es uno de los temas que más controversia ha generado, debido principalmente a que su uso se había limitado hasta casi suspenderse por la fuerte asociación entre la disfunción neuromuscular y la falla del retiro de la ventilación mecánica de uso prolongado. En pacientes con SIRA en particular y según la campaña de sobrevida en sepsis debe revaluarse el uso de relajantes en condiciones clínicas específicas y los efectos deben monitorizarse de manera continua.
Estudios recientes, especialmente con cisatracurio, en infusiones endovenosas continuas por 24 horas revelaron que este fármaco reduce el consumo de oxígeno, mejora y permite el acoplamiento del paciente a la ventilación mecánica, mejora la compliancia pulmonar, disminuye la presión pico y media y reduce el riesgo de barotrauma. Los estudios realizados con cisatracuriuo muestran disminución de la mortalidad a 28 días (31.6 versus 40.7%), reducción del tiempo de ventilación mecánica y de complicaciones relacionadas con la ventilación.69
Oxigenación por membrana extracorpórea y terapia celular 2010-2010
La oxigenación por membrana extracorpórea OMEC (conocida como ECMO por sus siglas en inglés) y la asistencia pulmonar extracorpórea (APEC, ECLA por sus siglas en inglés) se utilizan cada vez con más frecuencia, a pesar de que la mortalidad asociada a su uso es aún muy alta, principalmente en el grupo de pacientes adultos mayores y en quienes su uso es tardío. Los primeros estudios reportados de esta técnica en pacientes con SIRA se realizaron en los años 70; no obstante, se reportó un alto índice de mortalidad, por lo que la técnica fue abandonada.70,71
Hoy en día el uso de OMEC en modo VV (veno-venoso) está indicado sólo como medida de rescate en pacientes con SIRA, hipoxemia profunda e hipercapnia. Pese a ello hasta el momento su uso ha arrojado resultados no concluyentes en la mejoría de la hemodinámica pulmonar y la oxigenación en pacientes con SIRA, debido principalmente a que los estudios que se han realizado han carecido de significancia estadística para evidenciar disminución de mortalidad. En el año 2005 se llevó a cabo el estudio CESAR (Conventional Ventilation or ECMO for Severe Adult Respiratory Failure), en el cual se concluye que la utilización de ECMO disminuye la discapacidad a seis meses y muestra mejoría en la calidad de vida.72-75
La terapia con células madre en estudios preclínicos ha arrojado resultados favorables. Las investigaciones con células madre de origen humano derivadas de la médula ósea han demostrado disminuir la lesión pulmonar aguda en modelos porcinos y murinos de SIRA de origen bacteriano. Los mecanismos implicados incluyen mejoría en la fagocitosis por macrófagos y monocitos, aumento en la secreción de LL-37, un péptido antimicrobiano que facilita la destrucción bacteriana, atenúa la inflamación y acelera la recuperación de la lesión pulmonar, en dosis altas mejora la oxigenación y disminuye el edema pulmonar. Estudios recientes han revelado que estas células secretan microvesículas y mediadores como la lipoxina A4, ambas importantes en la modulación de la respuesta inmunológica ante la acción bacteriana.76-82
La células endoteliales progenitoras son células circulantes que favorecen la reparación endotelial y en modelos de SIRA reducen la lesión pulmonar mediada por lipopolisacáridos. Las células humanas embriogénicas, otro tipo de células en estudio, tienen la capacidad de diferenciarse en células endoteliales progenitoras y han demostrado ser efectivas en disminuir la lesión pulmonar por endotoxina o inducida por bleomicina. Las células pluripotenciales humanas inducidas son generadas por la expresión para transcripción de factores Oct4, Sox2, Klf4 y c-Myc de células somáticas y es posible inducir a su vez células respiratorias funcionales derivadas de ellas. Estudios preclínicos han comprobado que disminuyen la lesión pulmonar provocada por bleomicina.83-85
Conclusiones
El SIRA sigue siendo una entidad con alto índice de mortalidad a pesar de que durante estos 50 años los avances médicos han sido considerables. Sin duda uno de los pilares del tratamiento sigue siendo el uso de la ventilación mecánica. A pesar del desarrollo de nuevos ventiladores mecánicos, secuencias ventilatorias y monitoreo, hasta la fecha no existen patrones, modos o secuencias ventilatorias que, sin vigilancia estrecha, eviten la progresión o las complicaciones graves. No obstante, sí hay estudios clínicos contundentes que confirman que las técnicas de protección pulmonar pueden disminuir la mortalidad. Asimismo, a pesar del avanzado desarrollo en el mapeo genético y el conocimiento de genes directamente involucrados en la lesión pulmonar, la inmunomodulación y los patrones de respuesta inflamatoria, los estudios clínicos dirigidos hacia estos blancos terapéuticos han fallado en demostrar de manera clara la eficacia en disminuir la mortalidad, como el uso de esteroides.











 nova página do texto(beta)
nova página do texto(beta)