Introducción
El síndrome de insuficiencia respiratoria aguda (SIRA) engloba una constelación relativamente uniforme de características clínicas, radiológicas y fisiológicas en pacientes con falla respiratoria de inicio rápido.1,2
A pesar de la comprensión de la fisiopatología desde principios del siglo XIX y de los avances en el manejo médico, la mortalidad se mantiene alrededor de 26 a 44%.3 La incidencia anual de SIRA se estima en aproximadamente 60 por cada 100,000 habitantes y alrededor de 10% de los pacientes en la Unidad de Cuidados Intensivos sufren de falla respiratoria aguda, en quienes los criterios de SIRA o lesión pulmonar aguda cumplen con 20%.3,4 Los pacientes con SIRA por daño pulmonar directo debido a neumonía, contusión pulmonar y aspiración tienen casi el doble de mortalidad en comparación con aquéllos por daño indirecto, los cuales incluyen pacientes quirúrgicos o con trauma.5 En la actualidad existe aún controversia sobre las definiciones de este síndrome debido a sus hallazgos histopatológicos. El objetivo de este trabajo de revisión es dar a conocer los cambios histopatológicos en los pacientes con SIRA y la relación que existe con las clasificaciones clínicas actuales.
El SIRA no es una entidad patológica, sino que representa la vía final común del daño de los pulmones por una amplia variedad de agentes nocivos. Sin embargo, a pesar de la variedad etiológica la respuesta del tejido pulmonar es uniforme. La lesión pulmonar se correlaciona con la fase del daño alveolar más que con la causa específica.6 El SIRA se conoce con varios sinónimos, uno de los que ha destacado es el «daño alveolar difuso», ya que describe los hallazgos histopatológicos de este síndrome.5,6
El examen histológico del tejido pulmonar rara vez proporciona al patólogo un diagnóstico definitivo de la lesión original y la comunicación entre el clínico y el patólogo es de suma importancia en un esfuerzo por discernir la causa probable de esta enfermedad. La interpretación de biopsias o tejido en la autopsia del pulmón se ve obstaculizada por el hecho de que muchos de los eventos clínicos comunes durante el curso del SIRA tales como choque, coagulación intravascular diseminada (CID), sepsis, toxicidad por oxígeno y sobrecarga hídrica producen lesiones pulmonares que se asemejan a la lesión inicial descrita del SIRA.7 Las características patológicas de los pulmones en el SIRA se derivan de lesiones graves en la unidad alvéolo-capilar. El aspecto histológico de este daño es temporal y puede dividirse convenientemente en tres fases relacionadas entre sí y superpuestas que se correlacionan con la evolución clínica de la enfermedad: 1) la fase exudativa de edema y hemorragia; 2) la fase proliferativa de la organización y la reparación; y 3) la fase fibrótica de la etapa final de fibrosis. Las características patológicas del daño alveolar difuso (DAD) se correlacionan más con el tiempo que con el disparador (Cuadro I).8-10
Fase exudativa
La fase exudativa corresponde a la primera semana posterior a la aparición de la insuficiencia respiratoria.8 Los pulmones de los pacientes que mueren dentro de este periodo, se vuelven rígidos, de un color rojo oscuro-azul, con un peso total que excede 2,000 gramos. La superficie del parénquima pulmonar se torna hemorrágica, con una consistencia firme y a diferencia del edema pulmonar cardiogénico no presenta exudado.9,11,12
En una exploración minuciosa los espacios aéreos son menores de 1 mm de diámetro, lo que se ve representado por conductos alveolares dilatados con acentuación por el parénquima adyacente, el cual se encuentra indurado.13
Las características histológicas distintivas de la fase exudativa son, no obstante, membranas hialinas densas, eosinofílicas que por lo general son más prominentes a lo largo del conducto alveolar al que se adhieren en la punta de los septos alveolares y a menudo aparecen para sellar la apertura de los alvéolos adyacentes.10,14
Las membranas hialinas se componen de proteínas plasmáticas condensadas que después de una lesión en la barrera epitelio-endotelial se han filtrado en el espacio alveolar y mezclado con restos celulares.15 La presencia de volumen alveolar reducido se considera una complicación secundaria, posiblemente atribuible a alteraciones de la tensión superficial.12,16
En la fase exudativa del DAD hay pruebas ultraestructurales de daño endotelial como la inflamación de las células, la ampliación de las uniones endoteliales y el aumento en el número de vesículas pinocíticas. Las características inconstantes de lesión endotelial severa incluyen necrosis celular e interrupción, con denudación de la membrana basal de los capilares y la acumulación de fibrina intravascular. Los agregados intracapilares de los neutrófilos son focalmente prominentes, en especial en el DAD secundario a sepsis o trauma.17,18
Por lo regular un reducido número de neutrófilos están presentes en el espacio alveolar, pero cuando el alvéolo contiene masas compactas de neutrófilos, la neumonía bacteriana también es un diagnóstico posible. Los septos alveolares se amplían en gran medida por el edema intersticial, fibrina y eritrocitos extravasados.19 Con frecuencia el grado de edema intersticial es desproporcionadamente grave en comparación con los cambios ultraestructurales en una capa de células endoteliales en general «intacta»,20 aunque los cambios morfológicos sutiles en las células endoteliales pueden ocultar una pérdida funcional significativa de la integridad del endotelio o la capacidad de reparación extraordinaria de las células endoteliales, la cual podría hacer difícil rastrear las lesiones de tipo transitorio.21
En contraste con los cambios endoteliales irregulares y a menudo no significativos, el epitelio alveolar por lo general muestra extensa necrosis de las células de tipo 1 que se desprenden de la superficie alveolar, dejando una membrana basal denudada a la que se adhieren membranas hialinas gruesas, fibrina y restos celulares.22
Las células de tipo 2 también pueden sufrir lesiones y necrosis, pero por lo regular se ha demostrado que las células de tipo 1 son más susceptibles a las lesiones.23 Con la pérdida de la barrera epitelial alveolar el fluido intersticial puede escapar libremente en el espacio alveolar (Figura 1).17
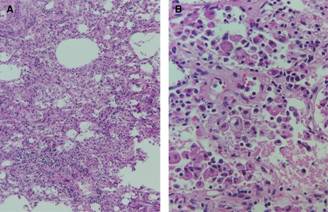
Figura 1: A. Imagen en la que se observan focos neumónicos adyacentes a la afección de las paredes alveolares que se caracterizan por infiltrado inflamatorio intenso (10x). B. En esta imagen se observa engrosamiento de las paredes alveolares con hiperplasia de neumocitos tipo 2. (40x). Imagen otorgada por: El Dr. Juan José Navarrete-Pérez. Servicio de Patología. Hospital General de México «Dr. Eduardo Liceaga».
Fase proliferativa
La fase proliferativa de DAD es la etapa de organización del exudado intraalveolar e intersticial adquirida en la fase aguda.24 Las células de tipo 2 comienzan a proliferar a lo largo de los septos alveolares tres días después de la aparición de SIRA clínico y la fibrosis es evidente antes del día 10. Esta conversión como etapa final es un factor limitante decisivo para la supervivencia en el síndrome de dificultad respiratoria aguda (SDRA).14,25
Entre la primera y la tercera semana posteriores a la lesión, la superficie del parénquima pulmonar es gris, macroscópicamente sólida, presenta palidez difusa y brillante, con una textura resbaladiza atribuible a la gran cantidad de tejido conectivo recién formado.15 Espacios de aire pequeños (< 1 mm de diámetro) se acentúan en algunas zonas, mientras que los espacios de aire están totalmente borrados en otras regiones. Histológica y ultraestructuralmente la regeneración de las células epiteliales anuncia el comienzo de la fase proliferativa, como filas de células cúbicas queratina cojinete se extienden a lo largo de la pared alveolar en un esfuerzo por cubrir la membrana basal previamente denudada.26 Muchas de estas células tienen cuerpos lamelares citoplasmáticos y microvellosidades en la superficie que pueden teñirse inmunohistoquímicamente de apoproteína tensioactiva, la cual es indicativa de la diferenciación celular de tipo 2 (Figura 2).27

Figura 2: Servicio de Patología. Hospital General de México. «Dr. Eduardo Liceaga». A. Se observa ruptura de las paredes alveolares e infiltrado inflamatorio adyacente. B. Se observa engrosamiento de las paredes alveolares con aumento de los espacios aéreos (enfisema). Imagen otorgada por: El Dr. Juan José Navarrete-Pérez.
Fase fibrótica
En los pacientes dependientes del ventilador que sobreviven más de tres o cuatro semanas desde el inicio del SDRA, el pulmón está completamente remodelado por tejido de colágeno de baja densidad celular. Macroscópicamente la superficie pleural muestra un aumento en su grosor y una apariencia de adoquines. La superficie del parénquima al corte es pálida y esponjosa y sustituye áreas microquísticas de espacios de aire de 1 a 2 mm de diámetro y zonas irregulares de cicatrización difusa alterna. La transformación del parénquima pulmonar en grandes quistes contiguos que refiere a displasia broncopulmonar aguda, es extremadamente rara. Los abscesos cicatrizados y el enfisema pulmonar intersticial crónico son causas adicionales de grandes espacios como quistes crónicos en el SDRA. Los bronquios periféricos aparecen dilatados y se encuentran anormalmente cerca de la superficie de la pleura visceral (bronquiectasia por tracción) (Figura 3).26,27

Figura 3: A. Se muestra aumento en el número de neumocitos tipo 2 con descamación de los mismos, los cuales ocupan los espacios alveolares. B. En esta imagen se observa la etapa avanzada de la enfermedad, en la que se encuentra el estroma con proliferación fibroblástica con depósito de tejido fibroconectivo, además de inflamación crónica. (40x). Imagen otorgada por: El Dr. Juan José Navarrete-Pérez. Servicio de Patología. Hospital General de México «Dr. Eduardo Liceaga».
Daño alveolar difuso (DAD) y síndrome de dificultad respiratoria aguda
Thille28 concluyó en 2013 que la definición de Berlín del diagnóstico clínico de SIRA mostró alta sensibilidad y baja especificidad del diagnóstico de DAD, debido a que este hallazgo se observó en menos de la mitad de los pacientes con criterios clínicos de SIRA con alta prevalencia (69%) en pacientes con SIRA grave que cumplieron con los criterios clínicos de éste durante más de 72 horas.28
Cabe señalar que los criterios del diagnóstico de DAD incluyen la presencia de membranas hialinas más por lo menos uno de los siguientes hallazgos histológicos: a) edema intraalveolar; b) proliferación de células de tipo II alveolar que cubren la membrana alveolocapilar denudada; c) proliferación intersticial de fibroblastos y miofibroblastos; d) organización de fibrosis intersticial.29
DAD se considera el sello histopatológico de SDRA,30 pero la especificidad está inevitablemente alterada por muchas otras enfermedades que se asemejan al cuadro clínico de SDRA, mas no están asociadas a la misma histopatología como en el caso de neumonía bacteriana o viral, neumonía intersticial difusa, infarto pulmonar o hemorragia, linfangitis o infiltración secundaria a cáncer.
Los hallazgos patológicos distintos a DAD en pacientes con SIRA se describen en el Cuadro II. Se ha sugerido que la identificación de poblaciones homogéneas de pacientes dentro del diagnóstico clínico de SIRA puede tener implicaciones en el diseño de ensayos clínicos y en la detección de biomarcadores de diagnóstico y pronóstico. Se desconoce si la presencia de DAD en el examen histológico define un subgrupo específico de pacientes con SIRA.31
Cuadro II: Hallazgos patológicos distintos a daño alveolar difuso (DAD) en pacientes con síndrome de insuficiencia respiratoria aguda (SIRA).

Se detectó alto grado de neumonía en la mitad de los pacientes que cumplían los criterios clínicos de SDRA sin DAD. Sin embargo, es importante señalar que aunque no hay criterios clínicos que permitan la diferenciación de los dos diagnósticos, un análisis microscópico adecuado de los pulmones puede diferenciar fácilmente la neumonía, que se caracteriza por una intensa infiltración neutrofílica en los espacios intraalveolares de SDRA con lesiones típicas de membranas hialinas.30
Hay que destacar que no todos los expertos que participaron en el desarrollo de la definición de Berlín estaban completamente de acuerdo en que DAD es la única correlación patológica de SDRA, pues algunas consideradas como neumonías eran compatibles con SDRA cuando se conocían los criterios clínicos.31 Según Thille y cols. (2013)28 DAD o neumonía estuvieron presentes en 74% de los pacientes con criterios clínicos de SDRA, los cuales se incrementaron hasta en 88% en quienes se consideraban con SDRA grave.
Se identificaron algunos pacientes que cumplieron con los criterios clínicos de SDRA sin ningún tipo de lesión pulmonar en el examen de autopsia. En este caso no es posible pasar por alto que las opacidades en la radiografía de tórax fueron atelectasias. Debido a ello, es necesario solicitar el inflado de los pulmones a alta presión antes de un examen microscópico para realizar la reexpansión de las áreas colapsadas, lo que permite mostrar que la existencia de una variabilidad interobservador significativa en el análisis de las radiografías de tórax15,32 puede conducir a la interpretación de falsos positivos de opacidades bilaterales, especialmente en pacientes con obesidad y grandes derrames pleurales.32
Thille y cols.28 también demostraron en 2013 que los pacientes con SDRA grave tenían menor distensibilidad pulmonar y que los pulmones eran más pesados en la autopsia que los pacientes con SDRA moderada y leve. Por otra parte la presencia de DAD se correlacionó significativamente con la gravedad de los criterios clínicos de SDRA, a mayor gravedad mayor presencia de DAD. El origen de SDRA no influyó en la tasa de ocurrencia de DAD que se presentó en 49% de los pacientes con SDRA pulmonar y en 42% de los pacientes con SDRA extrapulmonar.27,28
Un dato importante que hay que resaltar del estudio de Thille y cols. en 201328 es que éste se desarrolló durante dos décadas, señalando que durante la segunda década que corresponde de 2001 a 2010 los pacientes con algún factor de riesgo de SDRA fueron ventilados con volúmenes tidales más bajos y una frecuencia respiratoria más alta que durante la primera década de 1991 a 2000. En el momento de la muerte, los pacientes durante la primera década tenían lesión pulmonar de mayor gravedad que los pacientes de la segunda década, lo cual se concluyó por una menor proporción PaO2 / FiO2, un pico de presión de la vía aérea superior y una distensibilidad dinámica del sistema respiratorio menor. Entre los pacientes con algún factor de riesgo de SDRA, la proporción de pacientes con criterios clínicos de SDRA o DAD en la autopsia fue mayor durante la primera década que durante la segunda.
La ventaja de analizar autopsias durante dos décadas28,29 es que se abarca tanto la fase de mayor volumen corriente y de menor volumen tidal de ventilación. Con la mejora de la supervivencia que acompaña la reducción en la lesión pulmonar asociada al ventilador se esperaría que los cambios fibróticos fueran menos comunes en la fase bajo volumen corriente. Sorprendentemente, la fibrosis fue más frecuente en los pacientes sometidos a autopsia entre 2000 y 2010 que en la década anterior.32 Lo que podría explicarse de la siguiente manera: primero, la cantidad de pacientes con cambios fibróticos era reducida y el estudio probablemente fue insuficiente para examinar esta cuestión. Segundo, en la fase de bajo volumen corriente, mejores maniobras de apoyo podrían favorecer una supervivencia prolongada en algunos pacientes con lesión pulmonar más grave, lo que permitiría más tiempo para desarrollar cambios fibróticos y ser detectados en la autopsia.15,32
Para finalizar, ya que los únicos parámetros del ventilador disponibles en el estudio fueron a partir del momento de la muerte, no hay manera de saber hasta qué punto estaba realmente en uso alguna estrategia de protección del ventilador. En una serie de autopsias similares reportadas por los mismos autores,15,32 la evidencia histológica de DAD fue menos frecuente en la fase de volumen corriente bajo en todos los pacientes con SDRA clínico, lo que sugiere que la reducción del volumen corriente ha tenido cierto efecto en los hallazgos histopatológicos en el SDRA.33,34
Síndrome de dificultad respiratoria aguda
El síndrome de dificultad respiratoria aguda (SDRA) fue descrito por primera vez en 1967 por Ashbaugh et al.35 En 1994 la Conferencia Internacional de Consenso Americano-Europeo (AECC) sentó las bases para la definición de SDRA bajo los siguientes criterios clínicos:36 aparición reciente de síntomas después de un factor de riesgo conocido, hipoxemia grave definida por una relación PaO2/FiO2 inferior a 200 mmHg, infiltrados bilaterales en la radiografía de tórax y la ausencia de edema pulmonar de origen cardiogénico. Esta definición ha sido criticada debido a sus múltiples limitaciones.37,38 De hecho, la naturaleza aguda de los síntomas no se ha especificado, el nivel de presión positiva al final de la espiración (PEEP) no se tuvo en cuenta en los criterios de oxigenación y el edema pulmonar cardiogénico se definió como un aumento en la presión de enclavamiento de la arteria pulmonar, mientras que estudios recientes revelaron que altas presiones podrían coexistir con SDRA.38 El factor desencadenante de SDRA puede ser una enfermedad pulmonar (lesión directa) como la neumonía, aspiración o trauma en tórax o una enfermedad extrapulmonar (lesión indirecta) tal como la pancreatitis hemorrágica y/o shock séptico.35,36
Recientemente se han revisado y modificado los criterios diagnósticos clínicos de SDRA en la llamada definición Berlín.39-41 La definición de Berlín se ha establecido para clasificar a los pacientes según la gravedad de la enfermedad.8,42 El SDRA se clasificó en función de oxigenación como leve, moderada o grave si PaO2/FiO2 fue respectivamente entre 201 y 300 mmHg, 101 y 200 mmHg, o 100 mmHg o menos, con un nivel de PEEP mínima de 5 cm H2O. Los criterios de oxigenación se correlacionan bien con la gravedad, con una mortalidad respectiva de 27, 32 y 45% en el SDRA leve, moderado y grave.39 Cualquiera que sea el origen del SDRA, el daño alveolar difuso que consiste en cambios tales como la presencia de membranas hialinas, edema intersticial, necrosis celular y la proliferación o fibrosis, es el sello histológico de SDRA como lo describió Katzenstein en 1976.8 Desde entonces se ha asumido que estos cambios generalmente evolucionan con el tiempo en fases bien definidas (exudativa, proliferativa y fibrosis) clasificadas por los cambios histológicos específicos.40,41,43 No obstante, otras enfermedades clínicamente semejantes a SIRA no están asociadas a las características histológicas típicas de DAD.8
Estos cambios histopatológicos secuenciales propuestos pueden superponerse y la fibrosis puede ocurrir a partir del décimo día, mientras que la fase proliferativa se desvanece y puede llegar a su pico máximo con un aspecto crónico después de dos o tres semanas de evolución.40 La descripción de las diferentes etapas histológicas se basó en observaciones que se realizaron previo al desarrollo de la primera definición clínica de SIRA.40 La dependencia del tiempo de los cambios histológicos no fue validada en pacientes que cumplían los criterios clínicos del diagnóstico de SDRA. La identificación precisa de la cronología de la aparición de lesiones histológicas y sobre todo el tiempo de aparición de la fase proliferativa y la fibrosis en el trastorno es clínicamente relevante, ya que podría influir en la efectividad de los tratamientos. Por ejemplo, la terapia con esteroides podría ser eficaz sólo en el estadio temprano de la enfermedad mediante la atenuación de la inflamación durante la fase exudativa,43 mientras que podría ser ineficaz cuando la fibrosis ya está presente.44 Además, el potencial de reclutamiento alveolar inducido por la presión positiva al final de la espiración (PEEP) podría ser menor en la etapa tardía del SDRA cuando la presencia de fibrosis pulmonar ocasiona la consolidación y la rigidez de pulmón.41,43
El estudio de cohorte prospectivo de Thille y cols. en 2013 sobre la cronología de las lesiones histológicas en SIRA demostró que en una gran población de pacientes que cumplían los criterios clínicos de SDRA había daño alveolar difuso en el examen de autopsia, los hallazgos histológicos guardan una estrecha correlación con la duración de la evolución del SDRA. Aunque los cambios exudativos fueron predominantes durante la primera semana (90% de los pacientes), se produjeron cambios proliferativos tempranos en el curso del SDRA y se observaron en 54% de los pacientes con SDRA de menos de una semana de evolución. Después de tres semanas, sólo 17% de los pacientes presentaban cambios de tipo exudativo, mientras que no se observaron cambios proliferativos en todos los pacientes. Es raro que la fibrosis se detecte en la primera semana (4% de los pacientes), en tanto que en 61% de los pacientes se observó después de tres semanas de evolución. La fibrosis fue más frecuente en el SDRA de origen pulmonar que en el SDRA de origen extrapulmonar, 51% (19 de 37) frente a 20% (8 de 40) después de una semana de evolución (p = 0.0047). De acuerdo con estudios previos41,43,44 se observó una fase exudativa en casi todos los pacientes durante la primera semana de evolución. Sin embargo, se produjeron cambios proliferativos tempranos en el curso del SDRA y se detectaron en más de la mitad de los pacientes durante la primera semana.44











 nueva página del texto (beta)
nueva página del texto (beta)