Introducción
La administración de líquidos es una de las maniobras terapéuticas más frecuentes en los pacientes críticamente enfermos. El aporte de líquidos es mayor en las primeras horas de estancia en la Unidad de Cuidados Intensivos (UCI). Debe tenerse en cuenta que los líquidos son fármacos y que por lo tanto tienen indicaciones, contraindicaciones y efectos adversos.1 En Estados Unidos la solución salina al 0.9% (SS0.9%) es el líquido que más se emplea en la reanimación de los pacientes con choque séptico. Una de las consecuencias de la administración de grandes cantidades de solución salina al 9% es la alteración en la concentración del cloro y sodio a nivel plasmático, además de las alteraciones del equilibrio ácido-base.2 No hay duda de la asociación entre el tipo de líquido utilizado y el mal pronóstico en el paciente críticamente enfermo, pero no se le ha dado suficiente importancia. Las consecuencias de la reanimación con líquidos por lo general se han minimizado y aceptado como un «mal necesario», siendo su origen, en la mayoría de los casos, iatrogénico.
Al hablar del aporte de líquidos siempre existirán interrogantes que el médico se plantea cotidianamente: ¿qué líquido utilizar?, ¿cuánto líquido administrar? y ¿en cuánto tiempo? Los líquidos se clasifican en cristaloides y coloides. Los cristaloides pueden ser hipotónicos, isotónicos o hipertónicos. Los coloides son partículas de alto peso molecular, se dividen a su vez en sintéticos (gelatinas, almidones y dextranos) y naturales (albúmina).3 Parece que la controversia sobre el uso de coloides o cristaloides en pacientes críticamente enfermos, en especial sépticos, pierde fuerza sobre todo en publicaciones recientes. Sin embargo, el campo de batalla sólo ha cambiado de lugar y la discusión sobre cuál es la mejor solución cristaloide parece ahora estar en boga. La discusión se centra en particular en el uso y los posibles efectos secundarios de las soluciones ricas en cloro frente a las llamadas «soluciones balanceadas» (SB).4
En tiempos recientes se le ha prestado amplia atención a las SB, las cuales tienen una cantidad de electrolitos más parecida al plasma humano que otro tipo de soluciones (Cuadro I). La característica más importante de estas soluciones es su diferencia de iones fuertes (DIF) positiva debido a la menor cantidad de aniones de cloro. Las SB se caracterizan por su capacidad de evitar el desarrollo de acidosis metabólica hiperclorémica y anormalidades electrolíticas. En definitiva, una SB se define como «líquido con una concentración baja en cloro o más específicamente, una concentración de cloro que es inferior a su concentración de sodio». Las alteraciones del cloro habían sido menos estudiadas respecto a otros electrolitos, aunque en la actualidad se sabe que el cloro desempeña un papel predominante en las alteraciones ácido-base. La hipercloremia se asocia a la lesión renal aguda, incluso al incremento de mortalidad en pacientes críticamente enfermos, por lo que el cloro se ha convertido en el «nuevo villano».5 A través de esta revisión se evaluarán aspectos fisiopatológicos y la evidencia actual respecto del uso de SB en pacientes críticamente enfermos.
Cuadro I: Tipos de soluciones.
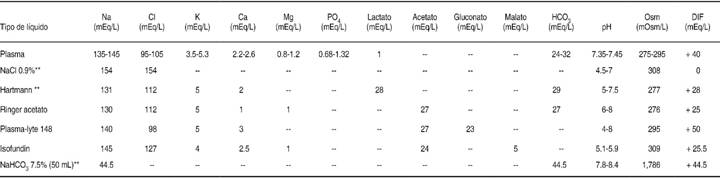
Na+ = Sodio, Cl- = Cloro, K+ = Potasio, Ca++ = Calcio, Mg+ = Magnesio, PO4 = Fosfato, HCO3 - = Bicarbonato, mEq/L = Miliequivalentes/litro, mOm/L = Miliosmoles/litro, NaCl 0.9% = Cloruro de sodio al 0.9%, pH = Potencial de hidrogeniones, NaHCO3 - = Bicarbonato de sodio, Disponible en México = **
Objetivos
Conocer aspectos fisiopatológicos y la evidencia actual respecto al uso de soluciones balanceadas en los pacientes críticamente enfermos. Resaltar los efectos deletéreos de la hipercloremia y su asociación al mal pronóstico.
Métodos
Se realizó una revisión no sistemática a través de las bases electrónicas: PubMed, OvidSP y ScienceDirect. En la búsqueda avanzada se emplearon los términos balanced solutions, fluid balanced, balanced salt solutions incluidos en el título, resumen o palabras clave hasta diciembre de 2016. Los artículos se clasificaron de acuerdo con la relevancia de los autores, posteriormente se hizo una revisión minuciosa de la fisiología, fisiopatología, enfoque clínico, diagnóstico, pronóstico y manejo.
Aspectos fisiopatológicos
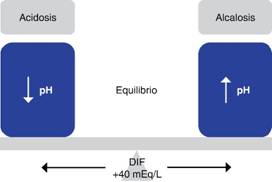
Para comprender cómo funcionan las SB debe saberse que la ecuación de Henderson-Hasselbalch no considera todos los factores que influyen en las alteraciones ácido-base y que los cambios en el pH según el modelo de Stewart dependen de la presión parcial de dióxido de carbono (PCO2), de la concentración total de ácidos débiles no volátiles (ATOT) y de la diferencia de iones fuertes (DIF).6 La PCO2 es la presión ejercida por el CO2 en la sangre arterial, los ATOT corresponden a la albúmina, fosfatos inorgánicos y la DIF depende de cargas positivas y de cargas negativas disueltas en el plasma (agua). Los iones más importantes son el sodio, el potasio, el calcio, el magnesio y el cloro. La DIF es positiva (40 mEq/L) debido al mayor número de cationes. El aumento de la DIF incrementará el pH y la disminución de la DIF hará que descienda (Figura 1).
El componente metabólico de las alteraciones del equilibrio ácido-base según el modelo de Stewart se determina a través de la DIF aparente (cationes menos aniones disueltos en agua) y por la DIF efectiva (ácidos débiles no volátiles y fosfatos). El gap de iones fuertes (GIF = 0 mEq/L) que se obtiene restando la diferencia de iones fuertes aparente (DIFa= +40 mEq/L), la diferencia de iones fuertes efectiva (DIFe= -40 mEq/L) representa los iones no medidos (cetoácidos, sulfatos, uratos, citrato, piruvato, acetato, gluconato). El modelo de Stewart considera el HCO3 - una variable dependiente cuyos valores están determinados exclusivamente por tres variables independientes (PCO2, ATOT, DIF). Las variaciones en la PCO2 determinarán el componente respiratorio7,8 (Figura 2).
El exceso de base (EB) es una variable que complementa la ecuación de Henderson-Hasselbalch, se utiliza para identificar acidosis metabólica y los cambios en ésta pueden correlacionarse con el modelo de Stewart. Un EB negativo se relaciona con disminución de la DIFa, la DIFe más negativa y GIF negativo, un EB positivo se relaciona con incremento de la DIFa, DIFe menos negativa y GIF positivo. La acidosis orgánica (iones no medidos) no modifica la DIFa, pero ésta disminuye en la acidosis hiperclorémica, la DIFe disminuye en los dos tipos de acidosis metabólica. El GIF es igual a cero (± 2 mEq/L) en la acidosis metabólica hiperclorémica, pero se vuelve negativo en la acidosis orgánica. Otro complemento de la ecuación de Henderson-Hasselbalch es la brecha aniónica (BA) que puede evaluarse o subrogarse a través del GIF. Una DIFe más negativa se relaciona con acidosis metabólica, puede acompañarse de GIF negativo (iones no medidos) o GIF de cero (acidosis hiperclorémica)8,9 (Cuadro II).
Cuadro II: Correlación del modelo de Stewart con el exceso de base y brecha aniónica.
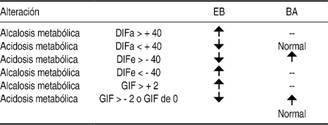
DIFa = Diferencia de iones fuertes aparente, DIFe = Diferencia de iones fuertes efectiva, GIF = Gap de iones fuertes, EB = Exceso de base, BA = Brecha aniónica.
La acidosis hiperclorémica no sólo depende de la concentración de cloro, la concentración de sodio también es importante (electroneutralidad), la diferencia entre cationes y aniones es responsable de los cambios en el pH. La acidosis metabólica puede mostrarse con cifras normales de cloro que se acompañan de hiponatremia y a su vez, en presencia de hipercloremia con hipernatremia proporcional, puede no causar acidosis metabólica. La diferencia sodio-cloro (Na+-Cl-) y el índice cloro/sodio (Cl-/Na+) pueden valorar magnitud de la hipercloremia en las alteraciones ácido-base. Acorde al modelo de Stewart la acidosis metabólica con disminución de la diferencia Na+- Cl- o incremento del índice Cl-/Na+ su principal componente sería la hipercloremia.8,9 Entonces según el modelo de Stewart las alteraciones del equilibrio ácido-base serían principalmente seis:10
Acidosis por el incremento de la PCO2.
Acidosis por disminución de la DIF: hipercloremia, hiponatremia, incremento del agua libre.
Acidosis por incremento de los ATOT: hiperfosfatemia, hiperalbuminemia.
Alcalosis por disminución de la PCO2.
Alcalosis por incremento de la DIF: hipocloremia, hipernatremia, disminución del agua libre.
Alcalosis por disminución de los ATOT: hipofosfatemia, hipoalbuminemia.
Discusión
El cloro es el electrolito con mayor concentración en el plasma humano sólo después del sodio y su importancia en el paciente críticamente enfermo ha sido tema de debate reciente. Van Regenmortel y cols. demostraron a través de una cohorte retrospectiva en una UCI polivalente la asociación entre la hipercloremia severa (> 110 mmol/L) y la mortalidad a 30 días con un OR de 1.81 (IC95%; 1.32-2.50) y un valor de p ≤ 0.001, concluyendo así la relación de la administración de soluciones ricas en cloro y sus efectos deletéreos en la condición clínica del paciente críticamente enfermo.11
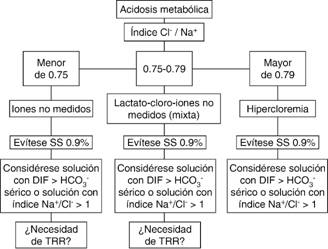
A través del principio de electroneutralidad (relación entre sodio y cloro) el modelo de Stewart permite evaluar el papel de la hipercloremia en la acidosis metabólica. La DIFa es una de las tres determinantes de los cambios en el pH y disminuye cuando existe hipercloremia sin un incremento proporcional del sodio. El objetivo de las SB es prevenir la acidosis metabólica, la hipercloremia y su impacto en los pacientes críticamente enfermos. El HCO3 - sérico del paciente podría determinar qué tipo de solución utilizar con respecto a su DIF, por ejemplo si la DIF de la solución es mayor que el HCO3 - sérico el pH aumentará, si la DIF de la solución es menor que el HCO3 - sérico el pH disminuirá y por último, si la DIF de la solución es igual al HCO3 - sérico el pH no se modificará.11,12 El índice Na+/Cl- podría ser otra opción en la toma de decisiones respecto a qué tipo de líquido emplear tomando en cuenta que el índice Na+/Cl- normal en la sangre es de 1.4 y que soluciones con índice Na+/Cl- igual o menor a 1 tienden a causar acidosis hiperclorémica.13
Los efectos adversos pueden ser resultado de la hipercloremia (índice Cl-/Na+ > 0.79 o relación Na+-Cl- < 31 mEq/L) per se, de la acidosis metabólica o de ambas y definitivamente están asociados a la cantidad y al tipo de líquido administrado, por lo que una adecuada reanimación debe ser una «maniobra correcta en el momento apropiado» y con el «líquido adecuado». Una misma acción puede ayudar o perjudicar dependiendo del tipo de solución y del momento en que se utilice.14-16 La reanimación intravenosa con líquidos con alto contenido de cloro es un factor de riesgo de desarrollar lesión renal aguda (RR 1.64; IC95%; 1.27 a 2.13; p < 0.001), acidosis metabólica hiperclorémica (RR 2.87; IC95%; 1.95 a 4.21; p < 0.001) y muerte, los cambios en el cloro sérico > 10 mEq/L respecto al basal incrementan el riesgo de muerte de manera independiente.17,18
Las SB están lejos de ser el líquido ideal: «es aquél que produce aumento predecible y sostenido del volumen intravascular, su composición es la más próxima al líquido extracelular, se metaboliza y excreta completamente sin acumulación en los tejidos, no produce efectos adversos metabólicos o sistémicos, es económico y mejora la evolución de los pacientes».1 Aun así las SB han demostrado beneficios en diferentes poblaciones de pacientes críticamente enfermos.
Roquilly y cols. evaluaron la incidencia de acidosis hiperclorémica (objetivo primario) en 40 pacientes con traumatismo craneoencefálico grave (escala de coma de Glasgow < 8 puntos) o hemorragia subaracnoidea (World Federation of Neurosurgical Society Grade 3) después del uso de soluciones balanceadas versus soluciones no balanceadas 48 horas posteriores a su ingreso. La acidosis hiperclorémica apareció en 95% de los pacientes del grupo de soluciones no balanceadas y en 65% en el grupo de soluciones balanceadas (HR 0.28; IC95% 0.11 a 0.70; p = 0.006). En la hipertensión intracraneal y en la mortalidad no hubo diferencias estadísticamente significativas.19 Por otra parte Lehmann y cols. emplearon soluciones no balanceadas versus soluciones balanceadas en 36 pacientes con hemorragia subaracnoidea por 48 horas posteriores al evento agudo. Hubo menor incidencia de acidosis hiperclorémica en el grupo de soluciones balanceadas sin hiponatremia o hipoosmolaridad, situaciones asociadas a mal pronóstico en este tipo de pacientes.20 Las SB (Plasma Lyte 148 e Isofundin) se presentan como una opción en los pacientes neurocríticos, ya que hasta hoy no se ha documentado incremento de la presión intracraneal, hiponatremia o aumento de la mortalidad condicionadas por su uso. La utilidad del Ringer Lactato es controversial en estos pacientes por su osmolaridad (277 mOsm/L), aunque sus efectos secundarios (hiponatremia, hipoosmolaridad sérica e incremento de la presión intracraneal) podrían estar relacionados con el tiempo y la cantidad infundida.21 Se ha reportado incremento de la mortalidad asociado al uso de Ringer Lactato en pacientes con trauma craneoencefálico grave en el medio prehospitalario (PROMMTT STUDY).22
Un reciente metaanálisis concluye que el uso de soluciones balanceadas se asocia a disminución de la mortalidad en pacientes con sepsis y choque séptico en comparación con el empleo de soluciones no balanceadas.23 Raghunatan y cols. documentaron en una cohorte retrospectiva que incluyó 53,448 pacientes sépticos que en los pacientes en quienes se emplearon soluciones balanceadas mostraron menor mortalidad hospitalaria (19.6% versus 22.8%; RR 0.86; IC95% 0.78-0.94, p = 0.001) respecto al grupo de solución salina isotónica, independientemente de la cantidad de líquido administrado. No hubo diferencias en la prevalencia de lesión renal aguda, estancia hospitalaria o estancia en terapia intensiva.24 Un ensayo clínico de Yunos y cols. demostró disminución de la lesión renal aguda y de la práctica de terapia de reemplazo renal en pacientes críticamente enfermos con una estrategia de restricción de cloro.25 El reto de líquidos sigue siendo la piedra angular de la reanimación hemodinámica en sepsis y choque séptico. Los beneficios de las SB asociados al uso de menores cantidades de cloro y sodio son claros. No se ha documentado en estudios clínicos la posibilidad teórica de menor aclaramiento de lactato en esta población de pacientes ni su impacto en la evolución clínica.
En los pacientes con trauma mayor los niveles de cloro se incrementan después de la reanimación con líquidos, lo cual se asocia a malos resultados. Un ensayo clínico aleatorizado, doble ciego y de grupos paralelos realizado en pacientes con trauma mayor comparó el empleo de SS0.9% versus Plasma-Lyte en la reanimación con líquidos en las primeras 24 horas posteriores a la lesión. Hubo diferencia significativa con Plasma-Lyte versus SS0.9% en el exceso de base (7.5 ± 4.7 versus 4.4 ± 3.9 mmol/L), el pH arterial (7.41 ± 0.06 versus 7.37 ± 0.07) y cloro sérico (104 ± 4 versus 111 ± 8) respectivamente. En la cantidad de líquido administrado, el gasto urinario y la mortalidad no hubo diferencias significativas.26 Un estudio reciente que incluyó 266 pacientes con trauma mayor que sobrevivieron más de 48 horas posteriores al ingreso, documentó que la incidencia de hipercloremia y el delta del cloro a las 48 horas (cloro a las 48 horas-cloro inicial) fueron factores de riesgo independientes de mortalidad a los 30 días y que los pacientes que recibieron SS0.9% tenían más probabilidad de sufrir complicaciones postoperatorias, lesión renal aguda e infecciones.27 La reanimación hemodinámica del choque hemorrágico no controlado con SS0.9% se asocia a mayor producción de orina, acidosis hiperclorémica y coagulopatía dilucional en comparación con ringer lactato. El incremento del nivel de lactato asociado al uso de solución Hartmann no condicionó acidosis metabólica.28
El impacto de la hipercloremia postoperatoria se evaluó en 22,851 pacientes quirúrgicos (cirugía no cardiaca) con cloro sérico y función renal normales previos a la cirugía. La incidencia de hipercloremia postoperatoria fue de 22% y se asoció al incremento de riesgo de muerte a 30 días (OR1.58, IC95% 1.25-1.98), más días de estancia hospitalaria (7 versus 6.3 días en el grupo de hipercloremia versus no hipercloremia respectivamente) y mayor probabilidad de lesión renal aguda.29 Una cohorte retrospectiva que incluyó 2,350 pacientes operados de cirugía cardiaca que ingresaron a la UCI, documentó que la hipercloremia (cloro sérico > 110 mmol/L) es un factor independiente de riesgo de mortalidad (OR1.81. IC95% 1.32-2.50; p = 0.001).11 Mayor mortalidad (SS0.9% 12%, SB: 5.9%, ambas: 10.8%, p = 0.018) e incremento de la necesidad de ventilación mecánica (SS0.9%: 27.9%, SB: 7.5%, ambas: 38.0%, p = 0.001) son las conclusiones de una revisión retrospectiva en pacientes de cirugía vascular que comparó el uso de soluciones no balanceadas versus soluciones balanceadas o ambas durante el perioperatorio.30 Un meta-ánalisis reciente evaluó la asociación entre reanimación con líquidos intravenosos con alto contenido de cloro y resultados perioperatorios documentando una asociación débil pero significativa entre líquidos con mayor contenido de cloro y resultados desfavorables (mayor incidencia de acidosis metabólica hiperclorémica, más volumen de transfusión sanguínea, más tiempo de ventilación mecánica e incremento de la lesión renal aguda), pero la mortalidad no se vio afectada.31 Los resultados de este meta-ánalisis son cuestionados por la inclusión de estudios observacionales, la variabilidad de las poblaciones estudiadas y la cantidad de pacientes incluidos.
Un ensayo clínico, doble ciego, aleatorizado, realizado en cuatro UCI (tres generales y una quirúrgica vascular y cardiotorácica) en Nueva Zelanda (ESTUDIO SPLIT) comparó el SS0.9% versus Plasma-Lyte 148 en pacientes con necesidad de cristaloides. No se encontraron diferencias significativas en lesión renal aguda (9.2% versus 9.6%), terapia de reemplazo renal (3.4% versus 3.3%) ni mortalidad (8.6% versus 7.6%).32 Sen y cols. describieron la asociación entre carga administrada de cloro y su relación con acidosis hiperclorémica, lesión renal aguda y muerte en pacientes críticamente enfermos con volúmenes de reanimación hídrica mayores de 60 mL/kg en las primeras 24 horas, observando una relación directa. Las tasas de acidosis hiperclorémica, lesión renal aguda y mortalidad hospitalaria se incrementaron de manera significativa a medida que aumentaba la carga de cloro (p < 0.001).33 Con estos datos es posible afirmar que los malos resultados del uso de SS0.9% están claramente relacionados con la gravedad del paciente, el tiempo de infusión del líquido, la cantidad de líquido administrado y la carga de cloro. Lo anterior considerando que en el estudio SPLIT el APACHE II promedio fue de 14 puntos, no se administraron más de 2,000 mL de solución durante las primeras 24 horas y no se tomó en cuenta la carga de cloro administrado. Recientemente el estudio SALT34 reportó que no hay diferencia significativa respecto a la mortalidad, lesión renal aguda y necesidad de terapia de reemplazo renal por el uso de soluciones balanceadas versus soluciones no balanceadas, pero al igual que otros estudios la gravedad del paciente, el tiempo de infusión del líquido, la cantidad de líquido administrado y la carga de cloro influyen en los resultados. Debe tenerse precaución al emplear la SS0.9% debido a la importante cantidad de datos sobre los riesgos y la ausencia de ventajas claras en comparación con las SB.
Otros enfoques para el diagnóstico de las alteraciones ácido-base (modelo de Stewart) han permitido detectar trastornos no evidentes para la ecuación de Henderson-Hasselbalch y a través de ellos desarrollar un conjunto de soluciones llamadas: «soluciones balanceadas», las cuales son adecuadas a las necesidades de cada paciente. La SS0.9% o también mal llamada «solución fisiológica» deberá emplearse sólo en condiciones muy específicas.35 La solución Ringer Lactato disminuye la incidencia de lesión renal aguda y la mortalidad en pacientes críticamente enfermos36 y se convierte en una excelente opción al alcance de cualquier médico que no disponga de SB «comerciales» (Figura 3).
Conclusión
El tipo de líquido a utilizar continúa generando controversia, el debate se agudiza respecto a sus componentes. La administración de líquidos intravenosos no debería determinarse sólo por la preferencia del médico, teniendo en mente que se trata de un fármaco con indicaciones, contraindicaciones y efectos adversos debería investigarse más. La prescripción debe ajustarse de manera individual a los antecedentes y sobre todo a las necesidades de cada paciente. Es indispensable anticiparse y reconocer los efectos secundarios del líquido que se emplea. La solución salina al 0.9% puede convertirse en un «problema» y no en una «solución» si no se selecciona al paciente correcto. Las soluciones balanceadas son una opción, pero no la misma solución para los diferentes casos de pacientes críticamente enfermos.











 nueva página del texto (beta)
nueva página del texto (beta)