Introducción
La ecocardiografía es una técnica que hace años abandonó los laboratorios de ecocardiografía para introducirse en otros ámbitos como los cuidados críticos. Sin embargo, a pesar de que diversas sociedades y grupos han publicado guías sobre cómo debería organizarse la formación,1,2 su expansión se ha visto lastrada en nuestro entorno por la ausencia de una formación reglada y acreditada. Si a ello se añade su aparente complejidad y necesidad de una formación prolongada, a menudo en el laboratorio de ecocardiografía (formación por otra parte esencial si se pretende tener un nivel de competencia avanzado), nos encontramos frente a una situación en la que la ecocardiografía en anestesiología se ha visto relegada a ámbitos muy específicos como el perioperatorio de cirugía cardiaca o el trasplante hepático pulmonar.
La ecocardiografía es una técnica que debe adaptarse a las necesidades del usuario. En cardiología su utilización es fundamentalmente diagnóstica, evolutiva y pronóstica desde un punto de vista estructural para tomar decisiones a mediano y largo plazo. No obstante, también puede utilizarse con una visión eminentemente funcional como un monitor hemodinámico a pie de cama.3,4
Existen numerosos artículos que describen algoritmos de ecocardiografía limitada para estudiar la inestabilidad hemodinámica del paciente crítico.5-7 La mayoría adolecen de tener una visión excesivamente estructuralista y no ofrecen una guía clara de cómo interpretar los hallazgos en un contexto tan complejo, lo que puede llevar a iniciar tratamientos o medidas de soporte innecesarios. Para ilustrar mejor esta situación se presenta un ejemplo:
Paciente de 73 años con antecedentes de diabetes mellitus insulinodependiente, hipertensión arterial y miocardiopatía dilatada isquémica con fracción de eyección de 25-30% (según informes previos, aunque no se dispone de ecocardiografía reciente) sometido a colecistectomía urgente por colecistitis aguda. Tras la inducción presenta hipotensión profunda que no revierte tras administración de volumen y de dosis bajas de efedrina, por lo que se decide hacer ecocardiografía urgente. Si se parte de un punto de vista estructural al realizar la ecocardiografía, lo que destacará será la disfunción ventricular izquierda grave y según la lógica de los algoritmos que se basan en estructura, el tratamiento a iniciar serán inótropos para mejorar la contractilidad. La realidad, en cambio, es que la mayoría de pacientes con miocardiopatía dilatada son capaces de mantener un gasto cardiaco adecuado a pesar de la mala función ventricular, precisamente porque manejan volúmenes telediastólicos elevados.
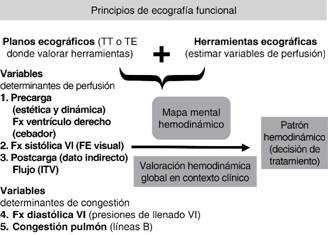
La finalidad de este artículo es explorar a fondo el uso de la ecocardiografía como instrumento de diagnóstico hemodinámico y por lo tanto dar una visión funcional. Este enfoque se basa en el estudio de una serie de planos limitados que nos permitirá mediante el uso de una serie de herramientas ecográficas estimar los determinantes de perfusión (precarga, postcarga y contractilidad) que integrados a través de un mapa mental y junto con la valoración clínica, analítica y de otras pruebas complementarias nos conducirá al diagnóstico del patrón de shock (Figura 1).
Para ilustrar con más claridad el proceso diagnóstico basado en la ecocardiografía funcional se expone un caso al que todo médico podría enfrentarse en su lugar de trabajo:
Estamos de guardia en la Unidad de Reanimación (REA) y nos llaman de la Unidad de Recuperación Postanestésica (URPA) para ingresar a un paciente que muestra hipotensión arterial tras la cirugía. Se trata de un paciente varón de 67 años con insuficiencia renal crónica terminal en hemodiálisis en tratamiento anticoagulante por dos episodios previos de tromboembolismo pulmonar (TEP) y diagnóstico de cardiopatía isquémica por infarto de miocardio (IAM) en 2006, aunque no disponemos de informes ecocardiográficos. Intervenido de urgencia tras reversión de la anticoagulación por un absceso perifístula arteriovenosa del brazo izquierdo habiendo presentado intraoperatoriamente un sangrado estimado de un litro debido a extensión considerable de la infección a planos profundos. A las dos horas del postoperatorio el paciente muestra un cuadro de inestabilidad hemodinámica con hipotensión severa e hipoperfusión (lactatos de 4.5 mmol/L). ¿Cuál es la causa de esta situación? Podría ser: hipovolemia, cuadro séptico, nuevo TEP o re-IAM. La pregunta es: ¿Se le administra volumen (no olvidemos que está en hemodiálisis y quizá lo sobrecarguemos), vasopresores (quizá tenga un bajo gasto cardiaco y le provoquemos mayor hipoperfusión), inotrópicos (si el origen es isquémico o está hipovolémico podemos empeorar la situación)? Éste es el tipo de paciente con el que nos encontramos a diario en REA y en el que la ecografía funcional puede ayudarnos en la toma de decisiones. Al final del artículo resolveremos el caso usando las herramientas ecográficas integradas al mapa mental del shock.
Herramientas ecocardiográficas
La valoración del estado hemodinámico se basa en dos conceptos: perfusión y congestión. Para cada uno existen herramientas ecográficas específicas, pero debido a limitaciones de extensión se omitirá la explicación de aquéllas que permiten valorar la congestión (ecografía pulmonar y función diastólica ventricular izquierda) y nos centraremos en la valoración de la perfusión. Esta exposición se enfocará en la ecocardiografía transtorácica, aunque existen herramientas idénticas o análogas en ecocardiografía transesofágica. De forma consciente se omitirá el estudio del pericardio, pues el taponamiento cardiaco es una entidad poco frecuente fuera de las unidades coronarias o del postoperatorio cardiaco.
Flujo (integral tiempo velocidad normalizado)
Para la valoración de la perfusión es fundamental la medición del gasto cardiaco (GC), siendo éste el resultado final de la interacción de las diversas variables determinantes de perfusión. Su cálculo a menudo justifica el uso de monitores invasivos como el catéter de arteria pulmonar (CAP) u otros sistemas basados en termodilución transpulmonar. La ecocardiografía permite realizar dicho cálculo de forma no invasiva y ha sido validado frente a otros monitores.8,9
La fórmula básica para entender hemodinámica y que siempre debe tenerse en mente es:
Presión arterial (PA) = gasto cardiaco (GC) x resistencias vasculares sistémicas (RVS).
A su vez:
GC = volumen sistólico (VS) x frecuencia cardiaca (FC).
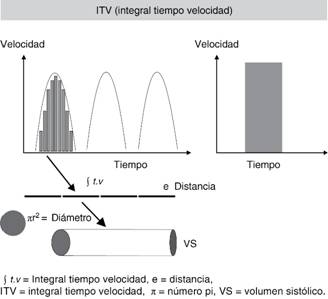
La ecografía permite calcular el VS mediante el uso de la técnica de Doppler pulsado que calcula la velocidad de los hematíes en un punto concreto del sistema cardiovascular. Si se aplica esta técnica a nivel del tracto de salida del VI (TSVI) se obtendrá una imagen triangular que representa el espectro de velocidades de los hematíes que pasan por ese punto durante un latido. Si con nuestro ecógrafo se traza la superficie de dicho triángulo se obtendrán diversos valores, destacando entre ellos lo que se conoce como cálculo integral tiempo velocidad (ITV) que se expresa en cm (Figura 2). El ITV se ha de interpretar como la longitud de la columna de sangre que pasa por el punto insonado en un latido. Si se tiene en cuenta que el TSVI es una estructura circular que no cambia significativamente de forma durante el ciclo cardiaco, puede calcularse el VS multiplicando el ITV por el área de sección (AS) del TSVI.
El principal problema de dicha medición consiste en que el ITV es una medida reproducible intraobservador e interobservador, pero el DTSVI (diámetro del tracto de salida del ventrículo izquierdo) es una medida con mala reproducibilidad. Como consecuencia al interpretar la evolución del GC no se sabrá si sus modificaciones son consecuencia de maniobras terapéuticas o de diferencias en la medición del DTSVI. Para soslayar dicha situación en nuestra unidad se ha optado por convertir el DTSVI en una constante, puesto que en el fondo es un valor que no cambia y a su vez es proporcional a la superficie corporal.10 Dicha simplificación nos permite asumir que VS = ITV y por tanto que los cambios en el ITV reflejan cambios en el VS, asunción que por otra parte ha sido refrendada recientemente en un artículo de consenso sobre monitorización en estados de shock.11
De esta manera es posible hacer una estimación del VS realizando una normalización a la media y asumiendo que todos los pacientes tienen un DTSVI de 2 cm, lo cual corresponde a la media poblacional.10,12,13 Al aceptar dicha premisa resulta que:
VS = ITV x [Π x (2/2)2] = ITV x Π (= 3.14).
Con base en ello puede calcularse el VS que correspondería a diferentes valores de ITV y determinar el valor de ITV que corresponde a un VS bajo.
Si se observa en la Figura 3 para un ITV de 17 corresponde un VS de 54 mL que está muy cercano a los 60 mL que es el límite inferior de normalidad recogido en los textos de hemodinámica y define un VS bajo. Se ha optado por dicho valor porque asumimos que con la ecografía hay una tendencia a infraestimar como consecuencia de los registros Doppler subóptimos y la existencia de un cierto grado de angulación entre nuestra línea de exploración Doppler y la orientación del TSVI. Así pues es posible valorar la perfusión utilizando el valor de ITV directamente o en caso de no estar familiarizados hacer el cálculo simplificado del VS.
Plano a utilizar: plano apical de cinco cavidades.
Herramienta: ITV a nivel del TSVI 1 cm proximal a la válvula aórtica.
Interpretación: como ya se ha comentado anteriormente, se toma el valor de 17 como el valor mínimo de ITV que diferencia un VS normal de un VS bajo. Cualquier punto de corte tan estricto debe interpretarse de forma no absoluta y puede requerir revaloración en un contexto clínico tan complejo como el del enfermo crítico, pero en aras de la simplicidad es útil tener una cifra clara en la memoria que nos sirva como referencia.
Limitaciones: la valoración del ITV no podrá realizarse en circunstancias en las que exista una alteración anatómica del TSVI (postoperatorio de cirugía cardiaca), aceleración del flujo en el TSVI (estenosis subaórtica, movimiento anterior sistólico de la válvula mitral, miocardiopatía hipertrófica obstructiva) o cuando el ITV no refleje el GC real por reflujo diastólico de parte del VS (insuficiencia aórtica moderada-severa).
Precarga estática
Los diferentes parámetros de precarga estática, ya sean presiones o volúmenes, han sido y siguen siendo los parámetros más utilizados para guiar la reanimación o incluso la fluidoterapia de mantenimiento,14 a pesar de que se ha demostrado que son malos estimadores de la capacidad de aumentar el gasto cardiaco tras la administración de volumen15 (fluid responsiveness o precarga dinámica). Por tanto no deberían utlizarse para tomar decisiones respecto a la necesidad de fluidos. Ello se debe a que fisiológicamente representan un solo punto en la curva de Frank-Starling que no permite definir si nos encontramos en la parte ascendente (precarga dependiente) o plana (precarga independiente) de la misma. Por otra parte, no hay valores absolutos que permitan definir un punto de corte y dependen del basal del enfermo en función de su patología de base y situación clínica.
Precarga dinámica
Los parámetros de precarga dinámica o fluid responsiveness son variables que basándose en la interacción cardiopulmonar provocada por la ventilación mecánica controlada permiten predecir si el paciente se encuentra en la parte ascendente o plana de la curva de Frank Starling y por tanto, si la administración de volumen va a aumentar el gasto cardiaco. En los últimos años han aparecido multitud de trabajos con respecto a la validez y límites de estos parámetros que nos han ayudado a comprender mejor su utilidad clínica16 y hay que recordar que para poder utilizarlos deben darse una serie de condiciones previas:
El paciente debe estar en ventilación mecánica controlada sin hacer esfuerzo respiratorio (la única interacción cardiopulmonar debe ser la inducida por el cambio de presión positiva a lo largo del ciclo mecánico).
Ausencia de arritmias significativas (producen por sí mismas variación latido a latido del volumen sistólico).
El volumen corriente (Vt) debe ser ≥ 8 mL/kg peso ideal (es probable que volúmenes menores no produzcan un cambio de presión intratorácica suficiente como para inducir una interacción cardiopulmonar clínicamente significativa).
Complianza sistema respiratorio > 30 mL/cmH2O (en los pacientes con baja complianza el aumento de presión a nivel alveolar no se transmite de forma efectiva a nivel pleural donde se ejerce la interacción cardiopulmonar).
Ausencia de disfunción ventricular derecha significativa (la disfunción ventricular derecha se ha asociado a falsos positivos y por tanto debe tenerse en cuenta que en su presencia no es posible valorar la precarga dinámica de acuerdo con los parámetros que se basan en la variación del volumen sistólico).
Existen las siguientes variables de precarga dinámica medibles por ecocardiografía:
Colapsabilidad de la vena cava inferior (VCI)
Plano a utilizar: plano subcostal de la VCI.
Herramienta: colapso respiratorio de la VCI en modo 2D o M 2 cm proximales a la desembocadura de la VCI (índice colapsabilidad = diámetro máximo-diámetro mínimo/diámetro mínimo).
Interpretación: el colapso respiratorio de la VCI en las condiciones descritas previamente (en esta herramienta las arritmias no son un impedimento para su valoración) se ha demostrado como un parámetro con una sensibilidad y especificidad de alrededor de 90% para predecir el incremento ≥ 15% del GC tras la administración de volumen.17,18 El punto de corte utilizado es de 18%. A efectos prácticos se recomienda realizar una estimación visual del colapso que para apreciarse visualmente debe ser al menos de 15-20%.
Limitaciones: la principal limitación de esta herramienta es la dificultad para la insonación del plano subcostal en pacientes postoperados de abdomen y existen dudas de su validez en pacientes con hipertensión intraabdominal.
Variación respiratoria del pico de velocidad del ITV
Plano a utilizar: plano apical de cinco cavidades.
Herramienta: se valorará la variación del ITV a nivel del TSVI a lo largo del ciclo respiratorio mecánico controlado. Variabilidad = pico velocidad ITV mayor - pico velocidad ITV menor/[(pico velocidad ITV mayor + pico velocidad ITV menor)/2].
Interpretación: la variabilidad del pico de velocidad del ITV a nivel del TSVI es una medida análoga a la variación de volumen sistólico (VVS) presente en muchos monitores hemodinámicos comercializados. Una variación mayor de 12% tiene una sensibilidad de 100% y una especificidad de 89% para detectar incrementos del IC ≥ 15% tras la administración de volumen.19
Limitaciones: al igual que todas las medidas basadas en la VVS sufre las mismas limitaciones (arritmias, ventilación espontánea, Vt < 8 mL/kg peso ideal, disfunción ventricular derecha).
Passive leg raising test ecográfico
Plano a utilizar: plano apical de cinco cavidades.
Herramienta: el passive leg raising test o maniobra de elevación pasiva de piernas consiste en apreciar la variación que se produce en el gasto cardiaco tras la autotransfusión de volumen mediante la elevación de las piernas hasta 45o en un paciente previamente en decúbito supino.
Interpretación: la maniobra se realiza mediante un ITV basal previo a la elevación de piernas y una nueva medición a los cinco minutos de haber efectuado la elevación. Si el ITV posterior a la maniobra es > 12% respecto al basal se tiene una sensibilidad de 77% y una especificidad de 100% de que la administración de volumen aumentará el ITV postinfusión > 15% respecto al basal.20
Limitaciones: esta herramienta a diferencia de las descritas previamente no tiene las limitaciones explicadas, puesto que en realidad se está autoadministrando volumen y valorando su respuesta, lo que la hace de elección en muchas circunstancias. A pesar de ello la sensación clínica es que se trata de una maniobra logísticamente compleja en enfermos en la que su estímulo (dolor, ansiedad) puede interferir en su interpretación.
Para finalizar esta valoración de la precarga dinámica debe tenerse en mente que es una herramienta que predice la capacidad de responder a la administración de volumen, pero en ningún caso debe interpretarse como la necesidad de administrar volumen. No es en sí misma un fin de tratamiento sino un medio para conseguir los objetivos hemodinámicos. La única razón para reanimar con volumen es aumentar el gasto cardiaco para corregir la hipoperfusión sistémica intentando limitar, en la medida de lo posible, la congestión con sus múltiples consecuencias adversas21,22 (edema pulmonar, síndrome compartimental abdominal, edema cerebral, congestión hepatorrenal, etc.).
Función ventricular derecha (cebador)
La valoración de la función del ventrículo derecho (VD) por ecografía es fundamental para detectar ciertas patologías (cor pulmonale agudo en contexto del síndrome de dificultad respiratoria aguda, TEP masivo, IAM de VD, etc.) y porque debido a la relación de interdependencia ventricular el VD se comporta como un cebador del VI pudiendo ser causa de bajo GC. La valoración de la función del VD por ecocardiografía puede llegar a ser muy compleja, pero a nivel práctico se utilizarán dos parámetros sencillos que son la relación de áreas entre VD/VI y el desplazamiento lineal del anillo tricuspídeo en sístole (TAPSE).
Relación áreas VD/VI
Plano a utilizar: plano subcostal o apical de cuatro cavidades que asegurar un correcto plano evitando la angulación anterior (aparición válvula aórtica).
Herramienta: se hará una estimación visual de la relación existente entre las áreas de ambos ventrículos.
Interpretación: el VD está adaptado para trabajar en un régimen de presiones bajas como las que se dan en situación fisiológica en la circulación pulmonar. Ante una sobrecarga ya sea de volumen o de presión el VD va a dejar de funcionar adecuadamente produciéndose una dilatación del mismo con el consiguiente cambio en la relación de áreas entre VD/VI que normalmente es < 0.7. Una excepción sería el infarto de VD en el que existe disfunción del VD sin dilatación, situación que se subsana mediante la valoración del TAPSE. La interpretación de la herramienta es la siguiente:23
Relación áreas VD/VI < 0.7. No existe disfunción VD.
Relación áreas VD/VI 0.7-1. Disfunción moderada VD.
Relación áreas VD/VI > 1. Disfunción grave VD.
Debe señalarse que la dilatación del VD puede ser aguda o crónica (se acompaña de hipertrofia ventricular) y lo realmente relevante es cómo esta disfunción afecta a nivel del VS y por tanto del GC. Una disfunción del VD con GC normal o elevado indica un proceso crónico compensado, mientras que con GC bajo indica un proceso agudo o crónico descompensado.
Desplazamiento lineal del anillo tricuspídeo en sístole (TAPSE)
Plano a utilizar: plano apical cuatro cavidades.
Herramienta: se efectuará un modo M haciendo pasar la línea de exploración por el anillo tricuspídeo lateral y se calculará el desplazamiento lineal (mm) hacia abajo en sístole de dicho anillo. La distancia recorrida refleja en parte la función sistólica del VD que tiene un movimiento parecido al de un pistón.
Interpretación: el VD tiene una anatomía y fisiología complejas, pero uno de los parámetros que mejor ha podido correlacionarse con su función sistólica y que tiene interés pronóstico es la distancia vertical que desciende el anillo tricuspídeo durante la sístole ventricular.24 Los valores de referencia son:
TAPSE > 18-20 mm. No disfunción VD.
TAPSE < 15 mm. Disfunción moderada VD.
TAPSE < 10 mm. Disfunción grave VD.
Función sistólica ventricular izquierda (FE visual)
La función sistólica del VI ha sido el parámetro más importante en ecocardiografía clínica desde sus inicios porque traduce el funcionamiento del generador de flujo de nuestro sistema cardiovascular. Su valoración se obtiene mediante diversos parámetros, pero el más conocido y quizás el único que la inmensa mayoría de clínicos es capaz de reconocer en un informe de laboratorio de ecocardiografía es la fracción de eyección (FE) entendida como el porcentaje del volumen telediastólico que se eyecta en cada latido. Existen muchas técnicas para su cálculo que son más o menos complejas, pero una estimación visual es suficiente para distinguir una función VI normal de una moderada o gravemente deprimida cuando se tiene una mínima formación.25 Consideramos que es mejor hacer un análisis cualitativo de la FE, aunque puedan pasar desapercibidas disfunciones leves porque por lo regular no son la causa de inestabilidad hemodinámica de un enfermo.
Plano a utilizar: plano subcostal cuatro cavidades, ejes cortos subcostales a nivel mitral, papilar y apical. Plano apical de dos y cuatro cavidades.
Herramienta: se hará una estimación del engrosamiento sistólico (mejor marcador de función sistólica) y del movimiento del endocardio valorando globalmente la FE.
Interpretación: es importante realizar una valoración en todos los planos posibles para tener una idea global y además debe tenerse en mente la posibilidad de que existan anomalías segmentarias de la contractilidad que hacen aún más compleja la interpretación y que en general deben orientarnos a la patología isquémica aguda o crónica. Debe distinguirse la existencia de:
No disfunción VI (corresponde a FE > 55%).
Disfunción moderada VI (corresponde a FE 30-45%).
Disfunción grave VI (corresponde a FE < 30%).
Debe tenerse en cuenta que aunque a menudo se toma la FE como un parámetro de contractilidad puro, la realidad es que no lo es, puesto que depende de precarga y postcarga. Además no debe tomarse como un objetivo de tratamiento, puesto que lo relevante es su influencia en la generación de GC.
Mapa mental basado en ITV
Una vez descritas todas las herramientas para estimar las variables determinantes de la perfusión continuaremos con nuestro caso clínico y su valoración ecográfica:
En el plano apical cuatro cavidades se estima la función sistólica del VI a través de la FE visual que está moderadamente deprimida (35%). Asimismo se valora el ventrículo derecho donde se objetiva una dilatación moderada por relación de áreas VD/VI de 0.9 así como un TAPSE de 13 mm. En el mismo plano se calcula un ITV de 21 y a su vez se realiza la maniobra de elevación pasiva de piernas con un incremento del ITV de 21 a 27 cm (↑ 22%) considerándose por tanto una respuesta positiva.
En resumen nos encontramos con una disfunción sistólica moderada del ventrículo izquierdo, una disfunción moderada del ventrículo derecho, respuesta a volumen positiva y una ITV de 21 cm (VS estimado de 66 mL).
El resultado es confuso, ya que casi todas las variables determinantes de perfusión están alteradas. ¿Cómo pueden jerarquizarse estos determinantes de manera que sea posible llegar al diagnóstico del patrón hemodinámico del shock? ¿Cómo se distingue cuáles elementos son probablemente crónicos y cuáles son agudos y causantes del shock?
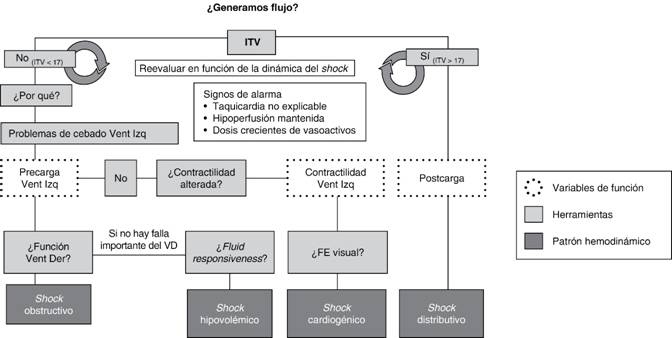
Para ayudar a la integración de los determinantes de perfusión en el contexto del shock y así diagnosticar su causa fundamental se ha diseñado un mapa mental (Figura 4). La primera duda que tiene que resolverse cuando nos enfrentamos a un shock es si el sistema cardiovascular genera suficiente flujo en forma de GC. La aproximación a la respuesta se hará a través de la medición del ITV. Si el ITV se encuentra por encima de 17 se considerará que el sistema es capaz de generar suficiente flujo, por lo tanto en el contexto de hipotensión nos encontraremos frente a una vasoplejía como mecanismo de shock. En este caso después de corregir la hipotensión con vasopresores se revaluará el ITV para descartar que haya disminuido como consecuencia del aumento de la postcarga.
Si por el contrario el ITV resulta inferior a 17, se considerará que el GC es insuficiente y el estudio continuará. En este punto se planteará cuál es la causa del bajo flujo e inicialmente se buscará la respuesta en los determinantes de la precarga del ventrículo izquierdo. Tras la valoración de la función del ventrículo derecho, si ésta se encuentra alterada el mecanismo más probable del shock será obstructivo y se tratará la causa. Si el ventrículo derecho tiene una adecuada función se valorará la precarga dinámica con las herramientas correspondientes. Si se presenta la situación de fluid responsiveness positivo se administrarán cargas de volumen rápidas valorando la respuesta en forma de aumento del ITV. Si no hay opción de hacer carga de volumen por estar el paciente en situación de fluid responsiveness negativo, se continuará analizando la contractilidad mediante la estimación visual de la fracción de eyección. En este caso, si se determina que la contractilidad está alterada se llegará al diagnóstico de shock cardiogénico.
El orden de evaluación de los determinantes de perfusión del mapa mental no es trivial, está pensado en torno a una idea fundamental: recuperar la perfusión perdida por el estado de shock sin sobrerreanimar. Para conseguir dicho fin se sigue la premisa de que ningún determinante de perfusión es relevante si el gasto cardiaco no disminuye de forma significativa y por lo tanto no tiene que ser tratado porque no va a contribuir a la causa del shock.
Aunque el paciente se encuentre en situación de fluid responsiveness positivo si se mantiene el ITV no se administrará volumen, puesto que esta situación es fisiológica y es donde la mayoría de las personas sanas se ubican. Es una situación que implica un estado de reserva funcional mantenida y por lo tanto, si se aumenta el volumen el sistema cardiovascular será capaz de incrementar el gasto cardiaco. Si este último no está alterado (ITV > 17), administrar volumen lejos de aportar beneficios puede aproximar al paciente a una situación de hipervolemia que no va a beneficiar su pronóstico.22,26
Aunque el paciente tenga la contractilidad alterada, si no hay disminución del gasto cardiaco (ITV < 17) no debe tratarse, ya que la indicación de los inotrópicos es tratar el bajo gasto cardiaco asociado a hipoperfusión.11 Si la perfusión está garantizada (ITV > 17) el uso de inotrópicos obliga a un corazón ya lesionado a aumentar el estrés mecánico y el consumo de oxígeno con alto riesgo de arritmias.
La existencia de disfunción del VD en contexto de GC mantenido significa que la causa de que el paciente esté hipotenso no será la disfunción. Por ejemplo, en el caso de que en el contexto de un shock se diagnosticara un TEP con gasto cardiaco mantenido, el fallo derecho no sería la causa fundamental del shock y habría que pensar en la existencia de un componente vasopléjico y buscar su causa.
En definitiva el tratamiento que no aporta beneficio sólo deja el daño potencial de sus efectos secundarios y debe tratar de evitarse a toda costa (primum non nocere).
Nuestro mapa mental no pretende ser un algoritmo extensivo que se ajuste a todas las situaciones posibles, puesto que forzosamente sería incompleto y por tanto no útil a nivel clínico. El mapa mental debe ser una forma de ordenar conceptos e ideas para facilitar su integración y obtener una mejor interpretación de la ecocardiografía en todos aquellos que se inicien en su uso en REA. Para finalizar se comentarán una serie de puntos que son vitales para que el mapa mental aporte todo su potencial:
Necesidad de reevaluación
Una vez aplicado el tratamiento es necesario revaluar ecográficamente para confirmar la estabilidad hemodinámica. Además deberán revaluarse cambios clínicos significativos cuando aparezcan como taquicardia, necesidades crecientes de fármacos vasoactivos y en situaciones en las que no reviertan el estado de hipoperfusión de forma esperada.
ITV límite
En situaciones en las que se observen valores de ITV cerca del límite inferior de normalidad (ITV entre 15-19) habrá que verificar con especial atención el estado de perfusión. Si mediante el uso de variables clínicas y analíticas de perfusión (relleno capilar, niveles de lactato, exceso de base y valores de saturación venosa central) se determina la persistencia de hipoperfusión, se asumirá la necesidad de aumentar el dintel de ITV y en consecuencia se aplicará reanimación.
Taquicardia
Debe valorarse si se trata de una taquicardia compensadora (hipovolemia, disfunción ventricular) y que por tanto merece tratamiento, o bien estamos ante una taquicardia no compensadora (fiebre, SIRS). Para ello se calculará el GC multiplicando el ITV x 3.14 x FC. Si el GC es normal o bajo (IC < 2-2.5 según el contexto), asumiremos que se trata de una taquicardia compensadora. Si por el contrario el GC es elevado (IC > 2-2.5 según el contexto) nos encontramos ante una taquicardia no compensadora, puesto que el sistema cardiovascular nunca sobrecompensa.
Resolución del caso
Siguiendo el mapa mental, respondemos a la cuestión de flujo suficiente mediante el cálculo del ITV que en este caso es de 21 cm. En consecuencia se considera que el flujo generado es suficiente, por lo tanto en el contexto de shock con hipotensión se asume que el mecanismo fundamental del mismo se debe a bajo tono vasomotor y por tanto nos encontramos ante una situación de shock distributivo. Se administrarán fármacos vasopresores para mejorar la presión de perfusión y se hará una revaloración.
Conclusiones
Este artículo de formación continuada intenta expresar un cambio de paradigma en el manejo hemodinámico basado en ecocardiografía. El cambio consiste en pasar de una visión estructuralista, basada en tratar las anomalías en las distintas variables determinantes de perfusión por separado sin integrarlas a una visión funcional fundamentada, a la valoración conjunta de todos los hallazgos anómalos mediante un mapa mental que permite detectar alteraciones realmente relevantes en situación de shock. Permitirá la estimación del patrón hemodinámico del enfermo y su tratamiento fisiopatológico racional intentando evitar la sobrecarga de fluidos o el sobreuso de fármacos inotrópicos. En definitiva, adoptar un tratamiento individualizado a cada paciente teniendo en cuenta sólo los determinantes relevantes y así evitar la sobrerreanimación.











 nueva página del texto (beta)
nueva página del texto (beta)