Introducción
La infección sistémica causada por hongos, principalmente de la microbiota endógena del huésped, resulta ser de las más fatales y cuya familia de Candida representa una alta morbimortalidad en la terapia intensiva que abarca tanto pacientes inmunocomprometidos previamente como los que no lo están. Es una complicación relevante en pacientes con neutropenia y en aquéllos sometidos a quimioterapia. Candida albicans es la especie más común (58%) seguida de parapsilosis (21%), con un incremento en la incidencia en los últimos 20 años a nivel mundial, según algunos reportes, de albicans (77.5%) seguida de glabrata (15%), tropicalis (5%) y krusei (2.5%). En países como Estados Unidos representa hasta 50% de los agentes etiológicos por hongos, Candida glabrata se cuenta como la tercera causa de candidemia y en general ha alcanzado hasta 38% de mortalidad, siendo más grave cuando se retarda la terapia antifúngica apropiada. Se ha reportado un incremento en la incidencia de especies raras como kefyr y lusitanea entre 1998 y 2013.1-7
Especies de Candida colonizan de forma habitual el tracto digestivo y genitourinario, por ende el tracto digestivo es la principal entrada de Candida al organismo y el paso al torrente sanguíneo ocurre con la alteración en las barreras anatómicas normales a través de una alteración en la integridad de la mucosa como en el caso de cirugías o por inoculación a través de instrumentos médicos como catéteres, en la que la filamentación desempeña un papel pivote en la formación del biofilm.4,6 Cuando existe una alteración o trastorno en la inmunidad, defectos en el número y función de neutrófilos o en la inmunidad medida por células, disfunción metabólica y en los extremos de la edad, puede presentarse sobrecrecimiento e infección oportunista y una de las formas de antivirulencia es mantener el microbioma y la ecología normal para suprimir el crecimiento de las poblaciones de Candida.4
El incremento en la frecuencia se ha atribuido al aumento de la complejidad de los procedimientos médicos y quirúrgicos que permiten prolongar la sobrevida en los pacientes críticamente enfermos.2,3 Algunos de los factores que se relacionan son el uso de antibióticos previo a hospitalización, catéteres centrales y urinarios, NPT, tumores y edad mayor de 75 años; es decir, depende tanto de la enfermedad subyacente como de otros factores como neutropenia, cirugía abdominal, terapia inmunosupresora y antibióticos de amplio espectro, choque séptico y factores alternos como neumonía, falla renal, tumores sólidos y enfermedad pulmonar crónica.2,7
Se ha considerado a los azoles como el primer nivel de manejo en la infección por Candida y antes de la introducción de las equinocandinas, el manejo con fluconazol representaba el medicamento de elección en la mayoría de estas infecciones; sin embargo, la resistencia a los antifúngicos ha ido en aumento y algunos de los factores identificados son el uso de antibióticos de amplio espectro, así como esteroides a dosis elevadas. La resistencia a azoles en Candida albicans es mediada por varios mecanismos, entre los cuales los relacionados con el transporte involucran genes de la superfamilia principal de transportadores o genes transportadores de casquetes ligadores de ATP. Los investigadores Song y cols. y Ying y cols. reportaron decremento en la susceptibilidad de Candida albicans por azoles de forma temprana y que el gen ERG11 es un marcador de resistencia a fluconazol en Candida albicans. Asimismo se ha observado resistencia a azoles en especies de Candida parapsilosis y glabrata4,7-9 y resistencia adquirida a equinocandinas incluso en algunas especies de Candida por alteraciones en el gen FKS1. La Candida multidrogorresistente no es un fenotipo común, aunque en Candida glabrata se ha observado resistencia temprana a azoles y equinocandinas de forma cruzada.4,8 Se usan equinocandinas como terapia de primera línea para candidemia por Candida lusitaniae, aunque pueden desarrollar resistencia a anfotericina. Se han empleado equinocandinas más azoles para evitar esta resistencia emergente.8 Por otra parte, se ha detectado resistencia emergente a equinocandinas en algunas especies incluyendo Candida albicans, dubliniensis, kefyr, glabrata, krusei, tropicalis y lusitaniae, en ésta con mutación en FKS1 HS1.8 Estudios recientes no constataron resistencia cruzada a otra clase de antifúngicos, a excepción de lusitaniae con previa exposición a caspofungina; por otra parte, la resistencia cruzada a anfotericina y equinocandinas ocurre sin previa exposición a anfotericina. Existe una correlación más alta entre el uso previo de equinocandinas y la no susceptibilidad a caspofungina que en relación con micafungina y anidulafungina.5,8
La resistencia a fluconazol se ha vinculado a la no susceptibilidad a equinocandina; sin embargo, es posible que las diferencias en las condiciones subyacentes hayan influido. El uso desmedido de equinocandinas puede resultar en el incremento de la diseminación en la resistencia, incluso la transmisión de la resistencia entre pacientes y las pruebas para determinar la susceptibilidad a los antifúngicos no se usan de forma amplia para dirigir el manejo de candidasis sistémica, pese al hecho de que ha emergido una resistencia de forma global.1,5 Se ha reportado el uso de «Etest» para probar la susceptibilidad a Candida como una prueba rápida que puede proveer resultados entre 24 y 48 horas; no obstante, no se recomienda para anfotericina.1 El uso de «MALDI-TOF» espectrometría en masa ha mejorado la identificación de hongos, así como la reducción de costos y mejores resultados en cuestión de tiempo.7
Justificación
La administración de fluconazol parece ser una medida razonable en la prevención de candidiasis por Candida albicans en pacientes hospitalizados con factores de riesgo. El inicio de la terapia dentro de 72 horas posterior a toma de cultivos se ha asociado a una menor mortalidad a los 30 días.2,6
A pesar del uso de terapia con antifúngicos así como en profilaxis no se ha detectado resistencia adquirida en antifúngicos en aislamientos, aunque en algunas series de reportes el uso de fluconazol en periodos prolongados puede inducir a mutaciones que expresan resistencia y ocasionar que los tratamientos fallen.3
Material y métodos
Planteamiento del problema
Pregunta: ¿Existe mayor riesgo de desarrollo de Candida no albicans con el uso de azoles de forma profiláctica en pacientes ingresados a la unidad de terapia intensiva?
Objetivos: objetivo principal: determinar si los pacientes que ingresan a la unidad de terapia intensiva que han recibido de forma profiláctica algún antifúngico del tipo azol tienen mayor incidencia en el desarrollo de especies de Candida no albicans.
Objetivos secundarios: determinar si existe relación entre mortalidad y la incidencia de Candida no albicans en los pacientes con uso previo de fluconazol. Revisar la relación entre Candida no albicans y la susceptibilidad a antifúngicos.
Hipótesis: hipótesis central: el desarrollo de Candida no albicans se relaciona con el uso de fluconazol de forma profiláctica.
Hipótesis nula: el desarrollo de Candida no albicans no se relaciona con el uso previo de fluconazol de forma profiláctica.
Metodología: estudio retrospectivo, longitudinal y analítico.
Criterios de inclusión: ingreso a unidad de terapia intensiva con diagnóstico de sepsis. Edad mayor de 18 años. Uso de antifúngico de tipo azol de forma profiláctica.
Criterios de exclusión: seguimiento incompleto. Uso de antifúngico no azol previo al aislamiento.
Se determinó qué pacientes recibieron de forma profiláctica azoles, se aplicó cuestionario con base en revisión de expediente clínico para variables epidemiológicas y seguimiento durante toda su estancia hospitalaria, de éstos se determinó quiénes desarrollaron especies de Candida albicans y no albicans y mortalidad a los 30 días.
Se realizó análisis estadístico mediante T de Student para comparación de grupo y χ2 para variables categóricas. Los resultados se expresan en promedio, ±, desviación estándar y porcentajes. Se considera estadísticamente significativo si p ≤ 0.05, análisis con uso de sistema de estadística SPSS Statistics 21.
Resultados
Se analizó un total de 25 pacientes en un periodo de dos años, con edad de 72 ± 13 (45-92) años, siendo 15 hombres (60%) y 10 mujeres (40%) con sepsis a nivel abdominal en 56% (n = 14), seguida de origen pulmonar en 32% (n = 8). Los pacientes registraron un APACHE II al ingreso de 14 ± 5 (5-29) y un SOFA de 6 ± 3 (2-14) (Cuadro I).
Cuadro I: Características basales de la Población.
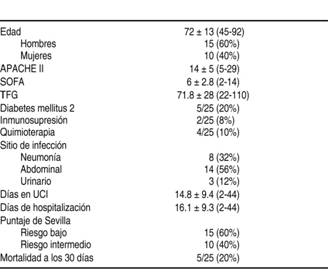
TFG = Tasa de filtración glomerular; UCI = Unidad de Cuidados Intensivos.
Se sabía que sólo 20% de los pacientes padecían diabetes mellitus tipo 2 y que 8% contaban ya con algún factor de inmunosupresión y los pacientes que habían sido sometidos previamente a quimioterapia representaban 16% (Cuadro I). Ninguno de los pacientes analizados contaba con estancia hospitalaria en los tres meses previos y sólo cuatro pacientes (16%) recibieron antibioticoterapia de amplio espectro previo al uso de fluconazol. En los cultivos revisados para gérmenes bacterianos no se encontró crecimiento en siete pacientes (28%), hubo crecimiento de bacterias Gram positivas en 12 (48%) y de bacterias Gram negativas en seis (24%).
Durante el seguimiento 40% (n = 10) de los pacientes recibieron dosis de esteroides durante más de 50% de la estancia hospitalaria y tres pacientes recibieron terapia de sustitución renal (12%).
En los cultivos para reporte de hongos se constató que en 16 pacientes (64%) no hubo crecimiento de hongos, en cuatro pacientes (16%) hubo desarrollo de Candida albicans y en cinco pacientes (20%) de Candida no albicans, de los cuales dos fueron Candida glabrata, dos krusei y uno parapsilosis. Sólo se observó resistencia a azoles en los pacientes en quienes se aisló Candida krusei.
En la evaluación al ingreso para el inicio de antifúngico de forma profiláctica se aplicó el Score de Sevilla, encontrando que 15 pacientes (60%) se catalogaron con bajo riesgo de desarrollar candidemia y 10 pacientes (40%) con riesgo intermedio (Cuadro I).
Sólo cinco pacientes (20%) en un periodo de seguimiento de 30 días fallecieron (Cuadro I).
Al realizar el análisis de factores que pudieron haber influido en el desarrollo de Candida albicans y no albicans se compararon los pacientes en quienes no hubo crecimiento con los que desarrollaron Candida albicans en la primera columna y con los que mostraron crecimiento de Candida no albicans en la segunda columna (Cuadro II).
Cuadro II: Tabla de comparación de variables según resultado de cultivos.
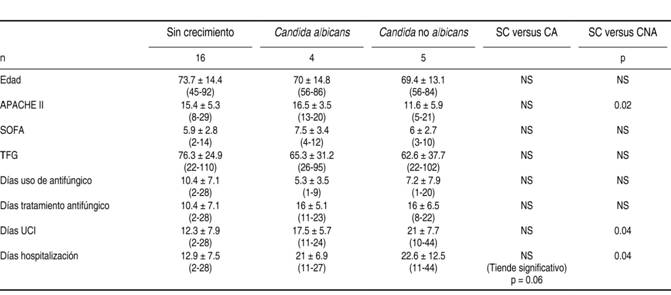
SC = Sin crecimiento; CA = Candida albicans; CNA = Candida no albicans; NS = No significativo. TFG = Tasa de filtración glomerular; UCI = Unidad de Cuidados Intensivos. Leyenda: relación entre factores de riesgo y grupos de pacientes separados por aislamiento de hongo en cultivos.
No se detectó diferencia significativa en edad, SOFA, tasa de filtración glomerular y días de uso de antifúngico al comparar a los pacientes sin crecimiento de hongos con los que presentaron crecimiento de Candida albicans y Candida no albicans (Cuadro II).
Por el contrario se observó diferencia significativa en APACHE II al comparar a los pacientes sin crecimiento con los de crecimiento de Candida no albicans (15.4 ± 5.3 versus 11.6 ± 5.9, p = 0.02), así como en días en terapia intensiva (12.3 ± 7.9 versus 21 ± 7.7, p = 0.04) (Cuadro II).
Se presentó mortalidad de 25% en ambos grupos, tanto en pacientes sin crecimiento de hongos como en los que desarrollaron Candida albicans, mientras que el grupo de Candida no albicans tuvo una sobrevida de 100% a los 30 días.
Discusión
La aparición de especies de Candida incluyendo Candida albicans que muestran resistencia a los tratamientos antifúngicos, incluso al manejo de primera línea con azoles, ha ido en aumento y se ha considerado que inclusive la terapia de profilaxis para hongos en poblaciones susceptibles como algunos pacientes en terapia intensiva debería incluir de primera línea manejo con equinocandinas. Desde hace tiempo se han analizado los factores más influyentes en la incidencia de candidemia y en nuestro estudio la edad, género, uso de antibioticoterapia previa y estados que generan cierto grado de alteración en la inmunidad no fueron factores significativos en la aparición de Candida albicans ni en no albicans en los pacientes en quienes se inició fluconazol de forma profiláctica. Sin embargo, cabe destacar que el número de pacientes con sepsis abdominal fue de mayor incidencia en todos los grupos, siendo más o menos homogéneo, presentándose en alrededor de 50% de todos los grupos.
Según el análisis del puntaje de SOFA no hubo diferencia significativa en ninguno de los tres grupos; no obstante, hay que resaltar que APACHE II en pacientes con desarrollo de Candida no albicans fue más bajo en comparación con el grupo sin desarrollo de Candida, aunque en este rubro interfieren factores como la estancia hospitalaria que fue más prolongada en el grupo de Candida no albicans, siendo más susceptible de adquirir este tipo de Candida y no se aplicó la escala de APACHE II a una segunda instancia, pues ésta sólo se utiliza para la valoración al ingreso de pacientes y podría ser más significativa la aplicación de SOFA subsecuente para corroborar que en realidad se trataba de pacientes menos graves al momento del aislamiento.
Los días de estancia en la unidad de cuidados intensivos así como el total de días de hospitalización fueron datos significativos, siendo más prolongados en los pacientes que desarrollaron Candida no albicans, apoyando el hecho de la adquisición de este tipo de Candidas dentro de la unidad hospitalaria.
Aun cuando no hubo diferencia significativa, el hecho de que la mayoría de los pacientes en los tres grupos desarrollaran bacterias Gram positivas con respecto a bacterias Gram negativas puede estar relacionado con el factor del diagnóstico de sepsis abdominal, siendo predominante la infección por enterobacterias.
Cabe mencionar que los pacientes que desarrollaron Candida no albicans mostraron un puntaje de Sevilla de riesgo intermedio en comparación con los otros dos grupos, además de que el tipo de Candida glabrata fue sensible a fluconazol y sólo el tipo krusei fue resistente a azoles. La mortalidad no fue significativa en los pacientes que desarrollaron Candida no albicans y no hubo diferencia importante con respecto a los pacientes que presentaron Candida albicans y el grupo sin crecimiento.
Conclusiones
Se determinó que la incidencia de Candida no albicans en esta unidad de cuidados intensivos en pacientes que reciben profilaxis con fluconazol es baja con un porcentaje menor de 20%, además de que no se encontró mayor mortalidad en este grupo; por lo que consideramos que el uso de fluconazol como manejo profiláctico sigue siendo una medida adecuada y que debe reevaluarse la tendencia actual del uso de equinocandinas como primera línea en algunas unidades de cuidados intensivos, ya que algunas especies de Candida no albicans mostraron sensibilidad a fluconazol. Consideramos que este estudio debería tener una población más amplia para ofrecer mayor peso estadístico; por otra parte, sugerimos que no puede considerarse para realizar un estudio multicéntrico, ya que dados los hallazgos en este estudio la terapia de profilaxis para hongos debe adaptarse de acuerdo con las especies de Candida de cada unidad y la resistencia detectada a antifúngicos.











 text new page (beta)
text new page (beta)


