Introducción
Una de las principales y más frecuentes metas en la terapia intensiva es la optimización hemodinámica, la cual se realiza mediante mediciones que no necesariamente reflejan la eficiencia cardiovascular, como la presión arterial media o el gasto cardiaco indexado. Varios autores como Sunagawa1 demostraron que la mejor forma de evaluar la eficiencia miocárdica es mediante el análisis del acoplamiento ventrículo-arterial, que es el concepto de que el sistema cardiovascular funciona mejor cuando el sistema arterial y el corazón se acoplan,2 es decir, cuando el corazón bombea sangre hacia el árbol vascular a una velocidad y volumen que coinciden con la capacidad del sistema arterial para recibir dicho volumen.3-6 Si estas condiciones se cumplen, el sistema cardiovascular proporciona la presión y flujo óptimos para perfundir adecuadamente a los órganos, mientras que ningún valor de presión arterial o gasto cardiaco puede garantizar la adecuada perfusión del sistema. Por eso no podemos tomar una misma meta de presión arterial o gasto cardiaco para todos los sujetos; incluso, la meta de presión y/o gasto cardiaco no es igual para el mismo paciente en condiciones diferentes.
La evaluación del acoplamiento ventrículo-arterial en el ser humano pocas veces se ha realizado a la cabecera del enfermo debido a la necesidad de técnicas invasivas para adquirir estas mediciones mediante un catéter intraaórtico.7 Actualmente, dada la importancia del acoplamiento ventrículo-arterial y su impacto clínico, se ha puesto mucho esfuerzo para poder obtener estas mediciones a la cabecera del enfermo, como el método desarrollado por Chang y colaboradores,8 que ha sido validado en la práctica clínica,9 pero requiere de instrumentos que se están volviendo poco frecuentes en terapia intensiva, como el catéter de Swan Ganz de gasto cardiaco continuo. Técnicas ecocardiográficas pueden estimar el acoplamiento ventrículo-arterial de forma no invasiva a la cabecera del individuo, pero se requiere de equipos especiales y un ecocardiografista experto,10 lo cual lo hace poco disponible en la práctica diaria. El sistema Doppler USCOM (monitor de gasto cardiaco por ultrasonido) genera un registro ultrasonográfico a nivel de la aorta que permite obtener mediciones hemodinámicas que pueden ser usadas para evaluar el acoplamiento ventrículo-arterial de manera no invasiva y que requieren un entrenamiento mínimo, además de ser un monitor que puede estar disponible todo el tiempo en las unidades de cuidados intensivos.
Material y métodos
Se realizó un estudio longitudinal, prospectivo, analítico con las personas hospitalizadas en la Unidad de Cuidados Intensivos del Hospital San Ángel Inn Universidad de enero de 2015 a enero de 2016 ingresadas en estado de choque (definido como una frecuencia cardiaca > 120 latidos por minuto o un lactato venoso > 4 mmol/L o un lactato > 2 mmol/L más alguno de los siguientes: frecuencia cardiaca > presión sistólica, presión sistólica < 90 mmHg). Se registraron las siguientes variables: edad, género, diagnóstico de ingreso, tensión arterial sistólica y diastólica, tensión arterial media, frecuencia cardiaca y lactato sérico; un ecocardiografista experto realizó las mediciones ecocardiográficas necesarias para obtener el cálculo del acoplamiento ventrículo-arterial, como se muestra adelante. Un residente de terapia intensiva de primer año obtuvo tras un entrenamiento de cuatro horas los siguientes valores mediante USCOM: índice de inotropismo de Smith-Madigan (SMII), tiempo de flujo corregido a frecuencia cardiaca (FTC) y radio de energía potencial (PKR),11 como se explica posteriormente. Las mediciones se realizaron tras 12 horas de estancia en la UCI.
Acoplamiento ventrículo-arterial por ecocardiografía
Para determinar el acoplamiento ventrículo-arterial a través de ecocardiografía, se requiere realizar una ventana apical de cuatro cámaras para obtener el volumen al final de la diástole del ventrículo izquierdo (VFDVI) y el volumen al final de la sístole (VSF) usando el método de Simpson descrito por la Sociedad Americana de Ecocardiografía.12
Para calcular la elastancia arterial (Ea), es preciso conseguir la presión sistólica final (PSF) y el volumen sistólico (VS). La PSF se deducirá multiplicando por 0.9 la presión arterial sistólica (PAS). Para estimar el volumen sistólico se necesita medir el tracto de salida del ventrículo izquierdo y la señal de Doppler pulsado. Con esto, nuestra fórmula final será:
La elastancia ventricular se determina usando el algoritmo modificado descrito por Chen,13 donde:
Posteriormente, se calcula el radio (ENd), que será igual a Ed/Ees, es decir, la variación en tiempo de elastancia durante una contracción isovolumétrica. Al sustituir la presión arterial diastólica por la presión del ventrículo izquierdo isovolumétrica y la presión arterial sistólica por la presión al final de la sístole del ventrículo izquierdo, obtenemos lo siguiente:
Donde Ved y Ves son los volúmenes telediastólico y telesistólico, respectivamente, VS es el volumen sistólico y ENd es la elastancia normalizada durante la eyección, y Pd y Ps son la presión arterial diastólica y sistólica, respectivamente.
End (est) es la elastancia ventricular ajustada al momento de la eyección, la cual se describe aplicando la siguiente fórmula:
ENd (est) = 0.0275-0.165 × EF + 0.3656 × (PAD/PAS × 0.9) + 0.515 × End (avg), donde EF es la fracción de eyección basal y End (avg) es derivada de la siguiente fórmula:
End (avg) = 0.35695-7.2266 × tNd + 74.249 × tNd2-307.39 × tNd3 + 684.54 × tNd4 - 856.92 × tNd5+ 571.95 × tNd6-159.1 × tNd7
Aquí, tNd es el radio del periodo de preeyección del periodo sistólico total.
Al obtener la Ea y la Ees, el acoplamiento ventrículo-arterial se obtiene de la siguiente manera:
Acoplamiento ventrículo-arterial = Ea/Ees
Ea = PFS/volumen sistólico
Ees = PFS/volumen diastólico - volumen sistólico - V0
V0 = Volumen intraventricular cuando la presión del circuito es de cero
Ea/Ees = (PFS/volumen sistólico)/(PFS/volumen diastólico-volumen sistólico- V0)
Una forma simplificada14 que no toma en cuenta el V0 es:
Acoplamiento ventrículo-arterial (Ea/Ees) = (volumen diastólico - volumen sistólico)/volumen sistólico.
Acoplamiento ventrículo-arterial por ultrasonografía Doppler con monitor USCOM
El monitor USCOM mide el potencial de energía (PE = ∆P × ∆V), que es la energía producida por un gradiente de presión, mientras que la energía cinética es la energía destinada a producir flujo sanguíneo; es decir, será el resultado de un cambio de presión (∆P) determinado por la presión de salida del corazón menos la de llegada, o sea, PAM (presión arterial media) menos PVC (presión venosa central), y esto multiplicado por cambio de volumen (∆V). La energía cinética (KE) para cualquier masa en movimiento está dada por la fórmula: KE = ½ mV2, donde m es la masa y V es la velocidad. Al aplicar esto al corazón, en que la masa será VS (volumen sistólico) × densidad, se obtiene lo siguiente:
Inotropismo o poder (watts) = (PE/flujo tiempo) + (KE/flujo tiempo)
[ (∆P-VS × 10-3)/(7.5 × FT)] + [ (D × VS × 10-6 × Vm2) ]/(2 × FT) (Fórmula Smith-Madigan).
D = Densidad, VS = Volumen sistólico, Vm = Velocidad media, FT = Flujo tiempo sistólico. Los factores 7.5, 10-3 y 10-6 son requeridos para convertir mmHg y mL a kPa y m3, respectivamente, para la conversión al sistema internacional (IS). El inotropismo se expresa en watts, siendo ésta la unidad de poder.
VDFVI = 2.7 × VS/SMII15
Éste puede calcularse al restarle el VS al VFDVI, es decir: VSF = VFDVI-VS.
Una vez obtenidos mediante el monitor USCOM los valores de VS y VDFVI, se puede calcular el acoplamiento ventrículo-arterial:
Acoplamiento ventrículo-arterial = Volumen sistólico/VDFVI
El punto final de este estudio fue determinar la correlación entre el acoplamiento ventrículo-arterial obtenido por ecocardiografía y el acoplamiento ventrículo-arterial estimado por el monitor USCOM. Otro objetivo fue determinar si el cálculo de acoplamiento ventrículo-arterial y el índice de SMII pueden predecir mortalidad en sujetos admitidos a terapia intensiva por estado de choque.
Resultados
Se estudiaron 47 pacientes con diagnóstico de estado de choque; género masculino 23 (48.9%), edad 59 años (41-73); de éstos, 22 individuos presentaron choque séptico (53.7%), 11 síndrome coronario (26.8%), siete cor pulmonale (17.1%), uno tromboembolia pulmonar (2.4%). El resto de valores se describen en el Cuadro I.
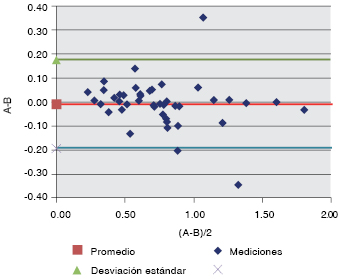
Figura 1: Balant y Altman acoplamiento mediante ecocardiografía (A) versus acoplamiento por USCOM (B).
Respecto a la mortalidad, el acoplamiento medido por ecocardiografía con un punto de corte de ≤ 0.7 predice mortalidad con una sensibilidad de 100% y una especificidad de 50%, con un área debajo de la curva de 0.75 (0.59-0.96), p = 0.46. El acoplamiento medido por USCOM con un punto de corte de 0.7 predice mortalidad con una sensibilidad de 80% y una especificidad de 60%, con un área debajo de la curva de 0.79 (0.64-0.95), p = 0.02. El único otro valor que predijo mortalidad fue el SMII con un punto de corte de ≤ 1.5, con una sensibilidad de 73%, una especificidad de 67% y un área debajo de la curva de 0.79 (0.64-0.95) p = 0.02 (Figura 2).
Discusión
Nosotros encontramos valores de acoplamiento ventrículo-arterial medidos por ecocardiografía y USCOM similares a los reportados con otros métodos de mayor complejidad.13,16 La falta de optimización hemodinámica manifestada por acoplamiento ventrículo-arterial inadecuado se correlaciona con mortalidad de manera muy parecida a la reportada por otros autores.8 Por esta razón, nosotros consideramos indispensable que estas técnicas de análisis hemodinámico estén disponibles para la atención de todo sujeto en estado crítico.
Propuesta de un protocolo de reanimación hemodinámica:
La fórmula de Smith-Madigan se divide entre la superficie corporal; con esto se obtiene el índice de inotropismo de Smith-Madigan (SMII). En personas normales, el valor establecido ha sido 1.6-2.2 W/m2; los pacientes con falla cardiaca tienen valores que oscilan entre 0.4-1.0 W/m2, lo que parece ser un excelente parámetro para medir inotropismo y los cambios en el mismo por la evolución clínica y las maniobras terapéuticas, que en teoría guarda una estrecha relación con el acoplamiento ventrículo-arterial. Nosotros encontramos un SMII de 1.5 como una potencial meta para optimizar la hemodinamia.
La impedancia es la resistencia al paso de energía del sistema de salida y el de entrada. Si la impedancia es muy baja, como sucede en la vasodilatación excesiva, habrá un gran flujo, pero con una presión muy baja (resistencias periféricas bajas); si sucede lo contrario, habrá una presión excesiva en relación con el flujo (resistencias periféricas altas); el radio de energía potencial (PKR) mostrará la impedancia del sistema cardiovascular. Tiralongo y colaboradores,17 usando el ultrasonido Doppler continuo de la onda de flujo (USCOM), demostraron que la impedancia arterial (PKR) describe adecuadamente estados de normotensión e hipertensión. El radio normal PE:KE es de 30:1 (25:1-34:1); en casos de hipertensión, esta relación puede encontrarse 60:1 o 150:1. Es decir, mediante este método de monitoreo no invasivo, este parámetro estima adecuadamente las resistencias vasculares periféricas.18 Por ello, este parámetro debe ser estudiado para optimizar los vasopresores.
El flujo de tiempo corregido (FTC) es el flujo sanguíneo a una frecuencia cardiaca de 60; estará en íntima relación con la precarga y el inotropismo. Un bajo volumen al final de la diástole del ventrículo izquierdo (VFDVI) conlleva a un bajo volumen sistólico (VS) y a un tiempo flujo lento, y viceversa. Evidencia reciente de la Universidad de Washington identificó que el USCOM tuvo 91% de valor predictivo positivo para pronosticar la respuesta al volumen en individuos con ventilación mecánica, en fibrilación auricular y con terapia vasopresora.18),19 Por ello, el FTC parece ser un buen indicador de respuesta a precarga.
Toda esta información se conjuga en la propuesta de algoritmo de reanimación que proponemos en la Figura 3.
Conclusión
Nosotros demostramos que es posible que personal médico con un entrenamiento de cuatro horas mida el acoplamiento ventrículo-arterial en pacientes críticos a la cabecera del enfermo de una manera comparable a lo realizado por un ecocardiografista experto, lo que permite emplear estos complejos análisis hemodinámicos de una manera no invasiva en el día a día de la atención del individuo grave. La utilidad de estos estudios para predecir mortalidad por una hemodinamia no optimizada debe comprobarse en futuros estudios, así como el uso de estos parámetros para protocolos de reanimación como el propuesto por nosotros.











 nueva página del texto (beta)
nueva página del texto (beta)





