Introducción
El daño renal agudo (DRA) es un problema de salud pública a nivel mundial. Se considera que en pacientes de unidades de cuidados intensivos (UCI) ocurre entre 5.5 y 36.1%, con una mortalidad de 15-60%.1 Los factores de riesgo asociados al daño renal agudo en UCI incluyen: edad avanzada, diabetes mellitus, creatinina sérica mayor al ingreso, sepsis o síndrome de respuesta inflamatoria sistémica, administración de fármacos nefrotóxicos, vasopresores y/o inotrópicos, cirugías de alto riesgo o de emergencia y una puntuación mayor en las escalas de severidad de la enfermedad.2 La progresión a daño renal agudo por el incremento temprano de creatinina sérica ha permitido desarrollar un modelo que estratifica los niveles de riesgo en muy alto, alto y moderado con base en diferentes antecedentes personales y situaciones agudas de cada uno de los pacientes.2 Asimismo, la variación entre los niveles de creatinina según el nivel de riesgo entre los valores basales y a 24 horas del ingreso del paciente predice la progresión con un área bajo de la curva (AUC) de 0.83.3
Chawla y colaboradores realizaron una prueba de estrés con furosemida (PEF) para valorar la función tubular renal e identificar pacientes con lesión tubular severa. Los pacientes con daño renal agudo KDIGO (Kidney Disease: Improving Global Outcomes) grados 1 y 2 fueron sometidos a PEF, concluyendo que si presentaban una diuresis menor de 200 mL en las siguientes dos horas de la prueba se asociaban a progresión de falla renal KDIGO 3 o muerte en 14 días posteriores a la prueba con una sensibilidad de 90% y especificidad de 74.2%, con un AUC de 0.82 a 0.87.4
La morbimortalidad de los pacientes críticos se ve severamente comprometida si éstos presentan daño renal agudo en cualquiera de sus estadios, por lo que identificar con mayor precisión a pacientes con alto riesgo nos permitirá realizar intervenciones tempranas a fin de prevenir el desarrollo del daño renal agudo severo.
La PEF es sencilla y accesible en nuestro medio para identificar a los pacientes que se encuentran en riesgo de presentar daño renal agudo severo. El objetivo principal fue establecer precisión pronóstica entre la respuesta a la PEF y el desarrollo de daño renal agudo severo (KDIGO 3) y los objetivos secundarios fueron determinar la asociación entre la PEF con la necesidad de TSR y con la mortalidad e identificar factores de riesgo asociados al daño renal agudo que puedan interferir en la PEF.
Material y métodos
Pacientes. Se realizó una cohorte prospectiva de septiembre 2014 a septiembre 2015 en pacientes que presentaron daño renal agudo en estadios tempranos (KDIGO 1 y 2) hospitalizados en el Servicio de Terapia Intensiva del Hospital Civil de Guadalajara «Fray Antonio Alcalde».
La falla renal aguda se definió de acuerdo con KDIGO (Kidney Disease: Improving Global Outcomes) como el incremento de la creatinina sérica por 0.3 mg/dL dentro de 48 horas o incremento de la creatinina sérica por 1.5 veces el nivel basal en los últimos siete días o un volumen urinario menor de 0.5 mL/kg/h por seis horas, se clasificaron los estadios de acuerdo con la severidad en KDIGO 1 incremento de la creatinina sérica por ≥ 0.3 mg/dL o flujo urinario < 0.5 mL/kg/h por > 6 h; KDIGO 2: incremento de 150-200% desde el nivel basal o flujo urinario < 0.5 mL/kg por más de 12 horas; KDIGO 3: incremento de la creatinina sérica > 300% desde el nivel basal o creatinina sérica > 4.0 mg/dL con un incremento abrupto de al menos 0.5 mg/dL o flujo urinario < 0.3 mL/kg/h por 24 horas o anuria por 12 horas.5
Se incluyeron pacientes que presentaban daño renal agudo KDIGO 1 y 2, con sonda Foley, adecuada reanimación hídrica previa a su ingreso, presencia de cristales celulares en el sedimento urinario, definido como George Washington Urine Sediment Score6 (GWUSS) > 2 o fracción excretada de sodio (FENA) > 1%. No se incluyeron pacientes con un filtrado glomerular (FG) de base < de 30 mL/min/m2, historia de uropatía obstructiva, embarazo, evidencia de sangrado activo, pacientes con alergia o sensibilidad a los diuréticos de asa, cumplimiento de criterios para daño renal agudo KDIGO 3 y evidencia de depleción de volumen previa a la administración de furosemida.
Al ingreso del paciente al estudio se realizó una historia clínica completa, recabando variables sociodemográficas, comorbilidades, antecedente de uso de fármacos Nefrotóxicos9 y hallazgos de laboratorios del día de la PEF, así como una evaluación mediante ultrasonografía enfocada al paciente crítico mediante: colapsabilidad de la vena cava inferior, variabilidad de velocidad del tracto de salida del ventrículo izquierdo, variabilidad del flujo carotídeo con elevación pasiva de miembros pélvicos como apoyo al clínico para descartar hipovolemia, se valoraron también con dispositivos invasivos como línea arterial con variabilidad de la presión de pulso, PICCO y Swan Ganz cuando estuvieran disponibles. La PEF se realizó con una dosis de 1 mg/kg de peso en aquellos pacientes vírgenes al tratamiento con furosemida y 1.5 mg/kg de peso en aquéllos que recibieron diuréticos en los siete días previos. Se tomó como punto de corte 200 mL de diuresis en las primeras dos horas para considerar la prueba como positiva.4 Se midió el gasto urinario en las seis horas posteriores a la administración de furosemida y se dejó a criterio médico la reposición de volumen urinario mediante soluciones cristaloides balanceadas durante el seguimiento, con la intención de minimizar el riesgo de hipovolemia.
Se dio seguimiento a estos pacientes durante 30 días posteriores a la fecha de realización de la prueba o al alta hospitalaria para evaluar la progresión a KDIGO 3, necesidad de TSR o muerte.
Análisis estadístico. Los datos demográficos y variables clínicas fueron evaluados mediante la prueba de χ2 de Pearson, prueba exacta de Fisher y U de Mann-Whitney, la precisión diagnóstica para la progresión a KDIGO 3 se realizó a través del análisis del área bajo de la curva (AUC) y curvas ROC, así como para puntos secundarios como mortalidad y TSR a 30 días de la PEF, las variables cuantitativas se expresaron como media e intervalos de confianza a 95% y las variables cualitativas como porcentajes. Se estimó el riesgo de progresión en pacientes no respondedores a la prueba en las seis horas de seguimiento.
Para el análisis estadístico se utilizó el software SPSS versión19 y 22 y MedCalc versión 12.7.2.
Resultados
De un total de 628 pacientes que ingresaron al servicio, se reclutaron 20 (3.1%) que cumplían los criterios de inclusión, los cuales se dividieron en grupos de respondedores (R) a PEF (16 pacientes) y no respondedores (NR) (4 pacientes); el grupo R estuvo compuesto de 50% de pacientes masculinos y el grupo NR de 75%, la mediana de edad fue de 34 a 51 años de edad; en el grupo R la patología de tipo quirúrgico se presentó en 87.5% de los casos, siendo ésta principalmente laparotomía exploratoria.
El Cuadro I muestra las características generales de la población. Puede apreciarse la diferencia significativa entre los grupos en las primeras dos horas después de la prueba, el grupo R mostró una diuresis mayor comparada con el grupo NR; sin embargo, esta diferencia se vuelve nula después de la tercera hora posterior a la prueba.
Cuadro I: Características demográficas de la población.

Abreviaturas: IMC = Índice de masa corporal. EVC = Evento vascular cerebral. HAS = Hipertensión arterial sistémica. VMA = Ventilación mecánica asistida. Diuresis horaria = 12 horas previas a la realización de la prueba. UCI = Unidad de Cuidados Intensivos, Apache,7 SOFA.8
§ Media (IC 95%). * Porcentajes.
Asimismo, los pacientes respondedores se identifican con una puntuación de SOFA más baja comparada con los no respondedores (7.5 versus 11.5 p = 0.02).
Es posible observar una diferencia importante en la prevalencia de la sepsis y choque séptico en los pacientes no respondedores a la prueba (56 versus 100%, 38 versus 75%, respectivamente), aunque la diferencia no es significativa (p = 0.14 y 0.21, respectivamente).
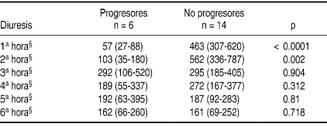
Se realizó un análisis estadístico comparando las diuresis entre los pacientes que desarrollaron KDIGO 3 y quienes no (Cuadro I). Las características demográficas de la población por grupos identifican que aquellos pacientes que presentaron progresión a daño renal agudo severo mostraron una diuresis significativamente menor en la primera y segunda hora (65 versus 430 mL/h p = 0.001 y 519 versus 45 mL/h p < 0.0001) (Cuadro II).
Se identificaron diferencias significativas entre aquellos pacientes que se clasificaron como respondedores a la prueba y su relación con progresión a KDIGO 3 así como con necesidad de TSR (p = 0.003 y 0.03, respectivamente). No se encontró diferencia entre los grupos con respecto a la mortalidad (0.7) (Cuadro III). Se identificó un riesgo relativo de 8 (IC 95% 2.1-29.2 p = 0.003) para progresión a KDIGO 3.
Cuadro III: Comparación entre respondedores y no respondedores a la prueba de estrés con furosemida y los objetivos principales.

* Porcentajes
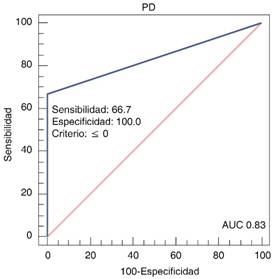
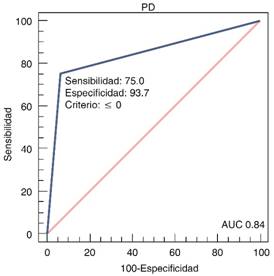
En relación con la progresión a KDIGO3 se documentó un AUC de 0.83 (IC95% 0.60-0.96) y con relación a TSR 0.84 (IC95% 0.61-0.96), no se detectó relación con mortalidad. Dando una sensibilidad para predecir progresión de 66.7%, con especificidad del 100%, para el uso de TSR se encontró una sensibilidad de 75%, con especificidad de 93% (Figuras 1 y 2).
No se identificaron eventos adversos relacionados con la administración de una dosis única de furosemida en los sujetos del estudio.
Discusión
Desde los años 70 se ha tratado de identificar el papel que desempeña la furosemida en los pacientes que presentan daño renal agudo y sus efectos. Los estudios son contradictorios en sus diversos resultados; algunos demuestran los cambios que pueden presentarse a nivel glomerular en relación con la hipoxia y cómo la furosemida puede ayudar en la reducción del consumo de oxígeno a este nivel10 preservando la reabsorción de glucosa y de fosfatasa alcalina, se concluye que la furosemida disminuye el transporte activo en la porción ascendente del asa delgada de Henle, puede incrementar la disponibilidad de oxígeno para otros segmentos y mejorar su supervivencia. No obstante, en otros estudios el daño puede llegar a ocasionar la administración de furosemida en los pacientes críticamente enfermos,9 de tal forma que el uso de la furosemida en los enfermos con daño renal agudo resulta aún controversial.
En este estudio se identificó que la prueba de estrés con furosemida descrita previamente por el Chawla,4 y bajo los criterios que estableció, es una prueba útil para la predicción de la progresión a estadio severo del daño renal agudo, se identificó un AUC de 0.83 en esta relación con una alta especificidad (100%) y para aquellos pacientes que requirieran manejo con tratamiento de sustitución renal con un AUC de 0.84 y una especificidad de 96%. Comparado con este mismo se identificó un AUC muy similar, en el presente trabajo se reporta un AUC en correlación con la progresión a KDIGO 3 para pacientes con diuresis < de 200 mL en las primeras dos horas de 0.87.
Dados los efectos adversos de hipovolemia y sus consecuencias en los pacientes críticos se realizaron estudios de ultrasonografía para determinar si el paciente se encontraba con déficit de volumen. Estos resultados asociados a la clínica permitieron una aproximación al estado de volemia y así excluir a aquellos pacientes con déficit de volumen no evidente clínicamente. Esta evaluación no se toma en cuenta en los estudios de PEF previos, la utilización de estos recursos podría disminuir las complicaciones por el uso de diurético en un paciente potencialmente hipovolémico.
Se conjuntaron las variables previamente descritas como principales factores de riesgo asociados a la progresión del daño renal agudo,2 los cuales se identificaron en pacientes que desarrollaron KDIGO 3 a una edad más avanzada, con mayor frecuencia en la presentación de diabetes mellitus, evento vascular cerebral, obesidad mórbida, cirugía de alto riesgo, uso de nefrotóxicos, sepsis y choque séptico, aunque todos éstos sin diferencia estadísticamente significativa. También fue posible documentar que la puntuación de SOFA en los pacientes que no respondieron a la PEF era mayor. Consideramos que es muy probable que debido al tamaño de la muestra no se hayan alcanzado diferencias estadísticas significativas.
Este estudio y estudios previos demuestran que el uso de una sola dosis de furosemida puede ayudarnos a identificar a aquellos pacientes que progresarán a KDIGO 3, situación que nos abre paso a la oportunidad de valorar a estos enfermos que no responden a la prueba para iniciar una terapia de sustitución renal temprana, lo cual puede fundamentarse en el metaanálisis realizado por Karvellas CJ y colaboradores11 en el que concluyen que la mortalidad disminuyó en los pacientes que fueron sometidos a una terapia de sustitución renal temprana (OR 0.45, IC 0.28-0.72).
La principal limitación de este estudio fue el número de la muestra, ya que esto altera los resultados principalmente en aquéllos que presentan tendencia a ser significativos como los factores asociados a daño renal agudo severo.











 nueva página del texto (beta)
nueva página del texto (beta)