Introducción
Instituir el aporte nutrimental adecuado en el paciente críticamente enfermo es prioritario, a tal grado que es un factor clave para la evolución favorable de la enfermedad de base.1 La terapia nutricional incluye como objetivos limitar el catabolismo proteico y la pérdida de masa magra,2 además de ofrecer soporte celular y orgánico vital, inmunológico, en la reparación de tejidos, en la síntesis proteica y en la capacidad muscular esquelética y cardiaca.3
En caso de que la vía enteral para alimentación esté contraindicada, la nutrición parenteral total (NPT) es la siguiente opción.4 A pesar de que la nutrición es una recomendación con alto nivel de evidencia en varias guías clínicas,5,6,7,8,9,10 aún existen muchas incógnitas en el tema.3 Por ejemplo, no se conoce con exactitud el momento idóneo para el inicio de la NPT11 ni la dosis de nutrientes específicos.12-14
Durante la NPT del paciente grave, la prescripción debe ser individualizada a cada persona y padecimiento específicos.7,15 Esta es una estrategia que disminuye la probabilidad de efectos adversos asociados, aunque es imposible asegurar que el aporte nutrimental parenteral sea por completo inocuo.16 Por lo tanto, se deben tomar en cuenta los inconvenientes que puedan derivarse de la NPT en varios contextos. Uno de estos escenarios es el de sobrecarga hídrica, donde se deposita líquido en el espacio intersticial, lo que afecta la perfusión tisular, especialmente de órganos encapsulados como los riñones.17 A la par, potencialmente surgen desequilibrio hidroelectrolítico, desequilibrio ácido-base, azoemia y síndrome de realimentación, que logran un efecto deletéreo sobre la homeostasis renal.18,19
Con esto en mente, realizamos este trabajo retrospectivo multicéntrico con el objetivo de analizar la relación entre la administración de NPT y el recibir terapia de reemplazo renal (TRR) durante la estancia en la unidad de terapia intensiva (UTI). En específico, nuestra hipótesis fue que la NPT se relaciona de manera independiente con recibir TRR y puede estar asociada, incluso, a otras complicaciones.
Material y métodos
Diseño del estudio
Este fue un estudio retrospectivo en cuatro hospitales privados de la Ciudad de México o su área conurbada. Los hospitales participantes fueron el Hospital Español, Ángeles Lindavista y Ángeles Acoxpa (los tres de la Ciudad de México) y el Hospital Ángeles Lomas (Huixquilucan-Estado de México). Todos los centros son de tercer nivel, y dos de estos (Español y Lomas) son centros académicos, con Programa de Especialización en Medicina Crítica. Todas las unidades cuentan con por lo menos un especialista en medicina crítica de manera continua y la relación enfermera-paciente habitual es de 1-1. Una invitación formal para participar en el estudio fue enviada al responsable de la base de datos de cada centro y al jefe de cada UTI.
Base de datos
En todas las UTI mencionadas, se recaba de manera prospectiva una base de datos de la UTI (BASUTI) de tipo administrativa. Esta base de datos se actualiza de manera diaria y se completa cada registro manualmente antes de que el paciente sea dado de alta del hospital. La BASUTI utiliza una plataforma similar en todos los centros, asentada en hojas de cálculo de Excel® (Microsoft Corp. Redmond, Washington, EUA). Las variables son, en su mayoría, equivalentes en todos los hospitales, aunque con ciertas adaptaciones para cada centro. Existe un responsable en cada hospital de la calidad de los datos recabados, y se realizan auditorías aleatorias de éstos por lo menos una vez al mes para asegurar que los errores sean mínimos en cada registro. La BASUTI se utiliza primordialmente para la monitorización de indicadores administrativos.
Pacientes
Incluimos a todos los individuos de 18 años o más ingresados en las unidades y cuyos datos estuvieran recolectados en la BASUTI (del 5 de septiembre de 2009 al 29 de abril de 2015 en el hospital A, del 19 de enero de 2009 al 29 de diciembre de 2014 en el hospital B, del 25 de enero de 2013 al 1 de abril de 2015 en el hospital C y del 2 de enero de 2010 al 24 de marzo de 2015 en el hospital D). Se extrajeron aquellas variables que fueran relevantes para el estudio. Éstas incluían características basales, el factor determinante del ingreso (falla orgánica, riesgo de falla orgánica o cuidado postquirúrgico), si el sujeto era catalogado como quirúrgico urgente al ingreso, si el diagnóstico principal era de enfermedad coronaria, el haber sido sometido a cirugía cardiaca, el uso de ventilación mecánica (invasiva o no invasiva) y el pronóstico de mortalidad por SAPS 3. También se recabó información sobre los procedimientos realizados, como la administración de NPT, la administración de nutrición enteral (NE) especializada (cualquier tipo de nutrición comercial o artesanal otorgada por sonda nasogástrica, nasoyeyunal o de gastrostomía) y haber recibido TRR. Se excluyeron aquellos enfermos que fueron reingresados a la UTI en la misma hospitalización y los trasladados a otro hospital.
Ética
La recolección de datos para la BASUTI ha sido aprobada por la dirección hospitalaria y los comités de ética y/o investigación en cada uno de los centros. Una vez enviada la invitación mencionada, cada responsable de la BASUTI presentó el protocolo de investigación para la aprobación correspondiente. Debido a las características retrospectivas (observacionales) y a la gestión anónima de los datos de todos los pacientes, este estudio fue aprobado por los comités de ética y/o investigación respectivos, obviando la necesidad de consentimiento informado.
Análisis estadístico
Los análisis fueron llevados a cabo con el programa estadístico STATA® versión 12 (StataCorp LP, College Station, Texas, EUA). El objetivo primario fue estudiar la relación entre la administración de NPT y recibir TRR en la UTI. Los objetivos secundarios fueron conocer las diferencias en días de estancia y mortalidad de los pacientes sometidos a TRR y los que no, al igual que a quienes se les administró NPT y a quienes no.
Las variables categóricas son reportadas en proporciones (porcentajes) y fueron examinadas con la prueba de Chi cuadrada (χ2) o prueba exacta de Fisher, según correspondía. Las variables continuas eran de distribución anormal, por lo que son reportadas en medianas [rango intercuartil] y fueron analizadas con la prueba U de Mann Whitney. Aquellas variables con un valor de p menor a 0.1 en el análisis univariado fueron incluidas en el análisis multivariado de regresión logística para TRR; los resultados de este último son reportados en razón de momios (RM).
Debido a la naturaleza retrospectiva del estudio, y para ajustar al máximo el sesgo de los pacientes que recibieron NPT, la propensión de cada individuo para recibir NPT fue determinada mediante la creación de un «índice de propensión».20 Este índice fue desarrollado en varios pasos: 1) Se realizó un análisis de regresión logística con selección anterógrada y retrógrada con «NPT» y «no NPT» como variable dependiente, manteniendo en el modelo las variables con p menor a 0.05. 2) Estas variables fueron sometidas al apareamiento por puntaje de propensión contigua 1 a 1 con reemplazos, con cada sujeto descartado con diferencia del índice de propensión de ± 5%. 3) El valor numérico de este índice para cada enfermo fue incluido como covariable en el análisis de regresión logística final para TRR. Un valor de p menor a 0.05 fue considerado significativo.
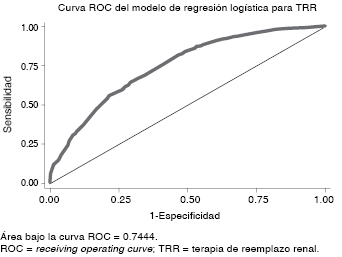
Una vez obtenido el modelo final para TRR, se probó la estabilidad del mismo mediante dos procesos. El primero con la prueba de Hosmer-Lemeshow en 10 subgrupos (deciles). El segundo mediante el muestreo bootstrap de 500 repeticiones.21 Cada muestreo del mismo tamaño, elegido de manera aleatoria, y cada registro seleccionado de manera independiente; es decir, que cada registro podía ser muestreado más de una vez. Por último, una curva ROC fue creada con el modelo final para predicción de la TRR.
Resultados
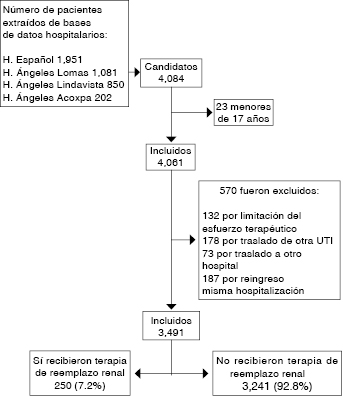
En total, de las cuatro bases de datos fueron incluidos 4,061 pacientes. Se excluyeron 570 registros, para un número final de 3,491 enfermos. El flujograma de los individuos incluidos y excluidos, así como la razón de las exclusiones, es presentado en la Figura 1.
Objetivos secundarios
En total, 250 personas recibieron TRR (7.1%). Las características basales y las variables de desenlace de los sujetos que recibieron TRR son presentadas en el cuadro I. Como era de esperarse, hubo diferencias significativas entre ambos grupos. En específico, la mediana de edad fue de 62 [47-75] años en el total de la población, mayor en aquellos que recibieron TRR (65 [55-75] versus 62 [46-74]; p = 0.001). Fue más frecuente la TRR en aquellos enfermos en quienes el ingreso se catalogó como falla orgánica (88.8% versus 57.5%; p < 0.001) y aquellos con NPT (24% versus 9.4%; p < 0.001). Las variables de desenlace, como días en la UTI (3.7 [2-8.9] versus 2.2 [1.14-4.7]; p < 0.001), días de estancia en el hospital (11 [6-21.2] versus 9.4 [5.4-16]; p = 0.007), mortalidad en la UTI (31.2% versus 10.5%; p < 0.001) y mortalidad hospitalaria (38.4% versus 15.5%; p < 0.001) fueron peores en los pacientes con TRR.
Cuadro I: Características basales y variables de desenlace en los pacientes con terapia de reemplazo renal.
| Variable | No TRR (n = 3,241) |
TRR (n = 250) |
Total (n = 3,491) |
p |
|---|---|---|---|---|
| Características basales | ||||
| Edad | 62 [46-74] | 65 [55-75] | 62 [47-75] | 0.001 |
| Masculino | 1736 (53.5%) | 148 (59.2%) | 1,607 (46%) | 0.085 |
| Factor de ingreso | < 0.001 | |||
| Falla | 1,864 (57.5%) | 222 (88.8%) | 2,086 (59.7%) | |
| Riesgo de falla | 771 (23.7%) | 20 (8%) | 2,086 (59.7%) | |
| Cuidado postquirúrgico | 605 (18.6%) | 8 (3.2%) | 613 (17.5%) | |
| Cirugía de urgencia | 467 (14.2%) | 27 (10.8%) | 494 (14.1%) | 0.115 |
| Coronario | 365 (11.2%) | 16 (6.4%) | 381 (11%) | 0.018 |
| Cirugía cardiaca | 176 (5.4%) | 13 (5.2%) | 189 (5.4%) | 0.877 |
| VM | 1,836 (56.6%) | 161 (64.4%) | 1,997 (57.2%) | 0.017 |
| SAPS 3 | 15 [5.1-37] | 37 [16.7-64] | 16 [6-39] | < 0.001 |
| NPT | 307 (9.5%) | 60 (24%) | 367 (10.5%) | < 0.001 |
| NE | 725 (22.3%) | 102 41%) | 827 (23.7%) | < 0.001 |
| Desenlace | ||||
| Días en la UTI | 2.2 [1.14-4.7] | 3.7 [2-8.9] | 2.3 [1.2-4.8] | < 0.001 |
| Días en el hospital | 9.4 [5.4-16] | 11 [6-21.2] | 9.5 [5.4-17] | 0.007 |
| Mortalidad en la UTI | 341 (10.5%) | 78 (31.2%) | 419 (12%) | < 0.001 |
| Mortalidad en el hospital | 502 (15.5%) | 96 (38.4%) | 598 (17.1%) | < 0.001 |
Los datos son número total (porcentajes) y mediana [rango intercuartil], según el tipo de variable.
TRR = terapia de reemplazo renal; VM = ventilación mecánica; NPT = nutrición parenteral; NE = nutrición enteral; UTI = unidad de terapia intensiva; SAPS 3 = simplified acute physiology score 3.
En total, 367 (10.5%) individuos recibieron NPT y 827 (23.6%) algún tipo de NE. Las características basales y variables de desenlace en quienes se administró NTP son presentadas en el cuadro II. La administración de NPT fue más frecuente en aquellos con falla orgánica como factor determinante de ingreso (74% versus 58%; p < 0.001), en los que ingresaron por cirugía de urgencia (22.8% versus 13.1%; p < 0.001), en los ventilados mecánicamente (74% versus 55.2%; p < 0.001) y en los que recibieron TRR (16.3% versus 6%; p < 0.001). De manera similar, casi todas las variables de desenlace eran significativamente mayores en los sujetos que recibieron NPT, incluyendo días de UTI (7.5 [3.8-14] versus 2.04 [1-4]; p < 0.001), días de estancia en el hospital (21 [12-36.5] versus 8.7 [5.1-15-1]; p < 0.001) y mortalidad hospitalaria (24.2% versus 16.3%; p < 0.001).
Cuadro II: Características basales y variables de desenlace en los pacientes con nutrición parenteral.
| Variables | No NPT (n = 3124) |
NPT (n = 367) |
Total (n = 3491) |
p |
|---|---|---|---|---|
| Características basales | ||||
| Edad | 62 47-74] | 62 [45-76] | 62 [47-75] | 0.601 |
| Masculino | 1,689 (54%) | 195 (53%) | 1,607 (46%) | 0.735 |
| Factor de ingreso | < 0.001 | |||
| Falla | 1,814 (58%) | 272 (74%) | 2,086 (59.7%) | |
| Riesgo de falla | 737 (23.6%) | 54 (14.7%) | 791 (22.6%) | |
| Cuidados postquirúrgicos | 572 (18.3%) | 41 (11.2%) | 613 (17.5%) | |
| Cirugía de urgencia | 410 (13.1%) | 84 (22.8%) | 494 (14.1%) | < 0.001 |
| Coronario | 374 (12%) | 7 (1.9%) | 381 (10.9%) | < 0.001 |
| Cirugía cardiaca | 189 (6%) | 0 | 189 (5.4%) | < 0.001 |
| VM | 1,726 (55.2%) | 271 (74%) | 1,997 (57.2%) | < 0.001 |
| SAPS 3 | 15 [5.7-38] | 28 [9-48] | 16 [6-39] | < 0.001 |
| TRR | 190 (6%) | 60 (16.3%) | 250 (7.1%) | < 0.001 |
| NE | 634 (20.3%) | 193 (52.6%) | 827 (23.7%) | |
| Desenlace | ||||
| Días en la UTI | 2.04 [1-4] | 7.5 [3.8-14] | 2.3 [1.2-4.8] | < 0.001 |
| Días en el hospital | 8.7 [5.1-15.1] | 21 [12-36.5] | 9.5 [5.4-17] | < 0.001 |
| Muertos en la UTI | 375 (12%) | 44 (12%) | 419 (12%) | 0.09 |
| Muertos en el hospital | 509 (16.3%) | 89 (24.2%) | 598 (17.1%) | < 0.001 |
Los datos son número total (porcentajes) y mediana [rango intercuartil], según el tipo de variable.
TRR = terapia de reemplazo renal; VM: ventilación mecánica; NPT: nutrición parenteral; NE: nutrición enteral; UTI: unidad de terapia intensiva; SAPS 3: simplified acute physiology score 3.
Objetivo primario
Tras el análisis logístico de regresión con selección retrógrada y anterógrada con NPT como variable dependiente, las variables incluidas en la elaboración del «índice de propensión» fueron los días de estancia en la UTI, la nutrición enteral, el ser catalogado como quirúrgico de urgencia, el uso de ventilación mecánica, los días de estancia en el hospital y el diagnóstico de enfermedad coronaria. Los resultados del índice de propensión son presentados en el Cuadro III.
Cuadro III: Variables incluidas en el modelo final de regresión logística para nutrición parenteral total e índice de propensión.
| NPT | Coeficiente | Error estándar | Z | Valor de p | IC (95%) | |
|---|---|---|---|---|---|---|
| Días de UTI | 0.068 | 0.007 | 8.61 | 0.000 | 0.05 | 0.08 |
| NE | 0.722 | 0.138 | 5.22 | 0.000 | 0.45 | 0.99 |
| Quirúrgico urgente | 0.717 | 0.144 | 4.96 | 0.000 | 0.43 | 1.00 |
| VM | 0.368 | 0.134 | 2.74 | 0.006 | 0.10 | 0.63 |
| Días hospital | 0.003 | 0.001 | 2.75 | 0.006 | 0.00 | 0.00 |
| Coronarios | -1.30 | 0.391 | -3.34 | 0.001 | -2.07 | -0.54 |
| Índice de propensión | ||||||
| T-Estadística | Variable | Muestra | Tratado | Control | Diferencia | EE |
| 7.27 | TRR | No pareado | 0.163 | 0.060 | 0.102 | 0.014 |
| 3.36 | PET | 0.163 | 0.073 | 0.089 | 0.026 | |
NPT = nutrición parenteral total; UTI = unidad de terapia intensiva; NE = nutrición enteral; VM = ventilación mecánica; TRR = terapia de reemplazo renal, PET = promedio del efecto de tratamiento en los tratados; EE = error estándar.
Este índice fue incluido como covariable en el análisis de regresión logística para TRR. Además, se incluyeron las variables con p < 0.1 en el nivel α, que fueron edad, género masculino, el factor determinante de ingreso (referencia «cuidado postquirúrgico»), diagnóstico de enfermedad coronaria, el uso de ventilación mecánica, la mortalidad predicha por SAPS 3 en porcentaje y la administración de NPT y NE. Los resultados de este análisis son presentados en el Cuadro IV. Se mantuvieron como significativas en el modelo final el género masculino (RM 1.35, IC 95% [1.03 - 1.78]; p = 0.030), el ingreso por falla orgánica (RM 5.54, IC 95% [2.67-11.5]; p < 0.001), la mortalidad predicha por SAPS 3 (RM 1.01, IC 95% [1.009-1.02]; p < 0.000) y el uso de NPT (RM 2.17, IC 95% [1.52-3.11]; p < 0.000).
Cuadro IV: Variables incluidas en el modelo final de regresión logística para terapia de reemplazo renal y resultados del análisis bootstrap .
| TRR | RM | p | IC (95%) | Sesgo (Bootstrap Bias) |
|
|---|---|---|---|---|---|
| Edad | 1.003 | 0.442 | 0.995 | 1.011 | 0.000 |
| Género masculino | 1.355 | 0.030 | 1.030 | 1.784 | 0.002 |
| Falla orgánica† | 5.548 | 0.000 | 2.675 | 11.509 | 0.057 |
| Riesgo de falla† | 1.866 | 0.141 | 0.813 | 4.282 | 0.043 |
| Coronario | 0.906 | 0.735 | 0.514 | 1.596 | -0.042 |
| VM | 0.838 | 0.241 | 0.624 | 1.125 | -0.001 |
| SAPS 3 | 1.014 | 0.000 | 1.009 | 1.020 | -8.95 |
| NPT | 2.177 | 0.000 | 1.523 | 3.111 | 0.002 |
| NE | 1.245 | 0.215 | 0.879 | 1.763 | 0.004 |
| IP | 1.858 | 0.270 | 0.617 | 5.592 | 0.031 |
† Versus cuidado postquirúrgico.
TRR = terapia de reemplazo renal; RM = razón de momios; NPT = nutrición parenteral total; NE = nutrición enteral; VM = ventilación mecánica; SAPS 3 = simplified acute physiology score 3, PET = promedio del efecto de tratamiento en los tratados; IP = índice de propensión.
El análisis de bondad de ajuste (goodness of fit) de Hosmer-Lemeshow resultó con una χ2 de 1.84 (p = 0.98). De igual manera, tras 500 replicaciones bootstrap se estimaron sesgos (bias) insignificantes, muy cercanos a cero, lo que denota que el modelo era estable. El área bajo la curva ROC para predecir TRR con el modelo final era de 0.74, y la gráfica es presentada en la Figura 2.
Discusión
Hallazgos principales
Condujimos este estudio multicéntrico, retrospectivo y observacional en cuatro UTI para examinar la relación de la administración de NPT y la TRR durante la estancia en la UTI. Encontramos una asociación independiente entre ellas. Adicionalmente, se agrega evidencia a lo ya conocido: la estancia en la UTI y en el hospital de los pacientes que reciben TRR es más prolongada y su mortalidad es significativamente mayor.22
Relación con estudios previos
No hay estudios aleatorizados, hasta nuestro conocimiento, que analicen las posibles complicaciones renales de la NPT. Sin embargo, los efectos secundarios de la administración de NPT sobre la función renal han sido descritos previamente. El estudio más significativo fue realizado por Rhee y colaboradores.23 Ellos ejecutaron un análisis retrospectivo en todos los pacientes consecutivos ingresados a una unidad de trauma durante seis años. Observaron los resultados de 2,964 individuos, de los cuales 464 habían sido tratados con NPT. Después de un análisis de regresión logística y el ajuste para diferentes factores, se encontró una mayor incidencia en la falla renal en sujetos con NPT (8.6% versus 1%, RM 2.8; p = 0.007). Esta significancia se mantuvo al excluir a los de estancia menor a dos días (8.8% versus 1.1%, RM 2.8; p = 0.009) y tras el análisis de apareamiento con controles (27% versus 5%; p < 0.001).
En un subanálisis de un estudio prospectivo multicéntrico aleatorizado24 realizado en 2013, Gunst y su grupo encontraron que la nutrición parenteral temprana no tiene impacto en la incidencia de lesión renal aguda (LRA); sin embargo, puede retrasar la recuperación renal del estadio 2 (5 [3-9] versus 4 [2-6] días; p = 0.04).24 Esto se explicaría por la teoría que expone que los aminoácidos administrados en la NPT pueden ser degradados hacia urea.24 Macías y sus colegas incluso sugieren que las dosis elevadas de proteínas en pacientes con LRA podrían aumentar el catabolismo.25 Estos hallazgos fueron respaldados por las conclusiones de Fiaccadori y su equipo, quienes señalan que dosis elevadas de hasta 40 kcal/kg/d no mejoran los resultados y podrían aumentar los efectos secundarios.26 Un efecto deletéreo de los aminoácidos ha sido reportado también en modelos animales de lesión renal aguda27 y sobre el endotelio vascular sistémico.18
Buchman y colaboradores demostraron complicaciones renales en un grupo de adultos que recibieron NPT durante tiempo prolongado. El aclaramiento de creatinina se redujo 3.5 ± 6.3% por año (p = 0.004). La función tubular, determinada por la reabsorción tubular de fosfato, estuvo afectada en el 52% de los participantes.28 A pesar de que hallazgos similares han sido descritos en otros estudios con NPT crónica,29 sería aventurado extrapolarlos al paciente crítico.
Las consecuencias metabólicas de la NPT podrían influenciar la evolución renal. Se ha reportado acidosis metabólica,30 hiperglucemia, sobrecarga hídrica y alteraciones electrolíticas,31 por lo que se recomienda un estricto monitoreo.31,32
Implicaciones del estudio
El hallazgo de que la NPT está relacionada con la TRR, incluso después del ajuste para diferentes factores de confusión, es importante y concuerda con nuestra hipótesis. El uso de NPT es bastante común, pero según nuestro conocimiento, hasta ahora no había sido evaluada como factor de riesgo para TRR. El que se mantenga la asociación estadística incluso después del ajuste para la propensión de cada individuo a recibir NPT y las características basales, sugiere que una evaluación formal y mejor planeada del rol de la NPT en la UTI debe llevarse a cabo.
Fortalezas y limitaciones
Este estudio tiene varias fortalezas, la principal es la característica multicéntrica y, por ello, haber incluido a casi 3,500 pacientes. Además, el llenado de la BASUTI de manera prospectiva con un responsable de los datos en cada hospital y las auditorías frecuentes optimiza la calidad de los datos. Por último, nuestro trabajo incluyó una evaluación estadística multifacética de la posible relación independiente entre NPT y TRR, ajustando para diferentes covariables, incluyendo la propensión de cada individuo para recibir NPT.
Sin embargo, esta investigación tiene también muchas limitaciones. Primeramente, aquellas inherentes a la naturaleza retrospectiva y a la restricción de las variables disponibles. La BASUTI es una base de datos administrativa que, a pesar de tener como uno de sus objetivos la investigación clínica, no fue diseñada con el propósito específico de este trabajo. Adicionalmente, al no tener variables dependientes de tiempo, no pudimos determinar si la NPT fue administrada antes o después de la indicación de TRR. Esto podría ser resuelto en el futuro con estudios prospectivos que incluyan variables dependientes de tiempo. El tipo de estudio per se restringe la posibilidad de extraer conclusiones causa-efecto.
Conclusiones
La administración de NPT en la UTI está relacionada con recibir TRR incluso después del ajuste a varios cofactores, incluyendo la propensión de cada sujeto a recibir NPT. Dentro de las limitaciones de este estudio multicéntrico y retrospectivo, los resultados sugieren que la administración de NPT podría considerarse factor de riesgo para recibir TRR durante la estancia en la UTI. Debido a la frecuencia con la que la NPT es indicada, y lo poco que se conoce el efecto de las posibles complicaciones en los resultados de los pacientes, la planeación de un estudio prospectivo aleatorizado diseñado para observar la relación de NPT con TRR es tanto racional como deseable.











 nova página do texto(beta)
nova página do texto(beta)