Introducción:
La enfermedad renal crónica es un conjunto de trastornos irreversibles con estructura y función alterada de los riñones; las guías internaciones The National Kidney Fondation (NKF) la han definido, como una disminución de la tasa de filtración glomerular menor de 30 mL / min / 1.73 m2durante un periodo mayor de tres meses, lo que equivale a una pérdida de la masa renal mayor del 50 % 1. Mientras que en adultos la principal causa es la relacionada a diabetes e hipertensión arterial complicada, en niños varía con la edad, zona geográfica y factores genéticos 2. En niños menores de 6 años presentan anomalías congénitas o hereditarias como enfermedad renal poliquística o síndrome de Alport, niños mayores de seis años se atribuye a glomerulopatías 3.
Epidemiológicamente afecta el 10% de la población mundial, existe una repercusión social ascendente por la condición de vida, la urbanización y la mala higiene; activando efectores inmunes favoreciendo el desarrollo de glomerulopatías 4. En países de alto desarrollo como Estados Unidos de Norteamérica su incidencia es de tres casos por millón de habitantes (cpmh) menores de 20 años 5, en América Latina es de 14 cpmh 6; otros países como España aumenta hasta 30 a 40 cpmh al año. Para el 2009, en México se estimó de 3000 a 6000 casos en menores de 15 años con una mortalidad del 35%, a causa de la poca posibilidad de acceder algún sistema de seguridad social 7.
El trasplante renal es el tratamiento preferido para los niños con enfermedad renal crónica y conduce a una mejor calidad de vida, crecimiento óptimo y supervivencia a largo plazo en comparación a un tratamiento sustitutivo. La supervivencia del injerto por donante fallecido y donante vivo en cinco años ha mejorado de 78.8% y 84.3% respectivamente 8; gracias a las mejorías en inmunosupresión. Los resultados del trasplante renal pediátrico son menores que en los adultos por la perdida aguda del injerto, atribuido a factores como un peso menor a 10 kilogramos, una disfunción cardiaca que no pueda mantener el gasto cardiaco ( Disfunción diastólica, miocardiopatía dilatada), trasplante en bloque o aquellos pacientes que no han recibido un tratamiento sustitutivo.
En el 2016 se realizaron 26 trasplantes renales en el Instituto Nacional de Pediatría, diez de donador vivo relacionado y 16 de donador cadavérico; con un incremento del 64.7% en los últimos 10 años 9, influido por una reducción en la estancia hospitalaria y el gasto económico.
Fisiopatológicamente la enfermedad renal crónica terminal cursa con alteraciones cardiovasculares, hematológicas, endocrinas; compartibles con un síndrome urémico, nefrótico y nefrítico. Es considerado como un paciente con alto grado de complejidad anestésica, caracterizados por una serie de eventos:
Renales: Es determinante la diuresis residual y el tratamiento sustitutivo empleado en las ultimas 24 horas, los niños pueden ser poliúricos, oligúricos o anúricos; la distribución alterada de liquido produce reducción de proteínas, edema y alteraciones electrolíticas incluyendo hiponatremia, hipernatremia, hipocalcemia e hipofosfatemia; la acidosis metabólica crónica es un factor común 10.
Cardiovascular: Las secuelas inducidas por la uremia son insuficiencia cardiaca congestiva e hipertensión arterial; la mayoría de los pacientes son tratados con bloqueadores beta, lo cual se recomienda continuar con el tratamiento en el período perioperatorio, mientras que otros, como los inhibidores de la enzima convertidora de la angiotensina I y II deberían ser suspendidos siete días previos debido al riesgo de hipotensión severa y refractaria en el perioperatorio 11.
Hematológicos: Anemia normocitica normocrómica crónica exacerbada por la supresión de medula ósea y hemolisis temprana, la capacidad de transporte de oxigeno se encuentra alterada por su desplazamiento hacia la derecha por aumento y compensación de 2,3 difosfoglicerato 12. Los pacientes pueden ser coagulopáticos por una disfunción plaquetaria y la aplicación de heparina sistémica residual después de diálisis peritoneal.
El manejo anestésico debe mantener las mejores condiciones para el injerto, el uso de técnicas regionales, han dado buenos resultados en pacientes adultos, sin embargo por el riesgo de hematomas originados por coagulopatía, no es de uso común en el paciente pediátrico. La anestesia general balanceada o intravenosa son técnicas de elección seguras, los halogenados como el sevoflurano no ha demostrado ser un riesgo clínicamente significativo por el compuesto A, por lo que puede ser usado 13. El desflurano parece ser seguro en el paciente nefrópata, al menos en la literatura disponible no se ha reportado evidencia conclusiva que demuestre lo contrario. Una reducción en la unión a proteínas y la semivida prolongada de fármacos con eliminación renal, es conveniente hacer una reducción del 25 % en dosis total en opioides e inductores 14. Los relajantes de mayor uso, atracurio y cisatracurio, poseen un mecanismo de eliminación tipo Hoffman (limitado por alteraciones metabólicas de pH y temperatura) con un bioproducto neurotóxico, la laudanosina metabolizada por el hígado 14.
Las metas principales en el perioperatorio son cambios hemodinámicos mínimos, promover diuresis y evitar vasoespasmo de la arterial renal; para ello es necesario mejorar sus condiciones vitales clasificadas por etapas en el trasplante renal pediátrico. La Fase prerenal, que va desde la inducción anestésica hasta la disección, se mantiene con fluidoterapia para perdidas insensibles obteniendo presiones venosas centrales (PVC) entre 8 a 10 cm de H2O 14, asegurando la perfusión satisfactoria a base de cristaloides.
En la fase de anastomosis, se realiza una cirugía de banco, con reparación de vena, arteria renal y uréter; no se recibe de un estimulo quirúrgico, sin embargo, se debe de optimizar la expansión agresiva de volumen intravascular, incrementando la precarga con cristaloides y albúmina a 0.5 g/Kg; es aconsejable no sólo por su efecto volumétrico sino por que se asocia a menores concentraciones séricas de creatinina en el posoperatorio y mejoría en la tasa de filtración glomerular inicial. Signos vitales ideales (PVC) entre 10 a 15 cm de H2O y tensiones arteriales sistólicas mayores de 120 mm de Hg 15. El uso de diuréticos protege al injerto de contrarrestar la respuesta elevada a la hormona antidiurética desencadenada por el estrés quirúrgico, el uso de manitol en dosis bajas previo al despinzamiento, es profiláctico de lesión isquémica cortical renal 15.
La ultima fase de revascularización y anastomosis del uréter, etapa critica cuyo objetivos previos con estabilidad hemodinámica y la reposición adecuada de volumen, serán dependientes de la discrepancia de tamaño del órgano trasplantado y del secuestro sanguíneo; provocando una respuesta hemodinámica dramática, recurriendo a agentes vasoactivos (Dopamina y norepinefrina) común cuando otras medidas han fallado; aunque su uso es cuestionado por múltiples estudios 16. Los diuréticos de asa después del pinzamiento mejoran la función renal alterada, pero la evidencia no es clara, el más usado es furosemida a dosis de 1 mg/kg.
Los avances en el tratamiento inmunosupresor han disminuido la frecuencia del rechazo agudo y aumentado la supervivencia a largo plazo del injerto renal en niños. La mejor estrategia es la administración minutos tras la reperfusión del órgano, generalmente administrado por el anestesiólogo; una falla en el tratamiento implicaría un rechazo hiperagudo, resultado de una trombosis masiva y pérdida inmediata del injerto 17. Una trombosis en la anastomosis es causa del 9.8% de las pérdidas de injertos renales en niños, por lo que debe plantearse el uso de heparina de bajo peso molecular en función del riesgo - beneficio en cada caso 18.
Descripción del caso:
Se presenta el caso de un paciente escolar con enfermedad renal terminal, programado para trasplante renal de donador vivo relacionado (Madre). Se trata de femenino de ocho años con ocho meses de edad, con diagnostico de enfermedad renal crónica tubulointersticial estadio V; ingresa al Instituto Nacional de Pediatría, el 28 de julio del 2016 al presentar astenia, adinamia y palidez generalizada; alteración en los laboratorios con urea de 240 mg/dL, BUN 112 mg/dL, creatinina de 6.22 mg/dL, hemoglobina 6.4 gr/dl; su tasa de filtración glomerular 4.8 ml/SC/min. Se inicio tratamiento sustitutivo a base de diálisis peritoneal con volumen de 800 ml de solución al 1.5%, cuatro recambios, tres horas de estancia en cavidad; para ello, se programo para colocación de catéter tenchkoff el 31 de julio del 2016, realizado con anestesia regional y sedación sin complicaciones durante el procedimiento.
A la exploración física, neurológicamente alerta, orientada y cooperadora con un Glasgow de 15 puntos, cardiopulmonar sin datos patológicos, fenotípicamente femenina tanner 1; extremidades hipotrofias, pulsos distales de buena intensidad y llenado capilar de dos segundos; una diuresis residual entre 100- 300 ml por día.
Cuanta con valoración por cardiología, con electrocardiograma ritmo sinusal con frecuencias de 100 lpm, sin crecimiento de cavidades cardiacas; ecocardiograma con tabique interauricular e interventricular íntegros, función ventricular conservada, FEVI 60% sin hipertensión arterial pulmonar. Estudios de gabinete, con ultrasonografía de riñón derecho con medidas de 5.3 x 2.3 x 2.6 cm, riñón izquierdo con dimensiones de 5.1 x 2.5 x 3.1 cm, ambos con aumento de ecogenicidad y perdida de la relación corticomedular. Laboratorios previo a procedimiento quirúrgico, con hiperazoemia BUN 100, creatinina 6.4 urea 214; gasométricamente con acidosis metabólica crónica hiperlactatemica esperada, el hemograma, electrolitos y tiempos de coagulación no presentaban alteraciones.
Tratamiento anestésico:
Se realiza monitorización invasiva, con signos vitales basales con tensión arterial: 101/62 mm Hg, frecuencia cardiaca: 100 lpm, frecuencia respiratoria: 20 rpm, temperatura: 36.5 °C, peso seco: 16.6 kg, talla 115 cm, volumen sanguíneo de 1040 mL y sangrado permisible de 118 mL. Inducción intravenosa para anestesia general balanceada con midazolam 1 mg, fentanilo 68 μg, lidocaína 16 mg, cisatracurio 2.5 mg y propofol 30 mg; intubación traqueal sin incidentes, mantenimiento con desflurane a CAM de 0.9 a 0.6, FiO2 50%, infusión continua con fentanilo (3-5 ng/kg/min). Gasometría inicial con acidosis metabólica hiperlactemica compensada esperada, para la fase de anastomosis se administro una precarga de cristaloides a 15 mL/kg y albumina al 5% a dosis de 0.5 g/kg, manteniendo balances positivos, tensiones arteriales sistémicas mayor a 110 mm Hg, tensiones arteriales medias 75 mm Hg, presiones venosas centrales entre siete a 12 cm de H2O, temperatura 36.2 ºC y profundidad anestésica monitorizado por índice biespectral 40-50.
En la fase de reperfusión del injerto presenta sangrado masivo inmediato de 1800 mL en hilio renal, requiriendo desarmar la anastomosis y realizar una nueva cirugía de banco, para reparación de vena y arteria renal. Hemodinámicamente inestable con presión arterial media 40 mm Hg, taquicardia de 163 lpm, gasométricamente con acidosis metabólica severa, a los cinco minutos del despinzamiento con lactato seis y hemoglobina 5.8 g/dL. Requirió maniobras de transfusión masiva: 1385 mL de concentrados eritrocitarios, plaquetas 180 mL, crioprecipitados 40 mL, plasma fresco 331 mL, terapia hídrica con albumina 5 % al completar dosis de 1.5 gr/kg en total. Continua con un sangrado difuso en capa en el lugar de la herida, con una perdida sanguínea total de 2800 mL correspondientes a tres volúmenes sanguíneos circulantes del paciente, se realiza una tromboelastografía con alteración en el índice de lisis del coagulo con un valor del 95% ( Valores normales de LY30 es 0-8 %) presentando un estado de hiperfibrinolisis secundario al shock hipovolémico; como tratamiento de elección se administró ácido tranexámico 160 mg i.v. (Dosis de 10 mg/kg) en dosis única. Al termino de procedimiento con reperfusión del injerto, ausencia de sangrado, estabilidad hemodinámica y con apoyo de norepinefrina a 0.1 - 0.02 μg/k/min en disminución paulatina manteniendo tensiones arteriales sistémicas de 100 mm Hg, presiones venosos centrales 5-7 cm H2O, frecuencia cardiaca de 120 lpm, temperatura de 35.8 ºC. Aporte de líquidos totales por reposición con balances hídricos positivos, ausencia de uresis, mejoría de acidosis metabólica con lactato 4.2, hemoglobina de 8.4 y potasio 5.3; tromboelastografía de control dentro de valores normales sin demandar de hemoderivados y antifibrinoliticos. Requiere de ventilación mecánica asistida, sedación con midazolam y fentanilo con RASS-5; condiciones que permiten el traslado a unidad de cuidados intensivos.
Evolución a las 72 horas, con hemodinamia estable ya sin aporte de vasopresores, una extubación exitosa y diuresis de 145 mL/h; se realiza ultrasonografía doppler del injerto con las estructuras vasculares de calibre y trayecto normal, con adecuada repleción de color lo que demuestra conservación de los patrones y velocidades espectrales normales, hasta este momento se descarta trombosis en anastomosis y datos de rechazo renal. Sin embargo presenta dos eventos de crisis convulsiva tónico-clónica con diagnostico de epilepsia focal motora. (Figura 1), muestra TAC cerebral simple con una zona de hiperdensidad en región parietal derecha sugestivo a un evento hemorrágico parenquimatoso y una zona hipodensa posterior occipital correspondiente a un evento isquémico agudo (Figura 2).
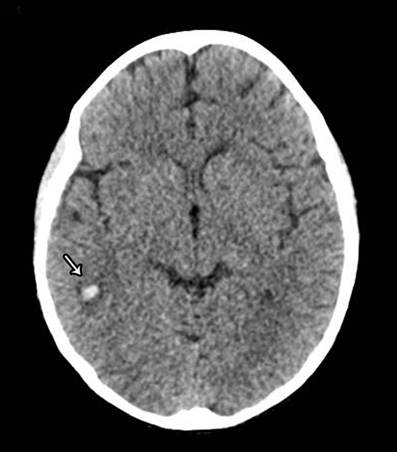
Figura 1 Tomografía axial computarizada cerebral simple que muestra una hiperdensidad en región parietal derecha sugestivo a un evento hemorrágico parenquimatoso
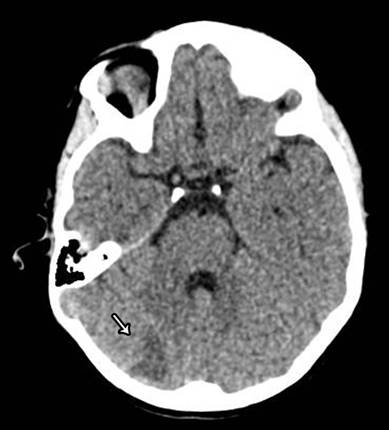
Figura 2 Tomografia axial computarizada cerebral simple con una zona hipodensa occipital posterior de un evento isquémico agudo transitorio.
La valoración por neurología determina una posible complicación de transfusión masiva o neurotoxicidad por el uso ácido tranexámico, aun con dosis únicas al tratarse de un fármaco con eliminación exclusivamente renal; actualmente no ha presentado un nuevo evento de epilepsia ni deterioro cognitivo.
Discusión:
Una hemorragia implica un elevado riesgo vital y pese a instaurar todas las medidas terapéuticas el paciente tiene muy alta probabilidad de requerir una transfusión. El sangrado masivo en pediatría se define como la pérdida del 50% de un volumen sanguíneo en 3 horas o el 20 % del volumen en menos de una hora, predisponiendo al paciente a la tríada letal de hipotermia, acidosis y coagulopatía 19. No existe consenso sobre el manejo de sangrado activo perioperatorio en pacientes sometidos a trasplante renal al tratarse de un procedimiento con sangrado mínimo; nuestro manejo anestésico fue dirigido en función a metas para evitar rechazo temprano del injerto con terapia hídrica de 15 a 30 mL/kg/h manteniendo PVC 9 a 12 mm Hg, presiones sistólicas >120 mm Hg, tensión arterial media > 70; 20sin embargo pese a las técnicas empleadas existió un fallo en la perfusión del injerto a los pocos minutos del despinzamiento por lesión en la anastomosis, requirió de transfusión masiva por la perdida de tres volúmenes sanguíneos circulantes y amerito de vasopresores para mejorar sus condiciones vitales.
En estas circunstancias, se considera transfusión masiva, siendo relevante un buen abordaje terapéutico y considerando las complicaciones inherentes como una mortalidad del 45%, eventos tromboembólicos en 12% y de forma más frecuente hipocalcemia, hipercalemia, hipomagnesemia y acidosis metabólica 21. La isquemia occipital de nuestro paciente presentada a las 72 horas pudiera ser secuela de la transfusión masiva sin descartar la posibilidad de alteraciones microcirculatorias y el desarrollo de convulsiones relacionados con el uso de ácido tranexámico, específicamente en pacientes con insuficiencia renal aún con dosis única de 10 mg/kg 22.
Las estrategias de reanimación previas para la hemorragia por trauma incluían la administración temprana de grandes volúmenes de cristaloides con posterior administración de plasma para tratar una coagulopatía que evolucionaba gradualmente a hemodilución, hipotermia y acidosis. Sin embargo, la identificación oportuna en víctimas de trauma desencadenó una reevaluación de esta estrategia, la tromboelastometría y tromboelastografía describen la interacción entre factores de coagulación, fibrinógeno, plaquetas y sistema fibrinolítico en sangre entera, en tiempo real, permitiendo la toma de decisiones terapéuticas especificas en determinadas situaciones clínicas de emergencia con sangrado crítico quirúrgico 23. Los antecedentes previos de transfusión de sangre perioperatoria en pacientes con trasplante renal se asocia con una peor supervivencia del injerto y del paciente, aumenta 7.2 veces el riesgo de rechazo hiperagudo a diferencia de aquellos que no han recibido una transfusión 24. La sustitución adecuada de perdidas sanguíneas en nuestro paciente y el establecimiento de terapias farmacológicas como el ácido tranexámico, el cual es útil para pacientes que experimentan fibrinólisis excesiva, justificado y demostrado por tromboelastografía 25.
El ácido tranexámico, derivado del aminoácido lisina, inhibe competitivamente la activación del plasminógeno a plasmina, impidiendo la degradación de coágulos sanguíneos 26. En el gran estudio observacional PED-TRAX de 766 pacientes menores de 16 años de edad sometidos a cirugías mayores de columna vertebral, cardíovasculares y craneofaciales, con la administración previa de ácido tranexamico a dosis de 5 - 20 mg por kilogramo en bolo, condujo a una disminución de la pérdida de sangre y una menor necesidad de transfusión de productos sanguíneos. Ninguno de los estudios identificó riesgos significativos, como aumento de eventos tromboembólicos 27.
La dosis recomendada de ácido tranexamico en pacientes adultos con función renal normal es de 500 mg de tres a cuatro veces al día, la eliminación de este fármaco es 95% renal, la dosis con insuficiencia renal debe reducirse progresivamente y puede ser tan bajo como 250 mg en 48 horas 28. A pesar de su papel beneficioso en cirugías de trauma y quirúrgicas, ha demostrado tener efecto epileptogénico en dosis altas; el riesgo es 14 veces más, en pacientes con enfermedad renal crónica 29.
Los mecanismos exactos de convulsión inducida por el antifibrinolitico son inciertos; se ha evidenciado vasoespasmo y trombosis que reduce el flujo sanguíneo provocando lesión isquémica cerebral. Otro mecanismo es a través de la inhibición de glicina y ácido aminobutírico tipo A, receptores cruciales para mantener un equilibrio entre neurotransmisores excitatorios e inhibitorios del sistema nervioso central 30.
Una preocupación potencial en el uso de ácido tranexamico a dosis altas, en donantes de riñón fallecidos por coagulación intravascular diseminada, es la presencia de microtrombos en los injertos y la presencia de anemia hemolítica clínicamente significativa en el receptor; generalmente estos efectos adversos ocurren con una frecuencia muy baja 31.
Conclusiones:
Las complicaciones quirúrgicas en los receptores de trasplante renal pediátrico y adolescente pueden minimizarse si se utilizan los principios básicos de técnicas de trasplante cuidadoso. La pronta identificación y el tratamiento de cualquier complicación son críticos para la supervivencia del injerto y el paciente.
El ácido tranexamico se utiliza con frecuencia en la práctica clínica para la prevención y tratamiento de diversos trastornos de coagulación, es efectivo para reducir los requerimientos de transfusión sanguínea. La neurotoxicidad podría ocurrir en pacientes con enfermedad renal terminal después de una dosis mínima intravenosa, por lo que no debe usarse en pacientes con trastornos convulsivos preexistentes. Los pacientes deben ser estrechamente monitorizados para la detección de síntomas neurotóxicos, la dosificación debe ser reajustada e individualizada; sin embargo en pacientes pediátricos no existe una recomendación específica sobre el ajuste de dosis en pacientes con falla renal.











 nueva página del texto (beta)
nueva página del texto (beta)


