Introducción
Los procedimientos de cirugía plástica (CP) de corta estancia y ambulatorios se han incrementado recientemente en más del 45.7% (1), debido a los bajos precios, a la disponibilidad global de cirujanos plásticos, las técnicas anestésicas mejores y más seguras. Este crecimiento exponencial se ha incrementado por una mayor información en los medios de comunicación, sobre todo en Internet. Cada vez más pacientes con un mayor número de enfermedades, obligan al anestesiólogo a desarrollar mejores técnicas anestésicas, usando métodos multimodales antes, durante y después de la anestesia.
Hoy en día es posible llevar a cabos procedimientos de CP ambulatoria, en personas con condiciones médicas clínicas, como isquemia miocárdica, arritmias, hipertensión arterial, desordenes de la coagulación, enfermedades pulmonares y diabetes mellitus, que en el pasado fueron impensables de realizar, etc.
Mejorar la seguridad y eficacia en todos los procedimientos anestésicos para CP es prioritario, cirujanos, pacientes, familiares y medios de comunicación, tienen su propia responsabilidad en la seguridad del paciente. La anestesia local, los bloqueos de los nervios del plexo, las técnicas neuroaxiales han sido reportadas con excelentes resultados, la aceptación y confort del paciente también han sido garantizados. Los procedimientos anestésicos espinales, epidurales o anestesia espinal-epidural combinada, han alcanzado un uso generalizado en pacientes de CP ambulatoria por debajo del nivel espinal T3-T4, también han sido aceptados por cirujanos y pacientes debido a su rápido inicio, fácil administración, costos bajos, efectos secundarios mínimos y pocas complicaciones. Los procedimientos ambulatorios como la liposucción, los implantes de glúteos o de pantorrilla y muchos más, se hacen con seguridad bajo anestesia espinal (AE). Cirugías mayores como la abdominoplastia, cirugías de la parte inferior del cuerpo o cirugías combinadas, que involucran tanto la parte superior como inferior del cuerpo, son realizadas en forma segura mediante AE o epidural (2,3,4). Las agujas en punta de lápiz han sido muy aceptadas para AE, sin embargo tienen un 0-3% de posibilidades de presentar cefalea postpunción (PDPH); que representa el efecto secundario más temible de la AE.
Existen varias opciones de anestésicos locales (AL), tanto para pacientes que reciben cirugía de corta estancia o ambulatorios, estos incluyen ropivacaína, levobupivacaína, bupivacaína racémica, prilocaina, mepivacaína y articaína, procaina y cloroprocaina, la lidocaína es controversial y generalmente ya no se recomienda su utilización en AE. Los fármacos coadyuvantes intraespinales como la clonidina y la dexmedetomidina, morfina fentanilo y sufentanilo, mejoran la calidad y duración de los bloqueos espinales.
La trombosis venosa profunda y la embolia pulmonar siguen siendo las principales causas de morbilidad y mortalidad en CP (5,6,7), la AE disminuye estas complicaciones, ya que facilitan la deambulación temprana. El dolor postoperatorio puede ser controlado mediante técnicas de analgesia preventiva preoperatoria, además de los medicamentos adyuvantes inyectados en el espacio subaracnoideo.
Para los propósitos de esta lectura, definimos a la cirugía ambulatoria (CA), como aquellos casos en donde el paciente es egresado el mismo día de la cirugía, mientras que los pacientes de corta estancia, son aquellos que permanecen en la unidad de cirugía o en el hospital, un promedio de 24 horas después de cirugía.
En este mismo capítulo revisaremos las indicaciones y contraindicaciones, ventajas, desventajas y los medicamentos utilizados en AE, CA, de corta estancia, y la AE ambulatoria par procedimientos quirúrgicos plásticos.
Técnicas de anestesia subaracnoidea
Existen tres formas de AE; inyección única, anestesia espinal-epidural combinada y AE continua con pequeñas agujas espinales y catéteres.
Inyección única. Es la técnica más ampliamente usada, ya que es fácil de realizar, segura y predecible, tiene una baja incidencia de efectos secundarios y un bajo costo. La adición de medicamentos adyuvantes provee un tiempo suficiente para prolongar los procedimientos quirúrgicos plásticos y por lo tanto es la técnica ideal en este tipo de pacientes (3).
Técnica espinal-epidural combinada. Combina los beneficios de una anestesia epidural (AEP) y una AE, disminuyendo algunas de las desventajas de ambos procedimientos. Esta técnica nos permite alcanzar un nivel sensorial superior y reducir las dosis totales de AL y continuar con la técnica anestésica tanto tiempo como sea necesario (8,9). Esto es recomendable en CP de larga duración, donde se involucra el tórax, el abdomen y las extremidades en el mismo paciente. En ocasiones es difícil mantener el catéter epidural en su lugar, ya que los catéteres epidurales pueden migrar fuera del espacio epidural (10,11).
Anestesia espinal continua. Descrita por Dean en 1907 (12) e introducida por Lemmon en 1940 (13). Tuvo varias modificaciones hasta que Hurley y Lambert (14) introdujeron el uso de la técnica espinal con microcatetéres muy delgados, de tamaño 32. Actualmente este procedimiento esta subutilizado, debido al reporte de varios casos de síndrome de cauda equina (SCE) por lo cual la FDA recomendó retirar la técnica. La principal ventaja de la AE continua, es que permite reducir las dosis de AL y prolongar la duración de anestesia/analgesia y provee de muy buena estabilidad cardiovascular (15). En el campo de la CP ambulatoria y de corta estancia, puede usarse en pacientes ancianos con procedimientos prolongados por abajo del dermatoma T8. La AE se realiza siguiendo los cánones anatómicos establecidos previamente. La introducción del ultrasonido en anestesia regional es una técnica con muchas ventajas y se reserva para aquellos casos en donde la anatomía es complicada o cuando el bloqueo es anticipadamente difícil, como es el caso del obeso mórbido o cuando el paciente tiene severas alteraciones anatómicas.
Indicaciones de la anestesia espinal
Existen dos grupos de pacientes que requieren procedimientos de cirugía plástica: a) aquellos en quienes la cirugía es exclusivamente por razones estéticas, con la finalidad de verse físicamente mejor y b) aquellos en quienes se requiere el procedimiento quirúrgico por demanda profesional o social.
Hay pacientes con necesidades especiales, la mayoría de las veces requieren de un trabajo estético a la perfección, no toleran errores o complicaciones ni efectos secundarios de la anestesia o de los fármacos usados, tampoco son tolerados errores insignificantes por pequeños que sean. Estas características exigen al anestesiólogo un trabajo impecable, requieren de un delicado plan de manejo a fin de alejar posibles complicaciones y disponer de un plan alternativo en caso de presentarse.
Normalmente la AE se usa para procedimientos quirúrgicos por debajo del nivel del dermatoma T10, que involucra pelvis, periné y extremidades inferiores. Sin embargo pueden realizarse procedimientos quirúrgicos de CP ambulatoria, que involucran dermatomas de T3 y T4 con seguridad, mediante AE.
La inclinación de la mesa quirúrgica, o posición de Trendelemburg inverso permite realizar procedimientos quirúrgicos como cirugía de pecho y mamas, liposucción de espalda, o abdominoplastia junto con cirugía de mama (16,17). La (Tabla 1 y 2) muestra las recomendaciones para pacientes ambulatorios y de corta estancia, para procedimientos que pueden ser realizados mediante anestesia por bloqueo espinal, incluyendo cirugías por arriba de los dermatomas T3, T4. En algunas circunstancias es conveniente usar técnicas de anestesia espinal-epidural combinada, para tener seguridad y prolongar la duración de la anestesia, como se discutió previamente.
Tabla 1 Procedimientos de cirugía plastica ambulatoria y anestesia neuroaxial
| Cirugía | Anestesia espinal | Adyuvantes | Anestesia epidural | Adyuvantes | Anestesia espinal-epidural | Adyuvantes |
| Liposuccion | L, PPX | C, F | L, PPX | C, F | L, PPX | C, F, S |
| Lipoescultura | L, PPX | C, F | L, PPX | C, F | L, PPX | |
| Implantes gluteos e ingertos de grasa | L, PPX | C | L, PPX | C | L, PPX | C, F, S |
| Implantes de pantorrilla | L, PPX | C | L, PPX | C | L, PPX | C, F, S |
| Pechos y liposucción | PPX | C, F | L, PPX | C, F | L, PPX | C, F, S |
| Plastía de mamas | No recomendado | No recomendado | L, PPX | No recomnedado | No recomendado | No recomnedado |
| Procedimientos perineales | L, PPX | C, F | L, PPX | C, F | No recomendado | No recomnedado |
L= lidocaína, PPX = bupivacaína racemica, levobupivacaína, ropivacaina, mepivacaina. F= fentanilo, C=clonidina
Tabla 2 Procedimientos quirurgicos de cirugía plastica de corta estancia y anestesia neuroaxial
| Cirugía | Anestesia espinal | Adyuvantes | Anestesia epidural | Adyuvantes | Anestesicos espinales-epidurales | Adyuvantes |
| Abdominoplastia (simple, extendida o circular) | PPX | C, F, S o M | PPX | C, F, M | PPX | C, F, S o M |
| Abdominoplastia con cirugía de mamas | PPX | C, F, S o M | PPX | C, F, M | PPX | C, F, S o M |
| Levantamiento cuerpo inferior | PPX | C, F, S o M | PPX | C, F, M | PPX | C, F, S o M |
| Pexia de mamas | No recomendado | No recomendado | L, PPX | C, F, M | No recomendado | No recomendado |
L= lidocaina, PPX = bupivacaina racémica, levobupivacaina, ropivacaina, mepivacaina, F= fentanilo, C = clonidina, M = morfina S = sufentanilo
Contraindicaciones de la anestesia espinal
Las contraindicaciones de la AE han sido divididas en dos grupos, absoluta y relativas, como se muestra en la (Tabla 3). Las contraindicaciones de la AE han cambiado en el tiempo, debido a los avances en el equipo, tales como la aguja de diámetro pequeño en forma de punta de lápiz, las agujas espinales tipo Quincke, las cuales tienen un diseño especial en su punta. Recientemente los AL y los medicamentos coadyuvantes, han permitido mejorar la calidad y duración de la AE. Los pacientes que desean tomar un avión de regreso a casa después de recibir cirugía, no podrán recibir técnicas de AE, porque los cambios de presión dentro del avión, pueden favorecer la pérdida de líquido cefalorraquídeo, a través del orificio de la duramadre. En suma hay pocas contraindicaciones absolutas en donde la AE no se debe administrar, como es el caso de aquellos pacientes que viven lejos del sitio de donde se aplicó la AE, por el peligro de desarrollar cefalea postpunción (CPP). En el caso de desarrollar CPP es recomendable que el paciente sea tratado por personal médico en la ciudad de origen del paciente, con la finalidad de evitar problemas de tipo legal. En algunas circunstancias, es posible que el tiempo requerido de cirugía sea más largo de lo que la AE podría cubrir, en tal caso es necesario recurrir a la anestesia general al final del procedimiento quirúrgico.
Tabla 3 Contraindicaciones absolutas y relativas de la anestesia espinal
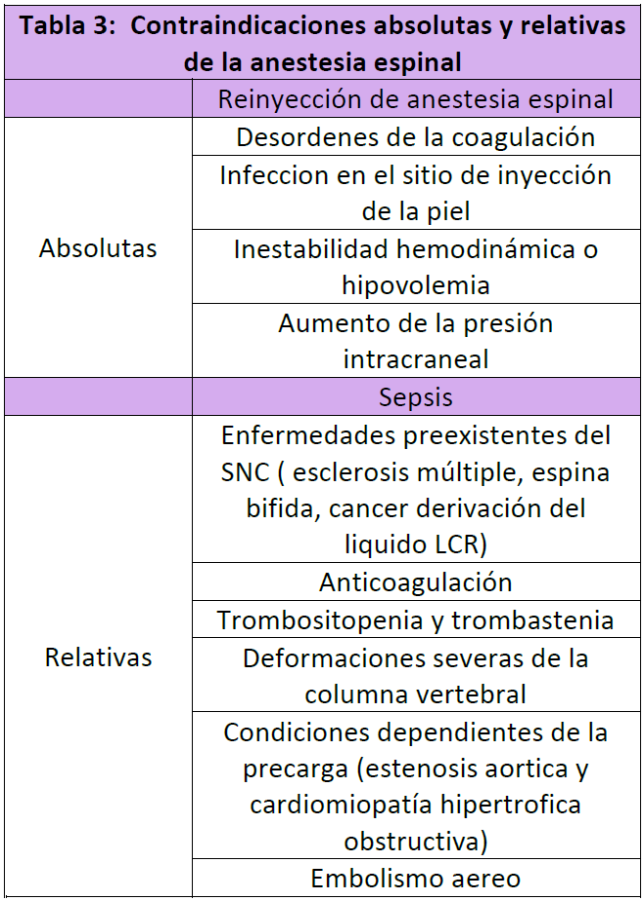
SNC = sistema nervioso central, LCR = líquido cefalorraquideo.
Las contraindicaciones absolutas y relativas se describen en el (Tabla 3).
Ventajas y complicaciones de la anestesia espinal
La AE es un procedimiento anestésico fácil, que provee un profundo y rápido bloqueo quirúrgico, mediante la inyección de pequeñas dosis de AL aplicados dentro del espacio subdural lumbar (18-19). Aunque el volumen de líquido cefalorraquídeo es el principal determinante de los efectos producidos por la inyección intratecal de AL. La duración y diseminación del AL se puede manipular fácilmente dependiente del tipo de AL, de la dosis, de la baricidad de la solución, y de la agregación de otras sustancias libres de conservadores, llamados medicamentos adyuvantes, como son opioides o alfa dos agonistas (19,20).
Aunque algunos aspectos de estos adyuvantes han sido controversiales, hoy en día se sabe que son medicamentos seguros en la AE (21). Con pocos efectos secundarios.
Ventajas. La AE para CA y para CP de corta estancia, se caracteriza por un rápido inicio, administración rápida y sencilla, además de económica, con mínimos efectos secundarios y pocas complicaciones. La técnica ofrece muchas ventajas para este tipo de pacientes, ya que puede utilizarse para procedimientos por debajo del dermatoma T3, T4, como puede ser cirugía de mama, procedimientos abdominales, liposucción y muchas otras cirugías más. La AE es más predecible y segura que la AEP o la general. La probabilidad de daño neuronal es mínima y se reduce cuando se compara con el bloqueo de nervios periféricos.
Los procedimientos de anestesia regional incluyendo el bloqueo espinal, el cual proporciona un mejor control del dolor postoperatorio, mejor preservación de la oxigenación y de la capacidad residual funcional, mejorando el flujo vascular visceral, una recuperación rápida del íleo postoperatorio y baja incidencia de enfermedad trombotica incluyendo el embolismo pulmonar.
Complicaciones y desventajas
La bradicardia y la hipotensión arterial, son los efectos secundarios más frecuentes, desde el punto de vista cardiovascular asociados a la AE, y están relacionadas a bloqueo simpático. La dosis/volumen total de AL inyectado, tiene una relación directa con la respuesta cardiovascular.
La bradicardia y la hipotensión arterial son relativamente fáciles de tratar con líquidos intravenosos y medicamentos vasoactivos. El paro cardiaco repentino es observado con una incidencia estimada de 0.7 a 0.15% (22-25). El cambio de posición del paciente y la hipovolemia son factores que se encuentran relacionados a paro cardiaco repentino, esta situación puede tomar lugar durante la liposucción extensa o durante la abdominoplastia. En estos pacientes es muy importante usar un tratamiento preventivo y establecer una terapia inmediatamente.
El daño a nervios, es la complicación más frecuente de la AE. Esto puede ser secundario a neurotoxicidad de los AL o a los medicamentos adyacentes utilizados, el daño directo de la aguja y la presencia de un hematoma o la presencia de una infección son otras de las complicaciones.
El SCE y síntomas neurológicos transitorios (TNS) debido a la irritación de las raíces posteriores de los nervios en su entrada a la medula espinal, (26) son los efectos secundarios más controversiales. Varios mecanismos han sido propuestos para explicar estas complicaciones.
La neurotoxicidad de los AL espinales fue publicada por Schneider (27). Algunos pacientes han desarrollado dolor en los glúteos y en las extremidades inferiores, después de recibir AE no complicada durante el periodo postoperatorio mediato. Numerosos artículos han descrito esta complicación de los AL espinales ya que no están libres de presentar neurotoxicidad. A esta complicación se le conoce como síndrome de irritación nerviosa transitoria (SINT) (27-30). Takenami y colaboradores (26) encontraron en las ratas, que la concentración de lidocaína inicialmente se limita a las raíces posteriores en su entrada a la medula espinal. Zong y colaboradores encontraron que la ropivacaína espinal 0.75- 1.0% induce neurotoxicidad después de inyecciones repetidas, la infiltración de células inflamatorias, vacuolación de mielina. En resumen la lidocaína espinal es la más neurotóxica, seguida en orden descendiente de la bupivacaína, levobupivacaína, ropivacaína, articaina, cloroprocaína y procaina (31).
Cefalea postpunción
La CPP es una complicación que se presenta del 0-3% cuando la aguja es en punta de lápiz o Quincke 25 a 27, la aguja 27 tipo Atraucan es otra aguja espinal especial, Ambas pueden ser usadas con seguridad. Se usan con seguridad aun en pacientes jóvenes considerados de alto riesgo para desarrollar CPP, este efecto secundario se observa rara vez, cuando se siguen los cánones de la técnica anestésica correcta (32,33). La CPP es atribuida a la pérdida de líquido cefalorraquídeo hacia el espacio extradural a través del orifico dejado y producido por la aguja espinal sobre la duramadre.
Reina y colaboradores (34) encontró que la aguja Quincke 25, produce un orificio dural bien definido sin reacción inflamatoria, mientras que la aguja Whitacree deja un orificio en la duramadre con separación e interrupción de las fibras de colágeno y un componente inflamatorio. Los autores afirmaron que el edema que ocurre por la reacción inflamatoria es responsable para el cierre del orificio de la duramadre, lo cual probablemente disminuya la incidencia de CPP por esta causa, ya que previene la pérdida de la cefalea. La CPP puede prolongar la convalecencia del paciente y ser factor determinante para la readmisión del paciente en el hospital. Entre el 70 y el 90% de las cefaleas postpunción tienden a resolverse expontanemante en una a seis semanas después de la punción. Su manejo involucra, reposo en cama, líquidos, analgésico y cafeína. El parche hemático rara vez utilizado para corregir la cefalea postpunción.
Bloqueo espinal fallido
Hay varios factores que explican el mal funcionamiento del bloqueo espinal, una de ellas es que la punta de la aguja este parcialmente dentro del espacio espinal, dosis inadecuada de anestésico local, anestésicos locales fuera de la fecha de caducidad, inyección del AL dentro del saco dural (quiste de Tarlov), fractura de la columna vertebral. Inadecuada acumulación de AL hiperbárico en las raíces sacras y en ocasiones cuando la cirugía se prolonga más allá del tiempo estimado por el AL (35). Cuando el bloqueo espinal falla deben transcurrir entre 20 y 30 minutos antes de repetir la dosis de AL, para evitar la posibilidad de efectos aditivos de la primera dosis de AL.
Es importante estar seguros de que la primera inyección de AL haya producido su máximo efecto, ya que la mayoría del AL se fija a la pared neuronal. Hay que recordar que la difusión del AL puede ser muy lento en algunos pacientes. La segunda inyección debe de ser realizada en el mismo espacio o en un espacio inmediato superior, y se recomienda no usar opioides en la segunda dosis para evitar eventualmente complicaciones como la depresión respiratoria. Tampoco se recomienda usar un vasoconstrictor en la segunda dosis ya que podría producir severo daño de los nervios por isquemia (36-37). La adición de clonidina podría ser segura durante la segunda aplicación de AL (30 a 450 μg).
Aracnoiditis
Recientes estudios sobre la incidencia de aracnoiditis secundaria a bloqueo neuroaxial, la cual parecer ser hoy en día la sombra de esta entidad, efecto deletéreo que deberá de ser considerado cada vez que el paciente reciba anestesia neuroaxial. Entidad que puede presentarse inicialmente como una TNS, SCE o como un cono medular, y entonces desarrollar radiculitis, fibrosis, cicatrización del saco dural, deformidades, siringomielia y paquimeningitis y pseudomeningocele entre otros. La aracnoiditis también han sido asociada a anestesia neuroaxial después de punciones traumáticas, así como a los propios AL, los antisépticos, conservadores de los AL, y otras sustancias inyectadas por accidente o intencionadamente dentro del espacio subaracnoideo (38).
Bloqueo espinal total
El bloqueo espinal total, puede ocurrir durante los intentos del bloqueo extradural con punción inadvertida de duramadre y la aplicación de grandes volúmenes de AL.
Durante la anestesia espinal los AL rara vez alcanzan un nivel metamerico alto, esta situación puede ocurrir con dosis de AL inadecuadamente altos. Descuidar la posición del paciente cuando se inyectan AL hipo o hiperbáricos. Cuando el nivel de anestesia es demasiado alto, se puede acompañar de bradicardia y paro cardiaco o falla respiratoria, en ambos casos se requiere de tratamiento farmacológico y soporte respiratorio.
Hemorragia
El desarrollo de un hematoma cerebral o espinal posterior a una anestesia espinal es una complicación seria y rara, exige de hacer un diagnóstico rápido e inmediato, ya que el tratamiento es quirúrgico y oportuno. Un estudio derivado de una serie de demandas legales, realizado en Finlandia durante el 2000 y 2009 (22), se encontró una incidencia de hematoma neuroaxial de 1:775,000, el cual es menos que los hematomas epidurales 1:26,000 y en el caso de anestesia espinal-epidural combinada fue de 1:17,800.
Castillo y colaboradores en Cataluña España (39), reporto una incidencia aproximada de un hematoma por cada 150, 000 anestesias neuroaxiales, (0.6% contra anestesia espinal 0.7 por cada 100,000 anestesia neuroaxiales).
Cuando se lleva a cabo la anestesia neuroaxial es importante apegarse a las directrices de la ASRA (40), evitar la anestesia regional en aquellos pacientes con riesgo de sangrado tales como anormalidades en la coagulación, terapia anticoagulante. Recordar que ciertas condiciones como la edad avanzada, anormalidades en la columna vertebral o en la medula espinal y dificultad en la técnica de bloqueos neuroaxial pueden incrementar la posibilidad de hemorragia.
Trauma e infección
El trauma y la infección han sido reportados después de la AE, por trauma directo a nervios, producido por la aguja espinal, y también hay reportes de infecciones manifestadas como meningitis o abscesos epidurales después de anestesia neuroaxial, por fortuna son extremadamente raros (25).
Como se analizó en los párrafos anteriores las complicaciones graves secundarias a la anestesia espinal, son extremadamente raras y por lo tanto difíciles de estudiar. Auroy y colaboradores realizaron un estudio prospectivo en Francia (25) con 756 anestesiólogos, y encontraron que la incidencia de eventos deletéreos después de anestesia regional, fue de 98 casos en 103,730 anestesias. Hubo 40,640 casos de anestesias espinales con paro cardiaco en 26 de ellos de los cuales murieron 6 (6.4 ± 1.2/10,000 pacientes), situación que fue significativa (p <0.05) cuando se comparó con otras técnicas de anestesia regional. Hubo 21 complicaciones neurológicas (radiculopatías, SCE, paraplejia).
Dos terceras partes de los pacientes con déficit neurológicos tuvieron ya sea una parestesia durante la colocación de la aguja o dolor durante la inyección de la anestesia, 75% de los pacientes con déficit neurológico después de anestesia espinal no traumática ocurrieron en aquellos que habían recibido lidocaína hiperbárica al 5%.
Medicamentos para anestesia espinal
Hay dos grupos de medicamentos usados en la AE; los AL y los adyuvantes. Los últimos se utilizan para mejorar el rendimiento de la AE y/o para reducir las dosis de AL y sus correspondientes efectos secundarios. Se pueden inyectar directamente a través de la aguja espinal o mediante la colocación de un catéter en forma de múltiples dosis.
La toxicidad sistémica de los AL no es un problema en AE ya que las dosis de AL son muy pequeñas en relación a las dosis utilizadas en AEP.
Sin embargo debido al creciente uso de la anestesia espinal-epidural combinada, en donde se usan dosis y volúmenes de AL más altos como lidocaína por ejemplo, para procedimientos quirúrgicos como la liposucción, abdominoplastia o el “lifting” del cuello y cara, es importante tener en cuenta la toxicidad sistémica manifestada por convulsiones, coma, arritmias cardiacas o fracaso del procedimiento anestésico.
La elección del AL está determinada por el tipo y la duración de la cirugía, estado de salud del paciente, tipo de hospital en donde se realiza la cirugía, experiencia del anestesiólogo y del grupo de médicos cirujanos, disponibilidad de fármacos, sin olvidar el sitio en donde vive el paciente, especialmente si se trata de cirugía de turismo, en donde el paciente generalmente es de un lugar lejano.
El perfil anestésico de cada fármaco intratecal, es el parámetro más importante que debe ser considerado al planear la anestesia espinal.
Anestésicos locales
Debido a las controversias no resueltas, sobre la neurotoxicidad local de la lidocaína (41) algunos investigadores han intentado determinar la utilidad de otros AL, en el campo de la CA y de corta estancia, teniendo en cuenta que el tiempo de recuperación para el paciente es muy importante, tanto para el pacientes, para los médicos, así como para terceros pagadores, y unidades quirúrgicas. Hoy en día hay bastantes opciones de AL como bupivacaína, levobupivacaína, ropivacaína, mepivacaína, prilocaína, cloroprocaina, procaina, articaína y lidocaína (3,42,43).
A los AL del grupo amino-amidas, se han incorporado cuatro fármacos más: bupivacaína racémica, mepivacaína, ropivacaína y levobupivacaína. Todos ellos son usados en anestesia ambulatoria espinal, en particular la bupivacaína. Las dosis totales de AL y algunos medicamentos adyuvantes, han estado usándose en forma creciente en el campo de la investigación y/o en la práctica clínica. Ropivacaína y levobupivacaina no han sido aprobados en todo el mundo para uso intratecal, sin embargo múltiples informes sobre su uso, y el hecho de que son libres de conservadores y seguros al momento de inyectarse en el espacio espinal, los hacen recomendables en este tipo de cirugía (43,44,45). En las siguientes secciones revisaremos brevemente algunos de los AL más usados en AE ambulatoria y de corta estancia, en diversos procedimientos anestésicos- quirúrgicos, analizando sus resultados. Primero describimos los AL tipo amida y luego los del grupo ester.
Lidocaína
La lidocaína es el AL más utilizado y estudiado. Durante las dos últimas décadas ha aumentado el número de pacientes que recibieron lidocaína, por lo tanto es posible que se conozca más sobre su neurotoxicidad temporal y permanente que resulto después de anestesia espinal.
Hoy en día el SCE es reportado rara vez después de AE con lidocaína, pero el SINT es significativamente mayor después de la aplicación de lidocaína comparada con la bupivacaína espinal, prilocaina, procaína, Levobupivacaína, ropivacaína y cloroprocaína (7.31 (95%), intervalo de confianza (CI) 4.16 a 12.86) (46). Afortunadamente los síntomas duran no más de cinco días, cuando no existe daño neuronal permanente. Entro otras causas la deambulación temprana es uno de los factores que se ha asociado al desarrollo de síntomas de toxicidad, por lo que en pacientes ambulatorios y de corta estancia, la lidocaína espinal podría estar contraindicada.
Aunque el uso de lidocaína espinal es controversial, algunos autores la siguen utilizando para procedimientos cortos. Una dosis de 40 mg es suficiente y se compara con bupivacaína 7.5 mg (19). Una dosis de sufentanilo 15 mg produce excelente anestesia y tiempo de recuperación mejor que lidocaína 50 mg sola, sin embargo el 50% de los pacientes desarrollaron prurito.
Frey colaboradores reportaron un estudio en voluntarios sanos (48) a quienes se les aplico lidocaína 100 mg, bupivacaína 15 mg y tetracaína 15 mg en tres soluciones hiperbáricas, a tres grupos de pacientes diferentes, ellos encontraros que la lidocaína tiene el mejor perfil de recuperación y no se encontraron diferencias importantes entre lidocaína espinal isobárica 80 mg al 2%, o mepivacaína espinal isobárica 2%, en cirugía artroscópica ambulatoria. Ningún grupo de pacientes desarrollo SINT (49). Prilocaína, mepivacaína, articaína, bupivacaína, ropivacaína, procaína a dosis bajas. Se han sugerido como alternativas a la lidocaína.
Articaína
El A 4-methyl-3(2-[propylamino] propionamido)-2-thiophenecarboxylic acid, methyl ester hydrochloride, originalmente fue llamado Carticaíne, fue preparado Rusching et al en 1969. Introducido en la práctica de odontología en 1973, y entró en la práctica clínica en Alemania con el nombre de Articaína. Es el único AL tipo amida que contiene un aniño de tiofeno y un anillo ester adicional. Investigaciones recientes han demostrado su utilidad en clínica, para casos ambulatorios cortos. Además de su inicio rápido y de su corta duración. Tiene una baja neurotoxicidad (50- 52). Dosis de 50 a 80 mg al 2 o al 3% de articaína hiperbárica, produce una AE satisfactoria durante aproximadamente una hora, con recuperación de 3.5 horas. La articaína hiperbárica se comparó con bupivacaína hiperbárica en cirugía, los resultados han mostrado un inicio más rápido de bloqueo sensitivo en el grupo de articaína, que en el grupo de bupivacaína, pero la hipotensión arterial se instaló más rápido y más frecuente con articaína (53).
Hendriks y colaboradores (54) compararon articaína simple 50 mg versus Prilocaína 50 mg, en pacientes sometidos a artroscopia de rodilla tipo ambulatorio y encontraron que la recuperación completa de la función motora fue más corta después de articaína que prilocaína (media (SD) 140 (33) versus 184 (46) minutos, respectivamente, (P = 0,001). El tiempo hasta la micción espontanea, fue más corto después de articaína que prilocaína (media (DE) 184 (39) versus 227 (45) minutos, respectivamente (P < 0.001). Un paciente del grupo de articaína informo un SINT leve, que se limitó al primer día del postoperatorio. No huno diferencia significativas en los efectos adversos, entre ambos grupos (50). La adición de fentanilo 10 μg para mejorar la analgesia postoperatoria, reducción en el consumo de analgésicos postoperatorios, sin prolongar el bloqueo motor o retardo en la recuperación (55,56).
Bupivacaína
Es un AL viejo que ha resistido la prueba del tiempo. Es un AL tipo recemico que contiene dos esteroisomeros, S y R+, siendo este último el más tóxico de los dos. Desde que apareció la controversia de la neurotoxicidad de la lidocaína espinal, la bupivacaína es quizá el AL más utilizado en anestesia subaracnoidea. Su potencia intratecal es similar a la de la levobupivacaína y más fuerte que la ropivacaína: 0.97 (IC del 95%: 0.81-1.17) para levobupivacaína/bupivacaína, 0.65 (IC del 95%: 0.54-0.80) para ropivacaína/bupivacaína y 0.68 (IC del 95%: 0.55-0.84) para ropivacaína/levobupivacaína (57). Aunque es un sustituto adecuado de la lidocaína intratecal para cirugía ambulatoria y de corta estancia, las dosis usuales de 15 a 18 mg, pueden reducirse de 8 a 10 mg para prevenir la retención urinaria y el retraso en el egreso a casa.
Con la bupivacaína no hay posibilidad de presentar el SINT. Una revisión sistemática de Nair y colaboradores (58) sugirió bupivacaína hiperbárica 4-5 mg, pueden producir AE para la artroscopia de rodilla con posición unilateral. Casati y colaboradores (59) compararon bupivacaína hiperbárica 8 mg al 0.5% versus bloqueo nervioso ciático-femoral con mepivacaína y encontraron que realizar bloqueos nerviosos periféricos requiere de más tiempo para realizar la técnica que la AE. Los pacientes bajo AE tuvieron un tiempo de bloqueo más corto, pero tardaron más en poder orinar, sin afectar el tiempo de realizar el efecto de la micción.
Una pequeña dosis de bupivacaína hiperbárica de 4 mg al 0.25%, redujo la altura del bloqueo sensitivo y motor y la duración del mismo. La dosis de bupivacaína espinal hiperbárica de 3-4 mg al 0.5%, con fentanilo 25 μg o sin opioide, puede utilizarse en cirugía con seguridad, en cirugía de extremidades inferiores y puede proporcionar criterios de liberación rápida y segura (60).
La inyección intratecal de bupívacaína isobárica 9.7 mg, actúa 5 minutos más rápido que la bupivacaína hiperbárica (61). Para procedimientos ambulatorios quirúrgicos cosméticos cortos, bupivacaína hiperbárica 8- 10 mg al 0.5-75%, son adecuadas, para procedimientos cortos como abdominoplastia más cirugía de mamas, dosis de 15- 22 mg se pueden usar en forma segura pero el tiempo total de recuperación se verá afectado.
Levobupivacaína
Es el último de los AL introducido en la práctica clínica en 1999, se trata de un L- esteroisomero con una mayor duración de acción, un perfil clínico similar a la bupivacaína racémica pero con menor toxicidad. La dosis letal de levobupivacaína es de 1.3 a 1.6 veces mayor que bupivacaína racémica, y ambos tienen efecto anestésico equipotente vía neuroaxial.
Algunos de los estudios realizados en animales no han mostrado algún daño a la medula espinal o la presencia de SCE (62,63).
En contraste, Takenami y colaboradores encontraron degeneración axonal en ratas a quienes se les inyecto levobupivacaína espinal (30).
Existen numerosos estudios clínicos que recomiendan levobupivacaína espinal en cirugía ambulatoria. Levobupivacaína hiperbárica/isobárica dosis de 7.5 a 15 mg al 0.5%, produjeron una anestesia satisfactoria (64,65). Se han administrado dosis más pequeñas con adyuvantes espinales agregados para cirugía ambulatoria. En pacientes ginecológicos levobupivacaína 3 mg, junto con fentanilo 10 μg, pueden ser usados con seguridad (66). Levobupivacaína intratecal 5 a 7.5 mg al 0.5% con fentanilo 25 μg en pacientes sometidos a herniorrafia inguinal, proporciona AE de buena calidad y minimiza las necesidades de analgesia intraoperatoria (67). En un estudio doble ciego Sanansilp y colaboradores (68) compararon levobupivacaína isobárica o hiperbárica 0.42%. Ellos encontraron que la levobupivacaína hiperbárica se propago por encima de la forma isobárica, lo que sugiere que la levobupivacaína es más predecible. En los pacientes de edad avanzada, la levobupivacaína espinal tiene mejores resultados hemodinámicos, como estabilidad comparada con la bupivacaína (69). Aunque levobupivacaína intratecal es segura, se ha reportado casos de SCE y SINT. Levobupivacaína espinal isobárica 20 mg, produce menos SINT que lidocaína isobárica 80 mg (0.33% versus 26.6%, (P = 0.002) (70). Describimos el caso de un paciente de 38 años de edad, que después de 27 horas de abdominoplastia/liposucción bajo anestesia espinal con levobupivacaína hiperbárica al 0.65% y clonidina 30 μg (71), desarrollo SINT.
Ropivacaína
AL identificado por Ekenstam en 1957. La ropivacaína se introdujo para anestesia regional y epidural en 1997. Es el primer AL, L-isómero disponible para uso en humanos. Es menos soluble que la bupivacaína y es por lo tanto menos tóxico dentro de los AL de la familia PPX. La posibilidad de SINT es del 0-1%. Poco después de su introducción, la ropivacaína se utilizó con seguridad para AE en el entorno ambulatorio. Ropivacaína es un tercio menos potente que bupivacaína o levobupivacaína (43). La ropivacaína hiperbárica al 0.5% es superior que bupivacaína hiperbárica al 0.5%, ya que la duración del bloqueo motor y sensitivo es significativamente más corta que la bupivacaína, pero con mejor estabilidad cardiovascular (72). Al igual que la levobupivacaína, las dosis bajas de ropivacaína se puede usar en CA, varios protocolos de investigación informan que las dosis pequeñas de 5 a 10 mg fueron suficientes para varios tipos de CA como cirugía anorrectal (73), artroscopia de rodilla (74), y herniorrafia (75).
Gautier y colaboradores (76) encontraron que ropivacaína intratecal 12 mg equivalen a bupivacaína 8 mg, sin beneficios adicionales, en pacientes ambulatorios sometidos a artroscopia de rodilla. Los accidentes de ropivacaína al 1%, 30 mg, sin efectos secundarios importantes, sugieren que dosis mayores pueden ser usadas en forma segura en procedimientos torácicos incluso para pacientes ambulatorios (77).
La dosis de ropivacaína isobárica o hiperbárica 4 a 30 mg, al 0.75 o 1%, pueden utilizarse en forma segura, para procedimientos de CP ambulatoria y de corta estancia.
Mepivacaína
Este AL se ha utilizado intratecalmente desde 1960. Tiene un comienzo corto a intermedio, su duración y toxicidad es baja. Su metabolismo hepático es rápido y es excretado por los riñones. Su perfil clínico es similar a la lidocaína, con una potencia relativa de 1.3:1. Mepivacaína espinal produce daño neurológico del tejido con infiltración de macrofágos y destrucción de vainas de mielina y axones en animales de experimentación como es el caso de las ratas.
El daño se ha localizado en la porción proximal de las raíces nerviosas posteriores, la zona de entrada en la médula espinal o el fascículo “gracilis” de la sustancia blanca posterior (28). Los síntomas neurológicos transitorios ocurren entre 0 y 30%. Un estudio de 1273 pacientes de CA, tratados con mepivacaína al 1.5% intratecal- epidural o intratecal, mostro que el 1.7% de las AE fueron insuficientes, y el 6.4% presentaron SINT. La edad media de los pacientes que presentaron SINT fueron 48 ± 14 años de edad, significativamente mayores, que aquellos que no presentaron SINT 41 ± 16 (p = < 0.001) (78). Pawlowski y colaboradores (79) estudiaron prospectivamente el perfil de recuperación anestésica en 60 pacientes ambulatorios, manejados con 60 y 80 mg de mepivacaína intratecal, y concluyeron que ambas dosis fueron adecuadas, aunque los pacientes manejados con 60 mg se recuperaron más rápido de la anestesia (20 a 30 minutos) y sin efectos secundarios. Los mismos autores no encontraron diferencias importantes entre lidocaína y mepivacaína en la anestesia intratecal. El tiempo para la deambulación y la micción fueron más largos en los pacientes que recibieron mepivacaína, así como un tiempo mayor hasta la administración de la primera dosis epidural para analgesia.
Ninguno de los dos grupos tenía síntomas de SINT. La mepivacaína y la lidocaína son anestésicos espinales apropiados para procedimientos ortopédicos de extremidades inferiores ambulatorios (80). La adición de fentanilo 10 a 30 μg de mepivacaína isobárica espinal acelera la regresión del bloqueo, acorta la recuperación y facilita la deambulación en pacientes sometidos a artroscopia unilateral de rodilla (81).
Cloroprocaína
La 2-cloroprocaína es un AL tipo éster, adecuado para procedimientos cortos bajo AE. Se ha utilizado cloroprocaína libre de conservadores, en lugar de lidocaína intratecal para evitar el SINT. La cloroprocaína tiene un efecto antagónico sobre los receptores opioides k y μ, que pueden interferir con los opioides neuroaxiales. La cloroprocaína espinal 10 mg/ml, 35, 40, 45, 50, y 60 mg proporcionar un bloqueo sensorial y motor consistente para la cirugía ambulatoria, mientras que la disminución de la dosis a 35 y 40 mg resultaron en un bloqueo espinal con una deambulación más rápida. Aunque 20 mg y 30 mg pueden producir anestesia sensorial adecuada para procedimientos quirúrgicos cortos, menor bloqueo. La mayoría de los estudios recomiendan dosis de 30 a 60 mg.
La dosis de 10 mg produce anestesia sensorial breve e inconsistente, y puede ser considerada una dosis sin efecto (82). Hejtmanek y Pollock (83) revisaron a 503 pacientes ambulatorios a quienes se les administro cloroprocaína espinal (dosis de 40 mg, rango de 20-60 mg) encontraron que desde la inyección del anestésico local hasta la ambulación del paciente, la micción, fue de 107 ± 24 y 171 ± 45 minutos, respectivamente. Más corta que lidocaína espinal (155 ± 40 y 224 ± 57 minutos) (P = < 0.05). No se presentaron reportes de SINT. Cuando compararon articaína 40 mg con cloroprocaína 40 mg, presentaron un inicio similar a dosis similares. La recuperación del bloqueo motor fue claramente más rápida con la cloroprocaína (84). La agregación de fentanilo parece prolongar el bloqueo quirúrgico sin prolongar el tiempo de vaciamiento de la vejiga. Cinco posibles casos de SINT después de cloroprocaína espinal se han presentado en más de 4000 pacientes y un caso de SCE incompleto regresivo (85).
En resumen la corta duración de la cloroprocaína espinal hace de este AL un contendiente fuerte para anestesia ambulatoria espinal, sin embargo parece que tiene un riesgo menor de producir el SINT que lidocaína.
Procaína
Este AL amino-ester se ha utilizado en el AE para cirugías de corta duración desde principios del siglo pasado. Su inicio de acción es más lento que la cloroprocaína, y solo dura 30 a 60 minutos, aunque procaína produce toxicidad local, es la menos neurotóxica cuando se aplica en el espacio espinal (28). SINT tiene una incidencia del 0 al 6%. Johnson y Swanson [86] Informaron de un paciente con SCE permanente después procaína 150 mg, al 10%.
Hodgson [87] usó procaína espinal hiperbárica 100 mg versus lidocaína hiperbárica 50 mg en artroscopia ambulatoria, y encontró que la procaína tiene una mayor tasa de fracaso anestésico (17% vs 3%), y mayor incidencia de náuseas (17% versus 3%). La incidencia de SINT fue menor con procaína (6% frente a 24%). La procaína ha sido considerada como una alternativa aceptable a la lidocaína en pacientes ambulatorios.
Al elegir un AL para la anestesia subaracnoidea es importante tener en cuenta que las formas hiperbáricas tienen una difusión intratecal más amplia en comparación con las soluciones isobáricas, por lo tanto son útiles para los procedimientos quirúrgicos que involucren dermátomas más altos. Los AL isobáricos son mejores para cirugías pélvicas y de extremidades inferiores. La epinefrina ya no se recomienda ya que alarga el tiempo de recuperación. Siempre es aconsejable considerar que el tiempo quirúrgico puede prolongarse, ya que hay muchos tiempos muertos quirúrgicos que pueden prolongan la cirugía. Además, a veces los planes quirúrgicos para cirugía plástica y cirugía cosmética originales se pueden ver modificados y prolongando así el procedimiento quirúrgico [3].
Existen mezclas de AL y adyuvantes según los tiempos de esperados, como cirugías de menos de una hora de duración, aunque es poco frecuente (revisión de cicatrices, liposucción de áreas pequeñas perineal) este tipo de cirugía. Para estos casos ultra cortos la combinación de procaína más clonidina más fentanilo, son excelentes, sin presentar el fantasma de SINT. Después de ropivacaína, bupivacaína o levobupivacaína, 5-8 mg producen más de 150 minutos de anestesia intratecal, esto es tiempo suficiente para la mayoría de los procedimientos ambulatorios de cirugía cosmética.
Existe prolongación de la acción de los AL mediante la adición de clonidina. Dosis relacionada; 150 a 300 μg pueden prolongar la AE hasta 4-5 horas. La somnolencia, bradicardia e hipotensión son más frecuentes con las dosis altas de AL, fáciles de tratar. (Tabla 4).
Tabla 4 Recomendaciones de medicamentos combinados para anestesia espinal de acuerdo al tiempo esperado
| Tiempo de cirugía esperado | Medicamentos recomendados |
| Más de una hora | Lidocaína mas clonidina. Lidocaína más fentanilo Articaína más fentanilo. Cloroprocaína más fentanilo o clonidina. Pequeñas dosis de PPX más fentanil o clonidina. |
| Una a dos horas | PPX más clonidina o fentanilo |
| Dos a cuatro horas | PPX más clonidina o fentanilo PPX más clonidina mas fentanilo |
| Más de cuatro horas | PPX más clonidina más fentanilo PPX más clonidina más morfina |
En nuestro centro de cirugía plástica, el AL más utilizado para pacientes ambulatorios y de corta estancia, es la bupivacaína hiperbárica 0,5% y 0,75%, seguido de ropivacaína hiperbárica 0,75%, levobupivacaína hiperbárica 0,5%. Evitamos el uso de lidocaína intratecal. Para casos ambulatorios breves preferimos usar dosis bajas de cualquier de los AL de la familia de bupivacaína racémica, levobupivacaína, ropivacaína o mepivacaína, (PPX), más clonidina de 30 a 50 μg.
Si el procedimiento ambulatorio es de más de dos horas, es aconsejable utilizar dosis regulares de AL, y añadir clonidina en dosis desde 75 hasta 150 μg. No recomendamos los opioides espinales en los casos de cirugía ambulatorios por la probabilidad de prurito y retención urinaria. Para procedimientos extensos de corta duración utilizamos bupivacaína hiperbárica de 15 a 25 mg, ropivacaína hiperbárica de 15 a 30 mg o levobupivacaína 15 a 25 mg. La mayoría de nuestros pacientes reciben clonidina espinal 150 a 300 mg con o sin fentanilo 12.5 a 25 μg o morfina 100 a 200 μg.
Medicamentos adyuvantes
Los fármacos adyuvantes para AE en pacientes ambulatorios y de corta estancia, son una rutina habitual en nuestra práctica diaria con el fin de disminuir la dosis de AL, facilitar una recuperación más rápida y mejorar la calidad de la analgesia postoperatoria, o analgesia postoperatoria efectiva.
Hay numerosos receptores que modulan el dolor espinal, sin embargo, sólo hay unos pocos fármacos para el uso subaracnoideo que actúan como adyuvantes. La adrenalina fue el adyuvante más utilizado en la AE antes de la aplicación de opioides neuroaxiales.
Su uso ha sido cuestionado porque la adrenalina 100-300 μg agregado a los anestésicos locales no prolonga la anestesia espinal, pero retrasa la recuperación anestésica.
Hay algunos otros adyuvantes intratecal que no han sido aprobados para ser utilizados en anestesia espinal, nos referimos al midazolam, ketamina y neostigmina. Los cuales pueden mejorar la calidad del bloqueo y prolongar la analgesia.
El sulfato de magnesio Intratecal potencia principalmente la acción analgésica de los opioides, sin efectos secundarios significativos. Un impacto positivo en la AE ha sido sugerido para los bloqueadores de los canales del calcio intratecales y los medicamentos antiinflamatorios no esteroideos. Los alfa2 agonistas y los opioides son los fármacos más utilizados como adyuvantes en AE.
Los fármacos alfa2 agonistas se utilizan cada vez más en pacientes en estado crítico y en anestesia. Además de la analgesia y la sedación, también disminuyen el tono simpático y atenúan la respuesta al estrés a la anestesia y la cirugía.
Históricamente, la adrenalina fue el primer alfa2 agonista utilizado por vía intratecal, pero ya está cayendo en desuso y no se recomienda más. La clonidina y la dexmedetomidina también son fármacos de este grupo de adyuvantes. Su sitio de acción implica receptores específicos de la medula espinal, en el asta espinal, dorsal y supraespinal en el núcleo coereleus en el pons. La Inyección espinal de clonidina y dexmedetomidina mejoran la duración y la calidad de la anestesia subaracnoidea sin datos clínicos de neurotoxicidad. La administración continua de clonidina espinal en ratas Wistar durante 14 días, no demostró daño neurotóxico (88). Erddivanli y colaboradores mostraron que la inyección de ratas Sprague-Dawley (89) con dexmedetomidina 3 y 10 μg administrados intratecal junto con bupivacaína, no encontraron cambios fisiopatológicos evidentes, 24 horas después de la aplicación de este medicamento (90).
Clonidina
La clonidina es un alfa2 agonista utilizado en anestesia para diversos fines. Cuando se inyecta neuroaxial, prolonga el bloqueo sensitivo y motor, aumenta la sedación y puede potenciar la hipotensión y la bradicardia. Ha sido ampliamente estudiado a dosis altas (> 150 μg), y bajas (<150 μg) y pequeñas dosis (<75 μg).
Las dosis de 150, 300 y 450 μg producen analgesia dependiente de la dosis, (91) y mejorar la raquianestesia, con relativa estabilidad hemodinámica. Dosis de 15 y 30 μg además de 11 mg de bupivacaína hiperbárica espinal (92) proporcionan una mejor sensibilidad y bloqueo motor, en comparación con la bupivacaína sola, pero la clonidina 30 μg se asoció con mayor incidencia y duración de hipotensión arterial.
Mirivirta y colaboradores utilizaron 15 μg de clonidina en la anestesia espinal, combinada con bupivacaína hiperbárica 5 mg (93) en pacientes ambulatorios, sometidos a cirugía de artroscopia de rodilla. Produjeron una AE unilateral intensa sin afectar el postoperatorio en el hogar.
Una revisión sistemática (94) que incluyo 1.445 pacientes, en donde se utilizó una amplia variedad de dosis de clonidina espinal como adyuvante de bupivacaína subaracnoidea, mepivacaína, prilocaína o tetracaína, y hallaron que entre 15 y 150 μg producen AE de manera dosis dependiente, para procedimientos de CP ambulatoria y de estancia corta. Se presentaron menos episodios de dolor intraoperatorio con clonidina (riesgo relativo, 0.24, 95% de confianza intervalo (CI), 0,09-0,64; (número necesario para tratar, 13), se presentaron más episodios de hipotensión arterial (riesgo relativo, 1,81; IC del 95%: 1,44-2,28), (número necesario para dañar, 8), El riesgo de bradicardia no cambio.
La dosis óptima de clonidina espinal sigue siendo desconocida. En nuestra práctica actual, usamos clonidina 30 a 50 μg agregada a los AL, sin afectar los criterios de alta de la unidad del postoperatorio en CP de corta estancia. Pero podemos utilizar desde 75 hasta 300 μg de clonidina como adyuvante para cualquier anestésico local de la familia PPX.
Dexmedetomidina
Es el agente más nuevo de este grupo. Fue aprobado por la FDA en 1999 para su uso en humanos para la analgesia y la sedación en pacientes intubados en cuidados intensivos. Dexmedetomidina tiene una relación de selectividad α2 / α1 que es ocho a diez veces mayor que la de clonidina. A pesar de que no se ha aprobado para el uso espinal, hay algunas investigaciones que muestran su seguridad y eficacia para prolongar tiempo de bloqueo sensorial y motor de la anestesia subaracnoidea. Kanasi y colaboradores (95) compararon la dexmedetomidina espinal 3 μg frente a la clonidina espinal.
Se agregaron 30 μg a bupivacaína 12 mg subaracnoidea frente a bupivacaına sola. Encontraron que ambos alfa2 agonistas acortan el tiempo de inicio del bloqueo motor y prolongan significativamente el bloqueo motor. El tiempo medio de regresión sensorial al segmento S1 fue de 303 ± 75 minutos en Dexmedetomidina, 272 ± 38 minutos en los que recibieron clonidina y 190 ± 48 minutos respectivamente.
En el grupo de control. La regresión del bloque motor a Bromage de cero fue de 250 ± 76 minutos en el grupo de dexmedetomidina 216 ± 35 minutos en los casos de clonidina y 163 ± 47 minutos en el grupo control. Los tiempos de inicio y regresión del bloqueo no fueron significativamente diferentes entre los grupos tratados con ambos alfa2 agonistas.
La presión arterial media, la frecuencia cardíaca y el nivel de sedación fueron similares en los tres grupos del intraoperatorio y postoperatorio. Se agregarondexmedetomidina 5 μg con ropivacaína isobárica al 0.75%, la cual prolongo la duración del bloqueo motor y sensorial, y mejoro la analgesia postoperatoria. (96) y significativamente prolongo el bloqueo sensorial y un bloqueo motor corto.
La demanda de analgésicos de rescate en 24 horas en comparación con fentanilo 25 y 30 μg clonidina, cuando se añadió bupivacaína hiperbárica 12.5 mg, para la anestesia espinal (97).
En pacientes ancianos tratados con bupivacaína espinal 6 mg al 0,5%, la adición de dexmedetomidina 3 μg aceleró el inicio del bloqueo y prolongó la duración de la anestesia y la analgesia postoperatoria, aunque la recuperación del bloqueo motor fue afectada (98).
Se ha demostrado que dexmedetomidina intravenosa y la clonidina prolongan significativamente la anestesia con bupivacaína espinal, con buen efecto sedante y estabilidad hemodinámica.
En 2003 Rhee y colaboradaores (99) publicaron el primer artículo clínico con clonidina intravenosa para prolongar la anestesia espina; Clonidina 3 μg/kg-1 durante diez minutos inmediatamente después del bloqueo subaracnoideo o 50 minutos después de la anestesia espinal, prolongó significativamente la duración de la sensibilidad motora y sensorial.
En 2007 se encontró que la dexmedetomidina i.v. también mejora la AE con bupivacaína espinal (100). En nuestra investigación usamos una Infusión i.v. dexmedetomidina 1 μg/kg administrada en 20 min, seguida de un goteo de dexmedetomidina 0.5 μg/kg/h hasta el final de la cirugía. Un grupo comparativo fue tratado con clonidina 4 μg/kg, administrados en 20 minutos i.v. mediante una infusión, la cual comenzó 20 minutos después del bloqueo espinal, y seguido por un goteo salino al 0,9% hasta el final de la cirugía. La duración del bloqueo sensorial fue mayor en ambos grupos, 208 ± 43,5 y 225 ± 58,8 minutos respectivamente, frente al grupo placebo 137 ± 121,9 min (p = 0,05). La duración del bloqueo motor fue mayor con clonidina que con dexmedetomidina (191 ± 49,8 y 172 ± 36,4) en comparación al grupo placebo (172 ± 36,4) sin diferencia estadística significativa.
Otros autores han confirmado nuestros resultados iniciales usando dosis de dexmedetomidina i.v. de 0,25 a 0,5 μg/kg como un bolo inicial, seguido o no de un infusión de 0,5 μg/kg/h (101, 102, 103). Dos metaanálisis (104,105) demostraron que dexmedetomidina i.v prolongó la duración de la anestesia espinal y mejoró la analgesia postoperatoria sin aumentar la incidencia de hipotensión y eventos adversos transitorios reversibles. La bradicardia fue un efecto secundario leve.
Opioides
Dado que Yask y Rudy demostraron que los opioides intratecal producían analgesia selectiva, hoy en día los opioides neuroaxiales son los fármacos más utilizados para este fin. Todos los opioides administrada por vía intratecal producen algún grado de analgesia mediada por receptores espinales. Las principales diferencias están relacionadas con sus características de solubilidad y su efecto sobre la acción, tasa de eliminación y efectos secundarios. Los estudios experimentales y clínicos han demostrado que después de su inyección neuroaxial, la liposolubilidad del opioide es inversamente proporcional a su selectividad espinal, que es mayor para los fármacos más solubles en agua, como morfina e hidromorfona, que para otros fármacos más lipofílicos, como el fentanilo y el sufentanilo (107). Morfina prolonga significativamente la analgesia espinal, fentanilo, sufentanilo mejoran y moderadamente y prolongar el bloqueo sensorial sin afectar la función motora. Los efectos secundarios más frecuentes son náuseas, vómitos, prurito y retención urinaria la depresión respiratoria rara vez se observa.
Morfina
Aunque la morfina espinal es el opioide estándar para analgesia neuroaxial postoperatorio, no es la mejor opción para cirugía ambulatoria ni de corta estancia debida a una mayor incidencia de efectos adversos que requiere una selección y un seguimiento cautelosos de los pacientes. Morfina produce una analgesia intensa hasta 24-30 horas con dosis tan bajas como 100 μg. En nuestra práctica evitamos su uso en pacientes de cirugía plástica.
Fentanilo
Es el opioide más adecuado para pacientes con CA. Tiene un efecto fuerte cuando se administra espinal o epiduralmente, produciendo una analgesia a corto plazo (1-4 horas), es muy útil en el dolor postoperatorio agudo. Se ha utilizado junto con la mayoría de los al en dosis de 10 μg hasta 25 μg. Proporciona una analgesia selectiva intraoperatoria y postoperatoria, satisfacción del paciente, sin retrasar el tiempo de recuperación (55- 60,66,67,107-110).
Las dosis más recomendadas es de 20 y 25 μg en diferentes escenarios ambulatorios. Levobupivacaína 3 mg más fentanilo 10 μg, se puede utilizar como una alternativa adecuada a lidocaína. Fentanilo 10 μg para anestesia subaracnoidea de corta duración, logra un resultado clínicamente equivalente, con un tiempo de resolución del bloqueo sensorial, condiciones intraoperatorias similares y buena satisfacción del paciente (111). Los efectos secundarios más comunes son náuseas, vómitos y picazón el cual fue tratado con nalbufina, droperidol (112), propofol u ondansetrón.
Criterios de alta a casa
Los pacientes ambulatorios de CP que recibieron AE deben cumplir con los criterios de alta antes de ir a casa.
El objetivo de estos criterios es egresar a los pacientes con seguridad y evitar reingresos hospitalarios urgentes, debido a complicaciones postanestésicas. El dolor, náuseas, vómitos y retención urinaria son ejemplos comunes de estas complicaciones. No es totalmente necesario cumplir con el 100% de estas normas de alta, pero los pacientes deben ser advertidos acerca de la desaparición gradual de la AE de los efectos secundarios y facilitar la comunicación con la unidad quirúrgica, entre el cirujano y el anestesiólogo, estos pacientes requieren cuidaos postanestésicos y postoperatorios adecuados y seguros, ordenes, transporte y ocasionalmente compañía profesional. Es vital que cada unidad defina sus propios criterios de alta quirúrgica ambulatoria, de acuerdo con las características y necesidades de sus pacientes (3,4). La (Tabla 5) muestra los criterios de alta más comunes.
Tabla 5 Criterios de alta a casa
| Criterios | Descripción |
| Estabilidad hemodinámica | Signos vitales con valores semejantes a los de preanestesia |
| Estado completo de alerta | Paciente despierto y bien orientado. La anestesia espinal permite un estado de alerta completo que permite las condiciones optimas para ir a casa |
| Sin dolor o minimo dolor | Dolor postoperatorio controlado, EVA menor de 2/10, sin analgesicos orales. La anestesia espinal con coadyuvantes proporciona un periodo prolongado de analgesia lo cual facilita el alta a casa y reduce las necesidades de analgesicos orales. Es adecuado prescribir la combinación de un analgesico opioide con uno no opioide, para dolor postoperatorio esperado. |
| Vaciamiento expontaneo de la vejiga | Este punto es controversial, algunos centros hospitalarios consideran que es necesario prevenir el reingreso al hospital por distención de la vejiga. En nuestra práctica, no consideramos este requerimiento como ensencial, pero el paciente sabe de la posibilidad remota de tener problemas para la micción. Evitamos el uso de opioides intratecales para reducir dicho riesgo de retencion urinaria. |
| Habilidad para caminar | Es conveniente que el bloqueo motor haya desaparecido por completo, el paciente puede tratar de caminar cuando la sensibilidad perineal ha desaparesido y el paciente es capaz de extender y flexionar los pies. En algunos casos es posible el alta a casa sin la recuperación al 100% del bloqueo motor. |
| Dolor de cabeza | La clasica cefalea postbloqueo ocurre entre dos y cinco dias despues de la anestesia espinal, hay pacientes que pueden desarrollar la cefale en el postoperatorio inmediato, es aconsejable investigar los sintomas de cefalea con el paciente sentado o parado. |
| Otros | Sin datos de sangrados quirurgicas, acompáñamiento garantizado durante en casa, transporte y alojamiento. No manejar. Mantener una comunicación segura con el hospital vía telefono, fax o e-mail. |
Conclusiones
Los casos de CP tipo ambulatoria y de corta estancia han crecido exponencialmente en todo el mundo. Los anestesiólogos necesitan proporcionar una anestesia segura a estos pacientes, que a menudo son sometidos a cirugías prolongadas, con riesgos que son más altos de lo esperado. Hoy en día la mayoría de las cirugías cosméticas se pueden hacer en instalaciones hospitalarias de pacientes ambulatorios y de corta estancia gracias a los avances en la anestesia.
Aunque la mayoría de los anestesiólogos usan anestesia general para estos procedimientos, las técnicas de anestesia regional han demostrado ciertas ventajas, tales como un mejor control del dolor, atenuación de la respuesta al estrés quirúrgico, preserva la función inmunológica perioperatoria, la oxigenación y capacidad funcional residual pulmonar, mejora de la capacidad vascular visceral, menor hemorragia, recuperación precoz del íleon postoperatorio y reducción de enfermedad por trombosis venosa y embolia pulmonar.
La AE es una técnica simple, con un pequeño volumen de fármacos que produce anestesia y analgesia, y carece de efectos secundarios farmacológicos sistémicos. Existen muchas opciones de AL para anestesia espinal de pacientes ambulatorios y de corta estancia y procedimientos ultra cortos.
Las mejores opciones son procaína, articaína o lidocaína. Para procedimientos de duración intermedia, Se pueden utilizar pequeñas dosis de AL o incluso lidocaína. Para procedimientos más largos se puede usar, bupivacaína, levobupivacaína y ropivacaína que son excelentes agentes. La adición de adyuvante a los AL mejoran la anestesia subaracnoidea con mejor recuperación, de acuerdo con lo esperado. El tiempo quirúrgico, la baja incidencia de efectos secundarios o complicaciones y la analgesia. La clonidina y la dexmedetomidina aceleran el inicio y prolongan la AE y analgesia.
Las complicaciones graves después de la AE son extremadamente raras; como paro cardíaco, meningitis, hematoma subdural intracraneal, hematoma epidural espinal, el SINT y el SCE. Los pacientes deben ser informados en detalle sobre la incidencia, gravedad y resultado de estas complicaciones.











 nueva página del texto (beta)
nueva página del texto (beta)


