Introducción
El uso de lidocaína intravenosa (LIV) para el control del dolor postoperatorio ha ganado interés en los últimos años (1). Estudios clínicos plantean que su aplicación en el perioperatorio a dosis bajas reduce el dolor y el consumo de opioides en el postoperatorio (2,3), pero su beneficio clínico no es aún concluyente y no se aplica de rutina en la práctica clínica (4). La administración transoperatoria de LIV ha mostrado que puede ser un método efectivo para el manejo dolor posoperatorio con una favorable disminución de la escala del dolor y consumo de opioides, así como una buena recuperación de la cirugía, sin evidencia de algún daño. Mientras los opioides siguen siendo la piedra angular para la analgesia postoperatoria, su uso puede estar asociado con efectos adversos, incluyendo íleo, que pueden prolongar la estancia hospitalaria. La LIV tiene un efecto analgésico, antiinflamatorio y propiedades antihiperalgésicas (5).
Es una manera efectiva, segura, sencilla, barata y ampliamente accesible para el control del dolor posoperatorio (6).
La anestesia general se define como un coma farmacológico inducido y reversible, cuya premisa fundamental es que todas las estructuras del sistema nervioso central sea el mismo ates y después de la administración de los diferentes fármacos. También se define como la inducción de un estado balanceado de inconsciencia, en donde existe ausencia de sensaciones dolorosas y parálisis del músculo esquelético. Sus pilares fundamentales descansan en fármacos como, analgésicos hipnóticos, relajante muscular y protección neurovegetativa, este último fármaco puede ser de carácter opcional en algunos casos (1).
A veces se agrega un fármaco conocido como adyuvante, y su finalidad es optimizar la acción del anestésico, se logrará a través de diferentes mecanismos de acción de cada uno de los fármacos, llámese sinergismo o aditividad, con lo cual mejora la calidad del estado analgésico y/o anestésico, De esta manera se permite una disminución de la dosis de los componentes y por lo tanto minimizando los efectos colaterales. Entre los adyuvantes más comunes están: ketamina, benzodiacepinas como el midazolam, alfa-2-agonistas como la dexmedetomidina, clonidina y sulfato de magnesio.
La lidocaína se sitúa como uno de los anestésicos locales “viejos”, recién llegados al arsenal de adyuvantes de la anestesia general. Se ha utilizado por vía intravenosa, desde la década de 1960 en bloqueos regionales, como antiarritmíco, como analgésico en el dolor neuropático y central, y más recientemente como adyuvante en el dolor postoperatorio, el cual incluye dolor posoperatorio refractario a opioides (2,5).
La transmisión del estímulo nociceptivo periférico depende de la presencia de voltaje canales de Na+. Dos tipos de canales se expresan en las neuronas sensibles periféricos (NAV 1.8 y NAV 1.9), (Canales iónicos dependientes de energía que se identifican como receptores de dolor de las membranas neuronales) mientras que el tercer tipo se puede encontrar en las neuronas sensibles del sistema nervioso simpático (NAV 1.7). Un subtipo de embrionario del canal de Na+ (NAV 1.3) se ha descrito en las neuronas periféricas dañadas y está asociada con el dolor neuropático y el aumento de la excitabilidad, ya que la hiperexcitabilidad periférica es causada en parte por una acumulación de canales de Na+ en el sitio de daño, el desarrollo de la hiperalgesia central de postoperatorio se puede reducir mediante el bloqueo de los canales de Na+ resistentes a tetrodotoxina sobre las terminaciones nerviosas de mecano receptores, particularmente sensibles a bajas dosis de lidocaína, en el cordón espina dorsal y la raíz del ganglio (2,10).
La LIV (y por consiguiente de su metabolito activo, monoetilglicinaxilidida) interactúa con canales periféricos y centrales de voltaje de los canales de Na+, en el lado intracelular de la membrana. Tiene más afinidad por el canal iónico abierto, que se produce durante la despolarización. La ubicación preferente del anestésico local cuando se penetra en la bicapa de fosfolípidos está determinada por su propiedad hidrófoba y estérica.
En cuanto a la sensibilización central, se ha sugerido un efecto periférico antihiperalgésico de lidocaína en el dolor somático, y efecto central sobre el dolor neuropático, con consiguiente bloqueo de la hiperexcitabilidad central.
La dosis de LIV no debe exceder de la concentración plasmática tóxica de 5 µg/ml y dosis no mayores de 5 mg/kg. Se debe administrar lentamente (no menor a (30 minutos) para considerarla como segura (7,8).
La acción analgésica final de la LIV refleja el aspecto multifactorial de su acción, resultante de la interacción con canales de Na+ y la interacción directa o indirecta con diferentes receptores y vías de transmisión nociceptiva.
A continuación se mencionan sus principales efectos
Antagonista muscarínico, inhibidor de la glicina, reducción de la producción de aminoácidos excitatorios, reducción de la producción de tromboxano A2, La liberación de opioides endógenos, reducción de neuroquininas, liberación de trifosfato de adenosina (2,5,10). Es un bloqueante de los canales de sodio usado como anestésico local en anestesia regional y antiarrítmico clase Ib mediante administración intravenosas.
Otras de sus acciones aparte de bloqueadores de los canales de sodio: Receptores acoplados de proteína G (ácido lisofosfatídico y tromboxano A2, Receptores muscarínico M1 de acetilcolina. (2,5,10).
Se sabe que el marcador por excelencia de respuesta inflamatoria, es la IL6 y que la activación endotelial seguida de adherencia y la migración leucocitaria son las respuestas iniciales de la inflamación sistémica perioperatoiro. La lidocaína intraoperatoria, modula la marginación, la adherencia y la diapédesis de los leucocitos hacia los sitos de lesión pero se inhiben la producción de radicales libres de oxígeno y la liberación de histamina. Disminuyen las concentraciones de citosina pro inflamatorias, como IL6 en las secreciones de lavado bronco alveolar de modelos animales de lesión pulmonar pre tratados con lidocaína.
Las concentraciones alveolares de factores quimiotácticos como C3a C5a TNF (factor de necrosis tumoral) alfa e IL 1 (interleucina 1) beta igualmente disminuyen en estos modelos. Se modula tanto la respuesta humoral como la tumoral. Bloquea la liberación de leucotrienos en especial B4 los cuales son esenciales para las fases iniciales de la respuesta inflamatoria sistémica al reclutar leucocitos promover su marginación y adherencia el endotelio (2,10,9,11)
Es un inmunomodulador de la respuesta inflamatoria sistémica y está relaciona a la cirugía. La respuesta inflamatoria es un paso importante y necesario para el proceso de curación y reparación, su amplificación no modulada lleva a mayor morbilidad y mortalidad (8,9)
Desde 1970 se sabe que la lidocaína disminuye en 40-60% la CAM (concentración alveolar mínima) de los anestésicos inhalados. La lidocaína disminuye la CAM del sevoflurano en 35% y desflurane en un 20% (8,9).
Su interacción con el propofol es de manera sinérgica. Al utilizar el BIS se sabe que los requerimientos de propofol disminuyen durante estimulación quirúrgica en 15% comparado con el placebo (10,11,13).
Durante la administración intravenosa durante el acto quirúrgico reduce el consumo de analgésicos y opioides en el periodo posoperatorio inmediato, está reducción es mayor al 2do y 3er día del posoperatorio lo que confirma que es un fármaco antihiperalgésico (11,12).
El reporte de un metaanálisis informa que al perfundir lidocaína durante y después de cirugía abdominal, mejora la recuperación del paciente y acorta la estancia hospitalaria. Disminuye el íleo posoperatorio y disminuye la incidencia de náusea y vómito (3,6,7).
Lidocaína es metabolizada en el hígado por medio de sistemas enzimáticos microsomales (conjunto de la P 450), se metaboliza a un ritmo de 0.85 L/kg/h. Produce metabolitos activos y han sido implicados en casos de intoxicación después de dosis repetidas de este anestésico local e infusiones continuas. Su eliminación por riñón con una fase de eliminación rápida de 8 a 17 minutos y una fase lenta de 87 a 108 minutos. Menos de 10% de la lidocaína se encuentra inalterada en orina.
Por tal motivo se diseñó un estudio clínico, cuyo objetivo principal fue, determinar si hay menores índices de dolor postquirúrgico en las primeras horas del postoperados de colecistectomía, laparoscópica, mediante la aplicación de lidocaína en infusión intravenosa. Y conocer los efectos secundarios derivados de la administración de lidocaína.
Material y método
Se diseñó un ensayo clínico aleatorizado doble ciego en 88 pacientes adultos, entre 20 y 55 años de edad, ambos sexos. ASA I y II. Programados para colecistectomías por técnica laparoscópica. Los pacientes fueron aleatorizados a dos grupos. El primer grupo o grupo L, formado por 44 pacientes, recibió lidocaína 1.5 mg/kg/h. La infusión de lidocaína se inició inmediatamente al después de la intubación traqueal y se suspendió al suturar la piel.
El grupo B o grupo control, con 44 pacientes, recibió una infusión de solución fisiológica como placebo. Ambas soluciones fueron preparadas por un tercer participante. Se excluyeron aquellos pacientes con crisis convulsivas, terapia antiarritmica o ingestión previa de opioides a la cirugía.
Todos los pacientes recibieron anestesia general con, propofol 2 mg/kg/i.v. fentanilo 4 μg/kg/i.v, cisatracurio 150 µg/kg/i.v, para la intubación traqueal. Para el mantenimiento de la relajación muscular se usaron “bolos” de cisatracurio 0,1mg/kg/i.v. El mantenimiento fue con sovoflurano o desflurano a 1.5 de MAC correspondiente. De la misma forma todos los pacientes recibieron, metoclopramida 100 µg/kg/i.v y ranitidina 1 mg/kg/i.v.
Durante el período postoperatorio inmediato se valoró intensidad del dolor por medio de la Escala Verbal Análoga (EVA), al ingreso a la UCPA (unidad de cuidados postanestesicos), a los 30, 60 y 90 minutos, donde cero significa sin dolor y diez corresponde a un dolor insoportable o el peor dolor sufrido en su vida. En donde 0-4 es dolor leve, 5-7 dolor moderado y 8-10 dolor severo. El monitoreo clase I se continuo en UCPA.
Análisis estadístico. Se examinaron las diferencias entre grupos utilizando T de Student o U de Mann-Whitney, de acuerdo al tipo de variable. La significación estadística se fijó con una P <0.05 y las diferencias entre los dos grupos se presentarán con medidas de tendencia central y dispersión de acuerdo a la distribución de la muestra. Estadística descriptiva, y chi cuadrada, con nivel de confianza mínimo del 95%, Q de Yule, porcentaje de riesgo atribuible.
La muestra se calculó para una proporción de factor de población 0.5 valor de “Z” 1.96 y una precisión de 0.05 corregido para una población finita 505 eventos.
Implicaciones éticas
El presente proyecto se ajustó a los preceptos señalados en la declaración de Helsinki y sus revisiones, así mismo, con lo estipulado en la Ley General de Salud en su artículo 17 referente a la investigación médica en sujetos humanos. Se solicitó firma de Carta de Consentimiento Informado que correspondió a un resumen en lenguaje claro y sencillo del proyecto y del como el paciente tomó parte dentro de éste, asimismo contó con espacio para la firma del paciente, testigos y el investigador responsable.
Resultados
Las características demográficas se presentan en la (Tabla 1). No se encontraron diferencias significativas entre ambas poblaciones. De los 88 pacientes estudiados, 81 (71.287%) fueron mujeres y 7 (28.72%) fueron hombres. Dentro del grupo “L”, la media de edad fue de 32.32 años con Intervalo de confianza de (28.87-35.77). En el grupo control, la media de edad fue de 30.36 (27.21-33.52). El peso en el grupo “L” fue de 64.48 (60.92-68.03) y en el grupo control fue de 64.59 (61.09-68.09); la Presión Arterial Media Inicial para el grupo “L” fue de 86.64 (83.10-90.17) y en el grupo control fue de 81.43 (78.56-84.30); todos estas variables, de acuerdo al análisis estadístico, presentaron una distribución normal. Ambas poblaciones no tuvieron diferencias significativas. (p > 0.05). Kolmogorov-Smirnov.
Tabla 1: datos demográficos
| Grupo | Lidocaína | Control | Valor de P |
| Número de pacientes | 44 | 44 | 30 |
| Edad | 32.32(28.7-35.77) | 30.36(27.21- 33.52) | 27 |
| Peso | 64.48(6092-68.03 | 64.45(61.09- 38.09) | 33 |
| Sexo | 43 | 38 | 11 |
| Mujeres | |||
| 81()71.28%) | |||
| 1 | 6 | ||
| Hombres 7 (28.72 | |||
| %) | |||
| Presión arterial | 86.64(83.64- | 81.46(78.56- | 16 |
| 90.17) | 84.30) | ||
| Media |
• Kolmogorov-Smirnov
A su ingreso de los pacientes a la UCPA, el dolor en el grupo “L” 40 pacientes (90.9%) presentaron dolor moderado, en contraste con el grupo control, que fueron 37 pacientes (84.1%); El dolor Leve 4 (9.1%) y en el grupo control 7 pacientes (15.9%), respectivamente; y ningún paciente de ambos grupos presento dolor grave. En el análisis estadístico no se encontró diferencia significativa en ambos grupos (p= 0.336). Los resultados se presentan en la (Tabla 2), Grafica 1).
Tabla 2: Características de la intensidad del dolor diferentes momentos
| Grupo Lidocína | Grupo Control | |||||
|---|---|---|---|---|---|---|
| Momento de calificación Del dolor | Dolor | Número | Numero | Valor De P | ||
| Recuperación | Leve | 4(9.1%) | 7(15.9%) | 0.336 | ||
| Postanestesica(ingr eso) | Moder ado | 40()90.9%) 0.(0%) | 37(84.1%) 0.(0.%) | |||
| Grave | ||||||
| A los 30 minutos en | Leve | 32(72.7%) | 19(43.2%) | 0.007 | ||
| Recuperación | Moder ado | 9(20.5%) | 20(45.5%) | |||
| Postanestesica | Grave | 20(45.5%) | 5(11.3%) | |||
| A los 60 minutos en | Leve | 32(72.7) | 22(50.0%) | 0.02 | ||
| Recuperación | Moder ado | 11(25.0%) | 17(38.6%) | |||
| Postanestesica | Grave | 1(2.3%) | 5(11.4%) | |||
| A los 90 minutos en | Leve | 37(84.1%) | 19(43.2%) | 0.00003 | ||
| Recuperación | Moder ado | 7(15.9%) | 17(38.6%) | |||
| Postanestesica | Grave | 0(0%) | 8(18.2%) | |||
* U de Mann Whitney
A los 30 minutos del ingreso de los pacientes a la UCPA, los pacientes del grupo “L” presentaron dolor leve en 32 de ellos (72.7%), seguida por dolor moderado en 9 (20.5%), y dolor severo en 3 pacientes (6.8%), mientras que en el grupo control, se reportó mayor porcentaje dolor moderado 20 pacientes (45.5%) seguido por dolor leve en 19 pacientes (43.2%); y dolor severo en 5 pacientes (11.3%. El análisis estadístico mostro diferencia significativa entre ambos grupos (p= 0.007). (Grafica 2).
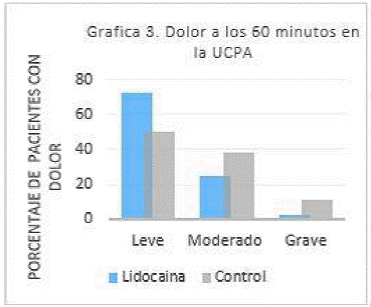
Durante el periodo de 60 minutos, el grupo “L” presento dolor leve 32 pacientes (72.7%), Dolor moderado 11 pacientes (25%), y un paciente con dolor severo (2.3%). En el grupo control 22 pacientes (50.0%) presentaron dolor leve, seguido de dolor moderado 17 pacientes (38.6%), y 5 pacientes presentaron dolor grave (11.4%). En el análisis estadístico, mostro una diferencia significativa entre ambos grupos, con una (p=0.02). (Grafica 3)
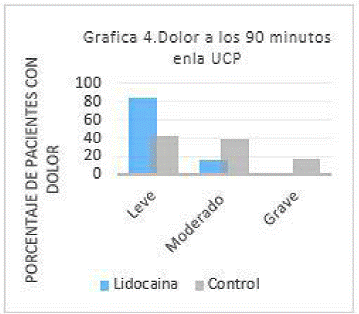
A los 90 minutos de ingresado el paciente a la UCPA última medición del dolor, el grupo “L”, presento dolor leve en 37 pacientes (84.1%), seguida por dolor moderado 7 pacientes (15.9%); y ningún paciente presento dolor grave, mientras que en el grupo control las proporciones fueron las siguientes, dolor leve en 19 pacientes (43.2%), seguida por el dolor moderado en 17 pacientes (38.6%); y 8 pacientes (18.2%) con dolor grave. En esta medición, se destaca que en el grupo “L” no reportó la presencia de dolor severo, en contraste con el grupo control, donde se reportó en 8 pacientes. Se encontró una diferencia estadísticamente significativa entre ambos grupos (p= 0.00003). (Tabla 2) (Grafica 4).
Con respecto a los cambios hemodinámicos, de presión arterial media, a los 30 minutos, en el grupo “L” la presión arterial media fue de 82.45 (78.92 - 85.99) y en grupo control fue de 82.75 (79.11 - 86.39), con una (p= 0.907), a los 60 minutos, en el grupo “L” la media fue de 82.39 (79.02 - 85.75) y en el grupo control 81.39 (78.13 - 84.64) (p= 0.668), a los 90 minutos se reportó, en el grupo “L” una media de 79.75 (76.47 - 83.03) mientras que en el grupo control se reportó media de 79.41 (76.37 - 82.45) (p= 0.878); en el análisis estadístico no se encontró diferencia significativa entre el grupo tratamiento y el grupo control.
Las características adicionales del evento quirúrgico fueron: El tiempo quirúrgico en ambos grupos, se encontró una media de 56.64 minutos en el grupo tratamiento y un rango de (52.56 - 60.71) y media de 63.07 minutos en el grupo control con un rango de (56.58 - 69.55). En el análisis estadístico no se encontró diferencia significativa entre ambos grupos (p=0.095). No se observaron alteración del ritmo cardiaco durante el monitoreo del área cardiaca por EKC.
Discusión
La lidocaína es un anestésico local cuyo principal mecanismo de acción es por bloqueo de los canales de sodio de forma transitoria. La infusión de lidocaína intravenosa posee propiedades analgésicas, antihiperalgésicas y antiinflamatorias entre otras. Otro de sus mecanismos de acción es por disminución de la producción de citoquinas proinflamatorias.
Recientemente se ha analizado la posibilidad de usar lidocaína a dosis muy parecidas a las antiarritmicas, para tratamiento coadyuvante del dolor postoperatorio y como una forma de disminuir el consumo de opioides, ya que presenta una buena estabilidad hemodinámica y con mínimos efectos secundarios importantes. Es un anestésico local con propiedades antinociceptivas, usado en una gran variedad de estudios clínicos, especialmente en estados de dolor neuropático. Es decir dominados por hiperalgesia. Es decir actuaría sobre nociceptores involucrados en la generación y mantenimiento de la hiperalgesia (15).
Marret y colaboradores menciona en su estudio, que existe una marcada disminución del dolor, en pacientes que recibieron lidocaína en infusión endovenosa durante la cirugía. Sun Y, demostró en un metaanálisis que la lidocaína sistémica, disminuye la intensidad del dolor posoperatorio acompañada de una marcada disminución de los días de estancia hospitalaria (11). Nosotros pudimos observar que el dolor leve se presentó en mayor porcentaje en las evaluaciones de dolor, en los pacientes que recibieron lidocaína sistémica, excepto en la calificación al ingreso de los pacientes a la UCPA, comparada con el grupo control.
Por el contrario otros autores han encontrado que lidocaína en condiciones similares a este tipo de estudios, no ha demostrado ser benéfica cuando se aplicó en pacientes con artroplastia total de cadera (16).
En el presente estudio el dolor fue de menor intensidad, en el grupo que recibió lidocaína en infusión, en todas las mediciones realizadas, y en todas las modalidades (leve, moderada y grave), sin embargo solo se obtuvo diferencia estadística a los 60 y 90 minutos. (p< 0.02) y (p< 0.00003) respectivamente. Lo cual significa que probablemente lidocaína es más efectiva en presencia de un estímulo nociceptivo doloroso, como podría ser el dolor postoperatorio inmediato. En resumen la LIV tiene un efecto prioritario sobre dolor visceral. El mejor ejemplo de ello, es la restauración rápida de la función intestinal después de cirugía.
Lauretti y colaboradores sugieren que la lidocaína a dosis bajas tendría sus mejores efectos cuando es administrada durante la cirugía y en presencia de un significativo estímulo nociceptivo. Por esta razón se ha usado menos frecuentemente en el postoperatorio. Groudine, al administrar lidocaína en infusión en un bolo de 1,5 mg/kg y luego una infusión de 2-3 mg/minuto en pacientes operados de prostatectomía radical, observó una disminución significativa del dolor en reposo hasta el tercer día del postoperatorio (17).
Se ha descrito que el efecto de la lidocaína es más pronunciada cuando su infusión se inicia en el periodo preoperatorio y se continúa infundiéndose por varios días. Se le han descrito tres periodos de analgesia, el primero de ellos es durante la infusión y 30 a 60 minutos después de terminada. El segundo periodo es de aproximadamente seis horas y es transitorio dura aproximadamente 6 horas después de la infusión y el tercer periodo aparece entre las 24 horas y las 48 horas después de terminada la infusión. Lo cual ha sido parte de la formulación diferentes hipótesis por diferentes autores (18).
Se puso especial atención en los posibles efectos secundarios de la lidocaína durante su periodo de administración, y aunque este tiempo fue muy corto, no se presentaron alteraciones electrocardiográficas, no le dimos oportunidad a que se almacenara el fármaco en el cuerpo, por el tiempo tan corto en que se administró. La toxicidad por lidocaína parece ocurrir cuando sus concentraciones en sangre superan los 5 µg/mL. Las dosis habituales varían entre 2 a 5 mg/kg, con lo cual se alcanzan concentraciones en sangre de 2µg/mL, lo que significa que la dosis está muy por debajo de la dosis que se usó en este estudio. Sin embargo las dosis para analgesia postoperatoria no están muy bien determinadas aun.
Rimback, Groudine y colaboradores han demostrado que la infusión intravenosa continua de lidocaína, proporciona un retorno más rápido de la función intestinal después de la cirugía. De manera similar, en el estudio de Kaba y colaboradores. La lidocaína sistémica mejoró la función intestinal postoperatoria, como lo demuestran los tiempos acortados hasta el primer flato y la defecación después de la cirugía. El íleo postoperatorio resulta de varias etiologías, incluyendo el consumo de opioides postoperatorio, la inflamación visceral secundaria a la cirugía y la estimulación simpática postoperatoria. Por lo tanto es muy posible que una de sus principales aplicaciones de la lidocaína en infusión, pueda ser para analgesia postoperatoria en cirugía de abdomen, en donde se manipulen las vísceras.
Finalmente dado que la acción de la lidocaína es tanto periférica como central, por una parte bloquea tanto los canales de sodio como los de potasio, actúa bloqueando receptores NMDA y disminuyendo la cantidad de sustancia P a nivel central. A nivel periférico la lidocaína inhibe la actividad anormal de las fibras aferentes primarias, especialmente las fibras C, promoviendo un bloqueo simpático y vasodilatación. El bloqueo de los canales de sodio resulta en una inhibición de la actividad neuronal lo cual resulta en una disminución delo dolor. También disminuye una disminución de la actividad medular lo cual contribuye a la diminución del dolor.
Una ventaja de este tipo de analgesia es que se trata de una forma efectiva, simple y de muy bajo costo. También puede estar indicada en aquellos casos en donde la epidural no sea posible instalar.











 nueva página del texto (beta)
nueva página del texto (beta)