Introducción
Debe distinguirse entre iatrogenia esto es, daño inducido a un paciente por ignorancia o negligencia médica, y la presentación de una reacción adversa (RA). Casi cualquier medicamento puede inducir una RA. Las hay de todos tipos: las relacionadas con el modus operandi del fármaco, las que están ligadas a la dosis y concentración plasmática alcanzada (reacciones tipo A), y las reacciones debidas a otro efecto del medicamento, no relacionado con su mecanismo de acción directamente, sino con un efecto mejor descrito como paradójico (reacciones tipo B).1 Las RA pueden generarse en un paciente por muchas razones (raza, edad, estado fisiológico, presencia de otros medicamentos, susceptibilidad individual, etc.); por ejemplo, una RA tipo A se presenta como consecuencia de la aplicación de una sobredosis de gentamicina a un caballo, al que induce daño renal. No obstante, dada la variabilidad de la vida media de la gentamicina en caballos, se puede inducir daño renal a un paciente susceptible, con dosis supuestamente adecuadas. Una RA tipo B se puede generar si se aplica gentamicina a un caballo deshidratado, y posterior a una anestesia. En estos casos, es posible que se presente un bloqueo neuromuscular y parálisis flácida de consecuencias fatales. En ambas instancias es obligación del veterinario reconocer la RA, distinguirla de una iatrogenia y, en lo posible, informarla en la literatura científica. Muchas RA se derivan de interacciones indeseables y pueden considerarse como otro rubro; pero en esta compilación no se hará la distinción.
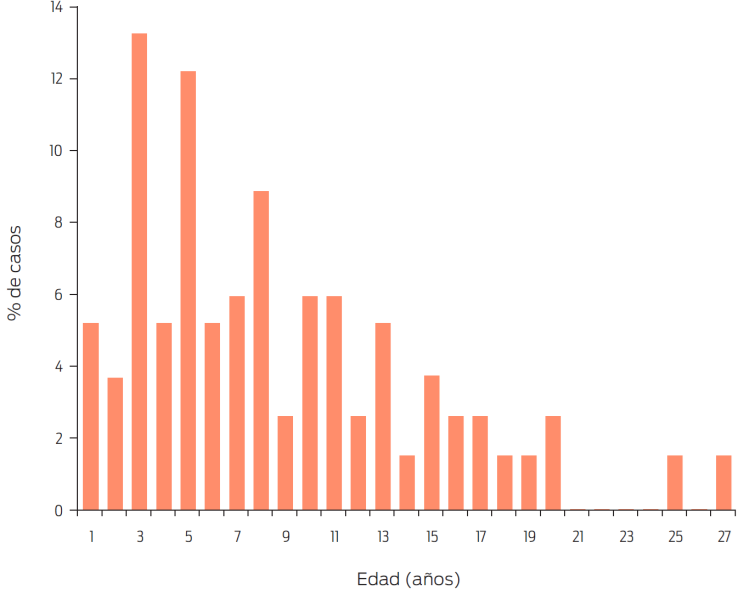
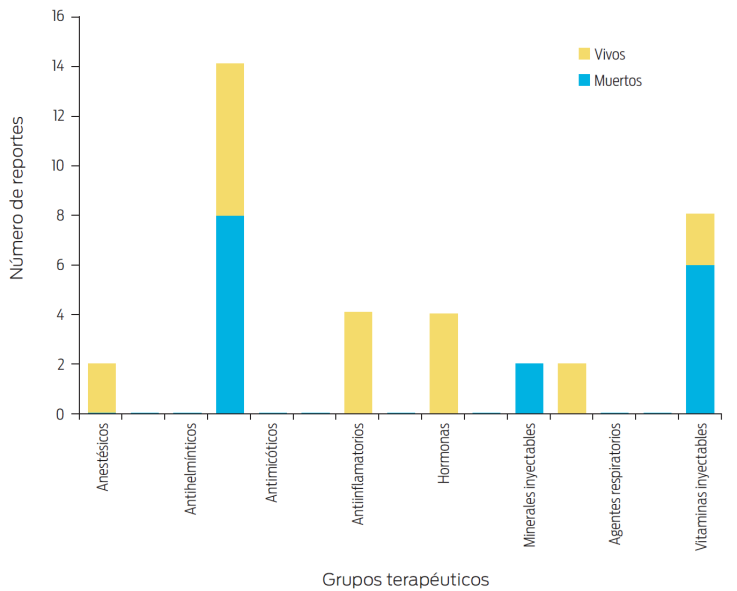
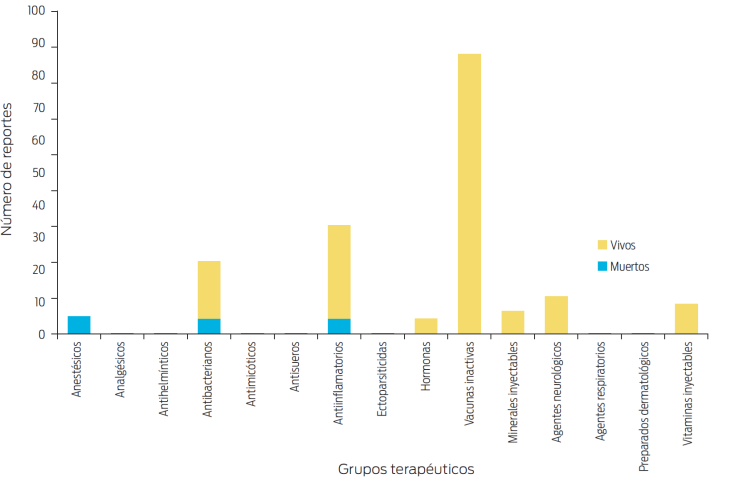
En este escrito se ha considerado como objetivo primario: presentar un estudio retrospectivo de las posibles RA (A y B) que afectan a los equinos, con el propósito de actualizar al especialista al respecto, para que en lo posible las evite. En las Figuras 1-4 se cuantifican, por grupos terapéuticos, las RA descritas para equinos en un estudio en 1994.
Tranquilizantes
Agonistas α2 adrenérgicos
Se pueden observar efectos agonistas cardiacos y vasculares α1 y α2 después de la administración intravenosa (IV) de xilazina o detomidina. Al principio, aumenta la presión sanguínea, como resultado de este agonismo doble. La respuesta se da después de 15 segundos de haber administrado el fármaco y dura poco menos de 15 minutos,2,3 pero después disminuye debido a la estimulación vagal y a los efectos persistentes sobre los receptores a2 en el sistema nervioso central (SNC).2,4-8
La xilazina ha sido descrita como agonista parcial de receptores α2-adrenérgicos en la periferia,9 por lo que puede inducir alteraciones cardiovasculares importantes. Induce bloqueo atrioventricular (AV) de primero y, en ocasiones de segundo grado,4,5,10-15 que en teoría pueden causar colapso cardiovascular, específicamente si se usa una anestesia con halotano,16 o en pacientes susceptibles. Estos efectos se observan con mayor frecuencia cuando se administra por vía IV y rara vez con la administración intramuscular (im).17 Hay disminución de la demanda de oxígeno por el miocardio y del flujo sanguíneo coronario.18 Pueden llegar a aumentar la isquemia digital,19 por lo que no deben considerarse como opción en el tratamiento de la laminitis.20 Los agonistas α2-adrenérgicos disminuyen la resistencia vascular y el consumo de oxígeno en el tubo intestinal.21,22 Clarke et al.23 observaron disminución del flujo sanguíneo arterial del colon. Puede haber disminución en la frecuencia respiratoria, el volumen corriente y la concentración parcial de oxígeno arterial.2,11,24,25 Sin embargo, Hubbell y Muir5 encontraron que el volumen corriente aumenta de manera refleja a la disminución de la frecuencia respiratoria en caballos conscientes, mientras que disminuye en caballos anestesiados. Los cambios cardiorespiratorios son transitorios (desaparecen en 1-2 horas) y dependen de la dosis.26 Estos efectos pueden ser aditivos con la administración repetida. La sobredosis (más de 2mg/kg) induce disnea, recumbencia y muerte con o sin signos extrapiramidales (movimientos de carrera en decúbito lateral), debido a colapso cardiovascular.27 Aunque existen informes de muertes por la administración de xilazina21,28 y por la combinación de detomidina con sulfas-trimetroprim,29 en ambas instancias, no se han podido esclarecer los mecanismos farmacodinámicos responsables de estos casos, si es que los hay. Se sabe que la administración intraarterial de xilazina puede producir excitación, colapso, convulsiones, rigidez muscular y a menudo muerte súbita.17,30,31 Para producir una analgesia caudal y reducir los efectos cardiovasculares que se observan con la administración IV, la xilazina se ha utilizado por vía epidural.2,14 Sin embargo, se ha observado que el uso de la mezcla xilazina-lidocaína para analgesia caudal, induce un efecto demasiado intenso con pérdida de la función motora de los miembros pelvianos, por lo que es necesaria la anestesia general para evitar que el paciente se lesione por el bloqueo motor completo que se refleja en ataxia durante varias horas.32
La detomidina por vía epidural induce un efecto de sedación profunda, ataxia, depresión cardiovascular, sudoración y diuresis, y por vía parenteral, comparte algunos de los efectos de bloqueo cardiaco que induce la xilazina.33 Con la administración de detomidina se observa disminución en la concentración de catecolaminas plasmáticas, pero no del cortisol, lo que puede indicar que se induce una reducción de la actividad simpático adrenal.34 Un caso similar es la romifidina (otro agonista α2) que, a una dosis terapéuticas, puede inducir colapso cardiovascular (hipertensión seguida de hipotensión severa) con temblores musculares y depresión respiratoria.4
Los agonistas α2 adrenérgicos pueden ocasionar ataxia;2,15 la romifidina la produce en menor grado35 que la medetomidina.36 Se puede presentar una marcada relajación de los cartílagos nasales y de los músculos laríngeos, lo que ocasiona, en algunos casos, un ruido característico;2,5 además puede haber supresión del reflejo tusígeno6 y una disminución en la velocidad de depuración mucociliar.37 Otros efectos pueden ser disminución de la presión intracraneana,5 hiperglicemia,38,39 hipoinsulinemia,17,39 incremento transitorio de ADH en plasma,17 aumento de la diuresis,2,5,17,38,39 glucosuria,17 aumento de la excreción urinaria de Na+,5 K+ y Cl-,17 hipotermia en potros,2 disminución transitoria del flujo sanguíneo en el músculo esquelético,40 disminución de la motilidad intestinal5,22,41 y del esófago.42 Aún no se precisa el impacto clínico de estas RA.
La mezcla quinalbarbitona (barbitúrico)-cinchocaína (anestésico local) produce eutanasia en forma suave y en un periodo de tres minutos; sin embargo, cuando se premedica al caballo con detomidina, xilazina o romifidina (α2-adrenérgicos) y butorfanol (analgésico narcótico), hay retardo del colapso y la eutanasia, con actividad muscular exacerbada y jadeos, por lo que sólo se recomienda la eutanasia en este caso en particular con estos fármacos, cuando no existe otra opción al alcance.35
Fenotiacínicos
Los fenotiacínicos como el clorhidrato de promacina y la acetilpromacina, pueden causar hipotensión y taquicardia refleja transitorias según la dosis, y estos cambios pueden persistir en caballos que se encuentren en situaciones de estrés, excitación o choque, ya que las concentraciones sanguíneas de catecolaminas serán elevadas y favorecerán estas condiciones transitorias.24 Además, puede haber secuestro sanguíneo por vasodilatación periférica (causada por bloqueo de receptores α1 adrenérgicos y estimulación β)2,24,43 y sudoración profusa, lo cual disminuye el flujo sanguíneo renal y hepático con el consecuente desarrollo de choque.24,44,45 Los candidatos predecibles a un choque por fenotiacínicos son, en su mayoría, caballos viejos, sujetos bajo condiciones de estrés, excitados o con disminución de volumen plasmático.5 Estas crisis se pueden tratar por medio de la administración IV de expansores plasmáticos o fluidos isotónicos.5 Los fenotiacínicos pueden ocasionar disminución en el hematócrito y en las proteínas plasmáticas totales, posiblemente por secuestro a nivel esplénico.46 La propionilpromacina (fenotiacínico), al utilizarse como preanestésico en anestesia con halotano, ocasionó mayor hipotensión sistólica y problemas locomotores pos-operatorios en comparación con la xilazina.47 Cuando se administra acepromacina por vía oral se ven menos afectados los parámetros de presión arterial media, frecuencia cardiaca y respiratoria y cuenta hemática, en comparación con la administración IV.48 Aunque los fenotiacínicos alteran la sensibilidad del centro respiratorio al CO2, los cambios en el sistema respiratorio parecen ser mínimos, ya que hay una compensación entre la disminución de la frecuencia respiratoria y un aumento del volumen corriente.5,49
El tiempo de espera para que se presenten los efectos por fenotiacínicos es impredecible. Puede requerirse 20 minutos para que se inicien los primeros signos, y de 45 a 60 minutos para que su efecto sea completo.5 El grado de sedación es variable;24 a menudo con inadecuada tranquilización y ataxia.6 Algunos signos de tranquilización persisten hasta por seis horas. No hay antagonistas específicos.5 Los fenotiacínicos inducen protrusión peneana2,50 que puede llegar a dificultar el manejo. En particular se ha relacionado el clorhidrato de propiopromacina con relajación irreversible del conjunto de músculos retractores del pene. Aunque esto ocurre ocasionalmente, de suceder, hace que el caballo quede inutilizado. Por otro lado, la protusión peneana se resuelve en un periodo de 2-10 horas y a menudo es el único signo remanente de tranquilización en caballos machos cuando se usa acepromacina o clorhidrato de promacina. La incidencia patológica de parálisis persistente del músculo retractor del pene es baja y su etiología es incierta.6,26 La administración oral de acepromacina (0.5 mg/kg) ocasiona efectos menos pronunciados en el prolapso peneano, en comparación con la administración IV (0.1 mg/kg), por lo que se ha postulado que las elevadas concentraciones plasmáticas del fármaco después de la administración IV pueden ser las responsables de este efecto.48
En caballos son escasos los efectos colaterales a nivel de SNC por fenotiacínicos. Pueden ocasionar respuestas extrapiramidales después de la administración de flufenacina, aunque en la mayoría de los casos los signos desaparecen sin necesidad de recurrir a tratamiento alguno. No obstante, se ha informado del uso exitoso de difenhidramina o fenobarbital.51,52 Este efecto puede deberse al bloqueo excesivo de la vía dopaminérgica en la sustancia nigra y en el ganglio estriado.51 Está contraindicada la administración de fenotiacínicos a caballos que presentan convulsiones, ya que disminuyen el umbral de excitación neuronal.2,5
Analgésicos narcóticos
La administración única de analgésicos narcóticos (etorfina, fentanilo, meperidina, metadona, morfina) está asociada frecuentemente a estimulación muscular y del SNC.2,5,25 Hay hiperactividad manifestada por movimientos circulares repetitivos con reposo ocasional y cambios de dirección; si hay alimento, algunos caballos lo mordisquean, pero no lo tragan. A dosis altas (más de 0.5 mg/kg) hay temblores, ataxia, recumbencia y hasta depresión del SNC. También se ha observado un trote coordinado sin moverse de un solo lugar.53 La metadona, un análogo sintético de la morfina, no tiene estos efectos estimulantes.15 Hay hipersensibilidad a los estímulos visuales y auditivos.2
La severidad de la depresión respiratoria (vg., fentanilo, etorfina) producida por los analgésicos narcóticos (excepto la meperidina) varía con el grado de excitación y con los efectos respiratorios que produzca la administración concomitante de otros fármacos.2,5 Los efectos cardiovasculares incluyen aumento de la frecuencia cardiaca, de la presión arterial media y del gasto cardiaco, los cuales persisten durante 5-60 minutos.2 Puede ser contraproducente la utilización de analgésicos narcóticos en algunos casos de cólico, ya que amén de enmascarar los signos clínicos de dolor, disminuyen de manera profunda y prolongada la actividad propulsiva del intestino. Este efecto no se observa con el butorfanol.5
Analgésicos que actúan en receptores opiáceos µ
Aun a dosis analgésicas se puede observar estimulación simpática y del SNC.2,15,53 Estos analgésicos catecolaminas endógenas (noradrenalina, adrenalina y dopamina).53 El fentanilo incrementa la frecuencia cardiaca y respiratoria, produce midriasis y una ligera hipertermia,54 además de aumentar la actividad locomotora espontánea.15,54-56 Esta respuesta locomotora es más fuerte con el análogo carfentanilo, seguido del 3-metilfentanilo, el sulfentanilo, el metilfentanilo, el alfentanilo y el fentanilo.57-59 Al administrar carfentanilo a un caballo premedicado con xilazina, se observó ataxia, inquietud, presión de la cabeza, recumbencia, fasciculaciones musculares, movimientos de carrera, sudoración, rigidez de miembros posteriores, rigidez y arqueamiento del cuello, taquicardia, hipertensión, hipertermia, expulsión de líquido serosanguinolento por ollares, hemoconcentración, acidosis metabólica moderada y taquipnea.8 Es importante resaltar que no todos los analgésicos narcóticos con acción en receptores µ producen excitación en todos los caballos en todos los casos. Hay una variación individual en la respuesta;53 sin embargo, con la etorfina, aun cuando se administra previa tranquilización, el caballo no está exento de presentar excitación locomotora.60,61 Además puede ocasionar taquicardia severa, aumento del tono muscular, toxemia, hipercarpnia e hipertermia.15 Al administrar oximorfona a caballos y luego someterlos a ejercicio submáximo, se observó una taquicardia mayor y más duradera durante el calentamiento y el recorrido de una milla en tres minutos, en comparación con el grupo testigo.8
Muir6 menciona que el fentanilo puede producir reacciones de hipersensibilidad a estímulos visuales, auditivos y táctiles. Esto último también lo menciona Kamerling,53 quien los define como respuestas exacerbadas a los estímulos ambientales. Además se ha observado sudoración, hipertermia, midriasis, taquicardia dependiente de la dosis y taquipnea.55 Con la administración IV de meperidina se ha observado hiperestesia, fasciculaciones musculares, sudoración profusa, dilatación de pupilas y lagrimeo, posiblemente por una liberación asociada de histamina.62
Cuando se administran a dosis bajas, los analgésicos narcóticos que actúan sobre receptores µ producen pocos efectos sobre las variables cardiovasculares y pulmonares y en los gases sanguíneos.6 Sin embargo, a dosis para ocasionar inmovilización, pueden producir depresión cardiaca y respiratoria; en el intestino inducen un aumento de los movimientos de segmentación y disminución de la actividad peristáltica propulsiva. Esto se manifiesta por defecación inicial, seguida por constipación de grado variable con heces secas.6 También estimulan la liberación de hormona antidiurética (ADH) e inhiben la liberación de hormonas adenocorticotróficas y gonadotróficas. Así pueden modificar el estro de la yegua.6
Analgésicos que actúan en receptores opiáceos kappa y delta
Los analgésicos narcóticos que actúan sobre receptores opiaceos no siempre producen estimulación locomotora.63 Sin embargo, por medio de estudios neurológicos, Gasthuys et al.64 encontraron que el butorfanol (0.04 mg/kg o más) produjo estimulación del SNC en caballos. Esto último concuerda con lo registrado por Kamerling et al.,65 quienes lo observaron con una dosis de 0.2 mg/ kg. Matthews y Lindsay66 y Nolan et al.67 encontraron el mismo efecto, pero en ponis. Posiblemente estos efectos de estimulación se deban a la interacción del butorfanol con los receptores.53 Se cree que estos receptores están asociados con signos de excitación, aumento en la locomoción, tolerancia a los analgésicos narcóticos, midriasis y taquicardia.6 El PD117302 también ocasionó estimulación locomotora en ponis.67 El U-50,488H produjo estimulación mínima, seguido de la etilquetazocina y del fentanilo.68,69
El butorfanol incrementa la frecuencia cardiaca y la presión arterial.53 Produce pocos efectos sobre los sonidos intestinales, el tiempo del transito intestinal o la frecuencia de defecación,6 a diferencia de los efectos de los analgésicos narcóticos que actúan sobre receptores µ.
Otros analgésicos
El hidrato de cloral se usa en preparado junto con sulfato de magnesio y pentobarbital, sólo por vía IV y en concentraciones menores al 12%, ya que es extremadamente irritante para los tejidos. Puede, además, producir ataxia severa aun a dosis bajas.2
La azaperona reduce el valor del hematócrito,70 posiblemente por secuestro esplénico. Además, puede producir cambios de comportamiento y aun exitación,71 por lo que su uso clínico no está difundido.
La reserpina requiere de un periodo muy largo para observar su acción; sin embargo, la duración de sus efectos persiste por mucho tiempo (hasta 10 días).26 Se ha informado de depresión inicial seguida de cambios súbitos en el comportamiento que, muchas veces, pueden ser únicamente detectados por quienes conocen el comportamiento normal del caballo.26
El diazepan no es útil para producir inmovilización con el caballo de pie, ya que el grado de sedación no es suficiente y al incrementar la dosis (0.15-0.2 mg/kg IV) se produce relajación muscular profunda, ataxia y recumbencia.2,5,72
Anestésicos
Todos los anestésicos generales alteran el aparato cardiopulmonar, aunque en diferentes grados, no importa cuál sea la técnica o protocolo anestésico utilizado.5 Esto último se debe a la actividad depresora de los anestésicos en el sistema cardiorrespiratorio y por la posición lateral o dorsal que guarda el caballo durante el procedimiento anestésico, lo que induce una insuficiencia de la relación ventilación-perfusión. Bajo recumbencia lateral se reduce la perfusión intersticial del músculo bíceps femoral (19.7 ± 0.15 mm Hg) y disminución del pH intersticial (de 7.07 ± 0.3 a 6.73 ± 0.21) con cambios fermentativos después de 45-150 minutos de anestesia.73 También existen informes de parálisis laríngea asociada con anestesia general,28 atelectasia,74 disminución de la respuesta inmune y de la fertilidad75 por modificaciones endocrinas no bien determinadas.
Barbitúricos
Inducen depresión dependiente de la dosis y se observan efectos que inician con calma, somnolencia, inconsciencia, anestesia y pueden llegar a inducir coma y muerte. Dado que tienen un índice terapéutico bajo, a menudo no se logra actividad anticonvulsiva sin ocasionar depresión general. Paradójicamente, se puede producir excitación con dosis subanestésicas;26 en este sentido, se recomienda su uso en caballos sólo como anticonvulsivos, inductores de la anestesia o agentes eutanásicos.
Otros anestésicos
Gliceril guayacol éter
Se ha comentado que a concentraciones mayores del 12% puede producir hemólisis.76 Al administrarlo por catéter IV y en concentraciones del 10%, se observaron trombos en venas yugulares en 100% de los casos (7 caballos), mientras que esto sólo se observó en uno de cinco caballos que recibieron el medicamento a una concentración del 5%. Es evidente, entonces, que deben observarse precauciones en caballos con alto riesgo de trombosis o tromboflebitis.77 Dickson et al.78 también registraron tromboflebitis en el sitio de inyección. La sobredosis se observa como rigidez muscular, hipotensión y respiración con apneas transitorias que pueden progresar a paro respiratorio que casi siempre se acompaña de paro cardiaco.5,33
Ciclohexilaminas
La ketamina debe administrarse siempre después de haber logrado sedación con algún otro fármaco, pues produce excitación,79 al igual que patrones respiratorios con apneas, los cuales son arrítmicos y producen pocos cambios en la presión parcial de oxígeno arterial y en la retención de CO2.5 Si la ketamina es readministrada más de una vez para prolongar el tiempo de anestesia, se corre el riesgo de disminuir la calidad de la recuperación, ocasionar rigidez muscular y hasta convulsiones.80 Igualmente, si se combina con xilazina no hay muy buena relajación muscular.5,81 Cuando se hace con detomidina se observa recuperación de menor calidad y con mayor grado de incoordinación, que cuando se combina con xilazina.79,81,82
El uso de xilazina junto con la mezcla de tiletamina (ciclohexilamina)-zolacepam (benzodiacepina) produce mayor relajación muscular y depresión respiratoria,5,81 pero la recuperación del paciente a la anestesia cursa con un periodo de excitación más prolongado, en comparación con el uso de la combinación xilazina-ketamina. Esto último se debe a la larga acción del zolacepam (relajación muscular), que se traduce en ataxia.81
Propofol
Al administrarlo como único agente anestésico, se llega a observar inducción difícil con movimientos ocasionales e impredecibles de las extremidades, taquicardia y depresión respiratoria.83 Únicamente se recomienda en potros.84
Anestésicos halogenados
Aun cuando se cuente con protecciones adecuadas en el quirófano, las altas concentraciones de halotano predisponen la presentación de miositis posanestésica.85 Al utilizar halotano (1.5 veces la concentración alveolar mínima) durante cuatro horas se observaron claudicaciones posanestésicas. Se concluyó que los cambios en la resistencia periférica son de extrema importancia en la producción de lesiones isquémicas tisulares.86 Cuando se mantuvo la anestesia con halotano (1.2 veces la concentración alveolar mínima) durante 12 horas hubo alteraciones de la función hepática y reducción del funcionamiento renal asociados a la anestesia.87 Cuando se premedicó acepromacina, se indujo la anestesia con midazolamketamina y se mantuvo con halotano a una concentración de 1.2% en ponis, se observó hipotermia, hiperoxia, acidosis respiratoria, hipotensión moderada e incremento ligero en las concentraciones de cortisol y lactato.88
Con isofluorano se detectó hipertermia en una potranca que tenía como diagnóstico de base, parálisis periódica por hiperkalemia.89 También se han presentado problemas de hipoxemia en caballos con cólico, a los que se les indujo a la anestesia con xilazinagliceril guayacol éter y ketamina, o tiobarbitúricos, mantenidos con isofluorano o halotano.90
Antibacterianos
Sulfonamidas
Se ha observado que las sulfonamidas, en general, pueden ocasionar cristaluria, hematuria y obstrucción tubular renal, si el consumo de agua es bajo y el pH de la orina es ácido.91,92 Puede haber necrosis tubular renal por precipitación (debida a la concentración y solubilidad de la sulfa y al pH de la orina) y deposición de cristales93,94 Empero, la sulfamerazina, la sulfametazina y la sulfadiazina son muy solubles, por lo que, a pesar de su rápida excreción, precipitan poco. Sin embargo, el uso de bicarbonato de sodio (alcaliniza) y la terapia de fluidos (induce diuresis) reducen el efecto de precipitación de la sulfa disuelta y aumenta su eliminación,93 por lo que son raros los efectos tóxicos agudos y, si acaso, están asociados principalmente con hipersensibilidad, sobredosis o administración IV rápida.95
Se ha comentado que no deben usarse sulfonamidas con trimetroprim (STMP) en caballos con daño del parénquima hepático, alteraciones sanguíneas, enfermedad renal, urolitiasis o historia de sensibilidad a las sulfonamidas.96 Existe una gran discrepancia con los efectos adversos que produce la administración IV de STMP. Se han informado casos de presencia de prurito con la administración de sulfadiazina/trimetroprim (SDZ/TMP),97 ataxia durante algunos minutos con la administración de SDZ,93 excitación y fasciculaciones musculares con sulfadiametoxina/ormetroprim (SDM/OMP),98 alteraciones cardiorrespiratorias con SDM y sulfadimidina,99 aunque igualmente existen informes en los que no hay efectos adversos.100 La causa exacta de estos efectos no se sabe con exactitud, pero se ha postulado que la sensibilización cardiaca (inducida por estrés) puede ser un factor precipitante.95 Para evitar la incidencia de RA, que parece ser cada vez mayor después de la administración IV de STMP, se recomienda aplicar la STMP de manera lenta en no menos de 1 minuto.95 Por otra parte, existe un informe en el cual la administración IV de TMP 5.5 mg/kg disuelto en ácido láctico acuoso (50 mg/mL) produjo la muerte de uno de seis caballos por choque anafiláctico agudo101.
Existen informes que indican que la administración oral de SDZ/TMP (30 mg/kg) es inocua.100 Sin embargo, otros autores102 observaron que la administración oral de la misma combinación durante tres o más días, produjo heces suaves y diarrea en 7% de los caballos tratados (n = 200). Se ha mencionado que las sulfonamidas potenciadas se han asociado con disminución del apetito, diarrea y muerte por cambios en la microflora intestinal.93,102 Estos fármacos no se reconocen como agentes causantes de colitis, aunque estas mismas se han asociado ocasionalmente con colitis aguda.103,104 Perrin et al.105 sospecharon que la administración oral de ptalilsulfatiazol y sulfadimidina, ambos a dosis de 66-830 mg/ kg durante siete días, junto con fenilbutazona, neomicina (30-300 mg/kg durante siete días), penicilina G sódica (33 000 UI/kg IV durante dos días) y penicilina G procaínica (12 500 UI/kg im durante cinco días), pudo haber causado el desarrollo de colitis por Clostridium difficile.
Se ha informado la presencia de sangrado profuso después de un procedimiento quirúrgico en caballos tratados con STMP, que cesó después de 48 horas de descontinuado el tratamiento. En el escrito original no se detallan dosis, intervalo de dosificación, ni vía de administración.106
β-lactámicos
La penicilina G procaínica constituye el antibacteriano más utilizado en la clínica de equinos.107-109 Su toxicidad es baja y se ha informado que la administración de 30 millones de UI/día por vía im durante siete meses no produjo RA, únicamente una leve irritación muscular en los sitios de aplicación;110 Sumano et al.109 informaron lo anterior con dos diferentes esquemas de dosificación durante tres días. En Australia de 1972 a 1987 sólo se notificaron 42 casos de RA en caballos, asociadas con este medicamento.111 Sin embargo, en este país y en un periodo de tres meses durante 1993, alrededor del 15% de los caballos que recibieron penicilina procaínica presentaron RA al fármaco.112 Las causas de toxicidad en esta especie al utilizar penicilina procaínica se deben a una reacción anafiláctica,111 intoxicación por la penicilina,113 pero sobretodo a la toxicidad de la procaína.109,111,114,115 Otras causas no idiopáticas son la aplicación de productos caducos o alergia al excipiente.107 Anteriormente se creía que la anafilaxia a la penicilina era el efecto adverso número uno que producían los ßlactámicos.116 Sin embargo, se ha visto que la toxicidad a la procaína puede ser la causa del 90% de las RA en el uso de la penicilina procaínica.107,111 Esto último se puede deber a que los caballos son aproximadamente 20 veces más susceptibles que los humanos a la toxicidad por procaína y que la estimulación del SNC por procaína ocurre a concentraciones séricas mucho menores.111 Tobin et al.117 informaron que la infusión IV de procaína (2.5 mg/kg) produjo excitación del SNC a los 30-40 segundos de haberla administrado. A pesar de lo anterior, en Australia, las presentaciones de penicilina procaínica para uso veterinario contienen una concentración de procaína de 20 mg/mL, y la única de uso humano sólo 7.3 mg/mL.107 Además, al calentar la penicilina procaínica a 50ºC (temperatura que se puede alcanzar durante el verano en la guantera del coche) durante uno o siete días, la concentración de procaína soluble se incrementó significativamente, lo cual puede influir sobre los efectos farmacológicos y toxicológicos.107 La procaína se metaboliza en el plasma y cuando la velocidad de absorción supera a la velocidad de hidrolización por las esterasas del plasma (vg, tratamiento reciente con organofosforados), se presenta la toxicidad.107,109,118,119Por lo anterior, es más frecuente que la administración de una dosis alta de penicilina G procaínica en un solo sitio de aplicación produzca toxicidad; en este sentido se recomienda la administración de la misma dosis en varias fracciones y en varios sitios de aplicación. Además, debido a la cinética de primer orden de la penicilina G, es más factible lograr mayor concentración sanguínea del fármaco con el último esquema de dosificación en comparación con el primero.109
En caballos, la anemia hemolítica inmunomediada puede ser idiopática o inducida por enfermedades infecciosas, neoplasias hemolinfáticas120 o por la aplicación de penicilina procaínica.120-122 Esta última se da por una producción patológica de anticuerpos IgG, los cuales se unen a la penicilina que a su vez se fija de manera covalente a las proteínas de los eritrocitos y a las proteínas plasmáticas, este complejo (penicilina-proteína) se une a las membranas de los eritrocitos a los cuales también destruye, en este proceso intervienen macrófagos y la activación del complemento.120,121 Se observa bilirrubinemia, hipokalemia, anemia, trombocitopenia, leucocitosis, bilirrubinuria, urobilinogenuria, acidosis metabólica compensada parcialmente y prueba de Coombs positiva.120-122 Aunque la anemia hemolítica inmunomediada no es muy frecuente en caballos, si no se reconoce y no se trata oportuna y adecuadamente, puede ser fatal.121 Es posible detectar concentraciones plasmáticas de penicilina procaínica aun después de tres a cuatro días de haber administrado la última dosis, y aunque no son concentraciones terapéuticas, pueden contribuir a continuar el proceso hemolítico inmunomediado en un caballo sensibilizado.122 Sin embargo, la cantidad de penicilina adsorbida por la membrana de los eritrocitos, la concentración plasmática de la penicilina procaínica y la capacidad del anticuerpo determinan la severidad de la hemólisis.121
Se ha informado que la penicilina G sódica (Pen G Na) ocasiona alteraciones cardiopulmonares en caballos conscientes y anestesiados.99,123 Aunque este fármaco no se reconoce como agente causante de colitis, ocasionalmente se le ha asociado con colitis aguda cuando se administran altas dosis (30 000-50 000 UI/ kg) del mismo.103,104
La ampicilina puede inducir enterocolitis letal.93 La administración de pivampicilina oral (25 mg/kg dos veces al día (bid) durante tres o más días resultó en la excreción de heces suaves y diarrea únicamente en 3% de los caballos tratados (n = 200). Aparentemente, en los caballos en los que se reduce el apetito debido a la administración de pivampicilina, hay mayor predisposición a presentar diarrea.124
La cefaloridina es altamente nefrotóxica, ya que se acumula entre las células de los túbulos proximales, ocasionando necrosis tubular,94 por lo que no es recomendable usarla. La ceftriaxona (60 mg/mL) administrada a dosis de 14 mg/ kg por infusión IV en un periodo de cuatro minutos, produjo depresión, anorexia y signos de cólico moderado. No se recomienda el uso de esta dosis, ya que por la rápida eliminación que sufre en el caballo, es necesaria una administración frecuente, lo cual incrementa considerablemente los costos de la terapia.125 La administración im de cinco dosis de ceftiofur (2 mg/kg bid) no ocasionó efectos adversos.126 Sin embargo, al administrarlo por vía im para tratar una infección de tracto respiratorio alto, ocasionó urticaria en cara y pecho, además de disnea moderada durante 40 horas. Se administró conjuntamente con sulfadoxina/TMP y fenilbutazona.27 La aplicación en los músculos glúteos o semitendinosos de cuatro dosis de cefoxitina (20 mg/kg tres veces al día [tid]), ocasionaron, en una de cuatro yeguas, depresión, fiebre moderada (38.3 ºC), disminución del apetito, claudicación del miembro posterior derecho (MPD), edema en los músculos semitendinosos y en la región perianal; la claudicación del MPD empeoró y posteriormente, también se observó en el MPI; al examen físico se diagnosticó laminitis aguda, la cual se corroboró en la necropsia.127
Tetraciclinas
Las tetraciclinas decoloran la dentina durante el desarrollo de los dientes en el periodo de gestación o durante la muda dentaria.128,129 Ocasionan diarreas severas y colitis fatal, posiblemente por el cambio de la microflora en el ciego y colon.129-132 La administración IV rápida de preparados farmacéuticos a base de propilenglicol y 2-pirrolidona producen efectos cardiovasculares adversos como alteraciones electrocardiográficas (ECG), hipotensión y colapso.93,133 Se pueden desarrollar superinfecciones;129 como en el caso de un portador de Salmonella, el cual desarrolla diarrea posestrés exacerbada por la terapia con tetraciclinas, dado que éstas remueven las bacterias antagonistas de la microflora normal contra Salmonella y, generalmente, esta última es resistente a las tetraciclinas.104 Algunas condiciones preexistentes como la hipovolemia, hipoxemia, toxemia, hemoglobinuria, mioglobinuria, hiperbilirrubinemia, septicemia o el uso concurrente de fármacos nefrotóxicos potencializan el efecto tóxico de las tetraciclinas.134 Éstas pueden ser hepatotóxicas debido a su acumulación si es que existe una eliminación renal ineficiente o por la administración frecuente de dosis más altas de las recomendadas.129 También pueden ocasionar necrosis tubular renal (se incrementa en casos de endotoxemia) y degeneración grasa del hígado (se incrementa en casos de preñez).93
En particular, la doxiciclina por vía oral ocasiona irritación gastrointestinal y superinfecciones en duodeno e intestino grueso; por vía im produce irritación en el sitio de aplicación.135 Al administrarla en caballos y ponis por infusión IV a dosis que van de 0.18 a 10 mg/kg y en un tiempo de infusión variable (3-40 minutos), se observó depresión, agitación, ansiedad, fasciculaciones musculares, taquicardia, taquipnea, disnea, arritmias, alteraciones ECG, colapso, paro cardiaco y en ocasiones muerte. Algunos caballos se recuperaron y otros fueron sacrificados. Estos eventos se relacionan con la velocidad de administración y no con la dosis administrada.135,136 La administración parenteral de doxiciclina en equinos no se recomienda.96 La oxitetraciclina aplicada por vía IV a dosis de 15 g durante 4-12 días ocasionó la muerte por colitis hemorrágica aguda en cinco de siete caballos.137 En ponis y caballos bajo estrés, la aplicación de tan solo 1-2 mg/ kg de oxitetraciclina produjo diarrea y colitis fatal, que posiblemente se debió a cambios en la microflora del ciego y colon.103,130,131,138 En un neonato de un día de edad con isoeritrolisis neonatal, la administración de 70 mg/kg IV de oxitetraciclina para tratar la contractura del tendón flexor, ocasionó hematuria, letargo, edema en las articulaciones metacarpo y metatarsofalángicas, edema y alteraciones del patrón bronquial, azotemia, hiponatremia, excreción fraccional de sodio alta, anemia, proteinuria, glucosuria, hemoglobinuria, consistentes con un patrón de falla renal aguda.134
Aminoglicósidos
La nefrotoxicidad es un efecto colateral bien identificado con el uso de aminoglicósidos. Probablemente hay efectos nefrotóxicos subclínicos en todos los pacientes que reciben cualquiera de estos fármacos; sin embargo, la nefrotoxicidad clínica se presenta con m ayor frecuencia en pacientes geriátricos o pediátricos, o cuando hay disminución del volumen circulante, existencia de disfunción renal o hepática, sepsis, alteraciones electrolíticas o exposición a otros fármacos nefrotóxicos (vg, antiinflamatorios no esteroidales) o nefroactivos (vg, diuréticos).93,139,140 Es común que al menos alguno de estos factores se presente con regularidad en caballos con problemas clínicos.139,140 No se conoce con exactitud el mecanismo por el cual se produce la nefrotoxicidad.140 Se ha correlacionado el riesgo de nefrotoxicidad con la acumulación de aminoglicósidos en la corteza renal durante el pico de concentración del fármaco, con la duración del tratamiento y con el intervalo de administración;41 sin embargo, toxicológicamente, la cantidad de fármaco administrado y su concentración plasmática durante los intervalos de dosificación son más importantes que el pico de concentración del fármaco. Se puede reajustar la dosis para cada caso por medio de seguimiento farmacológico.93 También el agente específico juega un papel importante en la presentación de efectos nefrotóxicos (vg, la neomicina es más tóxica que la estreptomicina).93 Se sabe que afectan varias funciones de la nefrona, al principio hay daño y disfunción tubular seguida de disminución en la velocidad de filtración glomerular. Esto produce cambios físicos en la orina (proteinuria, hematuria, cilindruria y disminución en la capacidad de concentración) y en los parámetros sanguíneos (aumento en la concentración de urea y creatinina y cambios electrolíticos).139
La toxicidad de la gentamicina se ha asociado con concentraciones pico mayores de 12 µg/mL y mayores de 2 µg/mL al momento de administrar la siguiente dosis.142 Para prevenir o corregir efectos tóxicos por este fármaco, se ha correlacionado la concentración de creatinina plasmática con la depuración de la gentamicina en caballos clínicamente sanos y enfermos, lo cual permite hacer ajustes en la dosificación del fármaco.143 La administración IV (8.8 mg/kg/día) durante 5-14 días indujo nefropatía tóxica demostrada por el incremento en la concentración de urea y creatinina.144 Además del incremento en la concentración de urea y creatinina, hubo hiposmolaridad de la orina en uno de tres caballos a los que se les administró la misma dosis que en el estudio anterior, y en uno de tres a los que se les administró la dosis de 17.6 mg/kg/día, ambos regímenes durante 14 días.145 En potros la administración de 4.4 mg/kg/día durante 14 días no reveló evidencia funcional de nefropatía tóxica; sin embargo, histopatologicamente se observó degeneración y necrosis tubulares compatibles con nefrosis tubular proximal.140 La administración de 20 mg/kg de gentamicina por vía IV tid durante 14 días en ponis, ocasionó nefrotoxicosis de grado variable. Dos ponis desarrollaron falla renal aguda y fueron sacrificados antes de concluir el tratamiento, otros cinco no mostraron anormalidades físicas o de comportamiento durante el tratamiento. Sin embargo, todos desarrollaron anormalidades ultraestructurales en el epitelio tubular proximal compatibles con nefrotoxicidad por gentamicina.146 Incluso la dieta influye en la nefrotoxicidad por aminoglicósidos; si se alimenta un equino sólo con avena entera (pobre en Ca y K) se favorece la nefrotoxicidad por gentamicina de manera más clara que con heno de alfalfa (rico en vitaminas y minerales). Esto último ha inducido a los investigadores a concluir que la dieta es importante en la nefrotoxicidad inducida por gentamicina.147 Los caballos anoréxicos o que consumen dietas bajas en minerales están más predispuestos a la nefrotoxicidad por gentamicina.140 En ponis clínicamente sanos no se logró inducir toxicidad a dosis de 5 mg/kg im tid durante 7-14 días. Sin embargo, los autores sugieren que se hubiera podido presentar si se tratara de animales enfermos, ya que éstos están más predispuestos a la toxicidad.142 Brumbaugh93 menciona que se puede inducir enterocolitis letal con gentamicina; sin embargo, no hace referencia sobre la dosificación.
La administración im de neomicina (10 mg/kg bid) durante 10 días (21 dosis) en caballos clínicamente sanos, ocasionó induraciones y algo de dolor en los sitios de aplicación, así como daño tubular renal (enzimuria y cilindruria) a los cuatro días de tratamiento, el cual disminuyó después de concluido. No se detectó nefrotoxicidad funcional significativa. Sin em bargo, debe esperarse mayor nefro-toxicidad en caballos enfermos que reciban neomicina, por lo que es recomendable realizar un seguimiento estrecho mediante pruebas clinicopatológicas.139
Macrólidos
A la eritromicina se le ha asociado ocasionalmente con colitis aguda.103,104 Es bien sabido que la administración parenteral puede inducir diarrea severa, que generalmente no es fatal y se detiene con la suspensión del tratamiento.93,148 Brumbaugh93 menciona, por referencia a su casuística, que la eritromicina puede inducir enterocolitis letal.
Lincosamidas
No se recomienda el uso de lincomicina y clindamicina en equinos, ya que produce colitis aguda.16,93,104,128,132 La administración de lincomicina por vía oral a razón de 25 mg/kg bid durante cuatro, cinco o siete tratamientos induce una colitis severa casi siempre fatal. Los signos que se observan son diarrea, taquicardia, dolor abdominal, deshidratación progresiva, depresión y muerte. Los cambios macro y microscópicos fueron consistentes con colitis y tiflitis132. No se ha determinado experimentalmente la dosis tóxica mínima por vía oral; sin embargo, se propone que 0.5 mg/kg por día durante dos días ocasiona signos clínicos que incluyen diarrea, taquicardia, membranas oscuras, fiebre (40.3ºC), sudoración, postración, laminitis, hemorragia, choque endotóxico y colitis necrótica seudo-membranosa fatal.93,149
Quinolonas
Se sabe que las fluoroquinolonas producen daño en las articulaciones que soportan el peso del animal en desarrollo o inmaduro,148 por lo que no deben administrarse a animales jóvenes que aun se encuentran en fase de desarrollo óseo (vg, caballos jóvenes y yeguas gestantes).150 La enrofloxacina ocasiona artropatía asociada con defectos cartilaginosos inducidos. Aun a la dosis más baja (5 mg/kg sid) utilizada en este estudio, hubo claudicación y aumento de volumen en articulaciones en uno de cuatro caballos adultos (3-11 años de edad) a partir del día 19 de tratamiento, de un total de 21 días. Concluido el tratamiento, a la necropsia, dos caballos mostraron lesiones medias en cartílago articular. Dosis mayores produjeron lesiones más temprano durante el tratamiento y fueron más severas. Los potros fueron más propensos a las artropatías y se presentaron los signos desde el día seis de tratamiento, todos presentaron lesiones a nivel de cartílago articular. Aunque no existen datos para poder correlacionar las concentraciones plasmáticas de la enrofloxacina con los efectos tóxicos, parece ser que el grado de artropatía depende de la dosis.151
Otros antibacterianos
A pesar de la gran variedad de efectos adversos atribuidos al cloranfenicol en el hombre y los animales domésticos,120,148 existen pocos informes en equinos. Se ha observado dolor en el sitio de aplicación (cuando es por vía im) y efectos adversos con formulaciones a base de propilenglicol.152 Cuando se administró cloranfenicol (12.5 mg/kg po sid) durante 40 días no se observaron anormalidades sistémicas.153 Probablemente esta aparente seguridad del fármaco en los equinos se deba a su rápida depuración y a lo difícil que es lograr altas concentraciones sanguíneas. Al administrarlo por infusión continua se observó que, al mantener niveles terapéuticos constantes de cloranfenicol en sangre, puede alterar la respuesta inmune a la infección.154
Brumbaugh93 menciona que la vancomicina puede inducir enterocolitis letal; sin embargo, no hace referencia sobre la dosificación. En un estudio retrospectivo de 200 casos a los que se les administró metronidazol, se observó que produjo disminución del apetito tan sólo en cuatro caballos y este efecto se resolvió cuando se descontinuó la administración del medicamento.155
Antiinflamatorios no esteroidales
La incidencia de toxicidad por antiinflamatorios no esteroidales (AINE) no es muy elevada. Por ejemplo, en Francia se detectaron 90 casos de toxicidad por AINE en perros en un periodo de seis años, mientras que en caballos sólo se registraron 11 casos.156 Aun así, es conveniente que el veterinario especialista en equinos conozca los riesgos asociados con el uso de estos fármacos con el fin de tomar las medidas profilácticas o terapéuticas apropiadas.
Se ha demostrado que algunos AINE tienen la capacidad de inhibir la síntesis de adhesinas y la actividad fagocítica de los macrófagos. Al parecer, la flunixina meglumina tiene menos efectos indeseables al respecto. Se ha demostrado que los polimorfonucleares obtenidos de exudados inflamatorios en reposo o estimulados con zimosan o acetato de forbol-miristato e incubados con diversos AINE, reducen la actividad fagocitaria. La inhibición máxima (para la síntesis de adhesinas y la actividad fagocítica de los macrófagos, respectivamente) fue de 64% y 36% para el ácido acetilsalicílico; 32% y 17% para la fenilbutazona; 15% y 31% para el sulfóxido de dimetilo; 32% y 19% para el ácido salicílico y 0% y 17% para el salicilato de sodio.157
Hay una gran variedad de RA debido a la distribución de enzimas capaces de formar eicosanoides y a sus muchas funciones fisiológicas,158 los efectos colaterales más comunes de los AINE se asocian con el tubo gastrointestinal (TGI), el sistema hematopoyético y el renal. En raras ocasiones se observa meningitis aséptica, depresión del SNC o hepatotoxicidad.159-161
Puede haber erosión y ulceración gastroduodenal por inhibición de la PGI2 (prostaglandina I2) y la PGE2 (prostaglandina E2) (que a su vez inhibe la secreción del ácido gástrico) y de otras prostaglandinas responsables de la estimulación de la secreción de moco y bicarbonato que mantienen una barrera entre el ácido y las células gástricas. La PGE2 es un vasodilatador que regula el flujo sanguíneo a la mucosa del tracto gastrointestinal (TGI), la isquemia y la hipoxia generadas por su bloqueo son las condiciones que predisponen a la ulceración y erosión con hemorragias y, en algunos casos, pérdida de proteínas, que conlleva al desarrollo de anemia e hipoproteinemia.18 En caballos y potros se ha encontrado ulceración de la mucosa oral por la administración oral de fenilbutazona disuelta en pasta de melasa, lo que indica que un mayor tiempo de contacto con el fármaco incrementa la formación de úlceras en la boca.162
Se ha establecido que la fenilbutazona a razón de 10 mg/kg po sid en ponis, de 10 mg/kg po bid en potros y de 8-30 mg/kg IV una vez al día (sid) en caballos adultos puede causar RA como malestar gástrico con sangrado y colitis. Algo similar, sucede con la flunixina meglumina a dosis de 1.1 mg/kg po bid o im sid en potros y a razón de 1.1 mg/kg tid en ponis. El ketoprofeno a dosis de 2.2 mg/kg IV tid en caballos mostró los mismos efectos.163 Al comparar los efectos adversos de la fenilbutazona (4.4 mg/kg), la flunixina meglumina (1.1 mg/kg) y el ketoprofeno (2.2 mg/kg) administrados por vía IV cada ocho horas durante 12 días, se demostró que la porción glandular del estómago fue el área del TGI más afectada por los tres fármacos. Además la fenilbutazona ocasionó edema y erosiones del intestino delgado, así como úlceras en colon mayor, conjuntamente con hipo-proteinemia e hipoalbuminemia.84 En este sentido, se estimó que el potencial tóxico de estos tres AINE es mayor para la fenilbutazona, menor para la flunixina meglumina y mucho menor para el ketoprofeno.164 Por otro lado, la aplicación de dipirona en forma crónica durante un mes sólo indujo malestares del TGI poco específicos.165 Hunt et al.166 informaron que la administración conjunta de dosis elevadas de isopirina, fenilbutazona y dipirona, a una yegua con historia de dolor abdominal persistente, pero no severo, ocasionó hemorragia dentro de la cavidad peritoneal; sin embargo, es el único informe que menciona este hecho. En casos de intoxicación crónica se pueden presentar cólicos intermitentes con o sin diarrea y pérdida de peso.163
En la sangre y sistema hematopoyético, inhiben la reacción de las plaquetas mediante la cual se conglomeran al impedir la síntesis de tromboxano. También se ha asociado a algunos AINE, como la fenilbutazona, con alteraciones de la médula ósea. Puede haber anemia asociada a hemorragias en el TGI.163
Las anormalidades más comunes en la química sanguínea, debidas a toxicidad por AINE, son hipoproteinemia e hipoalbuminemia, que predisponen al equino a edema ventral.167 La fenilbutazona (4.4 mg/kg cada ocho horas) modificó la concentración sérica de proteínas de 7.2 g/dL en el día 0 a 5.5 y 5.2 g/dL en los días 8 y 13, respectivamente. Generalmente no se incrementan las concentraciones séricas del nitrógeno úrico sérico (NUS) y creatinina hasta que el curso de la enfermedad se vuelve irreversible.168 En humanos, en un porcentaje mínimo de individuos, se ha asociado a la dipirona y a la fenilbutazona con agranulocitosis, a menudo mortal. En equinos no se ha informado de este efecto, y de hecho, en un ensayo de administración crónica no se obtuvo efecto alguno sobre las cuentas hemáticas.169
La administración IV de algunos AINE (vg, fenilbutazona) debe realizarse con mucho cuidado, ya que si se realiza de manera extravascular puede causar inflamación y abscesos severos que en algunos casos ocluyen permanentemente la vena yugular.170
Los AINE pueden causar nefropatías al inhibir la síntesis de prostaglandinas vasoprotectoras, las cuales regulan el flujo sanguíneo renal, la filtración glomerular, el transporte tubular de iones, la liberación de renina y el metabolismo del agua.170 Al disminuir la capacidad renal para autorregular el flujo sanguíneo hay riesgo de ocasionar isquemia renal localizada.163 MacAllister et al.164 observaron que uno de cinco y tres de tres caballos desarrollaron necrosis de la cresta renal con la aplicación de flunixina meglumina (1.1 mg/kg) y fenilbutazona (4.4 mg/kg) administradas por vía IV cada ocho horas durante 12 días. Los pacientes pediátricos, los que tienen problemas cardiacos, renales o hepáticos, los hipovolémicos o los que están recibiendo fármacos nefrotóxicos (vg, aminoglicósidos, anfotericina B) o nefroactivos (diuréticos), están más predispuestos a la nefropatía por AINE.
Acetaminofeno
El principal signo de toxicidad es la metahemoglobinemia y puede haber necrosis hepática centrolobular. El tratamiento incluye la administración de antioxidantes (vitamina C); la cimetidina puede reducir la formación de metabolitos tóxicos si se administra dentro de las 48 horas posteriores a la administración del acetaminofeno.159
Ácido acetilsalicílico
Con sobredosis puede haber depresión, hipertermia, desbalance electrolítico, convulsiones, coma y muerte. La toxicidad aguda se manifiesta por desbalance en el equilibrio ácido-básico, hiperventilación, alteraciones en la coagulación y hepatotoxicidad.159 El aumento en el tiempo de protrombina puede potencializar la epistaxis en algunos caballos en entrenamiento, durante o después del ejercicio.158,159
Ácido meclofenámico
La sobredosis produce anorexia, depresión, debilidad, pérdida de peso corporal, sangre oculta en heces y reducción en el hematócrito.159 En ponis ocasionó hipoproteinemia después de 10 días de administración a la dosis recomendada de 2.2 mg/kg/día.158,159,170 Aun durante varios meses, la administración crónica 2.2 mg/kg/día no induce cambios en la reproducción de yeguas y garañones.158,159,170 En yeguas ponis en el 2/3 de gestación 2.2 mg/kg/día por dos periodos de 10 días consecutivos, cada uno el tiempo de gestación fue ligeramente mayor que en el grupo testigo.164
Fenilbutazona FBZ
Su índice terapéutico es estrecho. En comparación con los caballos, los ponis son más sensibles a la toxicidad por este fármaco.171 La formulación, la vía de administración, el horario de alimentación, la raza y la edad son factores que influyen para que se presenten RA por FBZ. Algunas de éstas son hemorragias, hepato y nefropatías, fiebre, edema abdominal y facial.158 Los signos iniciales de toxicidad gastrointestinal incluyen inapetencia, depresión, diarrea, pérdida de peso167,172,173 y, a veces, cólico;172-174 posteriormente se pueden observar signos clásicos de choque hipovolémico por hemorragia gastrointestinal. La toxicidad puede ocurrir incluso semanas después de haber suspendido su administración. A dosis de 13.46 mg/kg/día IV ocasionó daño microvascular del TGI (pequeñas erosiones pilóricas multifocales) a partir de las 24 horas posadministración.175-177 Además se detectaron erosiones anulares en el duodeno y necrosis de la mucosa del colon a las 48 horas.49,177 Puede ocasionar colitis ulcerativa del colon dorsal derecho por adsorción del fármaco en el forraje.172,173,178 Puede haber flebitis necrosante en venas portales después de la administración oral y en venas yugulares después de la administración IV.159 En caballos, una dosis de 13.63 mg/ kg/día durante tres días, indujo degeneración y dilatación de la pared de venas de calibre menor, además de alteraciones hematológicas y en la química sanguínea.158 En ponis se ha visto aumento en el número de neutrófilos y disminución en el de linfocitos. En caballos tratados (3-10 g/día) al menos durante días se observó disminución en los valores de hemoglobina y en el conteo de eritrocitos y de leucocitos.174 A dosis de 10 mg/kg/día en forma crónica, hay edema en la pared ventral del tórax y abdomen, hipoproteinemia e hipoalbuminemia de larga duración (2-3 meses).167 La administración crónica a yeguas ocasionó muy pocos efectos sobre su capacidad reproductiva179 y en garañones no hubo cambios.180 Empero, grandes cantidades de FBZ atraviesan la barrera placentaria y penetran a circulación fetal.181 En yeguas en lactancia, la concentración de FBZ en leche no excede del 2% de la concentración plasmática y en los potros no se detectan concentraciones del fármaco o metabolitos en plasma.182,183 A razón de 4.4 mg/ kg de FBZ IV sid durante cinco días hubo disminución en la concentración de glucosa plasmática, pero no en la de insulina sérica. No hubo efecto sobre tolerancia a la glucosa, sobre la secreción de insulina o sobre el área bajo la curva de la proporción insulina/glucosa contra tiempo.184 Incrementa la reabsorción tubular de Na y CL, por lo que está contraindicada en pacientes con disfunción cardiaca, hepática o renal. En pacientes deshidratados puede causar necrosis de la cresta medular renal.170,185 Al administrar cuatro veces la dosis diaria recomendada de FBZ cúprica (vía tópica) durante cinco días, se observó irritación leve en la piel y se absorbió muy poco (trazas).186 En ponis los efectos tóxicos se pueden prevenir tratándolos conjuntamente con PGE2 sintética por vía oral.187 La administración de ranitidina (2 mg/kg IV bid) o sucralfato (4 g po bid) en potros de tres a cuatro meses de edad brinda sólo una protección parcial.163,188
Flunixina meglumina FM
Su toxicidad es rara, no se han observado reacciones adversas después de 10 días de administración a la dosis terapéutica.163 Produjo ulceración gástrica en 80% de los casos a una dosis de 1.1 mg/kg IV cada ocho horas (lo recomendable es cada 24) por 12 días.163 En una yegua poni, a razón de 3 mg/kg IV bid durante cinco días (cinco veces la dosis recomendada), produjo anorexia, depresión, ulceración oral, gástrica y colónica, neutropenia, hipoproteinemia e hipoalbuminemia.158 Más aún, en otros estudios en los que se administró tres y cinco veces la dosis recomendada por vía IV durante 10 y 5 días consecutivos, respectivamente, no se observaron signos clínicos ni bioquímicos de toxicidad. Algo semejante sucedió al administrar tres veces la dosis recomendada por vía oral durante 15 días consecutivos y por vía im durante 10 días consecutivos.158 El flujo plasmático renal efectivo y el flujo sanguíneo renal efectivo no se modifican significativamente con la administración de FM (1.1 mg/kg IV).189 En potros, dosis de 2.2-6.6 mg/ kg durante cinco días indujeron diarrea (no dependiente de la dosis), no hubo cambios significativos en la química sanguínea, aunque a los neonatos que se les administró la dosis más alta tuvieron una ligera hipoproteinemia. El día seis los neonatos que recibieron la dosis más alta mostraron ulceraciones gastroduodenales y hemorragias petequiales en el ciego; sin embargo, los autores concluyeron que no hubo diferencias clínico-patológicas significativas entre los neonatos tratados con el AINE, en comparación con los tratados con solución salina fisiológica.190,191 En potros, la dosis terapéutica recomendada (1.1 mg/kg) durante 30 días produjo erosiones en la porción glandular del estómago, sin importar la vía de administración oral o im. Al administrarla por vía oral produjo úlceras en la boca.187 Cuando se administró por vía IV provocó hiperventilación, sudoración, hiperactividad y temblores musculares. Estos signos se observan cuando la administración es intraarterial o cuando la dosis es muy elevada (no se hace mención sobre la dosis); el dueño fue quien administró el medicamento.27 La FM (1.1 mg/kg im durante cinco días) en casos de inflamaciones agudas y crónicas, disminuyó la proteína sérica y la proporción albúmina:globulina, aumentó las enzimas alanino aminotransferasa, aspartato aminotransferasa y fosfatasa alcalina, siendo más evidente en la aspartato aminotransferasa y en los caballos con procesos inflamatorios severamente agudos.192
Indometacina
Su toxicidad es poco predecible, pero mayor que la de otros AINE. A dosis de 2.5 mg/kg puede ser tolerada por caballos adultos,158 pero dosis de 0.5-1 mg/kg inducen alteraciones del SNC, incluyendo ataxia y convulsiones en ponis. Estos últimos efectos son transitorios y duran 5-10 minutos.16 La administración de 1.47 g causó disfunción del SNC, manifestada por somnolencia, ataxia de los miembros posteriores y paresia, estos signos desaparecieron después de 24 horas. Además los caballos desarrollaron leucopenia y neutropenia y presentaron rastros de sangre en heces.181 Una sola dosis de 3 a 9 mg/kg/día po produjo somnolencia, desorientación, paresia, neutropenia y sangre oculta en heces.159
Ketoprofeno
A razón de 2.2 mg/kg IV durante 1-5 días no produjo RA.193 Cuando se administró cinco veces la dosis recomendada, no hubo evidencia alguna de toxicidad gastrointestinal; es mucho menos irritante que el ácido acetilsalicílico.170 Sin embargo, se han detectado erosiones y úlceras en lengua y en las porciones glandular y no glandular del estómago, pero no se menciona el régimen de administración utilizado.159 Por vía im en la región del cuello y de los glúteos por 4-7 días, no produce calor ni erupciones en el sitio de inyección y tampoco inapetencia.194
Suxibuzona
A razón de 6 mg/kg IV y a una velocidad de 20 mL/min 150 mg/mL ocasionó escalofríos, incoordinación, ataxia de miembros torácicos y pélvicos, disnea, recumbencia, falta de respuesta a estímulos y muerte. Cuando se administró en forma más lenta 10 mL/min, se observó ataxia, indiferencia y disnea transitorias. No se recomienda la administración IV.195
Antiparasitarios
Ionóforos
Se utilizan como coccidiostatos y promotores del crecimiento en pollos de engorda y bovinos;196-199 generalmente, la fuente de exposición a los caballos es por consumo de alimento para pollos o bovinos, esto se da por libre acceso al mismo o por contaminación accidental durante la preparación de la premezcla alimentaria.198,200
Aunque el sabor amargo de la monensina actúa como factor intrínseco de seguridad al limitar su consumo en los caballos, éstos son sumamente susceptibles a la intoxicación por este antibiótico;201 la DL50 en esta especie es de 2-3 mg/kg.197,202 En burros, al administrar una dosis oral única de 3 y 5 mg/kg no se observó mortalidad; sin embargo, al incrementarla a 10 mg/kg sí la hubo.197 Los signos que se observan son depresión, anorexia, diarrea, tambaleo, recumbencia, letargo, pelo quebradizo e hirsuto, pulso débil e irregular, pulso yugular positivo, taquicardia, arritmias, membranas cianóticas, sonidos pulmonares anormales, edema ventral y en miembros, cólico severo, colapso, muerte súbita, o en 48 horas después de la aparición de los signos.197,198 Existe la posibilidad de que los efectos se presenten con retraso en forma de bajo rendimiento y hasta muerte durante el ejercicio, por lo que es conveniente detectar estos casos sub-clínicos antes de que se manifiesten clínicamente.203 Electrocardiográficamente, hay latidos ectópicos ventriculares, depresión del segmento S-T, fibrilación atrial y taquicardia atrial paroxística,197,203 cambios ECG compatibles con hipokalemia e hipovolemia.198 Clinicopatológicamente, hay incremento en la creatinino-cinasa y las isomerasas 1 y 2 de la lactato dehidrogenasa; a la necropsia se observa necrosis del miocardio197 y lesiones hepáticas y renales.201 Las yeguas gestantes que no abortan y que se recuperan paren alrededor de 3-4 semanas después de la fecha esperada, los potros son débiles y presentan baja viabilidad.197
En caballos, la DL50 de lasolacid es de 21.5 mg/kg197 y produce anorexia, inquietud, poliuria, disnea, ataxia progresiva, recumbencia, intentos fallidos por levantarse y muerte.198,199 Clinicopatológicamente se observa hipocalcemia, hipofosfatemia seguida de hiperfosfatemia y normofosfatemia, hipopotasemia, bilirrubinemia, aumento de la urea y ácido úrico e hiperglucemia.197 Dosis únicas de 47.5 mg/kg po en burros no causaron mortalidad, pero al incrementar la dosis (57.5 mg/kg po) sí la hubo.198
La narasina produce anorexia, inquietud, poliuria, disnea, sudoración, ataxia progresiva, recumbencia, intentos fallidos por levantarse y muerte.199 Mientras que la salinomocina produce signos clínicos indicativos de miocarditis y macroscópicamente se observa fibrosis del miocardio.74
Ivermectinas
Cuando se administran por vía IV ocasionan muerte súbita por reacción anafiláctica. Sin embargo, son seguras cuando se administran por vía oral en forma de pasta o se inyectan por vía im, aun en animales jóvenes.33 No se recomienda su administración en potros menores de cuatro meses de edad.152 Al administrar 10.6 veces (2 111 µg/kg) la dosis recomendada en un neonato de 16 horas de edad, se observó incoordinación, presión de la cabeza contra objetos, depresión, sonidos intestinales aumentados, diarrea e hipoproteinemia (por probable falla en la transferencia pasiva de inmunoglobulinas). El tratamiento fue sintomático y se restableció después de tres días.152 En caballos adultos no se observaron efectos adversos cuando se administró a razón de 1 200 µg/kg po (seis veces la dosis recomendada); sin embargo, cuando se administró a 2 000 µg/kg po (10 veces la dosis recomendada), 5 de 11 caballos desarrollaron ataxia, depresión y falla aparente de la visión. Cuando se administró por vía im y a razón de 12 000 µg/kg (60 veces la dosis recomendada) se observó depresión, midriasis, ataxia, depresión respiratoria y caída del belfo inferior en todos los casos. Dos de cuatro caballos que recibieron una dosis de 6 000 µg/kg im (30 veces la dosis recomendada), y dos de ocho caballos a los que se les administró a razón de 3 000 µg/kg (15 veces la dosis recomendada) mostraron midriasis, falta de respuesta pupilar a la luz y ceguera.204
Otros antiparasitarios
El triclorfón en ponis induce diarrea a dosis de 40 mg/kg vía sonda nasogástrica.205 Al administrarlo conjuntamente con oxfendazol por vía oral ocasionó diarrea, cólico, irritación oral e impactación intestinal.27 En caballos a los que se les administró triclorfón dos días antes de la anestesia con tiopental sódico, gliceril guayacol éter y halotano, se presentó aumento de la presión arterial pulmonar y del atrio derecho, así como disminución de la resistencia vascular pulmonar. En contraparte, la misma secuencia pero bajo anestesia fija con xilazina-ketamina, no indujo los cambios referidos; sin embargo, el tiempo de recuperación fue mayor.205
El amitraz no debe utilizarse bajo ninguna circunstancia en equinos.206-211 Disminuye la motilidad intestinal y provoca alteraciones en intestino grueso, las cuales no responden a los tratamientos de rutina; la consecuencia final es la muerte o eutanasia del equino.206,211 Todos los signos de toxicidad por amitraz se deben a su acción sobre receptores a-adrenérgicos, lo que ocasiona alteraciones en la coordinación de fibras musculares lisas y aumento en la absorción hidroelectrolítica a nivel de colon.209 Aunque se ha sugerido que el atipamezol (0.15 mg/kg IV), un a-antagonista selectivo, puede disminuir los signos, su eficacia clínica es relativa.167 La xilazina y detomidina están contraindicadas, ya que pueden agravar el cuadro por ser a-agonistas. Tampoco se recomienda la rifampicina.208 Al utilizar localmente soluciones a una concentración del 0.025-0.1% se observan signos de intoxicación a las 6-48 horas, dependiendo de la concentración.208 Los signos que se pueden observar incluyen anorexia, disminución del tránsito intestinal, constipación, meteorismo, cólico, somnolencia, postración, ataxia, bradicardia, arritmias (bloqueo atrioventricular (AV), mucosas congestionadas, alteración de la temperatura rectal (hipo o hipertermia, y normotermia), sudoración, postración, hiperglicemia, hemoconcentración, hiperalbuminemia, hiperproteinemia, acidosis metabólica, hiperkalemia y muerte.207,208,210 A la palpación rectal se percibe timpanismo del colon y deshidratación de la materia fecal.207,210,211 Se ha postulado que la carga parasitaria en intestino es de importancia en la toxicidad del amitraz.207,210
La administración subcutánea (sc) de 0.025 mL/kg de un compuesto con quinapiramina usado para el tratamiento de tripanosomiasis, ocasionó salivación e inquietud transitorias. En una mula ocasionó hiperpirexia y muerte a las 12 horas.212
Corticoides
Se les puede considerar como antianabólicos, gluconeogénicos y diabetogénicos, ya que disminuyen la utilización periférica de glucosa y aumentan el almacenamiento de glucógeno hepático. Los efectos catabólicos pueden ocasionar reducción de masa muscular, ósea, adelgazamiento de la piel, pérdida del pelo y balance de nitrógeno negativo.213 También se ha informado de inhibición del crecimiento en animales jóvenes, así como de la respuesta inmune y de la corteza adrenal.214 La respuesta inmune se puede ver afectada por disminución de la actividad fagocítica de macrófagos y neutrófilos215. Aunque hay informes en los que la administración de glucocorticoides no ocasionan RA,216,217 resulta difícil eliminar completamente las RA a estos medicamentos. Se ha comentado que su toxicidad depende de la duración del tratamiento, así como de la potencia del glucocorticosteroide.189 Quizá la RA más obvia sea la insuficiencia adrenal inducida por una terapia prolongada con glucocorticoides.218-222
En algunos caballos experimentales, la administración de 12 mg de acetonida de triamcinolona seguida de 200 mg ocasionó a la tercera y cuarta semanas, después de dos semanas del último tratamiento, poliuria, depresión, pérdida de peso, neutrofilia, linfopenia, glucosuria y elevación de los niveles de glucosa y de las enzimas aspartato transaminasa (AST) y gamma glutamiltransferasa (GGT), así como de ácidos biliares, y se detectó una supresión adrenal completa. Seis días después se presentaron casos de laminitis.218 Sin embargo, cabe señalar que el hiperadrenocorticismo inducido por glucocorticoides exógenos es menos común que el hiperadrenocorticismo por adenoma o hiperplasia de la glándula pituitaria.221,222
La administración intraarticular de corticoides puede ocasionar respuestas inflamatorias, artritis séptica, metaplasia ósea o artropatías.223,224 La respuesta inflamatoria es aséptica y se da por la suspensión de microcristales de los ésteres corticoides, la incidencia es aproximadamente del 2% y varía dependiendo del tipo de preparación utilizada.225 La artritis séptica se puede presentar por contaminación articular al momento de la artrocéntesis o por deposición hematógena de la bacteria en una articulación con resistencia disminuida a la infección a causa del corticosteroide.224 Las metaplasias óseas se deben a la deposición de corticoides de larga duración en los tejidos blandos periarticulares; se desconoce la causa de este efecto, se sospecha que el vehículo de los corticoides de larga duración es el responsable de este hecho, ya que no se ha observado este fenómeno con corticoides de corta duración.215 Las artropatías por corticoides se presentan cuando ya hay una lesión en el cartílago articular o cuando no se da el descanso apropiado después de la terapia. Se caracterizan por una acelerada destrucción articular con signos de claudicación, aumento de tamaño de la articulación por distención capsular y crecimento de hueso nuevo osteofítico, reducción del rango de movimientos y crepitaciones.215 Los cambios se pueden presentar con una sola aplicación; por ejemplo, 125 mg de acetato de metilpredisolona y pueden perdurar por más de 16 semanas.225,226
Puede haber disminución de la elasticidad del cartílago, del conteo de glicosaminoglicanos y ácido hialurónico con disminución de la viscosidad del líquido sinovial y degeneración progresiva del cartílago.227 A la necropsia se observa adelgazamiento de la membrana sinovial, presencia de placas en la membrana sinovial y apariencia rugosa del cartílago articular.215 Cuando se administran corticoides en una articulación que involucra una fractura, la lesión se exacerba más que en aquellos que no reciben corticoides. Es posible que esto último se deba a que los corticoides retardan el proceso de curación de la fractura y a que reducen la inflamación sinovial (mitigando el dolor y permitiendo mayor funcionalidad, con lo que empeora la osteoartrosis).227
En caballos con uveítis, la administración prolongada (meses a años) e intermitente o continua de corticoides por vía oftálmica puede ocasionar deposición de calcio en la membrana basal del epitelio corneal interparpebral, además de retardar la cicatrización y ocasionar infecciones severas en los sitios de la queratectomia.228
Antiarrítmicos cardiacos
Se sabe que todo antiarrítmico debe usarse bajo seguimiento con electrocardiografía (ECG), especialmente si se aplica por vía IV. Esta es la mejor manera de evaluar las arritmias229 y la eficacia o toxicidad de estos fármacos.230,231
Antiarrítmicos de clase I
Quinidina
Tiene un índice terapéutico estrecho; debe procurarse cuidado especial para evitar un flutter (aleteo auricular arrítmico), que provocaría fibrilación ventricular, potencialmente fatal.232,233 Tampoco se le debe utilizar en casos de insuficiencia cardiaca congestiva (ICC).234 Para evitar la aceleración potencial de la frecuencia ventricular producida por la quinidina, generalmente se premedica al paciente con glicósidos digitálicos.2,170 Sin embargo, se debe tener cuidado cuando se combine con digoxina, ya que los niveles plasmáticos de ésta aumentan con la administración conjunta de quinidina170,235 y pueden inducir toxicidad.
Algunos efectos indeseables de la quinidina incluyen aumento de volumen de la mucosa nasal (puede obstruir el paso del aire), urticaria, laminitis, molestia gastrointestinal, colapso cardiovascular, bloqueo atrioventricular (AV), otras arritmias, o muerte súbita.2,93,236,237 Induce prolongación de los intervalos PR, QRS y QT.2,170,193,234,235 Las dosis orales que exceden los 40 g por día predisponen la presentación de efectos indeseables.231 Las concentraciones terapéuticas fluctúan entre 2.5 y 5 µg/mL y concentraciones mayores a 5 µg/mL son tóxicas. No se logra la conversión de fibrilación atrial a ritmo sinusal durante el periodo en que se presentan los efectos tóxicos de la quinidina o cuando la concentración plasmática es mayor a 5 µg/mL.235 Puede inducir reacciones alérgicas y es un inhibidor del sistema microsomal, por lo que aumenta el efecto de muchos anestésicos y tranquilizantes.235 La quinidina está contraindicada en pacientes con bloqueo cardiaco completo, pues les induce paro cardiaco y muerte.235 De acuerdo con Brumbaugh,93 se pueden utilizar bicarbonato de sodio (0.5-1 mEq/ kg IV) y fluidos poliiónicos, para revertir temporalmente los signos.
Procainamida
Su metabolito activo (N-acetilprocainamida) tiene una vida media más larga y se puede acumular después de dosis múltiples.238,239 En pacientes con ICC se elevan las concentraciones plasmáticas de la procainamida y de la N-acetilpro-cainamida, o debido a una disminución en la excreción urinaria y a la hidrólisis sanguínea de la procainamina.238 Su toxicidad se manifiesta por un alargamiento del intervalo QT mayor al 50%.239 Además, se pueden presentar arritmias adicionales, bloqueo AV, bradicardia, taquicardia o hipotensión.2,170
Lidocaína
El nivel terapéutico fluctúa entre 1 y 5 µg/mL (incluyendo lidocaína y metabolitos). Por lo general, las concentraciones mayores a 8 µg/mL son tóxicas. Los signos clínicos de toxicidad incluyen fasciculaciones nerviosas que progresan a convulsiones170,234,236 y que pueden mitigarse con diazepan a razón de 0.1-0.2 mg/ kg IV.234 Hay además hipotensión, efectos cronotrópico e inotrópico negativos, ensanchamiento del complejo QRS, bloqueo cardiaco y paradójicamente, arritmias ventriculares.96,239 Es muy importante que se verifique que la lidocaína no contenga epinefrina. Para administrar la lidocaína se aconseja utilizar solución salina o Ringer, pues otras soluciones poliiónicas son químicamente antagónicas.
Fenitoína
La fenitoína es químicamente muy inestable y no se debe aplicar junto con ninguna otra sustancia. No se recomienda la administración im ya que se cristaliza en los tejidos, los necrosa e impide una absorción adecuada.235
Antiarrítmicos de clase II
Propranolol
No se debe administrar en casos de bloqueo AV profundo o ICC,2,235,236 las consecuencias son evidentemente fatales debido a la drástica disminución del inotropismo cardiaco. Puede favorecer el broncoespasmo en pacientes predispuestos y tiene un impacto definido sobre la presión arterial y el corazón, induciendo hipotensión, bradicardia y disminución del gasto cardiaco.2,170 Es recomendable disponer de teofilina (5 mg/kg po)240 o salbutamol (8 µg/kg IV),241 para contrarrestar un broncoespasmo y dobutamina (1-5 µg/kg/min)234 o isoproterenol (0.4 µg/kg/min.)96 en caso de colapso cardiovascular. Cuando se utilizan conjuntamente propranolol y digitálicos pueden producirse diversos grados de bloqueo cardiaco.170,231,242 En un caballo medicado con p ropranolol u otros bloqueadores ß-adrenérgicos, la aplicación de casi cualquier narcótico puede inducir un colapso cardiovascular potencialmente fatal.243
Antiarrímicos de clase III
Bretilio
Disminuye el tono adrenérgico y, por ende, se observa severa hipotensión.3,50,235 La administración de bretilio está contraindicada en pacientes anestesiados con compuestos halogenados, ya que sensibilizan al corazón a los efectos arritmogénicos de las catecolaminas endógenas y pueden producir arritmias ventriculares de larga duración.170,237 Además, por sí solo puede inducir diarrea, congestión nasal, dolor abdominal, bradicardia o eritema cutáneo.170
Antiarrítmicos de clase IV
Bloqueadores de canales de calcio
Tienen efectos inotrópicos negativos, por lo que no deben administrarse a pacientes con ICC y debe vigilarse que no provoquen una caída drástica de la presión arterial.170,237 Tampoco deben ser coadministrados con bloqueadores ß debido al efecto depresor que ambos producen sobre el corazón.237 También se puede presentar bradicardia sinusal y bloqueo cardiaco por depresión directa de la velocidad de disparo del nodo sinoatrial (SA) y de la conducción del nodo AV.170,235
Glicósidos digitálicos
La dosis diaria de mantenimiento, una vez digitalizado el paciente, es de 1/8 a 1/4 de la dosis de digitalización.242,244 Sin embargo, es recomendable el seguimiento con electrocardiograma (ECG) y por medio de la concentración plasmática del fármaco para hacer los ajustes necesarios. En un estudio en caballos y burros en los que se utilizó digoxina a la dosis recomendada para el tratamiento de FCC, se encontró que los valores del fármaco eran tóxicos e inadecuados en 17% y 54% de los casos, respectivamente.245
La ouabaina es más tóxica que la digitoxina o la digoxina.2 Concentraciones plasmáticas de digoxina de 0.5-2 ng/mL no son tóxicas en caballos246 y no se deben exceder los 2.5 ng/mL.237 La digoxina puede ocasionar depresión, anorexia, bradicardia, alteraciones en la conducción AV, alargamiento del intervalo QRS y aumento de la excitabilidad atrial y ventricular.93,146 Además se presenta isquemia cardiaca y reducción del gasto cardiaco debido a un aumento no productivo de la contractilidad cardiaca, que sólo induce un aumento del consumo de oxígeno y de la resistencia vascular periférica.93,246 También se ha observado depresión, pérdida del apetito o diarrea.146 La hipokalemia, hipoproteinemia, falla renal, deshidratación, o la interacción con quinidina o verapamilo pueden potencialmente incrementar la toxicidad de la digoxina.93 Cuando se combinan glicósidos digitálicos más quinidina para el tratamiento de ICC, primero se administra el glicósido digitálico o en su defecto se administran simultáneamente los dos fármacos,146 ya que se pueden presentar riesgos considerables si se administra primero la quinidina, pues éste es un inotrópico negativo.237 No deben utilizarse digitálicos en casos de bloqueos de segundo grado o bloqueo AV completo.146
Discusión
Dada la considerable variedad de fármacos que llegan a utilizarse en los caballos, así como la amplia gama de situaciones clínicas en las que éstos se aplican, las reacciones referidas pueden variar en intensidad, frecuencia e incluso forma. De tal suerte, el clínico deberá ponderar si una reacción determinada es debida o no al fármaco aplicado. Empero, el conocimiento en sí de que puede ocurrir una RA con el fármaco administrado, es de por sí una base necesaria para identificarla. A fin de presentar toda la información compilada, en el Cuadro 1 247-274 se resumen algunas RA identificadas para otras familias farmacológicas no incluidas en el texto. La información vertida lleva la intención de ser completa incluyendo las reacciones menos comunes.
Cuadro 1 Reacciones adversas más comunes en los equinos por grupos farmacológicos (no se incluyen las reacciones descritas en el texto)
El ejercicio médico conlleva la premisa hipocrática de primum non nocere (lo primero es no dañar); por ello, esta revisión pretende estimular a los clínicos a distinguir las RA y documentarlas a fin de enriquecer el quehacer clínico. Adicionalmente, a fin de tomar medidas correctivas, se deberá distinguir entre una RA inducida por sobredosis, clasificada como reacción tipo “A” y una generada por el mecanismo de acción del medicamento o por su interacción con otro, conocida como reacción tipo “B”. Desafortunadamente, aún no se tiene una red de información sobre RA, como la que se ha instrumentando en otras partes del mundo. Un ejemplo de los beneficios de un sistema de acopio de los informes de RA en equinos, se presenta en las Figuras 1- 4, de las que se pueden derivar datos de utilidad clínica, como la identificación del grupo farmacológico más relacionado con RA fatales y reacciones anafilácticas, que en el caso citado fueron los antibacterianos. Se destaca la elevada incidencia de RA en el tercer y quinto año de vida, posiblemente relacionando la edad con el número de fármacos utilizados en caballos dedicados a competencias de velocidad. Curiosamente, las vacunas arrojaron el mayor número de reacciones locales, aunque ninguna de ellas fatales.274
Las pretensiones de este artículo incluyen, evidentemente, actualizar a los clínicos al tiempo en que se les estimula a establecer vínculos encaminados a generar un sistema de vigilancia permanente sobre RA, que permita no sólo identificar una reacción determinada bajo una situación clínica específica, sino ubicar el medicamento, incluyendo marca, con el fin de forzar la mejoría en los procesos de su fabricación y control de calidad.











 nueva página del texto (beta)
nueva página del texto (beta)