INTRODUCCIÓN
La crianza de becerros para la producción de carne de bovino depende en gran medida de la eficiencia reproductiva de las madres (Alvarez et al., 2018). En México, en general y específicamente en las regiones tropicales del país, la eficiencia reproductiva en los sistemas de producción de becerro es baja (Lassala et al., 2020). Se ha reportado que solo el 32.6% de las vacas del hato nacional se encuentran gestantes, las vacas de la zona Noreste y Centro presentan el mayor porcentaje de gestación (41%), mientras que en la región Norte el porcentaje de gestación es tan solo del 25% (Gutiérrez, 2018). Si bien hay factores como la raza, el anestro posparto, la lactación y el estatus nutricional que afectan la eficiencia reproductiva en estos sistemas de producción, también existen algunos aspectos de manejo reproductivo que pueden agudizar esta problemática. En México, alrededor del 90% de los productores de becerro del país utilizan empadre continuo, solo entre el 2.4 y 9.4% emplean la inseminación artificial (IA) y menos del 10% realizan sincronización de estros (Lassala et al., 2020).
El conocimiento del control endocrino del ciclo estral y de la fisiología de la dinámica folicular en las vacas, ha permitido el desarrollo de biotecnologías como la sincronización del estro y ovulación que a su vez facilitan y hacen más eficiente la IA en ganado productor de carne (Marizancén & Artunduaga, 2017). Estas biotecnologías aplicadas correctamente, pueden ser usadas para mejorar la eficiencia reproductiva del ganado (Colazo et al., 2018; Barusseli et al., 2018). En vacas Nelore en posparto, el uso de un protocolo de sincronización de estro previo al inicio del empadre, incrementó 1.5 veces la probabilidad de que las vacas quedaran gestantes durante este periodo, así como la tasa de preñes del empadre (52.2% vs 27.6%; Ferreira et al., 2018). En vacas productoras de carne, el uso de los protocolos de sincronización de estro y ovulación al inicio del empadre, permite inducir y uniformizar la manifestación del estro en un periodo de tiempo preestablecido de corta duración, lo cual facilita realizar la IA, programar épocas de partos e inducir la actividad ovárica en novillas y vacas en anestro (Colazo & Mapletoft, 2014; Baruselli et al., 2018).
Los protocolos de sincronización de estro y ovulación se basan en el uso de hormonas para manipular la dinámica folicular y la duración de la fase lútea del ciclo estral (Lamb et al., 2010; Colazo & Mapletoft, 2014) por lo que es importante conocer a detalle estos procesos. Las hormonas que se usan para manipular la dinámica folicular son la hormona liberadora de gonadotropinas (GnRH), los estrógenos y la progesterona. Para manipular la duración de la fase lútea se puede usar prostaglandina F2α (PGF2-α) y progesterona (Lamb et al., 2010; Bó & Baruselli, 2014; Colazo & Mapletoft, 2014; Bó et al., 2016).
Es importante que cuando se apliquen tratamientos hormonales para manipular la respuesta reproductiva del ganado, se conozca el mecanismo por el cual se producen los cambios fisiológicos y endocrinos en cada etapa del ciclo estral que se desea modificar, así como los efectos que tiene cada hormona en un determinado protocolo. Este documento tiene como objetivo describir la regulación endocrina del ciclo estral y la dinámica folicular en los bovinos, resaltando cómo, a través del uso de hormonas exógenas se pueden manipular estos procesos para implementar los diferentes protocolos de sincronización del estro y la ovulación. Además, de presentan resultados de tasa de preñez a estro sincronizado (TPES) con diferentes protocolos de sincronización de estro y ovulación que se reportan en la bibliografía
MATERIAL Y MÉTODOS
Se realizó una búsqueda en las bases de datos Pubmed, ScienceDirect, Google Scholar y SciELO utilizando las palabras clave “Bovine estrus cycle” y “Bovine folicular waves” y se seleccionaron las revisiones y artículos originales más importantes sobre estos temas, incluyendo los que nuestro grupo ha publicado. Para describir los resultados de la tasa de preñez a estro sincronizado (TPES) obtenidos con los principales protocolos que se usan en la actualidad, realizamos una búsqueda únicamente en Pubmed usando las palabras clave “estrus synchronization beef cows estradiol” para obtener datos reportados usando protocolos basados en estradiol y con las palabras clave “estrus synchronization beef cows GnRH”, se recuperaron artículos con el uso de protocolos basados en GnRH. Además de los artículos que obtuvimos en esta última búsqueda, seleccionamos aquellos que usaron protocolos basados en progestágenos. En las dos búsquedas, se seleccionaron publicaciones del año 2000 al 2023. Los principales criterios de selección para los datos de TPES fueron aquellos en donde la asignación de tratamientos se hiciera completamente al azar. Adicionalmente, se tomaron datos de grupos experimentales donde evaluaron el efecto del uso de gonadotropina coriónica equina (eCG), efecto de la presentación de estro, ciclicidad y destete temporal. Cuando en un artículo evaluaron otras variables diferentes a las mencionadas arriba, sólo se tomaron los datos del grupo control. Con los datos de TPES de cada grupo experimental, se realizaron histogramas de frecuencia o gráficas de dispersión, para describir la variación de los datos.
Control Endocrino del Ciclo Estral en Bovinos
Las hembras de los mamíferos domésticos a partir de la pubertad y durante toda su vida reproductiva presentarán en forma periódica ciclos estrales, los cuales se definen como el período comprendido desde la aparición de un estro hasta el comienzo del siguiente (Lamb & Mercadante, 2016). El ciclo estral se caracteriza por una serie de cambios anatómicos, endocrinos y conductuales que tienen como finalidad la ovulación y preparar el medio ambiente uterino para una posible gestación (Bó et al., 2003). En bovinos, cada ciclo estral tiene una duración promedio de 20 días en novillas y de 21 días en vacas (Sartori & Barros, 2011). El ciclo estral se compone de cuatro etapas que son; el estro, metaestro, diestro, proestro y dos fases; la folicular, estrogénica o proliferativa que incluye el proestro, el estro y la lútea, progestacional o secretora incluye el metaestro y el diestro (Figura 1). En la fase folicular se desarrolla el folículo ovulatorio, así que la hormona dominante es el estradiol. Este esteroide promueve, a nivel uterino, la proliferación de las células endometriales. En la fase lútea, ocurre el desarrollo y funcionalidad del CL, por lo que la hormona dominante es la progesterona que estimula al endometrio para que secrete la leche uterina o histótrofo (Rathbone et al., 2001; Sartori & Barros, 2011).

Figura 1 Representación esquemática de las etapas y fases del ciclo estral en bovinos y de las olas desarrollo folicular
El establecimiento del ciclo estral y los cambios que en él se presentan, son regulados por la síntesis y secreción de hormonas del hipotálamo, como GnRH, de la hipófisis que produce la hormona luteinizante y la hormona folículo estimulante (LH y FSH), del folículo que secreta estrógenos e inhibina, del CL que produce progesterona y oxitocina y del endometrio que libera PGF2α (Sartori & Barros, 2011).
Durante el proestro, la producción de FSH se mantiene baja y constante porque no está regulada por GnRH, mientras que LH comienza a incrementar su frecuencia de secreción y a disminuir la amplitud de sus pulsos. Esto promueve la maduración final del folículo incrementándose la síntesis de estradiol y de inhibina (Rathbone et al., 2001). El incremento de estas dos hormonas ejerce a nivel de la hipófisis una retroalimentación negativa sobre la síntesis de FSH (Aerts & Bols, 2010). Por otro lado, hacia finales del proestro e inicios del estro, el estradiol ejerce un efecto de retroalimentación positiva sobre GnRH, al actuar sobre sus receptores α y β localizados en neuronas glutamaérgicas y kispeptinérgicas (Kenealy & Terasawa, 2012). Este efecto de estradiol desencadena el pico preovulatorio de GnRH-LH, y con ello la ovulación (Garverick & Smith, 1993; Forde et al., 2011; De Graaff & Grimard, 2018). Para desencadenar la ovulación, que ocurre entre las 10 a 12 horas después de finalizado el estro, la LH promueve la síntesis de prostaglandinas y enzimas para facilitar la ruptura de las paredes foliculares. Además, la LH estimula el reinicio de la meiosis en el ovocito (Delgado et al., 2011). Después de la ovulación, el CL se desarrolla a partir del folículo ovulado por efecto de LH y las concentraciones de progesterona se incrementan paulatinamente hasta alcanzar su máxima concentración a finales del metaestro e inicios del diestro (Forde et al., 2011). Las concentraciones máximas de progesterona se mantienen constantes durante todo el diestro para evitar la ovulación de los folículos dominantes desarrollados durante la fase lútea del ciclo (Baruselli et al., 2007).
Si el ovocito ovulado no es fecundado, alrededor de los días 16 y 17 del ciclo estral, el endometrio secretará PGF2α para inducir la regresión del CL (Rosales-Torres & Guzmán, 2011; Sartori & Barros, 2011). Para esto, la PGF2α al unirse a su receptor en los vasos sanguíneos del CL causa una elevación de Ca++ intracelular para inducir vasoconstricción. La vasoconstricción, reduce el aporte de nutrientes, oxígeno y colesterol hacia el CL, ocasionando la reducción en la síntesis de progesterona y la apoptosis de las células lúteas (Rosales-Torres & Guzmán, 2008; Shirasuna et al., 2012). La luteólisis causa la reducción en la concentración sérica de progesterona con lo cual la retroalimentación negativa que ejercía la progesterona sobre GnRH desaparece (Rathbone et al., 2001).
Olas de Crecimiento Folicular
El desarrollo folicular durante el ciclo estral en bovinos se presenta en forma de olas y es un proceso altamente selectivo donde usualmente solo un folículo puede llegar a ovular y el destino del resto de los folículos de la misma cohorte, es la atresia (Rosales-Torres et al., 2012). En cada ola de crecimiento folicular, se desarrolla un folículo dominante, aunque solo ovulará el folículo dominante de la última ola (Aerts & Bols, 2010; Bó et al., 2016; Ginther, 2016). Las olas de crecimiento folicular se componen de tres fases: reclutamiento cíclico, selección y dominancia (Aerts & Bols, 2010; Fortune et al., 1991; Rosales-Torres et al., 2012).
Durante el reclutamiento cíclico, una cohorte de folículos antrales pequeños inician su crecimiento en respuesta a un pico transitorio de FSH (Mihm et al., 2000; Driancourt, 2001; Aerts & Bols, 2010). Esta fase tiene una duración de alrededor de 2 días durante los cuales la FSH estimula el crecimiento de los folículos (Webb et al., 2004; Rodgers & Rodgers, 2010). La selección ocurre al final del periodo común de crecimiento, cuando uno de los folículos reclutados, es seleccionado como dominante para continuar su crecimiento (Sirard, 2016; Rosales-Torres et al., 2012). Finalmente, la dominancia se refiere al mecanismo por el cual el folículo seleccionado como dominante tiene un rápido desarrollo y suprime el crecimiento de los folículos subordinados (Ginther et al., 1989; Webb et al., 2004). Para ello, el estradiol y la inhibina producida en él impiden la síntesis y secreción de FSH (Beg & Ginther, 2006). Esta reducción de FSH causa la atresia de los folículos subordinados, mientras que el folículo dominante continúa su crecimiento a una tasa de hasta 1.6 mm por día (Sirois & Fortune 1988; Rosales-Torres et al., 2012). Si el folículo dominante se desarrolla durante la fase lútea del ciclo estral, las concentraciones circulantes de progesterona impiden el pico preovulatorio de LH por lo que no podrá ovular y se volverá atrésico (Figura 1). En ausencia de un CL funcional, el folículo dominante por su alta producción de estradiol induce el pico preovulatorio de LH y con ello la ovulación (Driancourt, 2001; Moore & Thatcher, 2006).
Es importante señalar que mientras el folículo dominante sea estrogénicamente activo, no podrá emerger una nueva ola de crecimiento folicular (Webb et al., 2004; RosalesTorres et al., 2012). Sin embargo, si el folículo dominante ovula o se vuelve atrésico, el bloqueo sobre FSH desaparecerá ya que se deja de producir estradiol e inhibina y se dará una nueva elevación transitoria de esta hormona, que estimulará la emergencia de una nueva ola de crecimiento folicular (Sartori et al., 2004; Beg & Ginther, 2006).
Existen algunas diferencias de acuerdo con la especie y raza en cuanto a la dinámica folicular (Baruselli et al., 2007). En ganado Bos taurus, la selección del folículo dominante ocurre 2 días después de iniciada la ola folicular y generalmente el folículo que alcance 8.5 mm de diámetro será el seleccionado como dominante (Fortune et al., 1991; Fortune et al., 2001). En el caso de vacas Bos indicus, la selección del folículo dominante será 2.6 días después de iniciada la ola y el folículo con un diámetro aproximado de 5.9 ± 0.4 mm será seleccionado (Sartori & Barros, 2011). Baruselli et al. (2018) reportan que las vacas Brahman, Nelore y Gyr pueden presentar entre dos y cuatro olas de desarrollo folicular por ciclo estral. Mientras que en vacas Bos taurus predominan de dos a tres olas (Sartori et al., 2004). Además de la diferencia en el número de ondas foliculares, las hembras Bos indicus reclutan mayor número de folículos por ola de crecimiento folicular que las hembras Bos taurus (33.4±3.2 versus 25.4±2.5 respectivamente). Finalmente, en hembras de Bos Taurus con dos olas de crecimiento folicular el diámetro mayor del folículo dominante es de 17.1 mm para la primera ola y de 16,5 mm para la segunda (Ginther, 2016), en tanto que en Bos Indicus los diámetros mayores del folículo dominante son de 11.3 mm, 12.1 mm y 10.4 mm para la primera, segunda y tercera ola de crecimiento respectivamente (Figueiredo et al., 1997).
Sincronización de Estro y Ovulación.
Los protocolos de sincronización del estro y ovulación tienen importantes ventajas para el manejo reproductivo de hembras bovinas productoras de carne y con el tiempo éstos han ido evolucionando para ser más efectivos. La implementación de estos protocolos facilita el uso de la inseminación artificial a tiempo fijo (IATF) o a estro detectado, homogeniza el nacimiento de becerros, permite la programación de partos, el cuidado del becerro recién nacido y aumenta los índices de preñez (Abel et al., 2017). En la actualidad, la manipulación hormonal del ciclo estral en bovinos para sincronizar el estro y la ovulación, se basa en cuatro grandes principios;
Simular la fase lútea del ciclo estral. Esto se logra mediante la administración exógena de progesterona usando dispositivos intravaginales que liberan progesterona (DIP) de manera constante (Colazo & Mapletoft, 2014) o mediante el uso de progestágenos orales como el acetato de melengestrol (MGA; Lamb et al., 2010). Actualmente los DIP son los más usados y se recomienda su uso por periodos de 5 a 7 días (Abel et al., 2017; Williams & Stanko, 2020). El sustento fisiológico del uso de los DIP consiste en que, al retirar el tratamiento, las concentraciones de progesterona en sangre se reducen rápidamente. Esto causa que los animales que no tengan un cuerpo lúteo entren en proestro y se dé la maduración de un folículo dominante que produzca suficiente estradiol para incrementar la frecuencia de pulsos de LH en la hipófisis y la posibilidad de que haya una ovulación (Rathbone et al., 2001; Lamb et al., 2010; Sartori & Barros, 2011).
Acelerar la regresión del CL mediante la administración de PGF2α o sus análogos sintéticos. La aplicación de PGF2α induce la lisis del CL para ocasionar la reducción en las concentraciones de progesterona endógena e inducir una nueva fase folicular en los animales que tienen un CL funcional (Abreu et al., 2018). La PGF2α induce la lisis del CL cuando se aplica al menos 6 a 7 días después de iniciado el estro, ya que previo a este tiempo, el CL se encuentra en desarrollo y hay muchos factores de sobrevivencia en el medio que lo rodea como la LH, el VEGF y el IGF-I que evitan el efecto luteolítico de la PGF2α (Wenzinger & Bleul, 2012; Abel et al., 2017; Scarpa et al., 2019). Es importante señalar que en ausencia de un CL la PGF2α no tiene efecto, sin embargo por cuestiones de manejo y la necesidad de tener experiencia para palpar la presencia de un CL, la PGF2α se suele aplicar aun cuando no haya in CL en ovario.
Sincronizar el inicio de una nueva ola de crecimiento folicular. Esto se logra mediante la aplicación de GnRH o estradiol. Cuando se aplica GnRH o sus análogos, se induce un pico de LH y si la hembra tiene un folículo dominante, éste ovulará. La ovulación del folículo dominante ocasiona una reducción de estradiol e inhibina lo cual permite una elevación de FSH para iniciar una nueva ola de crecimiento folicular (Adams et al., 1992; Aerts & Bols, 2010). En cuanto al uso de estradiol o sus análogos, se aplican en dosis elevadas (2 mg), para inducir una retroalimentación negativa sobre FSH a nivel hipofisiario y con ello ocasionar la atresia de los folículos de la ola de crecimiento en turno presentes en el ovario. Cuando los folículos se vuelven atrésicos, dejan de secretar estradiol e inhibina, se elimina la retroalimentación negativa que ejercían sobre FSH y se elevan las concentraciones de esta gonadotropina para iniciar una nueva ola de crecimiento folicular (Bó et al., 1994; Scarpa et al., 2019).
Inducir la ovulación del folículo dominante de la ola de crecimiento sincronizada. En ganado productor de carne, la ovulación se puede inducir mediante la aplicación de GnRH al momento de la inseminación artificial o con la aplicación en dosis bajas (1 ng) de estradiol en animales en proestro, para inducir el comportamiento estral y el pico preovulatorio de LH (Bó et al., 2016).
Principales Protocolos Usados Actualmente
A la fecha, los tratamientos comúnmente empleados para la sincronización de estro y ovulación usan como base, los DIP. Los protocolos difieren básicamente en la hormona que se usa para sincronizar el desarrollo folicular pudiendo ser GnRH, estrógenos sintéticos o progestágenos. Así, los protocolos de sincronización de estro y ovulación que se usan en la actualidad se basan en estradiol, GnRH o progesterona (Figura 2), aunque la mayoría de los protocolos utilizan una combinación de estas hormonas (Bó & Baruselli, 2014; Lamb & Mercadante, 2016; Bó et al., 2016).

Figura 2 Principales protocolos de sincronización de estro y ovulación en hembras bovinas productoras de carne usados actualmente. A-C) Protocolos basados en estradiol usando BE (A), GnRH (B) o ECP (C) como inductores de ovulación. D-F) Protocolos basados en GnRH sin (D) o con el uso un dispositivo intravaginal que libera progesterona (DIP) por siete (E) o cinco (F) días. G y H) Protocolos basados en progesterona sin el uso de GnRH previo a la aplicación de PGF2α (G) o con el uso de GnRH siete días previos a la aplicación de PGF2α (H).
Protocolos basados en estradiol
Los tratamientos basados en estradiol (Figura 2A a 2C) consisten en la inserción de un DIP más una inyección de 2 mg de benzoato de estradiol (BE) por vía intramuscular en el día 0. El estradiol permite inducir el inicio de la ola de crecimiento folicular y así asegurar la presencia de un folículo estrogénicamente activo que contenga un ovocito viable al momento de la IA (Bó et al., 1994; Uslenghi et al., 2014; Bó et al., 2016). El DIP se retira 7, 8 o 9 días después de su inserción y se aplica PGF2α para lisar un posible CL. De esta manera se asegura la reducción de progesterona en sangre y el inicio de la fase folicular. Después de esto, se debe inducir la ovulación del folículo dominante de la ola sincronizada, para lo cual se puede proceder de varias formas con relación al retiro del DIP: 1) aplicar 1 mg de BE 24 horas después, 2) aplicar GnRH 54 horas después o 3) aplicar cipionato de estradiol (ECP; 0.5 o 1 mg) al retirar el DIP. Con el uso de estos protocolos se recomienda realizar la IATF entre las 54 y 64 horas después del retiro del DIP (Colazo et al., 2003; Sales et al., 2012).
TPES en novillas tratadas con protocolos basados en estradiol
Usando protocolos basados en estradiol en novillas, la TPES más baja reportada en los artículos consultados fue de 39% (Reineri et al., 2023) mientras que la más alta fue 59% (Silva et al., 2018a). Respecto a las diferencias por inductor de ovulación, la TPES no difirió estadísticamente en novillas con el uso de GnRH (59%; Silva et al., 2018b) o ECP (53%; Silva et al., 2018b) o entre el uso de BE (48%) y ECP (47%; (Pfeifer et al., 2014).
En efecto del uso de eCG al momento del retiro del DIP en novillas, no ha sido evaluado tan ampliamente como en vacas (ver más adelante), sin embargo, el uso de 200, 300 o 400 UI de eCG parece no modificar la TPES (Pinto et al., 2020). De los datos recabados en novillas, en ningún caso se reportan las diferencias en TPES entre animales en estro o estatus puberal. Sin embargo, la presencia de CL al inicio del tratamiento indica que las novillas han empezado a ciclar. En este sentido, Silva et al. (2018b) reportan que la TPES es similar en novillas sin presencia de CL al inicio del tratamiento cuando se usa GnRH (50.5%) o ECP (50.5%) como inductores de ovulación. Sin embargo, la TPES fue mayor en animales con CL cuando se usa GnRH (68%) para inducir la ovulación que cuando se usó ECP (55%). Estas evidencias sugieren que, en novillas tratadas con protocolos basados en estradiol, se puede usar indistintamente GnRH, BE o ECP como inductores de ovulación. Sin embargo, si se pueden detectar novillas ciclando al inicio del tratamiento, en ellas es mejor usar GnRH para inducir la ovulación.
TPES en vacas tratadas con protocolos basados en estradiol
En vacas lactando la TPES más baja reportada fue de 23% (Malik et al., 2012) y la más alta fue de 72% (Rodrigues et al., 2018). En este grupo de animales tratados con protocolos basados en estradiol la mayoría de los datos de TPES (73%) reportados en los artículos consultados estuvo entre 41 y 60% (Figura 3A). Para los datos de vacas no lactando, la TPES más baja fue 44% y la más alta de 62% (Uslenghi et al., 2014).

Figura 3 Tasa de Preñez a Estro Sincronizado (TPES) con protocolos basados en estradiol en vacas lactando. A) Distribución de los datos de TPES totales. B) Distribución de los datos TPES con el uso de benzoato de estradiol (BE) y cipionato de estradiol (ECP) como inductores de ovulación. C) Distribución de los datos de TPES con el uso o no de 300UI de gonadotropina coriónica equina (eCG) al momento de retirar el DIP. Información recopilada de: Ross et al., 2004; Sa Filho et al., 2010; Malik et al., 2012; Campos et al., 2013; Pfeifer et al., 2015; Uslenghi et al., 2016; Pessoa et al., 2016; Cooke et al., 2016; Rodrigues et al., 2018; Santos et al., 2018; Silva et al., 2018a, Crepaldi et al., 2019; Oliveira-Filho et al., 2020; Noronha et al., 2020; Diniz et al., 2021; Alves et al., 2021; Pfeifer et al., 2022; Barbosa et al., 2022; Rodriguez et al., 2023; Aragunde-Vieytes et al., 2023.
La TPES reportada en vacas lactando con el uso de BE como inductor de ovulación, en protocolos basados en estradiol, estuvo entre 23 y 58%, mientras que cuando se usó ECP como inductor de ovulación, el 88% de los datos de TPES reportados estuvieron entre 41 y 70% (Figura 3B). Estos datos sugieren que la TPES se puede incrementar si se usa ECP en comparación con BE como inductores de ovulación. Sin embargo, en los artículos donde se compararon los diferentes inductores de ovulación en vacas lactando tratadas con protocolos basados en estradiol, no se observaron diferencias entre el uso de BE o ECP (Sales et al., 2012; Uslenghi et al., 2014; Uslenghi et al., 2016).
El uso de eCG (300 UI) al momento de retirar el DIP, es una estrategia para incrementar la TPES en vacas lactando tratadas con protocolos basados en estradiol. Como podemos ver en la figura 3C, la TPES reportada cuando no se usó eCG, en el 100% de los datos recuperados de la bibliografía, fue menor al 61%, mientras que cuando se usó eCG el 100% de los datos de TPES estuvieron entre 45 y 72%. Estos reportes sugieren que la TPES en vacas lactando tratadas con protocolos basados en estradiol, se puede mejorar con el uso de eCG. Esta hipótesis fue confirmada por Pessoa et al. (2016) quienes reportan que el uso de eCG al momento de retirar el DIP incrementa la TPES (45%) en comparación con vacas a las que no se les aplica eCG (30%). La eCG actúa principalmente sobre receptores a FSH en el folículo, para promover la síntesis de estradiol y el crecimiento folicular (Murphy & Martinuk, 1991). Se ha reportado que un mayor desarrollo folicular puede mejorar la calidad del ovocito y con ello la fertilidad (Simões et al., 2018) lo cual explica por qué, el uso de esta hormona mejora la TPES en protocolos basados en estradiol.
En vacas productoras de carne lactando, la presencia del becerro reduce la secreción de GnRH/LH (Crowe, 2008), por lo cual se recomienda hacer un destete temporal desde el retiro del DIP y hasta la IATF (Crowe, 2008). Sin embargo, Cooke et al. (2016) reportan que la TPES es similar en vacas en las que se realizó destete temporal (45.6%) que en vacas en las que no se realizó (46.6%), mientras que Pfeifer et al., (2014) reportan una TPES de 58.1% con destete temporal, que está dentro del rango de TPES reportado en el resto de los artículos revisados donde no se reporta haber realizado destete temporal (Malik et al., 2012; Rodrigues et al., 2018). Estas evidencias sugieren que no es necesario realizar destete temporal y que los protocolos basados en estradiol pueden contrarrestar el efecto negativo de la presencia del becerro sobre la secreción de GnRH/LH.
Otro factor que puede afectar la TPES, es la presentación de estro después de retiro del DIP. La TPES fue mayor (P<0.05) en vacas lactando y no lactando que presentaron estro, que en las que no presentaron estro (Cedeño et al., 2021; Pessoa et al., 2016; Rodrigues et al., 2018). La falta de conducta estral puede ser un indicativo de ausencia de un folículo preovulatorio maduro capaz de producir suficiente estradiol para estimular el estro y la ovulación, lo cual explicaría por qué los animales que no presentan estro tienen una TPES menor.
Recientemente se ha reportado una variación en los protocolos basados en estradiol donde se usa el DIP solo por 5 o 6 días. A este protocolo se le ha denominado J-synch y en novillas productoras de carne tratadas con este protocolo hay una TPES mayor (61.9%) en comparación con novillas tratadas con el protocolo convencional (51.4%; Bó et al., 2016). De manera similar a lo observado en novillas tratadas con el protocolo convencional basado en estradiol, novillas tratadas con el J-synch ciclando, tienen una TPES mayor que las novillas en anestro (Núñez-Olivera et al., 2022; Zwiefelhofer et al., 2021). Así mismo, en vacas lactando, el uso de J-synch tiende a incrementar la TPES (74.1%) cuando se compara con el protocolo basados en GnRH (66.5%; Macmillan et al., 2020). Adicionalmente, en este tipo de protocolos, la aplicación de eCG al momento del retiro del DIP, incrementa la TPES (Núñez-Olivera et al., 2020). La reducción de 8 a 5 días en el uso del DIP en protocolos basado en estradiol, evita la presencia de folículos persistentes ya que la liberación de progesterona por parte del DIP es suficiente para ejercer retroalimentación negativa para GnRH, lo cual favorece el recambio folicular (Day, 2015).
Protocolos basados en GnRH
Los tratamientos basados en GnRH consisten en la administración de esta hormona en el día cero, para inducir la ovulación del folículo dominante y con ello promover el inicio de una nueva ola de crecimiento folicular. Posteriormente, en el día siete se aplica PGF2α para inducir la regresión del CL y entre 48 a 72 horas después se aplica una segunda dosis de GnRH (Figura 2D) para inducir la ovulación y se realiza la IATF (Martínez et al., 1999; Martínez et al., 2000). La efectividad de este tratamiento depende en gran medida de que los animales ovulen después de la primera aplicación de GnRH. Si los animales ovulan, se formará un CL, por lo que al aplicar PGF2α en el día 7, las concentraciones séricas de progesterona se reducirán, los animales entrarán a una fase folicular y habrá un folículo preovulatorio que ovulará con la segunda aplicación de GnRH (Bó et al., 2016; Ginther, 2016). Debido a que el porcentaje de ovulación después de la primera aplicación de GnRH es muy variable (Bó et al., 2016), a este protocolo se le ha sumado el uso de un DIP junto con la primera aplicación de GnRH, el cual debe retirarse al momento de aplicar la PGF2α (Figura 2E). De esta manera, sin importar si los animales ovulan después de la primera aplicación de GnRH, al momento de retirar el DIP, todos entrarán en proestro. Adicionalmente, este protocolo ha sido acortado, usando el DIP solo por 5 días y aplicando dos inyecciones de PGF2α, una al momento del retiro de DIP y la segunda 6 a 8 horas después (Figura 2F).
TPES en novillas tratadas con protocolos basados en GnRH
En novillas tratadas con protocolos basados en GnRH usando el DIP por 5 días, la mayoría de los datos de TPES (91%) estuvieron entre el 51 al 70%. En contraste, cuando el DIP fue usado por 7 días, la mayoría de los datos de TPES estuvieron entre 41-60% (Figura 4A). Estos datos sugieren que la TPES se puede incrementar si se usa el DIP por 5 días en comparación con su uso por 7 días.
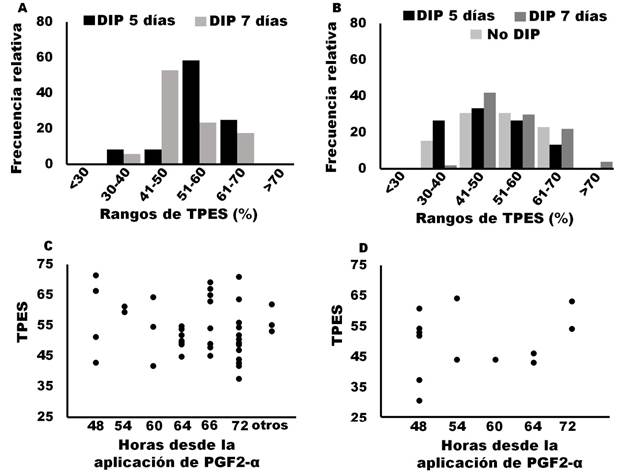
Figura 4 Tasa de Preñez a Estro Sincronizado (TPES) en hembras bovinas tratadas con protocolos basados en GnRH. A) Distribución de datos de TPES en novillas en la que se usó un dispositivo intravaginal que libera progesterona (DIP) por 5 o 7 días después de la primera aplicación de GnRH. B) Distribución de datos de TPES en vacas lactando sin el uso de un DIP o con su uso por 5 y 7 días después de la primera aplicación de GnRH. C) Distribución de datos de TPES a diferentes tiempos entre la aplicación de PGF2-α y la IA en vacas lactando tratadas con protocolos basados en GnRH y el uso de un DIP por 7 días. D) Distribución de datos de TPES a diferentes tiempos entre la aplicación de PGF2-α y la IA en vacas lactantes tratadas con protocolos basados en GnRH sin uso de un DIP. Datos recopilados de: Abel et al., 2017; Martínez et al., 2000; Bishop et al., 2017; Bridges et al., 2014; Macmillan et al., 2020; Burns et al., 2008; Busch et al., 2007; Busch et al., 2008; Cruppe et al., 2014; Dahlen et al., 2010; Echternkamp & Thallman, 2011; Esterman et al., 2016; Geary et al., 2001; Giles et al., 2013; Hall et al., 2017; Helguera et al., 2018; Hill et al., 2014; Hill et al., 2016a; Hill et al., 2016b; Kasimanickam et al., 2006; Kasimanickam et al., 2010; Kasimanickam et al., 2014; Kasimanickam et al., 2009; Kasimanickam et al., 2012; Knickmeyer et al., 2019; Lamb et al., 2001; Lamb et al., 2006; Larson et al., 2006; Marquezini et al., 2011; Marquezini et al., 2013a; Marquezini et al., 2013b; Martínez et al., 2002; Mercadante et al., 2015; Mialot et al., 2003; Nash et al., 2012; Oosthuizen et al., 2018a; Oosthuizen et al., 2018b; Oosthuizen et al., 2018c; RosalesTorres et al., 2017; Small et al., 2009; Stevenson et al., 2003; Thomas et al., 2014; White et al., 2016; Whittier et al., 2010; Whittier et al., 2013; Williams & Stanko, 2020; Wilson et al., 2010; Rodriguez et al., 2023; Bonacker et al., 2020; Rojas-Canadas et al., 2023.
Cuando se usa el DIP por 5 días en protocolos basado en GnRH, se recomienda aplicar 2 inyecciones de PGF2α al momento del retiro del DIP debido a que los animales que ovulan, con la primera aplicación de GnRH, tienen un CL joven que están bajo la influencia de estímulos tróficos que promueven su desarrollo (Niswender et al., 2000). Según la información consultada, la TPES se reduce en novillas tratadas con protocolos basados en GnRH+DIP por 5 días, si se usa una sola inyección de PGF2α en comparación con el uso de dos inyecciones de esta hormona (Kasimanickam et al., 2012; Kasimanickam et al., 2014; White et al., 2016; Helguera et al., 2018). Por esta razón lo más recomendable es aplicar dos inyecciones de PGF2α cuando se decida usar el DIP por 5 días.
La presentación de estro previo a la IATF ha mostrado resultados contrastantes sobre la TPES en novillas tratadas con protocolos basados en GnRH. Novillas sincronizadas con el protocolo GnRH y DIP por 7 días que presentan estro, tienen una TPES similar a las novillas que no lo presentaron (Martínez et al., 2002; Knickmeyer et al., 2019). En cambio, Oosthuizen et al. (2018ª) y Speckhart et al. (2022), usando el mismo protocolo, reportan que la TPES es mayor en novillas que presentan estro previo a la inseminación que las que no lo presentan. Así, parece que la TPES en novillas tratadas con protocolos basados en GnRH puede depender parcialmente de la presentación de estro. Sin embargo, inseminar solo novillas en estro, además de presentar un reto de manejo para detectarlo, puede reducir la tasa de pariciones al final del empadre por lo que se recomienda inseminar a todos los animales sin importar si presentan estro o no.
Respecto al estatus puberal al inicio del tratamiento, parece que la TPES no difiere entre animales púberes y animales peri-púberes sometidos a protocolos basados en GnRH con uso del DIP por 7 o 5 días (Busch et al., 2007; Helguera et al., 2018; Knickmeyer et al., 2019). El uso de GnRH y DIP en estos protocolos, además de sincronizar el estro y la ovulación, puede inducir la actividad ovárica en novillas peri-púberes con buen desarrollo corporal (Colazo & Mapletoft, 2014; Baruselli et al., 2018), explicando porque, no hay diferencias en la TPES entre novillas púberes y peri-púberes.
El tiempo entre el retiro del DIP y la IA ha mostrado efectos contradictorios sobre la TPES. Helguera et al., (2018) reportan que no hay diferencia en la TPES entre novillas tratadas con GnRH y DIP por 5 días e inseminadas a las 66 horas después del retiro del DIP con novillas inseminadas a las 72 horas. En contraste, en novillas tratadas con el mismo protocolo, la TPES es mayor cuando la inseminación se realizó a las 54 horas de retirar el DIP que cuando se hizo a las 72 horas (Kasimanickam et al., 2012). Si bien las diferencias en estos resultados pueden deberse a muchos factores, es importante señalar que entre más tiempo pase entre el retiro del DIP y la IA, se corre el riesgo que el folículo dominante ovule comprometiendo, la viabilidad del ovocito y la fertilidad.
TPES en vacas lactando tratadas con protocolos basados en GnRH
La distribución de los datos de TPES, en vacas lactando tratadas con protocolos basados en GnRH sin uso de DIP o con su uso por 5 o 7 días se muestra en la figura 4B. El rango de TPES, en vacas lactando tratados con protocolos basados en GnRH sin el uso del DIP fue de 31% (Stevenson et al., 2003) a 64% (Small et al., 2009). Mientras que en hembras sometidas a protocolos basados en GnRH y DIP por 5 días, el rango fue de 33% (Williams & Stanko, 2020) a 69% (Kasimanickam et al., 2009) y animales donde se usó el protocolo basado en GnRH, pero con DIP por 7 días, el rango fue de 38% (Rosales-Torres et al., 2017) a 71% (Lamb et al., 2001).
La TPES es mayor en animales en los que se usó DIP por 7 días después de la primera aplicación de GnRH en comparación con los que no lo tuvieron (Lamb et al., 2001 y Larson et al., 2006). En cuanto a las diferencias entre el uso del DIP por 7 o 5 días, los datos de TPES colectados sugieren que no hay diferencias (Figura 4B), sin embargo, se ha reportado que la TPES es mayor cuando se usa el DIP por 5 días en comparación con 7 días (Whittier et al., 2013). Basados en estos datos se recomienda el uso del DIP ya sea por 5 o 7 días en vacas tratadas con protocolos basados en GnRH para asegurar que los animales que no ovulen con la primera aplicación de GnRH entren a la fase folicular al momento de retirar el DIP (Bó et al., 2016; Ginther, 2016). Esto incrementa el número de animales que responden al tratamiento y con ello la TPES.
Como se mencionó anteriormente, el tiempo entre el retiro del DIP y la IA puede variar entre 48 y 72 horas. De los datos de TPES que recabamos de vacas lactando tratadas con protocolos basados en GnRH+DIP por 5 días, en la mayoría (85%) la IATF se realizó a las 72 horas del retiro del DIP, la TPES más baja fue del 33% (Williams & Stanko, 2020) y la más alta fue 69% (Kasimanickam et al., 2009). En vacas lactando tratadas con el protocolo basado en GnRH con y sin el uso de DIP por 7 días, el tiempo entre la aplicación de PGF2-α y la IA, así como los resultados de la TPES reportados fueron muy variables (figura 4C y 4D). En vacas lactando en las que se usó del DIP por 7 días, la TPES más alta (71%) se reportó cuando la IATF se realizó a las 48 (Lamb et al., 2001) y 72 horas (Nash et al., 2012), mientras que la más baja (38%) fue cuando la IA se hizo a las 72 horas (Rosales-Torres et al., 2017). Busch et al. (2008), muestran que la TPES es mayor cuando la IA se hace a las 66 horas que cuando se realiza a las 54 horas después del retiro del DIP. Sin embargo, debido a la variación de la TPES que se muestra en la figura 4C el efecto del tiempo entre el retiro del DIP y la IA en protocolos basados en GnRH y DIP por 7 días puede no ser importante. Finalmente, en vacas lactando tratadas con protocolos basados en GnRH sin el uso del DIP, la TPES varió de 31% cuando la IATF se realizó a las 48 horas después de la aplicación de PGF2α (Stevenson et al., 2003) hasta 64% reportada cuando la IATF se realizó a las 64 horas de la aplicación de PGF2α (Small et al., 2009).
La presentación de estro previo a la IA, el estatus ovárico al inicio del tratamiento, el uso de eCG y el destete temporal pueden afectar la TPES en vacas lactando tratadas con protocolos basados en GnRH. Varios reportes muestran el efecto de la presentación de estro previo a la IA sobre la TPES (Nash et al., 2012; Thomas et al., 2014; Hill et al., 2016a; Hill et al., 2016b; Abel et al., 2017) y concluyen que las hembras que presentan estro, tienen una TPES mayor que los que no presentan estro. En trabajos que usaron el protocolo basado en GnRH+DIP por 7 días, se reporta que la TPES más alta fue de 48% (Abel et al., 2017) y la más baja de 42% (Nash et al., 2012; Hill et al., 2016a) en vacas que no presentan estro previo a la IA, mientras que en animales que presentan estro, la TPES más alta fue de 71% (Nash et al., 2012) y la más baja 64% (Ferreira et al., 2018). Al igual que en protocolos basado en estradiol, en los que están basados en GnRH, la presentación de estro puede mejorar la TPES, ya que en los animales con comportamiento estral es más probable que tengan folículo preovulatorio maduro capaz de inducir su propia ovulación vía estradiol. Sin embargo, por cuestiones de manejo y para incrementar la tasa de pariciones al final del empadre, se recomienda al igual que en novillas que la IATF se realice en todos los animales.
En cuanto al efecto del estatus ovárico sobre la TPES, en hembras ciclando al inicio del tratamiento con GnRH+DIP por 7 días, el rango de TPES reportado es de 49% (Marquezini et al., 2013a) a 69% (Bridges et al., 2014), mientras que, en animales en anestro el rango es de 47% (Nash et al., 2012) a 63% (Busch et al., 2008). Por su parte, Giles et al. (2013), usando el protocolo basado en GnRH y DIP por 5 días reportan que la TPES es del 50% en vacas ciclando y del 52% en vacas en anestro. Como se mencionó, en el caso de novillas tratadas con protocolos basado en GnRH, éstos pueden inducir la ciclicidad en animales en anestro (Colazo & Mapletoft, 2014; Baruselli et al., 2018), explicando el porqué, no hay diferencias en la TPES entre vacas ciclando y vacas en anestro.
Aun cuando la presencia del becerro reduce la secreción de GnRH (Martínez et al., 2000), pocos estudios incluyen el destete temporal como factor para mejorar la TPES en los protocolos basados en GnRH revisados en este trabajo. Marquezini et al. (2013a y 2013b) reportan, en animales tratados con protocolos basados en GnRH+DIP por 7 días, que la TPES es similar cuando se hace destete temporal por 72 horas que cuando no se hace destete temporal. En contraste, Geary et al. (2001)reportan, que el destete temporal por 48 horas tiende (P=0.09) a incrementar la TPES en vacas tratadas con protocolos basados en GnRH con o sin DIP. Si bien la respuesta a los protocolos de sincronización basados en GnRH puede verse comprometida por la presencia del becerro y sus efectos negativos sobre la secreción de GnRH, por cuestiones prácticas y basados en estas evidencias, la sugerencia es no hacer el destete temporal.
El uso de eCG al final de los protocolos basados en GnRH no es tan común como en los protocolos basados en estradiol. Algunos reportes muestran, en vacas lactando tratadas con protocolos basados en GnRH con y sin uso de DIP, que la TPES es mayor en animales donde se usa eCG (400 UI) al momento de la aplicación de PGF2α que en vacas en las que no se usa eCG (Small et al., 2009; Randi et al., 2021). En contraste, en animales tratados con protocolos basados en GnRH+DIP por 7 días, más destete temporal, la TPES no es diferente en animales tratados o no con 400 UI eCG al momento del retiro del DIP (Marquezini et al., 2013b). Estos resultados sugieren que se debe realizar más estudios para validar si el uso de eCG puede mejorar la TPES en vacas lactando tratadas con protocolos basados en GnRH.
Protocolos basados en progesterona
Los protocolos basados en progesterona consisten en el uso de DIP o análogos de progesterona como el MGA por periodos prolongados para sincronizar el estro de las hembras, seguido de PGF2α y GnRH o de GnRH, PGF2α y GnRH. El DIP, se inserta en al día 1 y se retira 7, 9 o 14 días después. Esto tiene como objetivo, que los animales entren en estro y ovulen de manera sincrónica. Posteriormente cuando los animales se encuentren en la fase lútea, se aplica PGF2α para inducir la regresión del CL y que los animales entren en proestro de manera homogénea (Figura 2G). El tiempo más comúnmente usado, entre el retiro del DIP y el tratamiento con PGF2α es de 16 días, aunque esta hormona se puede aplicar a los 11 días (Eborn & Grieger, 2013). Después de la aplicación de PGF2α la IATF se puede realizar a las 66 o 72 horas. Una variación a este protocolo consiste en la aplicación de GnRH 7 días previos a la aplicación de PGF2α (Figura 2H). Es importante señalar que la GnRH se puede aplicar a los 2, 4, 9 y 12 días del retiro del DIP (Mallory et al., 2011; Eborn & Grieger, 2013).
TPES en novillas tratadas con protocolos basados en progesterona
En novillas tratadas con el protocolo P-PGF2α-GnRH la TPES más baja reportada fue de 31% (Thomas et al., 2017) y la más alta fue de 63% (Mallory et al., 2011). En el caso de novillas tratadas con la variación de este protocolo (P-GnRH-PGF2α-GnRH), el rango de TPES fue de 44 (Mallory et al., 2011) a 62% (Busch et al., 2007). De los datos de TEPS colectados de los artículos seleccionados el 45% reportan una TPES de entre 61 y 70% en novillas tratadas con el protocolo P-GnRH-PGF2α-GnRH, mientras que solo el 25% de los datos están dentro de este rango en novillas tratadas con el protocolo P-PGF2αGnRH (Figura 5A). Esto sugiere, que el protocolo P-GnRH-PGF2α-GnRH, incrementa la TPES en comparación con el protocolo P-PGF2α-GnRH. Al respecto, Eborn & Grieger (2013), usando MGA durante 7 días, muestran que la TPES es mayor cuando se usa GnRH después del retiro de la MGA (55%) que cuando no se usa (38%). De manera similar, la TPES es mayor en novillas cuando se usa GnRH después del retiro del DIP que en novillas en las que no se usa (Kasimanickam et al., 2016). Estas evidencias sugieren que el uso del protocolo P-GnRH-PGF2α-GnRH puede mejorar la TPES porque se sincroniza una nueva ola de crecimiento folicular con el uso de la primera GnRH.

Figura 5 Tasa de Preñez a Estro Sincronizado (TPES) en hembras bovinas tratadas con protocolos a base de progesterona. A) Distribución de datos de TPES en novillas en las que se aplicó o no GnRH después del retiro de progesterona. B) Distribución de datos de TPES en vacas lactando en las que se aplicó o no GnRH después del retiro de progesterona. Datos recopilados de Bader et al., 2005; Busch et al., 2007; Eborn & Grieger, 2013; Schafer et al., 2007; Mallory et al., 2011; Martin et al., 2014; Kasimanickam et al., 2016; Stegner et al., 2004; Thomas et al., 2014; Thomas et al., 2017; Ketchum et al., 2021.
Otros factores que pueden modificar la TPES en novillas tratadas con protocolos basados en progesterona son el tipo de progestágeno, la presentación del estro y el estatus puberal. En hembras tratadas con el protocolo P-GnRH-PGF2α-GnRH, no se observaron diferencias en la TPES entre el uso de progesterona o MGA (Eborn & Grieger, 2013). Mientras que, en novillas que presentan estro antes de la IATF y son tratadas con el protocolo P-PGF2α-GnRH, tienen una TPES mayor que cuando no presentaron estro (Thomas et al., 2014; Thomas et al., 2017). Respecto al estatus puberal de las novillas, no se observaron diferencias en la TPES entre novillas peri-púberes y novillas púberes sometidas a un protocolo basado en progesterona sin importar si se usó o no GnRH después del retiro de progesterona (Busch et al., 2007; Mallory et al., 2011). El uso de progestágenos en estos protocolos puede sensibilizar el hipotálamo de animales peripúberes para inducir la ciclicidad (Perry, 2016). Esto explica porque no hay diferencias en la TPES entre animales púberes y peri-púberes cuando son tratados con estos protocolos.
TPES en vacas lactando tratadas con protocolos basados en progesterona
De la información colectada de los artículos seleccionados, la TPES más baja reportada en vacas lactando tratadas con el protocolo P-GnRH-PGF2α-GnRH fue 50% (Schafer et al., 2007) y la más alta fue de 70% (Bader et al., 2005). En contraparte, las vacas tratadas con el protocolo P-PGF2α-GnRH la TPES más baja reportada fue 46% (Abel et al., 2017) y las más alta fue 76% (Abel et al., 2017). De acuerdo con los datos de TPES mostrados en la Figura 5B, el uso del protocolo P-GnRH-PGF2α-GnRH en vacas lactando parece incrementar la TPES en comparación con vacas tratadas con el protocolo P-PGF2αGnRH. Esto debido a que el uso de GnRH previo a la aplicación de PGF2α sincroniza una nueva ola de crecimiento folicular.
En vacas lactando sometidas a estos protocolos, la TPES es mayor cuando los animales presentan estro antes de la IATF que cuando no presentan estro (Thomas et al., 2014). En vacas lactando tratadas con el protocolo P-PGF2α-GnRH la TPES fue 71 y 76% cuando presentaron estro antes de la inseminación mientras que cuando no presentaron estro la TPES fue 43 y 53% (Abel et al., 2017). Con relación al estatus ovárico posparto, Schafer et al. (2007) usando el protocolo P-GnRH-PGF2α-GnRH reportaron que la TPES es similar entre vacas ciclando (59%) y vacas en anestro posparto (64%). De manera similar, en vacas tratadas con el mismo protocolo, sin importar si se usa MGA por 7 o 14 días, la TPES es similar entre vacas ciclando y vacas en anestro posparto (Bader et al., 2005). Al igual que en novillas, la presentación de estro en vacas lactando asegura la presencia de un folículo preovulatorio maduro capaz de ovular al aplicar la GnRH junto con la IA. Mientras que, los protocolos basados en progesterona al igual que los basados en GnRH pueden inducir la actividad ovárica en vacas en anestro posparto.
Conclusiones
En los protocolos de sincronización de estro y ovulación usados actualmente se manipula el desarrollo folicular con el uso de estrógenos, GnRH o progestágenos para posteriormente inducir la ovulación de un folículo preovulatorio y así realizar la IATF. Además, se debe asegurar que los animales entren a una fase folicular de manera sincrónica usando PGF2α y los DIP. Basados en la información revisada en este trabajo, los datos de TPES reportados son muy variables, sin embargo, independiente del tipo de protocolo usado, es posible obtener TPES de entre el 40 y 60%. Dependiendo del tipo de protocolo usado y el estatus fisiológico del animal, existen algunos factores que pueden ser usados para mejorar la TPES. En vacas lactando el uso de eCG incrementan la TPES cuando se incluye en protocolos basados en estradiol, mientras que en novillas y vacas lactando tratadas con protocolos basados en GnRH, la TPES se puede incrementar usando el DIP por 5 o 7 días. Finalmente, en hembras tratadas con protocolos basados en progesterona, el uso de GnRH previo a la aplicación de PGF2α mejora la TPES.











 texto en
texto en 



