INTRODUCCIÓN
Son muchos los trabajos que describen la importancia nutricional y económica de la pesca y la acuicultura a nivel mundial (Adugna et al., 2020; Chibwana et al., 2020; Okoye et al., 2014). Estas actividades producen anualmente más de 179 millones de toneladas de pescado (FAO, 2021) y uno de los más producidos, es el pez denominado "tilapia", término que se utiliza para referirse a los peces cíclidos de los géneros, Oreochromis, Sarotherodon y Tilapia. En México, durante los últimos 10 años, se ha reportado un incremento en la producción de tilapia, con un crecimiento promedio anual de 3.1% (Huerta-Mata & Valenzuela-Oyadener, 2019; SIAP, 2022). Debido a la expansión de la pesca y la acuicultura, los requisitos de las estrategias de seguridad alimentaria son obligatorios, v. gr., la presencia de microorganismos patógenos potenciales, como los parásitos, compromete la seguridad de los productos pesqueros (Ananda-Raja & Jithendran, 2015; Williams et al., 2020a).
Entre los helmintos, los más estudiados por su transmisión zoonótica a partir de la carne de pescado son los trematodos, coloquialmente denominados "gusanos", de las familias Heterophyidae (trematodos intestinales), Echinostomatidae (trematodos intestinales) y Opisthorchiidae (trematodos hepáticos), que están representados por las especies Clonorchis sinensis, Opisthorchis viverrini, O. felineus, Metagonimus yokogawai y Heterophyes spp. (Lima dos Santos & Howgate, 2011; Wiriya et al., 2013). También se estudian las tenias Diphyllobothrium latum y D. pacifica, así como los nematodos Capillaria philippinensis, Gnathostoma hispidum, G. spinigerum, G. doloresi, G. nipponicum, Pseudoterranova decipiens, Contracaecum osculatum y Anisakis simplex. Como ejemplo de importancia médica y económica, en Japón se producen anualmente más de 1.000 casos clínicos de anisakidosis transmitidos por la ingesta de más de 100 especies de peces que se comen sin cocinar (Bao et al., 2019). La gnatostomosis es otra enfermedad helmíntica notificada con frecuencia en turistas (Bravo and Gontijo, 2018). Aunque se habían registrado más de 1.000 casos de gnatostomosis en México entre 1970 y 1999 (Lamothe-Argumedo, 1999), no hay suficientes estudios sistemáticos de prevalencia y distribución de helmintos con potencial zoonótico que parasitaron peces de importancia económica (Carrique-Mas & Bryant, 2013; Pritt, 2015).Sin embargo, se sabe que en Asia, 18 millones de personas están infectadas por trematodos (Mahmoud et al., 2016; Wiriya et al., 2013) y en el mundo hay 500 millones de personas en riesgo de infección (Chi et al., 2008). De esta manera, considerando la importancia de los helmintos y el nivel comercial de la tilapia (Gulelat et al., 2013; Mahmoud et al., 2016; Soler Jiménez et al., 2016; Watterson et al., 2012); el objetivo de este trabajo fue realizar una revisión bibliográfica sobre la prevalencia y distribución de helmintos trematodos que pueden ser transmitidos como zoonosis durante la cadena productiva de la tilapia.
MATERIALES Y MÉTODOS
Investigación bibliográfica
La revisión se realizó con motores de búsqueda basados en el uso de las palabras clave: zoonotic parasite, trematode, foodborne parasites, Oreochromis y tilapia. Las variantes que hacen referencia a la enfermedad parasitaria zoonótica fueron centrocestiosis (Centrocestus), clonorquiosis (Clonorchis), opistorquiosis (Opisthorchis), heterofiosis (Heterophyes) y haplorquiosis (Haplorchis). Teniendo en cuenta estas palabras, la inclusión en su conjunto, se estructuró como se muestra, "(Centrocestus o centrocestiosis) y (Oreochromis o tilapia)" para cada organismo / enfermedad parasitaria. Se utilizaron seis buscadores bibliográficos especializados (ScienceDirect, PubMed, Primo, CONRICyT, LILAES y AJOL), obteniéndose un total de 1.044 resultados de búsqueda a los que se aplicaron criterios de exclusión, eliminando enfermedades parasitarias zoonóticas en otros taxones de parásitos y de peces que no estaban dentro del ámbito de esta revisión. Se eliminaron las réplicas y se definieron como estudios aquellos que incluían datos epidemiológicos básicos, prevalencia y distribución. La depuración delimitó 80 fuentes bibliográficas para el análisis cualitativo y 33 fuentes bibliográficas referidas a prevalencia que formaban parte de la información analizada en esta revisión, por lo que se analizaron un total de 113 trabajos. Posteriormente, la información se plasmó en tablas para la presentación de los datos en mapa de distribución geográfica, utilizando el programa informático de libre acceso RSstudio (Boston, MA, USES).
RESULTADOS Y DISCUSIÓN
Ciclo de vida general de los Trematodos
Los trematodos son helmintos taxonómicamente ubicados dentro del grupo de los platelmintos. En general, los platelmintos reúnen tres características: son acelomados, protostomados y triblásticos (Negrete & Damborenea, 2017). Los trematodos incluyen una serie de especies parásitas de animales que llegan accidentalmente al ser humano. La mayoría de los trematodos tienen ciclos de vida complejos que implican múltiples hospederos (Fang et al., 2018). El ciclo de vida general de los trematodos comienza con el gusano adulto monoico que se establece en las vísceras del sistema digestivo de un vertebrado. Los gusanos adultos ponen huevos que utilizan las heces del hospedero como vehículo de dispersión. Los huevos se dispersan en el agua y de ahí emerge la primera larva, que se llama miracidium y es móvil. El estadío miracidium busca el primer hospedaero intermediario (molusco gasterópodo), en hospedero se desarrolla en un esporoquiste y éste, a su vez, en redias que se reproducen asexualmente, finalmente el molusco expulsa el estadío de cercarias. Las cercarias nadan y se dispersan en el medio acuático hasta que encuentran el segundo hospedero intermediario, que puede ser un pez (Lima dos Santos & Howgate, 2011; Zhao-Rong et al., 2005). En el músculo esquelético del segundo hospedero intermediario, las cercarias se convierten en metacercarias, las cuales están rodeadas por una pared de quitina que les permite resistir cambios climáticos o simplemente el paso por el tracto digestivo del hospedero definitivo que de forma natural es un animal vertebrado con hábitos ictiófagos (Mutengu et al., 2018). En el hospedero definitivo, las metacercarias se liberan de la cápsula y se establecen en algunas de las vísceras del aparato digestivo, para convertirse en gusano adulto (Galaktionov & Dobrovolskij 2003; Burton et al., 2019). Las zoonosis de transmisión alimentaria son infecciones que afectan al ser humano y que se adquieren a través de la ingestión de alimentos de origen animal vertebrado (Carrique-Mas & Bryant, 2013). Este tipo de alimentos pueden transmitir la infección al ser humano porque proceden de animales que forman parte del ciclo vital de los parásitos; por ejemplo, de la carne cruda de pescado. En concreto, las trematodosis de los peces tienen ciclos vitales con múltiples hospederos (Fang et al., 2018), incluido un único hospedero definitivo para la fase adulta del gusano y uno o más hospederos intermedios, que albergan las diferentes fases de desarrollo del parásito (Chibwana et al., 2020; Hung et al., 2015). Los moluscos gasterópodos son hospederos intermediarios primarios (Chi et al., 2008), mientras que los peces son hospederos intermediarios secundarios y tienen un papel trascendental en la transmisión del parásito a través de la cadena trófica (Koinari et al., 2013).
Cercarias en el entorno de la tilapia
Dada la importancia de los moluscos gasterópodos en el ciclo biológico de los trematodos, se recomienda eliminar los caracoles de los estanques destinados a la producción de tilapia (Kang et al., 2013). En la acuicultura y la pesca de se han identificado algunas especies de gasterópodos como hospederos primarios de trematodos. La Tabla 1 muestra la prevalencia de cercaria encontrada en varios moluscos involucrados en la cadena de producción de tilapia. Los principales datos proceden de Asia. Por ejemplo, en Vietnam, donde convergen estanques y parcelas de arroz, se han descrito al menos 15 o más especies de gasterópodos, como Melanoides tuberculata, Bithynia fuchsiana y Stenothyra messageri, con una prevalencia de infección por cercarias de 8.9%, 6.4% y 1.5%, respectivamente (Madsen et al., 2015). El trematodo Haplorchis pumilio se ha aislado en estanques de peces con presencia de cinco especies de gasterópodos, una de las cuales pertenece a la familia Viviparidae (Angulyagra polyzonata) y las otras cuatro a la familia Thiaridae: Melanoides tuberculata, Thiara scabra, Tarebia granifera y Sermyla requetii (Van Phan et al., 2010). Se han registrado cercarias del género Procerovum en los gasterópodos Melanoides tuberculata (0,92%) y Bithynia fuchsiana (0,11%). Opisthorchis viverrini puede encontrarse en los gasterópodos Bithynia siamensis goniomphalos (0,86%) y B. funiculata (0,14%) (Dao et al., 2017; Hung et al., 2015). Se han registrado cercarias de Clonorchis sinensis en las familias Hydrobiidae, Bithyniidae, Melaniidae, Assimineidae y Thiaridae (Zhao-Rong et al., 2005), en particular en las especies Alocinma longicornis (27%), Bithynia fuchsianus (8%) y Parafossarulus striatulus (8%) (Petney et al., 2013; Zhao-Rong et al., 2005). Las cercarias de las familias Heterophyidae y Echinostomatidae se establecen en los moluscos Pomacea canaliculata, Bellamya aeruginosa y Cipangopaludina Oncomelania (Kang et al., 2013). Heterophyes heterophyes cercariae está relacionada con cuatro familias de gasterópodos como hospederos primarios (Potamididae, Melaniidae, Pleuroceridae y Littorinidae), aunque la especie más recurrente es Pirenella conica (Chai, 2014; Chai & Jung, 2017). Del mismo modo, se han notificado cargas de Clinostomun complanatum en Radix swinhoei como hospedero primario, con una prevalencia de 0,62 (Wang et al., 2017a). En América, se han encontrado informes de cercarias en Costa Rica, donde los gasterópodos Melanoides turricula, Pomacea flagellata, Haitia cubensis y el bivalvo Anodontiles luteola se han registrado como hospederos intermediarios de Centrocestus formosanus (Cortés et al., 2010).
Tabla 1 Prevalencia de cercaria asociada a la cadena de producción y captura de tilapia para consumo
| Cercaria | Hospedero intermediario primario | Distribución por continentes | Prevalencia de las cercaria | Hospedero intermediario secundario | Referencias |
| Opisthorchis viverrini | Bithynia siamensis goniomphalos Bithynia funiculata | Asia (Vietnam) | 0.14 0.86 | Oreochromis niloticus | (Dao et al., 2017) |
| Clonorchis sinensis | Parafossarulus striatulus Alocinma Longicornis Bithynia fuchsianus | Asia (China) | 3-8 27 8 | Tilapia mossambica Oreochromis Mossambicus Oreochromis mossambicus | (Zhao-Rong et al., 2005) (Petney et al., 2013) |
| Haplorchis sp., Procerovum varium e Indefinidos | Bithynia fuchsiana y Melanoides tuberculata | Asia (Vietnam) | 0.11-0.92 | Oreochromis niloticus | (Hung et al., 2015) |
| Haplorchis pumilio | Melanoides tuberculata, Bithynia fuchsiana y Stenothyra messageri | Asia (Vietnam) | 1.5-8.9 | Oreochromis niloticus | (Madsen et al., 2015) |
| Clinostomum complanatum | Radix swinhoei | Asia (China) | 0.62 | Tilapia zillii | (Wang et al., 2017a) |
El estudio de los moluscos gasterópodos es importante, ya que este organismo es extremadamente resistente a los factores abióticos, como Pirenella conica, que es resistente a la salinidad entre 15 y 80 ppm (Chai, 2014; Chai & Jung, 2017; Hung et al., 2013). Uno de los hospederos primarios más recurrentes es el molusco gasterópodo Melanoides tuberculata (Cortés et al., 2010; Hung et al., 2013; Petney et al., 2013; Pinto et al., 2014; Zhao-Rong et al., 2005), que es resistente a la desecación, a los bajos niveles de oxígeno y a la salinidad extrema, además, resiste una temperatura inferior a 18 °C (Fleming et al., 2011). En los estanques de cultivo, la vegetación circundante y los ambientes oligotróficos favorecen el establecimiento de diferentes poblaciones de gasterópodos (Chi et al., 2008; Cortés et al., 2010). Debido a estas características, el manejo sanitario de los moluscos gasterópodos requiere especial atención.
Estadío de metacercaria aislado en tilapia de pesca
Se ha reportado que la tilapia es transmisora de trematodos zoonóticos, convirtiéndose en un problema de salud pública y, en algunos casos, arruinando la percepción comercial de la acuicultura (Adugna et al., 2020; Chibwana et al., 2020). La Tabla 2 muestra la prevalencia de metacercarias en diferentes especies de tilapia; la tabla también muestra que las cercarias no tienen predilección por la región anatómica del pez. Los reportes analizados incluyen diferentes especies de trematodos, tales como, Heterophyes heterophyes metacercariae que es parásito de Tilapia simonis, T. nilotica y T. zillii (Chai, 2014; Chai & Jung, 2017). En cuerpos de agua naturales, se han recolectado metacercarias de Opisthorchis felineus, O. viverrini y Clonorchis sinensis en Oreochromis y Tilapia (Petney et al., 2013; Wang et al., 2018; Williams et al., 2020a; Zhao-Rong et al., 2005), mientras que se han recuperado metacercarias de Centrocestus formosanus en Oreochromis niloticus producidas en un lago artificial recreativo en Belo Horizonte, Brasil (Pinto et al., 2014). La prevalencia de metacercarias de Opisthorchis viverrini en crías de tilapia Oreochromis niloticus de un lago de la provincia de Binh Dinh, Vietnam, fue del 18,8% (Dao et al., 2017), mientras que en una presa de Zimbawe, la prevalencia de metacercarias de Clinostomum fue del 62,8% en Oreochromis mossambicus (Mutengu et al., 2018). En otro contexto, en el lago Agulu, Nigeria, la prevalencia de metacercarias Clinostomum tilapiae en Tilapia zillii fue del 1,54% (Okoye et al., 2014).
Metacercarias e infecciones parasitarias concomitantes en peces de la especie tilapia
Las coinfecciones en tilapia por diferentes grupos taxonómicos es un evento común. El estudio de las infecciones concomitantes es pertinente debido al riesgo de morbilidad y mortalidad en la producción de peces con fines comerciales y de consumo. Se han documentado infecciones concomitantes entre dos agentes etiológicos de diferentes grupos taxonómicos o múltiples agentes etiológicos del mismo grupo taxonómico. En el primer caso, podemos citar como ejemplo la infección entre los protozoos ciliados Trichodina heterodentata o Ichthyophthirius multifiliis con la bacteria Streptococcus iniae (Abdel-Latif et al., 2020). Con respecto a los helmintos, la coinfección entre el nematodo Contracaecum multipapillatum (51,8% de prevalencia) y el trematodo Heterophyes sp. (19,6% de prevalencia) en Tilapia zillii u Oreochromis leucostictus se documentó en el lago Neivasha en Kenia (Otachi et al., 2014). Además, se encontró infección concomitante entre larvas del nematodo Contracaecum sp. (5,48%) y metacecarias de Clinostomum sp. (27,39%) en el mesenterio, el área pericárdica y la cavidad branquial de Oreochromis niloticus residentes de la reserva de agua de Koka en Etiopía (Gulelat et al., 2013). En el caso del multiparasitismo, se pueden citar como ejemplo los hallazgos reportados en Tilapia nilotica y Tilapia zillii del lago Manzala (agua salobre) y del río Nilo (agua dulce). En el primer caso, la frecuencia de infección fue del 64,9%, mientras que en el segundo fue del 17,6% y las metacercarias recogidas pertenecían a los géneros Heterophyes heterophyes, H. aequalis, Pygidiopsis genata, Haplorchis yokogawai, H. pumilio, Phagicola ascolonga y Stictodora tridactyla (Elsheikha & Elshazly, 2008b; Hegazi & Abo-elkheir, 2014). Estos datos sugieren que la tilapia es un organismo que tolera el multiparasitismo. Asimismo, algunos parásitos como Clinostomum sp., mostraron una mayor prevalencia en la infección concomitante que cuando se recuperan individualmente, esto puede deberse a que algunos microorganismos surgen como infecciones oportunistas en organismos que tienen infecciones primarias (Fajer-Ávila et al., 2017).
Tabla 2 Informes de metacercarias en tilapia. Distribución geográfica y anatómica de los parásitos, sólo se incluyen los informes que tienen prevalencia
| Tilapia | Cercaria | Distribuciónn | Prevalencia de metacercarias | Distribución anatómica | Referencia |
| Oreochromis niloticus | Centrocestus formosanus Haplorchis pumilo | Vietnam, China | 11.8%-12.5% | ca, mu, pi, al, br, es | (Chi et al., 2008) |
| Oreochromis niloticus | Opisthorchis viverrini | Tailandia, Cambodia, Laos, Vietnam | 18.8% | - | (Dao et al., 2017) |
| Oreochromis niloticus, T. zillii | Heterophyes heterophyes, H. aequalis, | Egipto | 16.4%-17.6% | mu | (Elsheikha & Elshazly, 2008a) |
| Pygidiopsis genata, Phagicola sp., Haplorchis sp., Stictodora sp. | |||||
| Oreochromis niloticus | Heterophyidae Echinostomatidae | China | 1.5% | ca, br, mu, al, pi, es | (Kang et al., 2013) |
| Oreochromis niloticus, T. zillii | Heterophyes heterophyes, H. aequalis, Pygidiopsis genata, Ascocotyle (Phagicola) ascolonga, Haplorchis yokogawi | Egipto | 30% -33.3% | mu, ca | (Lobna et al., 2010) |
| Oreochromis niloticus | Centrocestus sp. | Egipto | 10% | br | (Mahmoud et al., 2016) |
| Oreochromis niloticus | Centrocestus formosanus | Brasil, Egipto, Vietnam, Arabia Saudita | 31.1% | br | (Pinto et al., 2014) |
| Oreochromis niloticus | Clonorchis sinensis, Haplorchis pumilio, H. taichui, Centrocestus formasanus | Vietnam, Corea, China, Tailandia | 2%-10% | - | (Van De et al., 2012) |
| Oreochromis niloticus, Oreochromis niloticus | Stellantchasmus falcatus, Haplorchis pumilio, Procerovum varium | Tailandia, Lao, Cambodia, Vietnam | 2%-50% | al | (Wiriya et al., 2013) |
| Oreochromis niloticus | Centrocestus formosanus | Costa Rica | 1026(total recuperado) | br, al y te | (Cortés et al., 2010) |
| Oreochromis niloticus T. zillii | Heterophyes sp., Pygidiopsis genata, Haplorchis pumilio, Phagicola sp., | Egipto Palestina, Hawai, Ucrania | 42.6% 64.9% | - | (Hegazi & Abo- elkheir, 2014) |
| Stictodora tridactyla | Canadá, Alaska | ||||
| Oreochromis niloticus, O. mossambicus | Haplorchis taichui | Laos, Tailandia, Cambodia, Vietnam | 0% | - | (Kopolrat & Sithithaworn, 2015) |
| Tilapia sp. | Clonorchis sinensis | China | 0% | mu | (Wang et al., 2017b) |
| Oreochromis niloticus | Heterophyes sp. | Kenia | 6%-8% | - | (Ojwala et al., 2018) |
| Oreochromis sp. | Haplorchis pumilio | Vietnam, China | 3%-15.6% | mu, hu, pi, ca, cau | (Chi et al., 2009) |
| Oreochromis aureus | Centrocestus formosanus | Estados Unidos | 0% | - | (Fleming et al., 2011) |
| Oreochromis niloticus | Haplorchis sp., Procerovum varium | Vietnam | 2.19%-23% | - | (Hung et al., 2015) |
| Oreochromis niloticus | Haplorchis pumilio | Vietnam | 32% | - | (Madsen et al., 2015) |
| Oreochromis mossambicus | Clinostomum sp. | Zimbawe | 62.80% | cb, pi, oj | (Mutengu et al., 2018) |
| Oreochromis leucostictus Tilapia zillii | Heterophyes sp. | Kenia | 19.6-51.8% | cp, br | (Otachi et al., 2014) |
| Oreochromis niloticus | Haplochis taichui | Vietnam | 24% | - | (Van Phan et al., 2010) |
| Oreochromis niloticus | Clinostomum sp. | Etiopía | 32.4%-58.8% | cbr, cp | (Adugna et al., 2020) |
| Tilapia guinensis | Clinostomum complanatum | Nigeria,Corea, Japón | 39.99% | cb, cbr, hu, oj, mu, cp, cab, mes, vis, vn | (Echi et al., 2009b) |
| Sarotherodon melanotheron | Clinostomum complanatum | Nigeria, Corea, Japón, Ghana | 20.80% | cb, pi, oj | (Echi et al., 2009a) |
| Oreochromis niloticus | Clinostomum sp. | Etiopía | 5.48-27.39% | mes, cp, cbr | (Gulelat et al., 2013) |
| Oreochromis niloticus | Clinostomum sp. | Benin | 6.17% | Pi, br, in, cb | (Sèdogbo et al., 2019) |
| Tilapia zillii | Clinostomum sp. | Nigeria | 1.54% | cab | (Okoye et al., 2014) |
| Oreochromis niloticus | Clinostomum sp. | Uganda | 22% | pi, es | (Walakira et al., 2014) |
Abreviaturas: ca (cabeza), mu (músculo), pi (piel), al (aletas), br (branquias), es (escamas), est (estómago), in (intestinos), te (tegumento), hi (hígado), ri (riñón), hu (hueso), cau (región caudal), cb (cavidad oral), oj (ojos), cbr (cavidad branquial) cp (cavidad pericárdica), cab (cavidad abdominal), mes (mesenterio), vis (vísceras) y vn (vejiga natatoria)
Metacercarias en granjas de tilapia
Los estudios de prevalencia en piscifactorías son de especial interés para determinar la prevalencia y distribución de agentes infecciosos que pudieran representar un riesgo para causar enfermedades en humanos o animales domésticos. La mayoría de los artículos analizados mostraban datos sobre Oreochromis tilapia procedentes de países asiáticos. En Vietnam, se encontró un 32% de prevalencia de metacercarias de Haplorchis pumilio en adultos y crías (Chi et al., 2008; Madsen et al., 2015) y un 24% de prevalencia para H. taichui durante los meses de diciembre y enero (Van Phan et al., 2010). Se encontraron metacercarias del género Clinostomun en la piel, branquias, intestino y cavidad oral de tilapias de África, particularmente en la República de Benín (6,17%), Uganda (22%) y Etiopía (32,4%), donde Clinostomiun se encontró de forma concomitante (58,8%) con larvas del nematodo Contracaecum sp. (Adugna et al., 2020; Cortés et al., 2010; Sèdogbo et al., 2019; Walakira et al., 2014). La presencia de metacercarias de Centrocestus formosanus se ha documentado en peces jóvenes (alevines) con un recuento de 1.026 larvas en Costa Rica (Cortés et al., 2010) y en Vietnam con una prevalencia del 11,8%, donde C. formosanus también se presentó en coinfección con Haplorchis pumilio (Chi et al., 2008). Se han encontrado otras metacercarias, de las familias Heterophyidae y Echinostomatidae, con una prevalencia del 1,5% en estanques de monocultivo y policultivo en Guangdong, China (Kang et al., 2013).
Estudios comparativos entre sistemas de pesca y acuicultura
Existen estudios en el campo de la parasitología para tratar de definir el comportamiento de la parasitosis en poblaciones de vida libre y en poblaciones hacinadas. Sin embargo, llama la atención que sólo se hayan encontrado algunos estudios en Vietnam y Tailandia que aborden esta comparación. En estos trabajos, las tilapias Oreochromis niloticus se encontraban en cautividad en granjas o estanques de acuicultura y los datos obtenidos se compararon con los peces de vida libre. En tres estudios (Vietnam), se observó que los peces presentaban infecciones únicas por Haplorchis pumilio o infecciones concomitantes por Procerovum varium o Centrocestus formosanus. La prevalencia de la infección en animales de vida libre fue del 14,3%, mientras que en las granjas fue del 52,8%, la prevalencia encontrada en la granja fue siempre mayor (Hung et al., 2015). Por el contrario, en un estudio en Tailandia, se registraron tres especies de metacercarias (Stellantchasmus falcatus, Haplorchis pumilio y Procerovum varium) en tilapias de vida libre, mientras que no se encontraron trematodos en peces recogidos en jaulas y estanques (Wiriya et al., 2013). La alta prevalencia en poblaciones acuícolas puede deberse a la elevada densidad de población que se maneja en algunos sistemas.
Hospederos definitivos de trematodos transmitidos por tilapia
La presencia de hospederos definitivos que viven alrededor de los cuerpos de agua son indicadores de que el ciclo de vida de los trematodos puede completarse y perpetuarse en el ambiente (Horak et al., 2019). En el ciclo de vida de los trematodos, donde las tilapias intervienen como hospedero intermediario secundario, se han identificado numerosas especies de aves piscívoras como hospedero definitivo. Por ejemplo, el ave aninga africana (Anhinga rufa) es el hospedero definitivo de Clinostomum (Mutengu et al., 2018). Otro tipo de hospederos son los denominados accidentales. Los reportes de prevalencia de trematodos asociados a tilapia en hospederos accidentales es inusual; mayormente, el hallazgo de gusanos adultos en hospederos inusuales es fortuito.
Tabla 3 Prevalencia de trematodos zoonóticos en hospederos accidentales asociados a la producción y captura de tilapia
| Trematodo | Hospedero intermediario secundario | Hospedero | Prevalencia de parásitos en adultos | Distribución | Referencia |
| Heterophyes heterophyes | Tilapia nilótica, Tilapia zillii | Chacal, Zorro, Perro | 14.2%, 33.3%, 2.5% | Corea | (Chai, 2014) |
| Clonorchis sinensis | Oreochromis sp. Tilapia | Camarón | 3% | Australia | (Wang et al., 2018) |
| Heterophyes heterophyes, H. aequalis, Pygidiopsis genata, Haplorchis yokogawai Phagicola ascolonga | Tilapia nilotica, T. zillii | Perro | 19.4%, 15.4%, 18%, 12% y 11.4% (Respectivamente para los parásitos señalados) | Egipto | (Elsheikha & Elshazly, 2008b) |
| Haplorchis sp., Procerovum varium | Oreochromis niloticus | Perro, Gato Cerdo | 32.7%, 49%, 13% | Vietnam | (Hung et al., 2015) |
| Haplochis taichui | Oreochromis niloticus | Gato Perro | 70.2% y 56.9% | Vietnam | (Van Phan et al., 2010) |
La Tabla 3 muestra los reportes de prevalencia de trematodos zoonóticos en hospederos accidentales asociados con la producción y captura de tilapia. Los animales vertebrados silvestres, así como los animales domésticos que ocasionalmente incluyen tilapia en su dieta, pueden convertirse accidentalmente en hospederos definitivos al consumir metacercarias que pueden encontrarse en la tilapia (Chai, 2014; Elsheikha & Elshazly, 2008b; Wang et al., 2017b). En general, se ha observado que el cerdo (Sus scrofa) puede ser hospedero definitivo de Haplorchis taichui y Procerovum varium (Hung et al., 2015; Van Phan et al., 2010). Uno de los animales domésticos más estudiados es el perro (Canis familiaris), quizás debido a su cercanía social con los humanos. Los cachorros de perro pueden actuar como hospederos de Heterophyes heterophyes, H. aequalis, Pygidiopsis genata, Haplorchis sp., Phagicola sp., Stictodora sp., Ascocotyle (Phagicola) ascolonga y Haplorchis yokogawai (Elsheikha & Elshazly, 2008a; Hung et al., 2015; Lobna et al., 2010; Van Phan et al., 2010). La identificación de los hospederos finales en la transmisión de parásitos zoonóticos es una herramienta útil para el control exhaustivo de las cargas parasitarias.
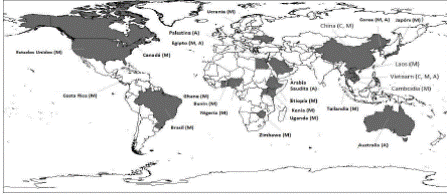
Distribución geográfica de los trematodos transmitidos por la tilapia
En la figura 1 se muestra la distribución mundial de trematodos transmitidos por el consumo de carne de tilapia. Sin duda, en el continente asiático se han realizado varios estudios para determinar la prevalencia y distribución de trematodos con potencial zoonótico, quizá motivados porque el consumo de carne de pescado cruda es habitual. En Vietnam, China, Tailandia, Laos, Filipinas e India se han descrito los géneros Centrocestus, Clonorchis, Echinostoma, Haplorchis, Heterophyes, Opisthorchis, Phagicola, Procerovum, Pyigidiopsis, Stellantchasmus y Stictodora (Chi et al., 2008; Dao et al., 2017; Hegazi & Abo-elkheir, 2014; Hung et al., 2015; Kang et al., 2013; Van De et al., 2012; Wang et al., 2017b; Wiriya et al., 2013). En el continente africano, habitualmente caracterizado por su abundante biodiversidad, se han registrado en Egipto los trematodos Ascocotyle (Phagicola) ascolonga, Haplorchis pumilio, H. yokogawai, Heterophyes aequalis, H. heterophyes, Pygidiopsis genata y Stictodora tridactyla (Elsheikha & Elshazly, 2008b, 2008a; Hegazi & Abo-elkheir, 2014; Lobna et al., 2010); mientras que, en Nigeria, Kenia, Zimbabue, Etiopía, Benín y Uganda, se ha documentado la presencia de los géneros Clinostomum (Adugna et al., 2020; Echi et al., 2009a; Mutengu et al., 2018; Okoye et al., 2014; Sèdogbo et al., 2019; Walakira et al., 2014), Centrocestus (Mahmoud et al., 2016) y Heterophyes (Ojwala et al., 2018; Otachi et al., 2015). En el continente europeo, Clonorchis sinensis, Heterophyes dispar y H. heterophyes se distribuyen en Grecia, Italia, Turquía, Francia, España, Rusia y Ucrania (Chai, 2014; Chai & Jung, 2017; Hegazi & Abo-elkheir, 2014; Hung et al., 2013; Wang et al., 2018). En el continente americano, los estudios epidemiológicos de trematodos en peces son aún insuficientes y, se documenta la ocurrencia de parásitos zoonóticos en alimentos gastronómicos de origen asiático (Castellanos-Garzón et al., 2019; Leroy et al., 2017); por lo que, es importante la necesidad de realizar estudios de inocuidad de la carne de pescado utilizada como fuente de alimento (Gutiérrez-Jiménez et al., 2019). Existen reportes de Centrocestus formosanus en Brasil, Costa Rica y Estados Unidos (Cortés et al., 2010; Fleming et al., 2011; Pinto et al., 2018). En México, los estudios de parásitos recuperados de peces se centran en la región suroeste del país. En los estados de Veracruz, Oaxaca y Puebla se han descrito 39 familias de helmintos que pueden infectar a 35 especies de peces. El Centrocestus formosanus puede desarrollarse en 16 especies de peces, entre ellas los cíclidos Astatherops robertsoni, Cichlasoma fenestratuma, Cichlasoma urophthalmus y Vieja synspila. En Chiapas se han identificado 72 especies de helmintos en 54 especies de peces de agua dulce, 10 de los cuales son cíclidos, y entre ellos se identificó el trematodo Clinostomum complanatum en peces del género Vieja (Salgado- Maldonado et al., 2005, 2011).
Influencia de las actividades socioeconómicas en la distribución de trematodos
La distribución de los parásitos zoonóticos que infectan a la tilapia (figura 1), depende de múltiples factores que pueden influir en su dispersión. Esto es relevante porque la pesca y la acuicultura de tilapia tienen lugar en más de 100 países de todo el mundo. Los principales países productores de tilapia son China, con 1,8 millones de toneladas anuales, Indonesia, con 1,1 millones de toneladas, y Egipto, con 875 millones de toneladas (Abdel-Latif et al., 2020). Sin embargo, la prevalencia y biodiversidad de trematodos trematodos están asociadas con las áreas geográficas donde convergen hospederos intermediarios y definitivos en la misma cadena trófica. Las actividades socioeconómicas, como el policultivo, los mercados húmedos, la venta no regulada de crías de peces (Tesana et al., 2014), el consumo de alimentos crudos, el turismo y el flujo migratorio (Chai & Jung, 2017), entre otras, favorecen la aparición y dispersión de parásitos zoonóticos (Carrique-Mas & Bryant, 2013). Un ejemplo de la influencia del hombre en la dispersión parasitaria está asociado a la importación/exportación de animales con fines zootécnicos.
Patología de trematodos en la acuicultura de tilapia
Los parásitos, como su definición indica, desarrollan problemas patológicos en el hospedero y, los peces no son una excepción a la regla. El curso de las patologías causadas por parásitos puede culminar en pérdidas económicas para el productor (Gulelat et al., 2013) y, los casos de clínica grave ponen en riesgo la seguridad alimentaria de algunas zonas con alto consumo de pescado. Los peces que presentan parasitosis son más propensos a presentar patologías secundarias debidas a virus, bacterias u hongos (Mutengu et al., 2018). Las tilapias no están exentas de presentar un cuadro clínico ante la presencia de larvas de trematodos (Echi et al., 2009b), que pueden ser causa de déficit en el crecimiento de los peces, culminando en cierta morbilidad e incluso mortalidad (Adugna et al., 2020; Fang et al., 2018). Por ejemplo, las metacercarias de Centrocestus formosanus provocan alteraciones en la natación (curvada, errática o en espiral) de las tilapias (Cortés et al., 2010), además de edema, hemorragia, pérdida de epitelio respiratorio, fusión de laminillas primarias, destrucción de laminillas secundarias y alteraciones y distorsión por hiperplasia del cartílago branquial (Fleming et al., 2011; Mahmoud et al., 2016), provocando una disminución de la capacidad respiratoria y la muerte. La infección de metacercarias de Clinostomum complanatum en Tilapia guinensis, desencadena hemorragias y daños en la piel debido a la penetración de las cercarias, diferentes grados de daño en los ojos, desde exoftalmia, células necróticas y ulceración de las membranas de revestimiento hasta ceguera (Echi et al., 2009b).
Diagnóstico de las metacercarias en los peces
El tiempo que una metacercaria puede estar en hipobiosis en el músculo de los peces es variable. Las metacercarias de Haplorchis pumilio son viables durante nueve semanas en Sarotherodon spilurus, pero las de Clinostomun complanatum pueden estar presentes durante toda la vida de Tilapia guinensis, que es de 2 a 3 años (Boerlage et al., 2013; Echi et al., 2009b). Debido a esta variabilidad, el diagnóstico en hospederos de peces es una tarea difícil. Además, las herramientas de diagnóstico en organismos acuáticos se aplican con más frecuencia en piscifactorías que en peces de vida silvestre. Las herramientas se pueden clasificar en macroscópicas, microscópicas, histológicas, microbiológicas, inmunológicas y moleculares, que permiten el seguimiento desde el diagnóstico presuntivo hasta el aislamiento e identificación del agente etiológico (Sitjà- Bobadilla & Oidtmann, 2017). En cuanto al diagnóstico parasitológico, son comunes las biopsias branquiales, la citología cutánea, el examen fecal y los estudios post-mortem dentro de las 6 a 8 horas posteriores a la muerte. Para la recuperación de endoparásitos, se examinan el hígado, el bazo y el tubo digestivo, entre otros (Mjakakhamis & Sagweorina, 2017. La recuperación y conservación de los parásitos requiere su depósito en solución de etanol al 70% para su identificación taxonómica, generalmente a través de características morfológicas (Elsheikha & Elshazly, 2008b, 2008a; Sepulveda & Kinsella, 2013). La recuperación de las metacercarias incluye la observación de la carne entre dos placas de vidrio a contraluz, utilizando una fuente de luz de 100 vatios. El aislamiento se logra a partir de una digestión artificial con pepsina, el material resultante se filtra y se lava con solución salina fisiológica al 0,85% (Diaz Camacho et al., 2002). Por otro lado, es bien conocido que el uso del diagnóstico molecular es fundamental para la confirmación de los casos y la identificación de los agentes etiológicos. Sin embargo, aún son insuficientes los estudios de diagnóstico en tilapia que han utilizado metodología molecular, como la reacción en cadena de la polimerasa en la identificación de trematodos zoonóticos. Por ejemplo, en Tailandia se identificaron tres trematodos, Stellantchasmus falcatus, Haplorchis pumilio y Procerovum varium, en tilapia del Nilo a partir de la amplificación del gen 28S rDNA y el uso de los cebadores LSU-5, 1500R y 900F (Wiriya et al., 2013).
Patología en humanos
Los cambios antropocéntricos, como la urbanización de los espacios naturales, la intensificación de la producción de alimentos y la modernización del mercado aumentan el riesgo de exposición humana a patógenos inusuales (Carrique-Mas & Bryant, 2013; Chi et al., 2009; Pinheiro et al., 2019; Wang et al., 2017b). Incluso el cambio o el descuido de los hábitos alimentarios humanos puede ser un riesgo en la transmisión de enfermedades zoonóticas. El consumo de carne de tilapia cruda o poco cocida puede ser la fuente de infección de larvas de helmintos (Wang et al., 2017b), (Wang et al., 2017b), cuando el ser humano consume metacercarias, estas larvas se desarrollarán en gusanos adultos y, en última instancia, los adultos serán el origen de la patología en el ser humano. Las manifestaciones de la enfermedad pueden ir de subclínicas a polisintomáticas con diferentes grados de gravedad, dependiendo de algunos factores como la carga parasitaria, el estado inmunitario y las exposiciones previas al agente etiológico (Chai, 2014). En general, la infección por gusanos adultos de Clonorchis sinensis, Opisthorchis verrini y O. felineus se asocia a eosinofilia periférica con ictericia intermitente y leucocitosis en el 40% de los casos clínicos (Zhao-Rong et al., 2005). En la infección temprana se observa una colangitis supurativa extendida al parénquima del tejido hepático, que causa hepatitis con formación de micro y macroabscesos, mientras que en la infección crónica puede haber colangiocarcinoma. Los adultos de O. viverrini se asocian con hiperplasia adenomatosa del epitelio biliar y engrosamiento de las paredes con tejido conectivo fibroso, hipertrofia y dilatación de los conductos biliares (Hung et al., 2013). La parasitosis por Clonorchis sinensis se caracteriza por hiperplasia y metaplasia del epitelio biliar intrahepático, seguido de fibrosis periductal (Dao et al., 2017; Hung et al., 2015; Wang et al., 2018). Los adultos de Clinostomum dañan la faringe, en la región aritenoidea, pared orofaríngea y banda linfática lateral, causando molestias en la garganta, dolor al ingerir alimentos, flema sanguinolenta y fiebre ((Acosta et al., 2016), llegando a diagnosticarse como faringitis, laringitis o el síndrome clínico denominado halzoun (Echi et al., 2009a; Fang et al., 2018; Williams et al., 2020b). Las infecciones con gusanos adultos de trematodos de la familia Echinostomatidae manifiestan diferentes grados de necrosis focal e inflamación de la mucosa intestinal, las infecciones graves pueden causar eosinofilia, dolor abdominal, diarrea severa, anemia y anorexia (Petney & Taraschewski, 2011). La infección por Heterophyes heterophyes, al igual que otras trematodos de la familia Heterophyidae, por ejemplo, Metagonimus, que transmite la carpa de agua dulce, causa diarrea y dolor abdominal, letargo, anorexia y pérdida de peso; además, puede haber parasitismo errático o extraintestinal en el corazón, el cerebro y la médula espinal (Chai, 2014; Wiriya et al., 2013). Los huevos de los trematodos heterofícidos pueden ser transportados por el torrente sanguíneo a lugares ectópicos inusuales, produciendo granulomas eosinofílicos en el corazón, el cerebro y la médula espinal (Elsheikha & Elshazly, 2008b, 2008a; Hegazi & Abo-elkheir, 2014; Kang et al., 2013). Un estudio epidemiológico realizado en Egipto documentó que los factores de riesgo de infección por Heterophyes aequalis, H. heterophyes, Pygidiopsis genata, Ascocotyle (Phagicola) ascolonga o Haplorchis yokogawaik estaban asociados con (1) el sexo femenino (odss-ratio [OR] = 1. 59), (2) ser pescador (OR = 1,39) o ama de casa (OR = 1,24) o (3) pertenecer a los grupos de edad de 15 a 45 años (OR = 2,22) o de 5 a 14 (OR = 1,29) (Lobna et al., 2010). En Vietnam se encontró que la frecuencia de infección es mayor en personas mayores de 19 años (4,2 a 53,8%) en comparación con los menores de 19 años (1,4 a 13,4%), asimismo, la ocurrencia por género fue de 31,1% en hombres, mientras que en mujeres fue de 13% (Hung et al., 2015). En Vietnam, durante la evaluación de la prevalencia de Haplorchis taichui en estanques donde se produce la tilapia Oreochromis niloticus, se documentó un efecto negativo del desconocimiento de los habitantes sobre la calidad sanitaria del agua con la que se producen los peces, la ocurrencia de los parásitos fue del 76% en estanques alimentados con agua de canal y del 82% en estanques donde el agua de alimentación tuvo contacto con descargas de drenaje (Van Phan et al., 2010).
Estrategias de intervención
Una de las actividades recurrentes en acuicultura para evitar infecciones parasitarias es la eliminación de hospederos intermediarios. El uso de fármacos antihelmínticos en acuicultura es habitual; sin embargo, el desarrollo de fármacos para uso exclusivo en acuicultura es aún insuficiente. El uso de niclosamida al 70% directamente en el cuerpo de agua es una estrategia para el control de parásitos mediante la eliminación de moluscos gasterópodos, que es el hospedero intermediario de Opisthorchis viverrini (Tesana et al., 2014). En cuanto al tratamiento contra los helmintos en la acuicultura, solo unos pocos fármacos como el praziquantel se han utilizado en Oreochromis niloticus (Bader et al., 2019). El praziquantel también se ha utilizado a una dosis de 2,5 mg/L como antiparasitario en pez globo diana (Sphoeroides annulatus), donde también se utilizó una combinación de praziquantel, ivermectina, pirantel y fenbendazol (Morales-Serna et al., 2018). El prazicuantel también se ha utilizado en dosis de 2 a 40 mg/L dispensadas en piensos para bagres, carpas y truchas (Bader et al., 2019). El albendanzaol también se ha utilizado como tratamiento antihelmíntico en tilapia, sin embargo, se necesitan más estudios sobre el uso de antihelmínticos en organismos acuáticos (Portela et al., 2020).
CONCLUSIÓN
En este trabajo se describió que la biodiversidad de trematodos con potencial zoonótico que pueden ser transmitidos por la tilapia es abundante. La mayoría de estos trematodos han sido descritos con mayor ocurrencia en Asia, África y Europa, pero los estudios de prevalencia y distribución son insuficientes en América. Asimismo, es evidente que las actividades humanas en la industria alimentaria también influyen en la diseminación de los trematodos en el mundo, sin tener en cuenta que los cambios climáticos y la condición del hospedero también pueden influir en la prevalencia de trematodos en peces. Finalmente, en este trabajo documentamos que la tilapia, un pez de alto valor socioeconómico, sin un manejo sanitario adecuado puede convertirse en transmisor de parásitos trematodos con potencial zoonótico. Debería realizarse nuevos estudios en tilapia con otro grupo taxonómico de helmintos, como nematodos y cestodos, para tener una visión completa de la biodiversidad de helmintos y el riesgo de ser transmitidos a humanos.











 texto en
texto en