INTRODUCCIÓN
Las especies exóticas representan una amenaza para la estructura, función e integridad de los ecosistemas (Ferreira et al., 2021), contribuyen a la extinción de algunas especies (Rocha et al., 2021) e introducen agentes infecciosos al ambiente colonizado (Hernandez-Colina et al., 2021). La paloma de collar turca (STRDEC, Streptopelia decaocto) es una especie invasora con amplia distribución en Norteamérica (eBird, 2021). Es un ave relativamente grande (Salazar-Borunda et al., 2019), que compite por alimento y sitios de anidación con la avifauna local (El-Mansi et al., 2021; Koenig, 2020) o bien, puede transmitir enfermedades al ambiente colonizado (Stilmmelmayr et al., 2012). En México, la paloma huilota común (ZENMAC, Zenaida macroura) comparte el hábitat con la S. decaocto (Otis et al., 2020) y representa una especie modelo para estudiar los efectos de la especie exótica sobre la avifauna de México.
Aunque la introducción de enfermedades exóticas es un fenómeno complejo y son múltiples los agentes etiológicos que pueden estar involucrados (Hawkins, 2021; Martínez-Pérez et al., 2021), los hemoparásitos han estado ampliamente distribuidos entre las aves (White et al., 1978; Starkloff et al., 2021). Este grupo de microrganismos es transmitido por insectos dípteros como mosquitos, hipobóscidos y simúlidos e incluyen los géneros Haemoproteus, Plasmodium, Leucocytozoon, Falissia, Garnia (Valkiūnas & Iezhova, 2018), Trypanosoma (Ham-Dueñas et al., 2017) y microfilarias (Noden et al., 2021).
Cuando infectan a las aves, los hemoparásitos pueden provocar signos clínicos agudos o crónicos. En la presentación aguda, el hospedero desarrolla una alta parasitemia asociada a fenómenos sistémicos generados por formas exoeritrocíticas e intraeritrocíticas (microgametocitos, macrogametocitos y merontes). La fase crónica en cambio, ocurre días o semanas después de la infección, cuando las aves infectadas experimentan una baja parasitemia e impactos clínicos leves que pueden durar años con recaídas estacionales (Valkiūnas & Iezhova, 2017). Aunque son comunes en las poblaciones de aves (Palinauskas et al., 2011) en ocasiones son mortales (Cardona et al., 2002; Yoshimoto et al., 2021), especialmente cuando son introducidos (Warner, 1968).
En cuanto a su prevalencia, los hemoparásitos varían entre regiones ecológicas (Loiseau et al., 2012), temporadas del año (DeBrock et al., 2021) o bien, en función de la respuesta de los vectores hacia fluctuaciones climáticas (Wood et al., 2007). El conocimiento de la prevalencia hemoparasitaria de una especie exótica y una nativa enriquecerá el conocimiento biológico de esa interacción ecológica. Por ello, el objetivo de este estudio fue determinar y comparar la prevalencia hemoparasitaria entre las palomas de collar turcas y huilotas en el municipio de Durango, México, durante dos épocas del año.
MATERIAL Y MÉTODOS
El área de estudio corresponde a las localidades de “José Refugio Salcido” (23.97 N, -104.51 O), “Praxedis Guerrero Nuevo” (23.94 N; -104.56 O) y “La Purísima” (23.96 N; -104.57 O) del municipio de Durango, México. Se extrajeron muestras de sangre (500 µl) de STRDEC (n= 40) y ZENMAC (n= 40), durante la época reproductiva (primavera- verano, 2014) y no reproductiva (otoño-invierno, 2013) bajo el amparo del permiso de colecta científica SGPA/DGVS/12294/13.
Colecta de sangre
De cada ave se realizaron dos frotis sanguíneos, los cuales, se secaron a temperatura ambiente (2 min) y se fijaron con metanol al 100 % (3 min). Una vez secos, se envolvieron en papel para evitar el contacto directo entre ellos, y posteriormente se tiñeron con una solución Giemsa (pH 7.0-7.2 a 18-20 °C durante 1 h; Santiago Alarcón & Carbó-Ramírez, 2015). De la sangre colectada, se depositaron 100 µl en un tubo Eppendorf estéril, con solución buffer (100 mM Tris HCl, pH 8.0, 100 mM EDTA, 10 mM NaCl, 0.5 % SDS; Longmire et al., 1988) para mantenerla congelada (- 20 °C) hasta su análisis molecular.
Análisis molecular
Se determinó la presencia y ausencia de hemoparásitos a través de la reacción en cadena de la polimerasa (PCR) dirigiéndose a una región de 479 pares de bases del gen citocromo b (Hellgren et al., 2004). La extracción del ADN se realizó siguiendo el protocolo de DNeasy blood & Tissue® (Quiagen, 2021). La PCR se realizó con 100 ng de AG, 10 mM de Tris-HCl (pH 8.3), 50 mM KCl, 3.0 mM de MgCl, 0.4 mM de desoxinucleótidos trifosfatados, 5 µl de buffer Q y 0.5 µl de Taq. La amplificación se realizó de los oligonucleótidos HaemNFI-HaemNR3 (Hellgren et al., 2004) y HaemF- HaemR2 (Bensch et al., 2000). Los productos de esa reacción se depositaron dentro de una cámara de electroforesis (25 mA, 25 min) junto a 0.01 µg/µL Tracklt TM y SYBR® para observarlos en una cámara fotodocumentadora de luz ultravioleta (ImageQuant LAS 4000, exposición de 6 s).
Análisis microscópico
Para confirmar la presencia o ausencia de estructuras parasitarias, se examinaron frotis sanguíneos con los aumentos altos seco (40 ×, 30 minutos) y húmedo (100 ×, 30 minutos) para al menos 100 campos, mediante un microscopio óptico binocular (Carl Zeiss®, modelo Primo Star). La identificación de los parásitos, limitada a nivel de género, se realizó siguiendo los criterios de Valkiūnas y Iezhova (2018). La prevalencia de hemoparásitos se estimó mediante el cociente de aves infectadas entre el total de individuos muestreados.
Para determinar la parasitemia de hemoparásitos, se contabilizaron los elementos parasitarios observados al contar 10 000 glóbulos rojos del huésped (Godfrey et al., 1987).
Análisis estadístico
La prevalencia, la parasitemia promedio y sus respectivos intervalos de confianza del 95%, se calcularon con el Quantitative Parasitology QPweb (Reiczigel et al., 2020). La estimación de la prevalencia como para la parasitemia, se basó en 5 000 repeticiones de bootstrap, con el método Sterne para datos binomiales de prevalencia (Rózsa et al., 2000; Ham-Dueñas et al., 2017; Reiczigel et al., 2019). Los índices de prevalencia y parasitemia se compararon entre géneros parasitarios (Haemoproteus sp.vs. Plasmodium sp.). La prevalencia se analizó mediante un análisis de Chi cuadrada y la parasitemia con un modelo lineal generalizado (GLM), utilizando la distribución binomial negativa.
El efecto de la época del año y la especie se evaluó mediante modelos mixtos lineales generalizados (GLMM, Paterson & Lello, 2003), utilizando la regresión logística para la prevalencia de hemosporidios y la distribución binomial negativa para la parasitemia. Estos análisis se implementaron utilizando el paquete “MASS” (Venables & Ripley, 2002) en la versión R 4.0.5 (R Core Team, 2021).
RESULTS
De las 80 palomas en las que se buscaron hemoparásitos con PCR, 70 estaban infectadas (87.5 %, IC 95%=78.3-93.3). Las tasas de prevalencia oscilaron entre 80 y 100 % y el gen parasitario se amplificó en mayor proporción durante la temporada no reproductiva (Tabla 1).
Tabla 1 Porcentaje de aves infectadas con hemoparásitos, diagnosticadas morfológicamente y a través de la amplificación del gen mitocondrial parasitario citocromo B en Durango, México
| Especie | Diagnóstico morfológico | |
|---|---|---|
| Reproductiva* | No reproductiva** | |
| ZENMAC | 14 n , 70 % P , 47.5-86.0 IC | 19 n, 95 % P, 75.6-99.7 IC |
| STRDEC | 13 n, 65 % P, 42.4-83.3 IC | 14 n, 70 % P, 47.5-86.0 IC |
| Especie | Diagnóstico molecular | |
| Reproductiva* | No reproductiva** | |
| ZENMAC | 17 n, 85 % P, 62.8-95.8 IC | 20 n, 100 % P, 83.3-100 IC |
| STRDEC | 16 n, 80 % P ,57.6-92.9 IC | 17 n, 85% P, 62.8-95.8 IC |
ZENMAC Zenaida macroura, STRDEC Streptopelia decaocto, n Número de aves infectadas, P Prevalencia, IC intervalo de confianza al 95%, *Primavera-Verano 2014, **Otoño-Invierno 2013.
Aunque la mayoría de las infecciones se diagnosticaron por ambos métodos, el análisis microscópico reflejó prevalencias más bajas. La mayoría de las muestras positivas, tenían infecciones únicas por hemosporidios. No obstante, un ave de cada especie mostró coinfección entre Haemoproteus sp. y microfilarias.
La prevalencia de hemoparásitos detectada por microscopia óptica fue del 75.0 % (60 aves, IC 95 %= 64.4-83.4) e identificó en promedio 7.03 (IC 95 %= 5.68-9.04) hemoparásitos por cada 10,000 eritrocitos infectados. El porcentaje de prevalencia y la parasitemia promedio para cada especie, taxones de hemoparásitos y estación se muestran en la Tabla 2.
Tabla 2 Porcentajes de prevalencia de hemoparásitos y parasitemia promedio en Streptopelia decaocto y Zenaida macroura durante la época reproductiva y no reproductiva en Durango, México
| Grupo | Aves infectadas | n | Prevalencia % (IC 95%) | Parasitemia1 promedio (IC 95%) |
|---|---|---|---|---|
| STRDEC | 27 | 40 | 67.5 (51.3-80.2) | 4.0 (3.1-5.2) |
| ZENMAC | 33 | 40 | 82.5 (67.7-91.6) | 9.4 (7.4-12.8) |
| Haemoproteus sp. | 55 | 80 | 68.8 (57.5-78.3) | 6.3 (5.0-8.17) |
| Plasmodium sp. | 17 | 80 | 21.2 (13.6-31.8) | 2.6 (1.9-3.4) |
| Microfilarias | 4 | 80 | 5.0 (1.7-12.3) | 3.0 (1.0-4.7) |
| Reproductiva* | 27 | 40 | 67.5 (51.3-80.2) | 5.15 (3.8-7.4) |
| No reproductiva** | 33 | 40 | 82.5 (67.7-91.6) | 8.58 (6.67-11.9) |
1Número de elementos parasitarios en 10 000 glóbulos rojos cuantificados, n Total de muestras, IC intervalo de confianza al 95%, STRDEC paloma de collar turca, ZENMAC paloma huilota, *Primavera-Verano 2014, **Otoño-Invierno 2013.
Las estructuras parasitarias se identificaron en diferentes estadios evolutivos. Se detectaron macro y microgametocitos para Haemoproteus sp., merontes para Plasmodium sp. y estadios larvarios de filarias (Figura 1). Las infecciones por Haemoproteus sp. fueron mayores que las realizadas por Plasmodium sp. (prevalencia: X 2 = 1.14, df = 1, P = 0.02, parasitemia: F = 508.80, P = 0.001).
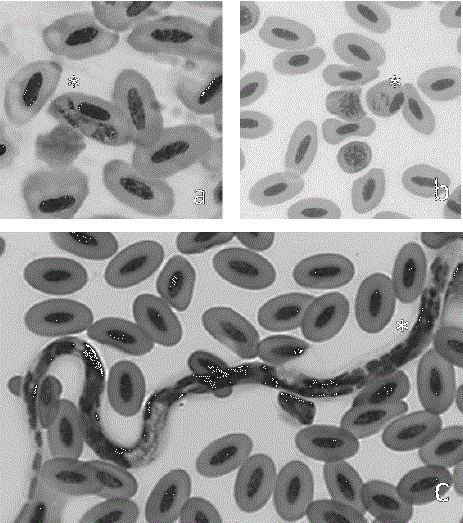
Figura 1 Fotomicrografías de frotis sanguíneos de aves columbiformes parasitadas naturalmente por hemoparásitos (*). a. Haemoproteus sp., b. Plasmodium y c. Microfilarias (c); Giemsa, 100 x.
Los modelos lineales mixtos generalizados revelaron que la parasitemia varió entre especies y épocas del año (F= 337.8, P= 0.001). El ajuste del GLMM que explica la parasitemia fue moderado (R2 = 0.89). La parasitemia fue mayor durante la temporada no reproductiva, especialmente en ZENMAC (Tabla 2). Finalmente, el efecto de la especie (P= 0.18) y la temporada (P= 0.50) sobre las tasas de prevalencia no fueron significativos.
DISCUSIÓN
La hipótesis que sustentaba que las tasas de prevalencia difieren significativamente entre especies de aves y entre épocas del año no fue apoyada por los datos. Lo cual se traduce en que el fenómeno del parasitismo es común en ambas especies de aves. El valor de prevalencia que se registró es más alto que algunos valores reportados en México (Reinoso-Pérez et al., 2016; Ham-Dueñas et al., 2017; Villalva-Pasillas et al., 2020). No obstante, estos resultados no deben sorprender debido a que la respuesta hacia el parasitismo sanguíneo depende de factores asociados a la temporalidad, inmunología o comportamiento del huésped, como lo reportado en estudios similares en aves paseriformes (Lee et al., 2006; Dubiec et al., 2016) y columbiformes (Schumm et al., 2021).
La influencia de tales variables sobre los parásitos sanguíneos es monitoreada en estudios de largo plazo, y generalmente no reflejan diferencias significativas entre las prevalencias durante varios años (Bensch et al., 2007; Dubiec et al., 2016). En este sentido, aunque los patrones observados en este estudio pueden ser considerados confiables, deben ser monitoreados en la misma región a lo largo del tiempo. Por otro lado, los resultados de este estudio sustentan la hipótesis de que la parasitemia varía entre especies y épocas. Las causas de que la cantidad de hemoparásitos fuera significativamente mayor en ZENMAC pueden estar asociadas a las diferencias en la distribución de ambas aves o a características propias de los vectores y parásitos (Reinoso-Pérez et al., 2016). Fokis et al. (2008), reportó una menor incidencia de hemoparásitos en aves de hábitos urbanos y, aunque ambas especies llegan a compartir hábitat (Green et al., 2020), las ZENMAC capturadas para este estudio se distribuyeron hacia áreas más abiertas, con cuerpos de agua adyacentes, probablemente con más vectores (Lega et al., 2017; Lynton‐Jenkins et al., 2020) y con mayor probabilidad de contagio (Hellard et al., 2016). La influencia de la estación del año (reproductiva) sobre la parasitemia pudiera ser considerada normal, al coincidir con la época de reproducción de los vectores (Inumaru et al., 2021) y eventos hormonales relevantes en la solución de la parasitemia por parte del hospedero aviar (Deviche & Parris, 2006).
Aunque pueden existir diferencias regionales, Haemoproteus es el género hemoparasitario más común en aves, seguido por Plasmodium y Leucocytozoon (Carlson et al., 2013; Heym et al., 2019). Este patrón se observó en este estudio a excepción del género Leucocytozoon, cuya ausencia podría estar asociada a las características altitudinales y climáticas del sitio de estudio que restringen la abundancia de los mosquitos y el desarrollo del parásito en estos vectores (Borji et al., 2011; Nath et al., 2014). Los resultados se traducen en que el sitio de estudio cuenta con una cantidad de vectores suficiente y capaz de transmitir hemoparásitos en ambas especies de aves (Valkiūnas & Iezhova, 2018; Inumaru et al., 2021).
Los trabajos que analizan la parasitemia son limitados (Huang et al., 2020) y asocian este parámetro con el daño generado por el parásito al hospedero (Knowles et al., 2010; Muriel, 2020). Hasta donde sabemos, no existe un estudio que examine la parasitemia sanguínea en las especies muestreadas en este estudio. Sin embargo, las tasas de parasitemia cuantificadas fueron menores a las reportadas en columbiformes de Sudáfrica (Nebel et al., 2020), Islas Canarias (Foronda et al., 2004) e India (Gupta et al., 2011), cuyos efectos adversos en los hospederos dependieron de factores como la inmunidad del ave o la disponibilidad de alimento (Chagas et al., 2016). Así mismo, hay que considerar que en circunstancias normales, los géneros Haemoproteus y Plasmodium solo ocasionan problemas de salud cuando el hospedero cursa por eventos de estrés, inmunosupresión (Valkiūnas & Iezhova, 2017) o al ser introducidos en comunidades no nativas (Yoshimoto et al., 2021), por ello, se deben descartar estos fenómenos en estas especies.
En México, los estudios que reportan microfilarias en aves son escasos y su impacto en el hospedero se cree poco severo (Yanga et al., 2011). Aunque fue el parásito menos observado, las prevalencias calculadas superan a las reportadas por estudios similares en México (Clark & Swinehart, 1969; Villalva-Pasillas et al., 2020). Sin embargo, se debe monitorear el desarrollo futuro de los hemoparásitos y determinar los posibles efectos sobre las comunidades de columbiformes, especialmente en el escenario de cambio global, ya que el aumento de temperatura y cambios antropogénicos en el uso de la tierra, podrían brindar nuevas oportunidades para la transmisión de estos microorganismos hacia las comunidades aviares.
Cabe señalar que en este estudio utilizamos dos análisis (molecular y microscópico) para evaluar la prevalencia hemoparasitaria con la mayor precisión posible. Estos dos enfoques condujeron a discrepancias entre análisis, al determinar una prevalencia más baja en los recuentos de extendidos sanguíneos. Este evento coincide con estudios previos en columbiformes, en donde las prevalencias del análisis microscópico y molecular fueron diferentes (Dunn et al., 2017; Tavassoli et al., 2018). Las aves cuya sangre tuvo ausencia de estructuras parasitarias, pero fueron positivas a la PCR, pudieran estar cursando una ligera parasitemia con pocos gametocitos, esporozoitos o restos de parásitos que interrumpieron su desarrollo (Valkiūnas & Iezhova, 2017). El método molecular en cambio, se basó en la detección del gen parasitario, pero no revela si los parásitos han tenido o se convertirán en una infección exitosa (Chagas et al., 2016; Valkiūnas & Iezhova, 2017).
CONCLUSIÓN
El parasitismo sanguíneo se observó en las aves de ambas especies, principalmente por el género Haemoproteus spp. La parasitemia fue mayor en Z. macroura durante la época reproductiva y por tanto, la estacionalidad debe ser una variable importante para considerar en estudios que involucren el parasitismo de esta especie. Este estudio contribuye a la comprensión de la diversidad de hemoparásitos que infectan a las aves silvestres del orden Columbiforme en Durango, México. Aunque no logramos determinar la causa de las diferencias en las parasitemias calculadas, este estudio ofrece información de referencia para monitorear las poblaciones de aves en los sitios de estudio o bien, los posibles cambios futuros en los rangos y diversidad de parásitos.











 texto en
texto en 



