INTRODUCCIÓN
La sobrepoblación canina es un problema a nivel mundial el cual impacta en la salud pública y animal (Rubel & Carbajo, 2019), debido a que son una fuente de problemas de salud, políticos, socioeconómicos y de bienestar, particularmente en los países en desarrollo. Estos problemas incluyen vagar por las calles causando accidentes de tráfico, ladrar, agresión y morder. La creciente población de perros callejeros en los países de América Latina es alarmante, varios factores contribuyen al aumento de su población, el más común es el abandono por parte de los responsables, el cual es la causa principal del número de perros que recorren las calles o viven en refugios caninos (Mota-Rojas et al., 2021).
La principal preocupación de la sobrepoblación canina está relacionada con las enfermedades zoonóticas, especialmente rabia canina, enfermedad subreportada y desatendida en los países en desarrollo, la cual es responsable del 99% de los casos de rabia humana transmitida por perros a nivel mundial, produciendo anualmente la muerte de aproximadamente 59,000 [Intervalo de confianza al 95%: 25,000-159,200] personas en todo el mundo. Se están realizando esfuerzos para reducir a cero las muertes humanas debido a la rabia mediada por perros para el año 2030 (Hampson et al., 2015; Hampson et al., 2019).
La esterilización quirúrgica es el mejor método para prevenir la reproducción y, en consecuencia, la sobrepoblación canina. Sin embargo, el impacto de los programas de esterilización ha sido limitado, principalmente debido a los altos costos operativos que dificultan llegar a la mayor cantidad de perros posible (Evans et al., 2022; Belsare & Vanak, 2020). Debido a esto, el sacrificio masivo sigue siendo utilizado como el principal método de control poblacional en gran parte del mundo, siendo poco aceptado por la sociedad, por lo que la Organización Mundial de la Salud publicó directrices en 1990 que desalientan el uso del sacrificio y recomiendan métodos alternativos como los métodos contraceptivos (Smith et al., 2019).
Debido a esto, diferentes investigaciones se han enfocado en encontrar y proponer alternativas de control de la fertilidad canina, entre las cuales se incluye el uso de hormonas sintéticas (por ejemplo, andrógenos sintéticos), esterilización química (por ejemplo, gluconato de zinc neutralizado con arginina, cloruro de calcio), inmunocontracepción (por ejemplo, vacuna inhibidora de la hormona gonadotropina) (Sandam et al., 2021; Root Kustritz, 2018; Asa, 2018; Massei et al., 2013 ), así como, el uso del ultrasonido terapéutico a diferentes frecuencias (Leoci et al., 2015), entre otras. Sin embargo, algunas metodologías pueden presentar diferentes efectos adversos y no han mostrado ser totalmente efectivas (Sandam et al., 2021; Asa, 2018; Root Kustritz, 2018). Por tal motivo, como método complementario se contempla el uso de fitoestrógenos.
Los fitoestrógenos (FE) son compuestos polifenólicos derivados de las plantas, los cuales se dividen en varios grupos, incluyendo isoflavonas (genisteína), lignanos (enterolactona), flavonas (luteolin), estilbenos (resveratrol) y coumestanos (coumestrol) (Adler et al., 2015; Pérez-Rivero et al., 2009). Tienen estructuras similares a los estrógenos endógenos y pueden inducir o inhibir la respuesta en receptores hormonales debido a que tienen la capacidad de unirse a los receptores estrogénicos (RE) alfa (REα) y beta (REβ) localizados en los tejidos en diferentes órganos incluyendo el reproductivo. Esta unión se realiza con mayor afinidad a los REβ (Rietjens et al., 2017).
Algunas investigaciones indican que los FE actúan como disruptores endocrinos compitiendo con los estrógenos endógenos por la unión a sus receptores y pueden producir efectos biológicos positivos o negativos en la salud animal (Beszterda & Frański, 2018). Similar a lo que ocurre con cualquier fármaco, depende de la dosis o la vía de administración de los FE la intensidad del efecto en el tejido blanco, debido a que son sometidos a diferentes procesos de absorción, biotransformación, distribución y excreción. Asimismo, sus efectos pueden variar dependiendo del fitoestrógeno, las especies expuestas, el sexo, la vía de administración, la dosis y la duración de la exposición, además del momento de la exposición durante el desarrollo reproductivo o la vida adulta. Por lo tanto, los FE tienen la capacidad de actuar como agonistas estrogénicos produciendo los efectos estrogénicos clásicos o como antagonistas estrogénicos (inhibiendo el efecto de los estrógenos) (Domínguez-López et al., 2020; Mostrom & Evans, 2018).
De manera adicional, los FE pueden modular el eje hipotálamo-hipófisis, también tienen la capacidad de inhibir la expresión del ARNm de la aromatasa (citocromo P450), produciendo la disminución de la biosíntesis local de estrógenos, dando como resultado la inhibición celular, incluyendo la espermatogénesis, participando como reguladores intracelulares del ciclo celular y la apoptosis (Domínguez-López et al., 2020; Lephart, 2015; Cerendolo et al., 2009; Kawakami et al., 2004).
El coumestrol (COU) se encuentra presente en alfalfa (Medicago sativa), trébol blanco (Trifolium repens), espinacas (Spinacia oleracea) y brotes de soja (Glycine max) (Cerendolo et al., 2009; Domínguez-López et al., 2020). Tiene la capacidad de actuar como disruptor endocrino de ERα y Erβ, los cuales se encuentran ampliamente distribuidos en el tracto reproductivo del macho durante su desarrollo y la edad adulta (Cooke et al., 2021). En el perro se ha detectado la presencia de RE en las células intersticiales de Leydig, espermátidas redondas, espermatogonias, y en el tejido conectivo del epidídimo (Serrano et al., 2008).
Una peculiaridad del COU es que puede ser detectado de manera natural mediante fluorescencia cuando se une a los RE, este se excita a una longitud de onda de 390-400 nanómetros (azul) y emite fluorescencia con una longitud de onda de 532-559 nanómetros (color verde) (Wang et al., 2014).
El COU ha sido estudiado como un posible método de control reproductivo en perros. En hembras cuando es administrado por vía oral induce la disminución de los niveles de progesterona e incremento de los valores de estrógenos séricos, sin afectar la celularidad del epitelio vaginal (Peña-Corona et al., 2020). En machos, cuando se administra por vía oral afecta la histoarquitectura del epitelio germinal de los tubos seminíferos (Pérez- Rivero et al., 2009). También se ha reportado el mismo efecto en murciélagos hematófagos (Desmodus rotundus) machos (Pérez-Rivero et al., 2014).
Los espermatozoides que pasan de los testículos al epidídimo son gametos no funcionales, es durante su tránsito a través de este último, donde mediante su interacción con proteínas, maduran, adquieren motilidad progresiva y la capacidad de fertilizar a los óvulos (Ali Hassan et al., 2021; Cornwall, 2009), por lo que el epidídimo puede ser un blanco para el control reproductivo de especies consideradas transmisoras de enfermedad. Debido a lo anterior, el objetivo de este estudio fue conocer el efecto de la administración subcutánea de coumestrol en el epidídimo de perros adultos como alternativa para su control reproductivo.
MATERIAL Y MÉTODOS
Bienestar animal
El estudio fue aprobado con el número de protocolo DC-2017/2-4, por el Comité Interno para el Cuidado y Uso de Animales de la Facultad de Medicina Veterinaria y Zootecnia de la Universidad Nacional Autónoma de México. Se realizó con apego a los principios de las 3 R´s de la investigación con animales (NCRRAR).
Animales
Se incluyeron 10 perros machos de entre 2 y 3 años, de diferente raza, sexualmente maduros, con peso promedio de 14 ± 2.9 kg. Clínicamente sanos con ambos testículos escrotados.
Experimento
Se dividieron aleatoriamente en dos grupos con cinco perros cada uno: Control (C) y tratamiento con coumestrol (TCOU), y se les dio seguimiento por 5 semanas continuas. En la primera semana, el grupo TCOU recibió una dosis única de 1.2 mg/kg por vía subcutánea de coumestrol (COU, Sigma Aldrich® Lot# BCBH0742V Pcode: 101171142 y Lot# BCBN3969V Pcode: 101652427), disuelto en dimetil sulfóxido (DMSO, Sigma Chemical Co®) para tener una concentración de COU: 100 µg/µl, el cual fue mezclado con un vehículo de quitosan 300 µl. El grupo C solo recibió el vehículo de DMSO y quitosan en la misma cantidad y vía de administración (Miranda-Castro & Lizarraga- Paulin, 2012).
Estudios clínicos
A cada perro de ambos grupos: C y TCOU, previo a la administración del tratamiento, a la primera semana de la administración del tratamiento y posteriormente cada semana por 4 ocasiones, le fueron realizadas cuatro evaluaciones: evaluación de la producción y calidad seminal, ecografía para evaluar testículos y epidídimo y obtención de sangre para determinación de indicadores hormonales.
Concentración, morfología y motilidad espermática
Después de obtener el eyaculado, se evaluó la motilidad progresiva a 4X y a 10X, la concentración espermática y la morfología se determinaron según la metodología propuesta por Zuvela & Matson (2020) y Johnston (1991).
Ecografía
Los perros fueron colocados en decúbito lateral izquierdo sin sedación, para realizar la evaluación ecográfica de ambos testículos y el epidídimo de manera transescrotal. Se utilizó un equipo de ultrasonido K10-Vet (KontroLab®) y transductor microconvexo de 7.5 MHz, para determinar de manera cuantitativa la ecogenicidad de los testículos, mediastino y en la cabeza del epidídimo. De cada región anatómica, se obtuvieron y evaluaron imágenes digitales en el plano sagital, se seleccionaron al azar veinte áreas sobre cada imagen para determinar los píxeles en escala de grises de cada una. Se consideró un valor de “0” totalmente negro y “255” totalmente blanco. Se utilizó el software ImageJ (NIH; Morales et al., 2021).
Morfología gonadal
En la quinta semana, a todos los perros de ambos grupos se les realizó orquiectomía bilateral bajo anestesia inhalada (isoflurano-oxigeno) y, se llevó a cabo disección del epidídimo de ambos testículos. Secciones de cabeza y cuerpo del epidídimo se fijaron en solución de Bouin para su procesamiento por inclusión en parafina y se obtuvieron cortes de 3 micrómetros de grosor que fueron teñidos con hematoxilina y eosina (Aziz & Zeman- Pocrnich, 2022; Kurowicka et al., 2015).
Secciones de la cabeza del epidídimo se evaluaron por microscopía óptica (Optisum® MIC 900T) se tomaron microfotografías a 20X y 40X. Posteriormente, se determinó el diámetro de los túbulos, área y el grosor del epitelio tubular, así como, el área ocupada por el paquete espermático en el lumen de cada túbulo con el programa computacional LSM 5® (Carl Zeiss).
Identificación de receptores estrogénicos
Dos cortes histológicos sin teñir de cada testículo de ambos grupos (C y TCOU) fueron evaluados mediante microscopía confocal Leica TCS SP2 con una longitud de onda de 400 nanómetros (luz azul) para excitación y de 550 nanómetros para detectar la emisión de fluorescencia en verde asociada al COU ligado a los receptores estrogénicos presentes (Serrano et al., 2008; Pérez-Rivero et al., 2009). También se obtuvieron imágenes digitales para determinar la intensidad de la fluorescencia emitida expresada en píxeles con el programa ZEN Blue 3.5 Carl Zeiss Microscopy GmbH.
Parámetros séricos de testosterona y estradiol
Las muestras de sangre se obtuvieron por venopunción yugular en horario diurno con al menos 8 h de ayuno, se dispensaron en tubos sin anticoagulante. Se determinó la concentración sérica de testosterona y estradiol mediante el ensayo de inmunoadsorción ligado a enzimas (ELISA) utilizando kits comerciales (DRG Testosterone ELISA EIA-1559 y DRG Estradiol Sensitive ELISA EIA-4399, DRG Instruments GmbH®, Alemania) y siguiendo los protocolos del fabricante. La sensibilidad analítica de las pruebas para testosterona y estradiol fue de 0.083 ng/ml y <1.399 pg/ml respectivamente. Los coeficientes de variación intraensayo e interensayo de las pruebas fueron de: 3.59%, y 7.12% para testosterona, y de 6.36%, y 7.60% para estradiol. Si la concentración sérica se encontraba por debajo del límite de cuantificación, se le asignó a esa muestra el valor del límite inferior.
Análisis estadístico
El análisis estadístico se realizó con el software PAST 3.01® (Hammer, 2001). Se obtuvieron las medianas ± error estándar (EE) y el rango entre cuartiles (Q1-Q3) de los parámetros de celularidad determinados en las gónadas, así como también de la intensidad de los pixeles de las ecografías y de las imágenes con fluorescencia. Las diferencias entre grupos se analizaron con la prueba de Mann-Whitney. El nivel de significancia se estableció en p < 0.05.
Producción espermática
La concentración espermática inicial del grupo C, fue de 1.79±0.001 108 espermatozoides/ml, la cual en las siguientes semanas no mostró variaciones. Por el contrario, en el grupo TCOU (Tabla 1), la concentración espermática en los eyaculados mostró una evidente disminución numérica de la semana uno a la cuatro, la concentración determinada en la quinta semana que fue de 0.420±0.002X108 espermatozoides/ml fue inferior (p<0.05) a las concentraciones determinadas en las cuatro semanas anteriores. La motilidad espermática disminuyó de manera significativa (p<0.05) a partir de la semana 3. En lo referente a la morfología espermática se observó un incremento en la semana 3 de alteraciones en la cola y gotas citoplásmicas proximales y distales asociadas con la maduración en el epidídimo (Tabla 1).
Tabla 1 Concentración, morfología y motilidad espermática semanal de perros tratados con coumestrol (grupo TCOU)
|
Concentración espermática X108 espermatozoides/ml. Mediana±EE (Q1-Q3) | ||||||
| Semana | 1* | 2 | 3 | 4 | 5 | Mann- Whitney P |
| Tratado | 1.79±0.001 (1.78-1.79) | 1.58±0.05 (1.48-1.68) | 1.17±0.09 (1.01-1.32) | 0.952±0.03 (0.41-1.49) | 0.420±0.002a (0.41-0.42) | <0.05 |
| Control | 1.79±0.001 (1.78-1.79) | 1.68±0.03 (1.68-1.78) | 1.68±0.04 (1.58-1.70) | 1.60±06 (1.55-1.79) | 1.78±0.02 (1.70-1.79) | >0.05 |
|
Motilidad espermática % Mediana (Q1-Q3) | ||||||
| Tratado | >90 (89-92) | >90 (88-91) | 50a (50-50) | 50a (45-60) | 60a (50-60) | <0.05 |
| Control | >90 (89-92) | >90 (89-92) | >90 (89-92) | >90 (89-92) | >90(89-92) | >0.05 |
| Morfología espermática % ± EE | ||||||
| Tratado Normal | 86±1.5 | 88±1.1 | 65±7.0a | 56±5.5a | 57±2.9a | <0.05 |
| Control Normal | 86±1.5 | 87±2.0 | 88±1.0 | 86±2.0 | 89±1.5 | >0.05 |
| Tratado Cola enrollada | 1±0.80 | 4±1.5 | 10±4.5a | 9±4.5a | 5±2.5 | <0.05 |
| Control Cola enrollada | 1±0.80 | 1±0.5 | - | - | - | >0.05 |
| Tratado Gota proximal | - | - | - | 2±2 | 7±4 | >0.05 |
| Control Gota proximal | - | - | - | - | - | - |
| Tratado Gota distal | - | 1±0.5 | 1±0 | 7±1a | - | <0.05 |
| Control Gota Distal | - | - | - | - | - | - |
| Tratado Cola Doblada | 4±2 | 2±0.25 | 18±10 | 34±13a | 32±6.9a | <0.05 |
| Control Cola Doblada | 4±2 | 2±1 | - | - | 2±1 | >0.05 |
* Inicio del tratamiento. a Indica el parámetro donde existe diferencia significativa en la prueba de Mann- Whitney
Indicadores ecográficos y morfología gonadal
La ecogenicidad gonadal (Tabla 2), mostró que el parénquima gonadal del grupo TCOU (69.9±2.9) se incrementó (p>0.05) con respecto a la ecogenicidad que se determinó en el grupo C (63.9±2.6).
Tabla 2 Ecogenicidad gonadal en perros de Grupo control y tratados con coumestrol
| Grupo /Cuartil | Control Mediana±EE | Q1-Q3 Mediana | Coumestrol Mediana±EE | Q1-Q3 Mediana | Mann Whitney P |
|---|---|---|---|---|---|
| Parénquima | 63.9±2.6 | 45.5-77.5 | 69.9±2.9 | 51.5-83.5 | >0.05 |
| Mediastino | 67.3±2.0 | 55.5-77.0 | 60.0±2.4 | 46.5-73 | <0.01 |
| Cabeza del epidídimo | 53±2.9 | 35.5-64 | 44±1.8 | 39-47 | <0.05 |
Ecografía gonadal / Pixeles gris
En la ecografía testicular (Figura 1), la intensidad de pixeles mostró una disminución de la ecogenicidad en la región del mediastino (red testicular) y en la región de la cabeza del epidídimo (p<0.05).
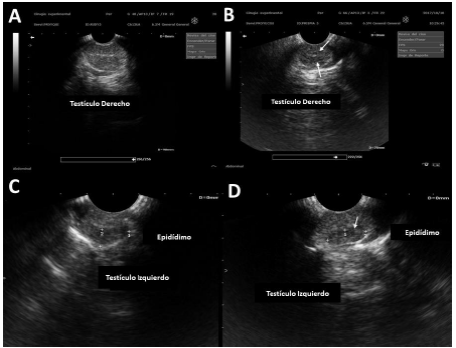
Figura 1 Ecografía de testículo y epidídimo. Se observa: A. Grupo control. B. Grupo TCOU, nótese la disminución en la ecogenicidad a la altura del hilio testicular (flechas). C. Ecogenicidad evidente en epidídimo de perros del grupo control. D. Ecogenicidad menor en epidídimo de perros del grupo TCOU.
La evaluación de la celularidad en la cabeza de epidídimo de ambos grupos C y TCOU (Tabla 3) no mostró diferencias entre ellos, sin embargo, fueron evidentes los rangos de los valores determinados en cada grupo observados en los cuartiles.
Tabla 3 Parámetros de celularidad del epidídimo de perros tratados con coumestrol
| Cabeza del Epidídimo | Control Mediana±EE | Q1-Q3 Mediana | Coumestrol Mediana±EE | Q1-Q3 Mediana | Mann Whitney P |
|---|---|---|---|---|---|
| Morfometría | |||||
| Diámetro µm | 273±5.7 | 235-306 | 314±5.3 | 279-340 | <0.01 |
| Área µm2 | 60882±2593 | 43665- 73608 | 79688±2716 | 61362- 90872 | <0.01 |
| Grosor del epitelio µm | 59.7±1.0 | 53.4-64.4 | 75.9±1.0 | 67.0-83.6 | <0.01 |
| Longitud de las microvellosidades en µm | 23.6±0.4 | 20.8-25.6 | 13.0±0.6 | 8.6-17.9 | <0.01 |
| Espermatozoides (Área del paquete espermático en µm2) | 12703.9±2026.7 | 7991.1- 18201.5 | 8371.8±2605.5 | 781.0- 14181.5 | <0.05 |
En las observaciones histológicas de la celularidad epididimal (Figura 2), se destaca que el grupo TCOU, presentó una disminución de la masa espermática y de las microvellosidades luminales.
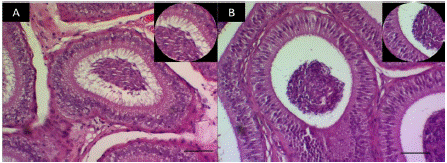
Figura 2 Corte histológico de un segmento de la cabeza del epidídimo. A. Cabeza del epidídimo grupo control (40X), inserto detalle de las microvellosidades B. Cabeza de epidídimo grupo tratado con coumestrol (40X), inserto amplificación del detalle que muestra ausencia de las microvellosidades. Barra 100µm.
Presencia de receptores estrogénicos
La presencia de receptores estrogénicos (Figura 3 y Tabla 4), se evidenció con el incremento numérico en la media de los pixeles, en el tejido conectivo en las estructuras del epidídimo del grupo TCOU de 21.5±0.9 comparado con el grupo C el cual presentó de 6±0.5 (p>0.05).
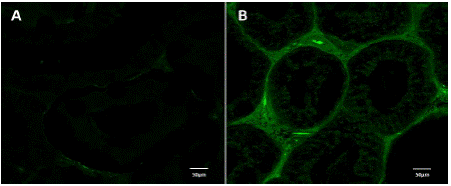
Figura 3 Fluorescencia, en epidídimo, que demuestra la presencia de receptores a estrógenos (coumestrol). A. Fluorescencia escasa en el epidídimo de perros del grupo control, en los cuales destaca la disminución de epitelio. B. Fluorescencia intensa en el epidídimo de perros tratados con coumestrol en los cuales se evidencia el incremento del tejido conectivo.
Tabla 4 Intensidad de fluorescencia asociada a la presencia de receptores estrogénicos
| Grupo /Cuartil | Control Mediana±EE | Q1-Q3 Mediana | Coumestrol Mediana±EE | Q1-Q3 Mediana | Mann Whitney P |
|---|---|---|---|---|---|
| Epitelio | 1.4±0.1 | 0-3 | 3.1±0.4 | 0-5.7 | <0.01 |
| Tejido conectivo | 6.0±0.5 | 3-8 | 20.9±0.9 | 14.2-26 | >0.05 |
Intensidad de fluorescencia / Pixeles Verdes
Parámetros hormonales
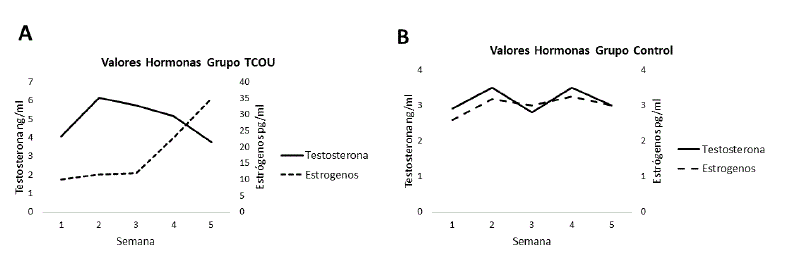
Los niveles hormonales determinados (Figura 4), mostraron diferencias entre el grupo C y el grupo TCOU. En el grupo C, los niveles de testosterona se mostraron constantes, por el contrario, se determinó una variación en los niveles de estradiol. En el grupo TCOU, a partir de la semana cuatro y de manera tendiente, hasta la semana cinco fue evidente un descenso en los niveles de testosterona, asociados a un incremento en los niveles de estradiol.
DISCUSIÓN
Los eyaculados caninos normales deben tener al menos un 80% de espermatozoides morfológicamente normales y viables (Chłopik & Wysokińska, 2020). En este estudio se encontró la morfología espermática normal del 60% o inferior a partir de la tercera semana del tratamiento, lo que es similar a lo reportado en perros considerados infértiles (Barbosa de Souza et al., 2015). La disminución en la concentración espermática y el incremento de espermatozoides con gota citoplásmica son evidencia del efecto inhibitorio de la actividad gonadal por efecto del coumestrol.
La motilidad espermática reportada en perros fértiles debe ubicarse por encima del 70% (Johnston,1991), en el presente estudio en los perros del grupo TCOU a partir de la semana 3 se ubicó en 60% o menor, valor similar a lo reportado en perros infértiles (Barbosa de Souza et al., 2015). En el presente estudio se encontraron alteraciones secundarias de la morfología espermática, las cuales se asocian con su maduración en el epidídimo o durante la preparación de muestras de semen. Dentro de las principales alteraciones se encontraron cola fuertemente enrollada a partir de la semana 3 y la gota citoplásmica distal a partir de la semana 4 post tratamiento. Un punto para considerar al interpretar estos resultados es que el tiempo medio del paso por el epidídimo de los espermatozoides en perros domésticos es de 15 días (3 semanas) (Chłopik & Wysokińska, 2020), mismo intervalo de tiempo en que se empezaron a detectar alteraciones en el espermiograma.
Debido a que la estructura de los fitoestrógenos es similar a la de los estrógenos endógenos y tienen la capacidad de unirse a los RE, es posible observar efectos fisiológicos en los tejidos que expresan al receptor (Rietjens et al., 2017; Beszterda & Frański, 2018). Una vez que la molécula del COU se une a cualquiera de los receptores estrogénicos (ERα y ERβ) puede emitir una señal fluorescente (Serrano et al., 2008; Wang et al., 2014). En el presente estudio, se detectó dicha señal con mayor intensidad en el tejido conectivo del epidídimo de los perros del grupo TCOU, lo que confirma que el COU es absorbido y probablemente se une a los receptores estrogénicos presentes en este tejido, lo cual previamente fue reportado por Pérez-Rivero et al. (2014) en testículos de murciélagos hematófagos (Desmodus rotundus) adultos y por Serrano et al., (2008) en perros machos, en ambos casos cuando se administró COU por la vía oral. Con respecto a la ecogenicidad del parénquima testicular se aprecia homogénea en toda la periferia, se observa una zona con disminución de la ecogenicidad en la región del mediastino, la cual corresponde a la localización de los conductos deferentes y la red testicular, lo que concuerda con los cambios encontrados a nivel histológico relacionados con la dilatación de los túbulos del epidídimo, la pérdida de las microvellosidades y la disminución del contenido de espermatozoides en su lumen (Mantziaras, 2020; Lubinus et al., 2006).
El proceso de biosíntesis de estrógenos depende de la actividad de la enzima aromatasa, un miembro de la superfamilia del citocromo P450 (Hess & Cooke, 2018). La aromatasa es responsable de convertir la testosterona y la androstenediona en estrógenos aromáticos, 17β-estradiol y estrona, respectivamente (Hess & Cooke, 2018). Se ha descrito que el COU puede unirse a la enzima aromatasa, lo que provoca la inhibición de la biosíntesis de estrógenos, por lo que, es posible considerar que el aumento en la concentración sérica de testosterona se deba a este efecto (Wyse et al., 2021; Lephart, 2015).
Los estrógenos se encuentran en concentraciones elevadas en las células epiteliales que recubren los conductos eferentes, siendo su principal función reabsorber el líquido luminal y con ello aumentar la concentración de espermatozoides. La ausencia del efecto biológico de los estrógenos induce la acumulación de líquido en los conductos eferentes, lo que finalmente genera dilatación de los mismos y de la rete testis, de manera posterior se presenta disminución de la altura epitelial, del número y altura de las microvellosidades en el epidídimo y de manera posterior la atrofia del epitelio seminífero, todos estos cambios favorecen la dilución del semen (Hess & Cooke, 2018; Pérez-Rivero et al., 2009).
CONCLUSIÓN
Los estudios realizados, demostraron que la administración subcutánea de coumestrol puede ser una alternativa no invasiva para disminuir la capacidad fertilizante de los perros, ya que indujo alteraciones en la actividad y celularidad gonadales asociadas a la disminución de la producción y calidad espermática. Sin embargo, aún se requieren estudios para evaluar su posible efecto reversible y capacidad fertilizante de los espermatozoides.











 texto en
texto en