INTRODUCCIÓN
A nivel mundial, la acuicultura de ornato es una actividad que ha ganado importancia dado a la contribución económica que representa para el sector acuícola, por lo que se estima genera cerca de 500 millones de dólares anuales (Opiyo et al., 2016; Sicuro, 2018; Velasco-Santamaría & Corredor-Santamaría, 2011; Ghosh et al., 2003). Actualmente, países miembros de la Unión Europea, Estados Unidos y Japón, representan los mayores mercados de peces ornamentales a nivel mundial, sobresaliendo especies como discos, guppy, espada, molly, molly velero y goldfish; además de especies marinas (Ghosh et al., 2003; Velasco-Santamaría & Corredor-Santamaría, 2011).
México no ha sido la excepción, puesto a que la producción de peces ornamentales ha permitido el desarrollo regional mediante la creación de empleos e ingresos, especialmente en las zonas rurales (Martínez et al., 2010; CONAPESCA, 2018; Sivakumar et al., 2015); sin embargo, el éxito productivo de la actividad se encuentra comprometido por una baja eficiencia técnica dentro de las unidades de producción acuícola (UPA); así como por su desarrollo de manera empírica, lo cual conflictúa la operación de las unidades, especialmente cuando se busca pasar de un sistema de producción extensivo a uno intensivo; por lo que es común que los acuicultores se enfrenten a una gran diversidad de problemas, donde los asociados a la calidad del agua representan los más habituales (Njoku et al., 2015; Martínez et al., 2010; Rajeshwari & Devasree, 2017). En este sentido, se ha determinado que los parámetros físicos y químicos del agua de cultivo, influyen en el estado de salud de los organismos y a su vez en la composición de la microbiota del estanque, lo cual determina la incidencia de enfermedades durante los ciclos productivos (Chidambaram et al., 2013; Ginson et al., 2017; Ajayi & Okoh, 2014). Aunado a lo anterior, es importante mencionar que a nivel nacional se requiere de la actualización y/o modificación en materia legislativa, con respecto a la producción de especies acuáticas con fines ornamentales. De manera particular, los temas a trabajar están relacionados con la sanidad, dentro de los que se engloban cuestiones de calidad del agua de cultivo; así como referente a prácticas de manejo aplicadas en las UPA´s. Con lo anterior, se pretende garantizar un producto libre de patógenos, ya que la falta de regulación en estos aspectos podría tener consecuencias no solo a nivel productivo, sino también sobre la salud humana y de los ambientes circundantes (Valenzuela-Armenta et al., 2018; Vasile et al., 2017; Saremi et al., 2013).
Debido a lo anterior, el objetivo del presente estudio estuvo enfocado en determinar el estatus bacteriológico de granjas productoras de peces de ornato de Morelos y la calidad del agua empleada durante los procesos de cultivo, considerando las normas nacionales vigentes que aplican.
MATERIAL Y MÉTODOS
Área de estudio
El estudio se realizó en cuatro granjas productoras de peces de ornato localizadas en la Subcuenca del Río Apatlaco en el Estado de Morelos, México. Las coordenadas de cada una de ellas, así como la forma en que fueron identificadas son las siguientes:
Granja A: 18° 38' 53.9" N y 99° 13' 13.2" W
Granja B: 18° 38' 52.3" N y 99° 13' 10.4" W
Granja C: 18° 38' 55.9" N y 99° 13' 09.4" W
Granja D: 18° 39' 20.4" N y 99° 12' 00.9" W
El estudio comprendió dos temporadas del año 2017, correspondientes a la época de sequía durante los meses de febrero a marzo y la temporada de lluvias durante junio y julio.
Muestreos
Muestras de agua, alimento y organismos de la especie Poecillia sphenops, comúnmente conocida como molly, fueron colectadas en cada una de las unidades; se consideró a esta especie dado a que representa una de las de mayor demanda y producción en la región. Para evaluar el estado sanitario de los peces y determinar el tamaño de muestra se emplearon las tablas propuestas por el Manual de Pruebas de Diagnóstico para los Animales Acuáticos, considerando peces con apariencia clínica normal y el volumen de producción en cada unidad (alrededor de 2000 organismos); además de una prevalencia del 10% y una confiabilidad del 95%, por lo que se incluyeron 27 organismos en cada unidad por visita (OIE, 2008).
Los organismos fueron colectados al azar de cada uno de los estanques y transportados vivos con aireación continua, en bolsas de plástico con agua de los mismos estanques. La colecta de agua se realizó a partir de los estanques de producción de P. sphenops en cada una de las granjas; asimismo, muestras de agua del canal de Las Estacas (suministra agua a las granjas A, B y C) y del canal del río Apatlaco (suministra agua a la granja D) fueron colectadas. Para el muestreo se siguieron las estipulaciones de las Normas Oficiales Mexicanas NMX-AA-003-1980 y NOM-001-ECOL-1996. Se obtuvieron tres muestras simples del mismo punto, colectadas de manera aséptica mediante el empleo de frascos estériles; su transportación y mantenimiento se realizó a 4º C (FAO, 2011).
Finalmente, la colecta de muestras de alimento en cada una de las unidades de producción se realizó por triplicado y de manera aséptica, empleando bolsas estériles para su transportación (NOM-109-SSA1-1994).
Todas las muestras fueron colectadas semanalmente durante las temporadas estudiadas, y para su análisis se transportaron al Laboratorio de Química en Alimento Vivo de la Universidad Autónoma Metropolitana, Unidad Xochimilco.
Análisis microbiológico
El análisis de los organismos fue aprobado por el Comité de Ética de la División de Ciencias Biológicas y de la Salud de la Universidad Autónoma Metropolitana. La eutanasia de los organismos se realizó con una sobredosis de benzocaína, empleando el método de inmersión (AVMA, 2013); posteriormente bajo condiciones asépticas se realizó la disección de estos para exponer los órganos internos y extraer las vísceras, las cuales fueron homogeneizadas en solución salina estéril al 0.89% (OIE, 2008). Para el caso de las muestras de alimento y agua se analizó 1 g-1 y 1 mL-1 de cada una de ellas, las cuales se homogeneizaron en 9 mL de solución salina estéril (0.89%) (Prado et al., 2013).
En todos los casos se realizaron tres diluciones seriadas, las cuales fueron inoculadas por triplicado en placas de agar infusión cerebro corazón (BHI) de la marca BD Bioxon ® (214700), tiosulfato citrato bilis sacarosa (TCBS) marca BD Difco™ (265020) y eosina y azul de metileno (EMB) marca BD Bioxon ® (210600) e incubadas a 35 ± 2º C durante 48 horas bajo condiciones aerobias. Transcurrido este periodo se caracterizó la morfología colonial y se realizó el conteo de unidades formadoras de colonias (UFC) empleando un contador de colonias y seleccionando aquellas placas que tuvieran entre 30 y 300 colonias (Velasco & Tapia, 2014).
Para determinar el número de UFC mL-1 o UFC g-1 se empleó la siguiente fórmula (Njoku et al., 2015; Prado et al., 2013; NOM-110-SSA1-1994):
Donde:
N: promedio de número de colonias
ID: inverso de la dilución
V: volumen de muestra inoculado
Para la identificación bacteriana se realizó la elección diferencial de colonias en función de la morfología, para que fueran representativas de los distintos tipos de colonias recuperadas. Mediante resiembras sucesivas se aislaron las bacterias y con tinción de Gram se verificó su pureza (Velasco & Tapia, 2014). Las bacterias se identificaron mediante pruebas bioquímicas y utilizando un sistema comercial de identificación bacteriana mediante galerías API® (20 E; 20 NE; 50 CH y 50 CHB) (BioMerieux, México).
Análisis de coliformes
El conteo de coliformes se determinó siguiendo la metodología propuesta por la NMX- AA-042-SCFI-2015, empleando como medio de cultivo caldo lactosado Bioxon ® (211700) y caldo bilis verde brillante Difco™ (273000). La temperatura de incubación fue de 35º C durante 48 horas para la prueba presuntiva; mientras que la prueba confirmativa de coliformes totales se incubó a 37º C por 48 horas, y para coliformes fecales a 44º C durante 24 horas. Los análisis de cada punto muestreado se realizaron por triplicado y los resultados se expresaron como NMP por cada 100 mL-1 de agua.
Parámetros fisicoquímicos
La medición de parámetros como pH, temperatura, oxígeno disuelto (O.D), salinidad y sólidos totales disueltos (STD) se efectuaron in situ (NMX-AA-008-SCFI-2011), empleando una sonda multiparamétrica modelo HI 98194 (HANNA®, México). Los parámetros químicos como las formas nitrogenadas (N) y el fósforo (P), se analizaron con un fotómetro multiparamétrico modelo HI 83203 (HANNA®, México), siguiendo las instrucciones del fabricante para cada caso.
Análisis de demanda biológica de oxígeno
La determinación de demanda biológica de oxígeno a los cinco días (DBO5), se efectúo empleando el método Winkler determinado por la NMX-AA-028-SCFI-2001, realizando los ensayos por triplicado. La medición de la concentración de oxígeno disuelto inicial y final se realizó con un oxímetro modelo HI 9146 (HANNA®, México).
Análisis estadístico
Los datos se sometieron a un análisis descriptivo; posteriormente para determinar diferencias entre los sitios de muestreo y las temporadas monitoreadas, se aplicaron pruebas de comparación de medias múltiples por análisis de varianza y prueba t de Student por mínima diferencia significativa (P<0.05), previa verificación de que los datos cumplieran los supuestos de normalidad. Para el caso de los resultados microbiológicos (UFC mL-1), los datos fueron transformados a Log 10 para cumplir los supuestos de normalidad. Todas las pruebas estadísticas fueron realizadas empleando el programa estadístico SYSTAT 13.0 ®.
RESULTADOS
Análisis microbiológico de agua
El análisis microbiológico de agua permitió aislar e identificar un total de 10 especies bacterianas pertenecientes al grupo de las Proteobacterias y Firmicutes, donde ambos afluentes de agua presentaron la mayor diversidad y abundancia bacteriana durante las temporadas analizadas, determinándose inclusive diferencias significativas para la mayoría de las bacterias identificadas en el canal de Las Estacas, respecto a las granjas que se abastecen del mismo, como se puede observar en la tabla 1. Asimismo, se observó un cambio en la composición de la microbiota durante la temporada de lluvias en el canal de Las Estacas y las granjas que se abastecen de éste, desplazándose especies como Burkholderia gladiolii y Bacillus thuringiensis; registrándose por el contrario a las especies Vibrio parahaemolyticus y Aeromonas hydrophila. Cabe señalar que B. gladiolii solo fue registrada en el canal de Las Estacas durante la temporada de secas; mientras que Pseudomonas luteola se reportó solo en la granja A durante la época de lluvias. En relación al grupo de las Enterobacterias, Klebsiella sp. y Escherichia coli, mostraron un ligero aumento en el recuento de UFC mL-1 durante la época de lluvias en el canal de las Estacas; sin embargo, no se determinó diferencia estadística para E. coli (p>0.05) de una temporada a otra.
Tabla 1 Valores promedio de conteos bacterianos en muestras de agua
| Conteos de UFC mL-1 | |||||||
|---|---|---|---|---|---|---|---|
| Especies | Época | Canal las Estacas | Granja A | Granja B | Granja C | Canal Apatlaco | Granja D |
| Escherichia coli | S | 2.6 ± 0.2 | 2.4* ±0.2 | 2.6 ± 0.0 | 2.8* ± 0.1 | 3.0 ± 0.3 | N/D |
| LI | 2.8 ± 0.0 | N/D | 2.7 ± 0.5 | N/D | 2.2 ± 0.2 | N/D | |
| Klebsiella sp. | S | 3.5* ± 0.1 | 3.2 ± 0.5 | 2.6 ± 0.0 | 2.7 ± 0.2 | 3.7 ± 0.5 | N/D |
| Ll | 4.5* ± 0.1 | N/D | 3.2 ± 0.2 | 2.7 ± 0.1 | 4.4 ± 0.1 | 2.4 ± 0.1 | |
| Bacillus thuringiensis | S | 3.5* ± 0.3 | 3.3 ± 0.6 | 2.5 ± 0.3 | 2.0* ± 0.0 | N/D | N/D |
| Ll | N/D | N/D | N/D | N/D | N/D | N/D | |
| Burkholderia cepacian | S | 2.6 ± 0.3 | 2.5 ± 0.1 | 2.3 ± 0.3 | N/D | 3.2 ± 0.5 | 2.4 ± 0.1 |
| Ll | 3.0* ± 0.2 | N/D | N/D | 2.0 ± 0.0 | 4.4 ± 0.2 | 2.4 ± 0.1 | |
| Bacillus cereus | S | 3.2 ± 0.5 | 2.7 ± 0.0 | N/D | 3.3 ± 0.4 | 2.6 ± 0.6 | N/D |
| Ll | 3.2* ± 0.1 | 2.3 ± 0.0 | 2.5 ± 0.0 | 2.4 ± 0.5 | 4.2 ± 0.2 | 4.7 ± 0.1 | |
| Burkholderia gladioli | S | 2.5 ± 0.2 | N/D | N/D | N/D | N/D | N/D |
| Ll | N/D | N/D | N/D | N/D | N/D | N/D | |
| Aeromonas hydrophila | S | N/D | N/D | N/D | N/D | N/D | N/D |
| Ll | 3.1* ± 0.5 | 2.0 ± 0.0 | 2.3 ± 0.2 | 2.8 ± 0.1 | N/D | 2.4 ± 0.1 | |
| Vibrio parahaemolyticus | S | N/D | N/D | N/D | N/D | N/D | N/D |
| Ll | 2.2 ± 0.3 | N/D | N/D | N/D | N/D | N/D | |
| Pseudomonas luteola | S | N/D | N/D | N/D | N/D | 2.1 ± 0.2 | 2.5 ± 0.2 |
| Ll | N/D | 2.2 ± 0.2 | N/D | N/D | 3.4 ± 0.3 | N/D | |
| Bacillus firmus | S | N/D | N/D | N/D | N/D | 2.0 ± 0.0 | N/D |
| Ll | N/D | N/D | N/D | N/D | N/D | N/D | |
Nota. S: Secas; Ll: Lluvias; N/D: No detectado; ± Desviación estándar; * Diferencia significativa (p < 0.05).
Un comportamiento similar se observó en el canal del río Apatlaco, en el que altos conteos bacterianos fueron registrados; sin embargo, no se determinaron diferencias estadísticas con respecto a la granja D (p >0.05). No obstante, se pudo constatar que a medida que se incrementaron los conteos de bacterias como Klebsiella sp. y Bacillus cereus, éstas pudieron ser registradas en la granja D durante la temporada de lluvias. Por el contrario, la especie E. coli solo fue detectada en el canal del rio Apatlaco; mientras que A. hydrophila solo estuvo presente en la granja D (tabla 1).
Análisis microbiológico de peces
A partir del análisis microbiológico de los organismos, se lograron identificar un total de siete especies bacterianas para la temporada de secas y cinco para lluvias, presentándose la mayor diversidad en la granja B durante ambas temporadas (tabla 2). Del total de especies registradas solamente Enterococcus faecalis y Vibrio alginolyticus resultaron ser diferentes a las reportadas en el análisis de agua.
Tabla 2 Valores promedio de conteos bacterianos en Poecillia sphenops durante las estaciones analizadas
| Especies | Época | Conteos de UFC mL-1 | |||
|---|---|---|---|---|---|
| Granja A | Granja B | Granja C | Granja D | ||
| Vibrio alginolyticus | S | 2.5 ± 0.2 | 2.6 ± 0.0 | 3.2 ± 0.0 | 4.6* ± 0.2 |
| Ll | 2.7 ± 0.4 | 2.7 ± 0.3 | N/D | 3.5* ± 0.4 | |
| Enterococcus faecalis | S | 3.4* ± 0.1 | 2.0 ± 0.0 | N/D | N/D |
| Ll | N/D | N/D | N/D | N/D | |
| Escherichia coli | S | 4.4 ± 0.0 | 4.4 ± 0.0 | 4.8 ± 0.1 | 4.7 ± 0.5 |
| Ll | 4.3 ± 0.1 | 4.2 ± 0.0 | 4.3 ± 0.0 | 4.6* ± 0.1 | |
| Klebsiella sp. | S | 4.4 ± 0.0 | 4.8 ± 0.0 | 4.4 ± 0.1 | 5.0* ± 0.2 |
| Ll | 4.1 ± 0.0 | 4.4 ± 0.3 | 4.2 ± 0.0 | 4.4 ± 0.0 | |
| Bacillus cereus | S | 4.4 ± 0.0 | N/D | 4.4 ± 0.0 | 4.6 ± 0.2 |
| Ll | N/D | N/D | N/D | N/D | |
| Vibrio parahaemolyticus | S | N/D | 2.5 ± 0.6 | N/D | 2.8 ± 0.3 |
| Ll | 2.3 0.0 | 3.2* ± 0.2 | N/D | 2.6 ± 0.0 | |
| Burkholderia cepacian | S | 4.4 ± 0.0 | 5.3 ± 0.2 | 5.7* ± 0.3 | 5.0 ± 0.1 |
| Ll | N/D | N/D | N/D | N/D | |
| Brevibacillus sp. | S | N/D | 4.2 ± 0.3 | N/D | N/D |
| Ll | N/D | N/D | N/D | N/D | |
| Aeromonas hydrophila | S | N/D | N/D | N/D | N/D |
| LL | 4.9 ± 0.1 | 4.4 ± 0.0 | 4.9 ± 0.1 | 4.9 ± 0.0 | |
Nota. S: Secas; Ll: Lluvias; N/D: No detectado; ± Desviación estándar; * Diferencia significativa (p < 0.05).
Los mayores recuentos bacterianos se registraron en las granjas A y D, determinándose diferencias significativas como se aprecia en la tabla 2. Tales datos sugieren que existe una influencia directa de la microbiota del agua, sobre las bacterias presentes en los organismos; ya que además durante la temporada de lluvias, se observó que a medida que se redujeron concentraciones bacterianas de especies como Bacillus cereus y Burkholderia cepacea en agua, éstas ya no fueron registradas en los peces, y por el contrario se reportaron las especies Pseudomonas luteola y A. hydrophila (tabla 2).
En relación con las especies E. coli y Klebsiella sp., el análisis microbiológico de los peces reveló una reducción en su concentración durante la temporada de lluvias; reportándose las concentraciones más altas en los organismos colectados en la granja D, existiendo diferencia estadística (p=0.0212 y p=0.0009) respecto al resto de las unidades (tabla 2).
Análisis microbiológico de alimento
Los datos obtenidos a partir del análisis microbiológico del alimento se presentan en la tabla 3, en la que se muestra el aislamiento de seis especies bacterianas. Del total de bacterias recuperadas, Bacillus megaterium únicamente fue registrada a partir de muestras de alimento, donde los mayores recuentos se presentaron en las granjas C y D, para las cuales se determinó diferencia estadística (p=0.0272) respeto al resto de las granjas; asimismo, P. luteola y B. cereus solo fueron aisladas de muestras provenientes de la granja B durante la época de lluvias.
Tabla 3 Valores promedio de conteos bacterianos en muestras de alimento durante las estaciones analizadas
| Especies | Época | Conteos de UFC mL-1 | |||
|---|---|---|---|---|---|
| Granja A | Granja B | Granja C | Granja D | ||
| Klebsiella sp. | S | 2.4 ± 0.6 | N/D | 2.6 ± 0.2 | 3.9* ± 0.6 |
| Ll | 3.1 ± 0.1 | 3.1 ± 0.1 | 3.0 ± 0.2 | 2.8 ± 0.2 | |
| Bacillus cereus | S | 2.3 ± 0.0 | 2.8 ± 0.3 | 2.5 ± 0.2 | 4.4* ± 0.2 |
| Ll | N/D | 2.8 ± 0.2 | N/D | N/D | |
| Burkholderia cepacia | S | 2.2 ± 0.2 | 2.5 ± 0.3 | N/D | 5.1* ± 0.6 |
| Ll | 2.8 ± 0.1 | N/D | 4.0 ± 0.1 | 4.7* ± 0.2 | |
| Bacillus megaterium | S | 2.7 ± 0.1 | 2.6 ± 0.0 | 3.8* ± 0.3 | 5.4* ± 0.2 |
| Ll | N/D | N/D | N/D | N/D | |
| Aeromonas hydrophila | S | N/D | N/D | N/D | N/D |
| Ll | 4.0 ± 0.0 | 3.2* ± 0.2 | 3.9 ± 0.2 | N/D | |
| Pseudomonas luteola | S | N/D | N/D | N/D | N/D |
| Ll | N/D | 3.1 ± 0.2 | N/D | N/D | |
Nota. S: Secas; Ll: Lluvias; N/D: No detectado; ± Desviación estándar; * Diferencia significativa (p < 0.05).
De manera general, el análisis de alimento de la granja D presentó los mayores conteos de UFC mL-1, determinándose inclusive diferencias significativas con el resto de las unidades de producción como se aprecia en la tabla 3.
Determinación de coliformes
En la figura 1 apartado a, se puede observar que para el caso de las granjas que se abastecen de agua a partir del canal de Las Estacas, la mayor concentración de coliformes totales se reporta en la granja C durante la temporada de secas; mientras que en época de lluvias se registra una reducción en su concentración; en contraposición, el canal Apatlaco y la granja D muestran una tendencia en aumento.
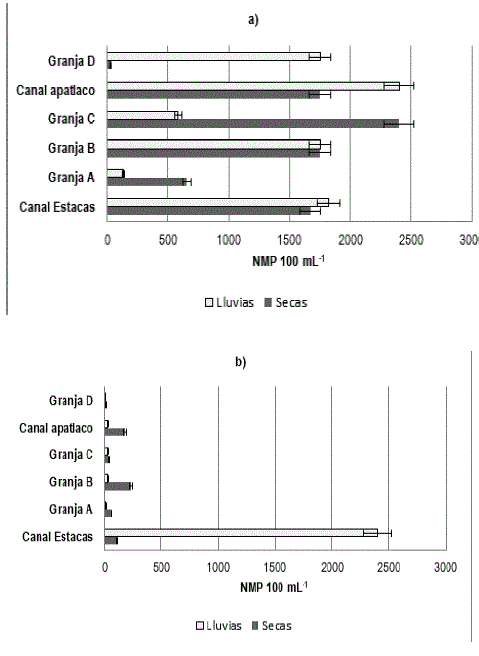
Figura 1 Valores promedio de conteo de bacterias coliformes. a) Coliformes totales; b) Coliformes fecales. * Diferencia significativa (p < 0.05)
Con respecto a las coliformes fecales, en la granja B se registraron las mayores densidades durante la época de estiaje; mientras que el canal de Las Estacas mostró un incremento significativo (p=0.0482) en la temporada de lluvias, el cual incluso supera el límite máximo permisible (1000 NMP por cada 100 mL-1) por la NOM-001-ECOL-1996. Por otro lado, la granja D y al canal del río Apatlaco mostraron una reducción en la carga bacteriana de este grupo durante lluvias, determinándose diferencia significativa para el canal del rio Apatlaco (p=0004) (figura 1, apartado b).
Parámetros fisicoquímicos
Los datos obtenidos de los parámetros fisicoquímicos se presentan en la tabla 4, donde se muestra que la temperatura del agua se mantuvo en los 21.9 ºC y 25.7 ºC durante la época de secas y dentro de los 23.2 ºC a los 29.5 ºC en lluvias, registrándose las menores temperaturas en ambos canales con respecto a las granjas; determinándose diferencia estadística para el canal de Las Estacas en temporada de secas (p=0.0360). En contraste, las máximas temperaturas fueron registradas en las granjas B y D. Para el caso de pH, nuevamente los afluentes presentan los valores más bajos; mientras que en las granjas D y A se registró la mayor alcalinidad con valores de 9.8 y 9.6 unidades durante la temporada de secas y lluvias respectivamente.
Tabla 4 Valores promedio de parámetros fisicoquímicos registrados en agua durante las estaciones analizadas
| Parámetro | Época | Canal las Estacas | Granja A | Granja B | Granja C | Canal Apatlaco | Granja D |
|---|---|---|---|---|---|---|---|
| Temperatura (°C) | S | 21.9* ± 1.6 | 22.6 ± 3.5 | 24.7 ± 4.5 | 23.1 ± 0.2 | 23.4 ± 1.6 | 25.7 ± 0.2 |
| Ll | 24.2 ± 1.4 | 29 ± 0.3 | 29.2 ± 0.4 | 28.3 ± 0.3 | 23.2 ± 1.2 | 29.5 ± 0.5 | |
| pH | S | 7.9 ± 0.2 | 8.16 ± 0.2 | 8.8 ± 0.4 | 7.9 ± 0.3 | 8.4 ± 0.003 | 9.8* ± 0.4 |
| Ll | 8.3 ± 0.5 | 9.6* ± 0.2 | 8.6 ± 0.1 | 8.8 ± 0.4 | 8.2 ± 0.4 | 9.2 ± 0.001 | |
| OD (mg L-1) | S | 9.1 ± 0.8 | 9.7 ± 2.7 | 10.2 ± 1.6 | 6.6 ± 2.9 | 8.2 ± 0.01 | 7.5 ± 1.9 |
| Ll | 7.1 ± 2.9 | 7.9 ± 0.4 | 7.7 ± 1.2 | 5.5 ± 2.3 | 7.7 ± 1.1 | 7.6 ± 1.1 | |
| STD (ppt) | S | 0.61 ± 0.01 | 0.64 ± 0.01 | 0.57 ± 0.01 | 0.58 ± 0.01 | 0.51 ± 0.01 | 0.43 ± 0.0 |
| Ll | 0.59 ± 0.04 | 0.78* ± 0.08 | 0.62 ± 0.04 | 0.52 ± 0.03 | 0.37 ± 0.2 | 0.44 ± 0.06 | |
| NH4 (mg L-1) | S | 0.26 ± 0.0 | 0.17 ± 0.02 | 1.3 ± 0.4 | 0.21 ± 0.03 | 0.29 ± 0.2 | 0.19 ± 0.08 |
| Ll | 3.21* ± 0.9 | 0.39 ± 0.1 | 0.28 ± 0.1 | 0.62 ± 0.2 | 0.37 ± 0.09 | 0.19 ± 0.09 | |
| NO2 (mg L-1) | S | 0.07 ± 0.03 | 0.19 ± 0.1 | 0.07 ± 0.04 | 0.03 ± 0.01 | 0.13* ± 0.06 | 0.04 ± 0.01 |
| Ll | 0.2 ± 0.1 | 0.07 ± 0.0 | 0.12 ± 0.0 | 0.07 ± 0.1 | 0.63* ± 0.2 | 0.02 ± 0.02 | |
| NO3 (mg L-1) | S | 2.2 ± 1.0 | 3.55 ± 0.4 | 0.73* ± 0.9 | 3.27 ± 0.5 | 6.85 ± 0.4 | 2.65 ± 1.2 |
| Ll | 3.45 ± 1.1 | 2.57 ± 0.6 | 0.95 ± 0.2 | 1.9 ± 0.6 | 5.3 ± 0.7 | 0.46* ± 0.8 | |
| P (mg L-1) | S | 0.51 ± 0.25 | 0.39 ± 0.3 | 0.15 ± 0.07 | 0.26 ± 0.07 | 0.82 ± 0.0 | 0.56 ± 0.4 |
| Ll | 0.83 ± 0.5 | 0.32 ± 0.3 | 0.05* ± 0.0 | 0.15 ± 0.1 | 0.75 ± 0.2 | 0.4* ± 0.06 | |
| DBO5 (mg L-1) | S | 3.4 ± 1.8 | 34.5* ± 0.42 | 16.7 ± 2.8 | 6.82 ± 3.1 | 10 ± 3.1 | 11.8 ± 3.4 |
| Ll | 4.5 ± 2.6 | 17.3 ± 1.8 | 17 ± 3.7 | 13.6 ± 2.6 | 3.8* ± 0.4 | 8.8 ± 4.7 |
Nota. S: Secas; Ll: Lluvias; ± Desviación estándar; * Diferencia significativa (p < 0.05).
De manera general, la concentración de O.D mostró una disminución de la temporada de secas a la de lluvias (tabla 4), registrándose la menor concentración en la granja C; mientras que la mayor fue registrada en la granja B durante la temporada de secas (10.2 mg L-1) y en la granja A durante lluvias (7.9 mg L-1). En ningún caso hubo diferencia estadística.
En lo que respecta a los STD, los mayores valores se reportan en la granja A durante ambas temporadas, determinándose incluso diferencia estadística en época de lluvias (p=0.0007); en contraposición los menores valores se registraron en la granja D (0.43 ppt) y en el canal del río Apatlaco (0.37 ppt). Por otro lado, las formas nitrogenadas mostraron una tendencia en aumento de la temporada de secas a la de lluvias en ambos canales, con excepción de los nitratos (NO3) en el canal Apatlaco. En cuanto a concentraciones de fósforo, se observa una tendencia en decremento durante la temporada de lluvias con respecto a la de secas, no obstante en el canal de Las Estacas ocurre lo contrario ().
Finalmente, se presentan los valores de DBO5 (tabla 4), donde la mayor concentración fue reportada en la granja A con 34.5 mg L-1 durante la época de estiaje, mostrando una diferencia significativa (p=0.001), respecto al resto de las granjas que se abastecen del canal de Las Estacas y el mismo canal; así como una reducción en su concentración (17.3 mg L-1) durante la temporada de lluvias. Por el contrario, la concentración más baja fue registrada en el canal de Las Estacas y en el canal Apatlaco en época de lluvias, determinándose diferencias estadísticas para este último (p=0.0279), respecto a la granja D a la cual abastece.
DISCUSIÓN
Los resultados microbiológicos del presente estudio se asemejan a los reportados por Smith et al. (2012), quienes a partir de un análisis metagenómico del agua de acuario de peces ornamentales, reportan al grupo de las Proteobacterias como las especies bacterianas más representativas y dentro de las cuales encontramos a las especies A. hydrophila, V. alginolyticus y V. parahaemolyticus; bacterias que pudieron ser dentificadas en el presente estudio a partir de muestras de agua y de los organismos. Dichas bacterias son consideradas parte de la microbiota normal de organismos acuáticos; sin embargo, son clasificadas como bacterias oportunistas, por lo que un aumento en su concentración asociado a estrés en los organismos pueden originar brotes infecciosos en los peces (All-Sunaiher et al., 2010, Sahoo et al., 2016, Younes et al., 2016, Rameshkumar et al., 2017). En este sentido, es preciso mencionar que durante la temporada de lluvias A. hydrophila presentó la mayor frecuencia de aislamiento en los organismos, evento que concuerda con lo reportado en otros estudios al realizar la vigilancia de bacterias presentes en Poecillia sphenops (Carnevia et al., 2013; Rajeshwari & Devasree, 2017); no obstante, en este caso no se registraron daños o lesiones en los organismos.
Es importante tener presente que durante los ciclos de cultivo los peces son propensos a ser colonizados por bacterias presentes en su ambiente, por lo que las características microbiológicas del agua, estanque y alimento juegan un papel importante sobre su microbiota (Sivakumar et al., 2015; Vasile et al., 2017). Contemplando lo anterior, los resultados obtenidos hacen notorio el impacto que el agua procedente de los afluentes, tiene sobre la microbiota de los peces, lo cual podría ser atribuido a que ésta no recibe ningún tratamiento previo a ser empleada dentro de las unidades, por lo que la presencia de bacterias como E. coli y Klebsiella sp., indicaron contaminación fecal procedente de organismos homeotermos (Tenaillon et al., 2010). Tales resultados concuerdan con los obtenidos por Valenzuela-Armenta et al. (2018), quienes reportan altas concentraciones de E. coli en muestras de agua obtenidas de estanques de producción de tilapia en granjas de Sonora, México. Por otro lado, Njoku et al. (2015), reportan a partir de un análisis bacteriológico de estanques de producción de peces a la bacteria E. coli como dominante, lo cual fue atribuido al empleo de fertilizantes orgánicos basados en estiércol de animales. En el presente estudio no pudo ser confirmada dicha práctica; no obstante, es evidente la falta de buenas medidas sanitarias en las unidades, ya que incluso los resultados microbiológicos del alimento podrían ser causados por contaminación cruzada, debida a un manejo inadecuado.
Por otro lado, las especies B. firmus y B. thuringiensis detectadas en los estanques, pudieran ser atribuidas a que la región estudiada es de vocación agrícola, y ambas bacterias son comúnmente empleadas como control biológico de patógenos de importancia agrícola, por lo que su presencia puede ser causa de escurrimientos hacia los canales (Terefe et al., 2009).
En relación a la presencia de coliformes y en función a las normas mexicanas encargadas de regular la calidad de los efluentes provenientes de la actividad acuícola, todas las granjas cumplen con los límites máximos permitidos de coliformes totales y fecales (NOM-001-ECOL-1996); sin embargo, aunque los organismos producidos en las granjas estudiadas no son para consumo humano, es importante tener presente que este tipo de microorganismos podrían afectar la salud del personal de las unidades.
Parámetros como temperatura y materia orgánica evaluados en el canal de Las Estacas, concuerdan con los reportados por Gómez-Márquez et al. (2013) para el embalse localizado en el municipio de Tepalcingo, Morelos; quienes reportan un aumento de temperatura de la temporada de secas (25 ºC) a la de lluvias (28 ºC), así como un aumento en la presencia de materia orgánica en los meses de junio y julio (estación de lluvias), lo cual es debido al acarreo de materia orgánica que propician las lluvias; además de ello, señalan que el aumento del nivel de agua del embalse durante la época de lluvias genera una dilución en la concentración de parámetros químicos; tal fue el caso de las concentraciones de amonio y fósforo en el canal Apatlaco. En contraposición, dichos parámetros aumentaron en el canal de Las Estacas, rebasando incluso los límites permitidos por la norma oficial NOM-001-ECOL-1996, por lo que es importante hacer mención a que durante esta temporada se realizó el desazolve del canal y aunque se presentaron lluvias en la zona, el nivel del agua se vio fuertemente reducido, afectando a su vez a las granjas que se abastecen del mismo.
Con respecto a los parámetros fisicoquímicos reportados en los estanques, todos se encontraron bajo lo estipulado por las normas encargadas de regular la calidad de los efluentes provenientes de la actividad acuícola (NOM-001-ECOL-1996; Proyecto NOM- 089-ECOL-1994), donde parámetros como el fósforo, considerado un indicador trófico e indispensable para la producción de fitoplancton, se mantuvo por debajo del máximo soportado por organismos acuáticos (2 mg L-1); así como por debajo de lo que se considera un proceso de eutrofización (> 0.5 mg L-1) (Coldebella et al., 2018). Asimismo, la concentración de nitritos, los cuales resultan tóxicos para los peces en concentraciones superiores a 1 mg L-1 (Ginson et al., 2017) se mantuvieron por debajo de lo mencionado, a pesar de que durante época de lluvias las granjas que dependen del canal de Las Estacas no realizaron recambios de agua. Finalmente, el considerable incremento de DBO5 durante la temporada de secas en la granja A, puede ser un reflejo de las prácticas de manejo empleadas, puesto a que como menciona Sipaúba-Tavares et al. (2013), la calidad del agua en las granjas está en función de la densidad de los peces y del manejo de los alimentos, donde altas tasas de alimentación aumentan la cantidad de materia orgánica, reducen el O.D, producen un exceso de compuestos como NH3 y NO2 e inclusive propician el incremento de bacterias; debido a la disposición de nutrientes (Ajayi & Okoh, 2014). Aunado a ello, cabe resaltar que según el estudio elaborado por Coldebella et al. (2018), a medida que avanza el ciclo productivo la materia orgánica presente es menos biodegradable por las bacterias encargadas de realizar la remoción de nutrientes, por lo que la descomposición biológica se hace más lenta. Contemplando lo anterior, es importante considerar que de no realizarse el correcto manejo de los efluentes de las granjas acuícolas, existe un aporte significativo de materia orgánica y sustancias químicas hacia los cuerpos de agua receptores, implicando una fuente de contaminación constante; por lo que se hace indispensable contar con obras que den un tratamiento previo y un constante monitoreo de la calidad del agua de descarga (Boyd, 2003; Velasco-Amaro et al., 2015).
CONCLUSIONES
Los resultados en el presente estudio determinaron que la calidad del agua del canal de Las Estacas y del canal del río Apatlaco se encuentra alterada, lo cual tiene un impacto significativo sobre la calidad sanitaria de los organismos producidos en las UPA´s; no obstante, las granjas cumplen con las normas oficiales mexicanas, encargadas de regular los efluentes derivados de la actividad acuícola. Sin embargo, es importante implementar medidas sanitarias en las unidades, con la finalidad de reducir riesgos de producción, garantizar la calidad del producto y con ello aumentar el valor de éste; así como cuidar la salud del personal y de los ambientes circundantes.











 texto en
texto en 



