INTRODUCCIÓN
La camaronicultura en los países en desarrollo contribuye a su crecimiento económico y brinda fuentes de empleo (Patil et al., 2021); dentro de esta actividad, la producción de camarón L. vannamei a nivel mundial (4,966241 t) supera la de otros camarones peneidos (154,615 t) (FAO, 2018); sin embargo, las enfermedades infecciosas y las diferentes condiciones ambientales han supuesto un desafío continuo en el cultivo de camarón de cualquier especie (FAO, 2018), generando grandes pérdidas económicas e inestabilidad en la industria camaronícola (Varela et al., 2017).
Las enfermedades virales son las más difíciles de controlar por su gran poder de diseminación, sus múltiples vías de infección y el amplio espectro de hospederos tanto silvestres como cultivados (Wang et al., 1997). El virus del síndrome de la mancha blanca (por sus siglas en inglés, WSSV) es uno de los virus de camarón más patógenos que infecta a una amplia gama de crustáceos decápodos en todo el mundo; algunos de estos poseen el papel de vectores o reservorios (Flegel & Alday, 1998; OIE, 2019). Este virus, además puede causar mortalidades masivas alcanzando casos hasta de un 100 % durante un periodo de tres a diez días, después de los primeros signos clínicos de la enfermedad (Marks, 2005).
A pesar de los tratamientos para el manejo y control de la enfermedad y mortalidad provocada por la presencia del WSSV, la única alternativa efectiva hasta el momento en la producción de camarón es la implementación de prácticas de bioseguridad o exclusión como filtración y desinfección (Esparza-Leal et al., 2009). Sin embargo, las investigaciones científicas actualmente se encuentran centradas en mejoras de las prácticas de manejo y en la disminución de condiciones de estrés, mediante la evaluación y desarrollo de aditivos inmunoestimulantes; por lo que se han convertido en una estrategia novedosa y promisoria para establecer las bases de resistencia y medidas profilácticas para L. vannamei contra agentes patógenos (Barracco et al., 2014).
Las sustancias inmunoestimulantes son obtenidas a través de fuentes naturales y también por síntesis química con base en la estructura molecular de productos naturales, estas sustancias tienen la capacidad de regular o modificar la respuesta inmune; por lo cual también se les conoce como inmunomoduladores o inmunopotenciadores, y se pueden definir como un componente natural que regula el sistema inmune e incrementa la resistencia del hospedero contra enfermedades causadas por agentes patógenos (Bricknell & Dalmo, 2005).
Niu et al. (2018) mencionan que al utilizar la macroalga Porphyra haitanensis (2.51 y 3.14 %) como suplemento en alimentos acuícolas se mejora la respuesta inmune de L. vannamei, aumentando la resistencia contra virus y bacterias, generando un mejoramiento en la función intestinal y una resistencia al estrés oxidativo.
DebMandal & Mandal (2011) hacen una revisión acerca de los compuestos bioactivos de C. nucifera dentro de la medicina tradicional hindú, en cuanto a la promoción de la salud y prevención de enfermedades. Dentro de estos compuestos bioactivos del coco se encuentran principalmente los ácidos grasos de cadena media, como el láurico, mirístico y palmítico, compuestos fenólicos y vitamina E (Montoya, 2021). Dado el impacto negativo del síndrome de la mancha blanca en la camaronicultura, se destaca que por todo lo anterior el coco puede presentar actividad antiviral, antibacteriana, antiparasitaria y además tiene un efecto inmuoestimulatorio en diversos modelos de animales; incluyendo un efecto antiviral potencial contra el SARS-CoV-2 (DebMandal & Mandal, 2011; Elsbaey et al., 2021; Angeles-Agdeppa et al., 2021).
En el presente trabajo se evaluó el aceite de coco (C. nucifera), suplementado en la dieta con potencial antiviral para reducir mortalidades ocasionadas por el virus de la mancha blanca en el cultivo de camarón blanco L. vannamei
MATERIAL Y MÉTODOS
Consideraciones éticas. Este estudio cumple con la Norma Oficial Mexicana NOM-062ZOO-1999, especificaciones técnicas para la producción, cuidado y uso de animales de laboratorio. L. vannamei no se considera una especie en peligro de extinción o protegida.
Aclimatación de los camarones a las condiciones del cultivo. Para los bioensayos se recolectaron camarones presuntivamente sanos provenientes de granjas acuícolas de San Blas, Nayarit, e inmediatamente fueron transportados al Laboratorio de Biotecnología Molecular Experimental (LABME) de la Escuela Nacional de Ingeniería Pesquera (ENIP) en contenedores de plástico de 100 L, con agua de los estanques de cultivo y aireación ( = 5.4 ± 0.12 mg/L). La aclimatación de los camarones a las condiciones del cultivo se realizó durante 48 h, ajustando la salinidad 2 ‰/h hasta llegar a 35 ‰. Se empleó un tanque de plástico con capacidad de 1000 L que contenía 800 L de agua de mar filtrada (20 µm); se mantuvieron los organismos con aireación continua y a su vez fueron alimentados con una ración diaria correspondiente al 5 % de su biomasa total dos veces al día 08:00 y 17:00 h con alimento comercial (AC, 35 % de proteína).
Preparación de las dietas experimentales con aceite de coco (C. nucifera): El ACEV empleado para la preparación de las dietas experimentales se sometió a un análisis del perfil de ácidos grasos, de acuerdo con el método propuesto por la AOAC (2012). Para la inclusión del aceite de coco extra virgen (prensado en frío), se pulverizó el AC en un procesador de alimentos (Oster® modelo FPSTFP1355); se mezcló el AC con aceite de coco (ACEV) al 2.5 % y 5 % por 0.5 kg-1 de alimento. Una vez realizada la mezcla se agregó una disolución de grenetina (4 %) en 180 mL de agua destilada hasta formar una pasta. El pellet se elaboró con la pasta resultante mediante un molino de carne (Torrey modelo 22), equipado con un dado de 3/32” (3 mm). Los pellets formados se colocaron en charolas para su deshidratación y secado a temperatura ambiente durante 24 h; posteriormente el alimento fue almacenado a 4 °C.
Análisis proximal de las dietas experimentales. Se realizó el análisis proximal del AC y del AC con 2.5 % de ACEV y AC con 5 % de ACEV. Los análisis realizados fueron humedad con el método NMX-F-083-1986, cenizas con el método NMX-F-607-NORMEX2013, lípidos (extracto etéreo) con el método NOM-086-SSA1-1994 (apéndice normativo C, numeral 1), proteína (NX6.25) con el método NMX-F-608-NORMEX-2011, fibra cruda con el método NMX-F-613-NORMEX-2017 y carbohidratos totales con el método NOM051-SCFI/SSA1-2010 (por diferencia de análisis proximal).
Inóculo viral del WSSV y su detección molecular por PCR. El inóculo viral del WSSV (251018) fue donado por el Centro Interdisciplinario para el Desarrollo Integral Regional (CIIDIR IPN Unidad Sinaloa), previo a su uso fue analizado usando PCR sencillo y anidado (Kimura et al., 1996). La detección del WSSV en el inóculo y los organismos se realizó mediante PCR punto final en dos fases; primero las muestras fueron analizadas con PCR sencilla, y las que resultaron negativas fueron analizadas mediante PCR anidada con los oligonucleótidos propuestos por Kimura et al. (1996).
Análisis de la prevalencia del WSSV. La prevalencia fue determinada de acuerdo al porcentaje de organismos enfermos y/o infectados por el WSSV, entre el número de organismos analizados de acuerdo a Margolis et al. (1982).
Obtención de la hemolinfa y conteo total de hemocitos (CTH). La extracción de la hemolinfa se realizó antes de la primera ración de alimento (7:00-8:00 a.m.), para evitar diferencias en el ciclo circadiano; la hemolinfa se obtuvo con una jeringa estéril (1 mL) en la arteria ventral abdominal (Fisher et al., 1995). La jeringa fue cargada previamente con 200 µL de solución isotónica anticoagulante SIC-EDTA (450 mM NaCl, 10 mM KCl, 10 mM EDTA-Na2, 10 mM HEPES, pH 7.3 y 850 mOsm kg-1) pre-enfriada (4 °C) para camarones (Vargas-Albores et al.,1993), depositándola en tubos estériles de 1.5 mL sobre hielo. Se tomaron 50 µL de la dilución 2:1 de SIC-EDTA-hemolinfa y se mezclaron con 150 μL (1:3 v/v) de una solución de formaldehido pre-enfriado al 4 %, para fijar los hemocitos. A partir de esta dilución se realizó el conteo individual utilizando una cámara Neubauer con una retícula de 0.01 mm bajo un microscopio binocular (Leica DM300). La respuesta inmune del camarón se evaluó mediante el conteo total de hemocitos de acuerdo a Cabrera-Pérez et al. (2019):
(CTH) (células/mL) = (Hc ∗ D ∗ C)/0. 4,
Donde: Hc es el número total de hemocitos contados; D es el factor de dilución de la hemolinfa y C es la conversión del factor x 0.1 mm3 x mL (1000).
Bioensayo I. Evaluación de la concentración del aceite de C. nucifera como inmunoestimulante. La duración de este bioensayo fue de 20 días; se llevó a cabo en tanques de plástico con capacidad de 200 L, que contenían 180 L de agua de mar (35 ‰) filtrada (20 µm) y aireación constante. El bioensayo consistió en tres tratamientos cada uno por triplicado (30 camarones por tanque con un peso promedio inicial de 5.46 ± 0.19 g): I) Control AC; II) AC + 2.5 % de ACEV; III) AC + 5 % de ACEV. Los organismos experimentales se alimentaron dos veces al día (8:00 a.m. y 17:00 p.m.). Durante el bioensayo se monitorearon las variables fisicoquímicas dos veces al día: El pH fue medido con un potenciómetro Hanna Hi98130, la salinidad con refractómetro ATAGO modelo 2491, la temperatura y el oxígeno disuelto con un multiparámetro YSI pro20i.
La determinación de amonio, nitritos y nitratos se realizó cada 10 días con un fotómetro YSI 9500. Al final de cada bioensayo se determinó la supervivencia mediante la ecuación:
S = (N° ind f / N° ind. i) ∗ 100
Donde N° ind f es el número de individuos vivos al final del bioensayo y N° ind i es el número de individuos vivos al inicio del bioensayo (Escobar-Gil et al., 2017). La tasa de crecimiento específica (TCE) fue determinada mediante la ecuación:
TCE (%día − 1) = [100 ∗ (LnW2 − LnW1)]t
Donde: W2 es el peso final, W1 el peso inicial y t es el número de días de cultivo (Ziaei-Nejad et al., 2006).
La respuesta inmune del camarón se evaluó mediante el conteo total de hemocitos de acuerdo con lo descrito por Cabrera-Pérez et al. (2019). Se analizaron individualmente (27) organismos en el CTH, 9 organismos por tratamiento que representaron el 30 % de la población total de cada tratamiento.
Bioensayo II. Evaluación de la actividad antiviral del aceite de coco suplementado en la dieta de L. vannamei infectado con WSSV. La duración del bioensayo fue de 27 días, donde en el día 23 se infectó a los camarones con el inóculo del WSSV. Se llevó a cabo en acuarios con capacidad de 80 L, las cuales se llenaron con 50 L de agua de mar (35 ‰) filtrada (20 µm). El bioensayo consistió en cuatro tratamientos, cada uno por triplicado (10 camarones por acuario con un peso promedio de 7.7 ± 0.25 g): I) AC + WSSV; II) AC + 2.5 % de ACEV + WSSV; III) Control de AC; IV) Control de AC + 2.5 % de ACEV. Los organismos experimentales se alimentaron dos veces al día (8:00 a.m. y 17:00 p.m.). Durante el bioensayo se monitorearon las variables fisicoquímicas dos veces al día de la misma forma que en el biensayo I.
Al final de cada bioensayo se determinó la supervivencia de acuerdo a Escobar-Gil et al. (2017) y la TCE de acuerdo a Ziaei-Nejad et al. (2006). Previo a la infección se realizó un análisis inicial de prevalencia de WSSV de camarones provenientes de la granja el cual fue de 100 % (determinados por PCR anidado). En el día 23, la infección de los camarones en el tratamiento I y II se reinfectó con 10 µL de inóculo de camarón previamente infectado con WSSV el cual fue inyectado en la parte dorsal del segundo segmento abdominal con una jeringa de insulina de 0.3 Ml; además, a los organismos de estos tratamientos (I y II) se procedió a alimentarlos con pasta de camarones infectados con WSSV.
Se cuantificó la prevalencia del WSSV en el camarón, como se describió anteriormente (Margolis et al., 1982). Para determinar la prevalencia del WSSV, los camarones infectados permanecieron en observación hasta presentar signos evidentes de la enfermedad de la mancha blanca. Se analizaron individualmente 30 organismos por tratamiento; además los organismos moribundos fueron recolectados y sacrificados para verificar la presencia del WSSV con PCR sencilla y anidada; se conservaron a -80 ºC. También se evaluó la respuesta inmune del camarón mediante el conteo total de hemocitos (Cabrera-Pérez et al., 2019). Se analizaron individualmente 3 organismos por réplica para el CTH, 9 organismos por tratamiento que representaron el 30 % de la población total de cada tratamiento.
Análisis estadísticos. Se realizó una prueba de normalidad (Kolmogorov Smirnov) y homocedasticidad (Bartlett), un análisis de varianza de una vía (ANOVA) y una prueba de comparaciones múltiples de Tukey (HSD), para identificar la naturaleza de estas diferencias en la supervivencia, tasa de crecimiento específica, conteo total de hemocitos y la prevalencia del WSSV; utilizando el programa STATISTICA Versión 6 (StatSoft 2003). Los valores de p<0.05 fueron considerados significativamente diferentes. Los datos de supervivencia y prevalencia se transformaron mediante una función arcoseno de acuerdo a Font et al. (2007).
RESULTADOS
Perfil de ácidos grasos del aceite de coco (C. nucifera). Se identificaron un total de 36 ácidos grasos, de los cuales 12 presentaron valores porcentuales (g/100 g de grasa) (tabla 1). El resto de los ácidos grasos presentaron valores de <0.01 por debajo del límite mínimo de calibración detectable. Dentro de esta determinación el 94.52 % corresponde a grasas saturadas, 4.90 % a grasas monoinsaturadas y 0.83 % a grasas poliinsaturadas.
Tabla 1 Perfil de ácidos grasos del aceite de coco puro
| NOMBRE COMÚN | TIPO DE GRASA | CONCENTRACIÓN (%) (g/100g de grasa) | |||
|---|---|---|---|---|---|
| Ácido lignocérico | Saturada | 0.03 | |||
| Ácido araquídico | Saturada | 0.08 | |||
| Ácido caproico | Saturada | 0.77 | |||
| Ácido esteárico | Saturada | 2.92 | |||
| Ácido cáprico | Saturada | 6.38 | |||
| Ácido palmítico | Saturada | 8.03 | |||
| Ácido caprílico | Saturada | 8.60 | |||
| Ácido mirístico | Saturada | 17.97 | |||
| Ácido láurico | Saturada | 49.47 | |||
| Ácido butírico, ácido pentadecanoico, ácido heptadecanoico, ácido heneicosanoico, ácido behénico, ácido tricosanoico | Saturada | <0.01* | |||
| cis-11- Ácido eicosenoico | Monoinsaturada | 0.03 | |||
| Ácido oleico (grupo omega 9) | Monoinsaturada | 4.87 | |||
| Ácido miristoleico, cis-10- ácido pentadecenoico, ácido palmitoleico, cis-10- heptadecenoico, ácido nervónico (Grupo Omega 9), ácido erúcico (Grupo Omega 9) | Monoinsaturada | <0.01* | |||
| Ácido linoleico (Grupo Omega 6) | Poliinsaturada | 0.83 | |||
| g- Ácido linolénico (Grupo Omega 6), ácido linolénico (Grupo Omega 3), cis-4,7,10,13,16,19- ácido docosahexaenoico (Grupo Omega 3), cis-5,8,11,14,17- ácido eicosapentaenoico (Grupo Omega 3), cis-11,14- ácido eicosadienoico, cis-8,11,14- ácido eicosatrienoico (Grupo Omega 6), cis-11-14-17- ´ácido eicosatrienoico (Grupo Omega 3), ácido araquidónico (Grupo Omega 6), cis-13,16- ácido docosadienoico (Grupo Omega 6) | Poliinsaturada | <0.01* | |||
| Ácido elaídico (C18:1 TFA), ácido linolelaídico (C18:2 TFA), C18:3 TFA | Trans | <0.01* | |||
*Por debajo del nivel más crítico de calibración
Composición químico-proximal de las dietas experimentales. Los resultados de análisis proximal del tratamiento I (AC), tratamiento II (AC + 2.5 % de ACEV) y tratamiento III (AC + 5 % de ACEV) se presentan en la tabla 2. El porcentaje de humedad fue menor en el tratamiento III con un valor de 10.91 %, seguido del tratamiento II con un valor de 12.30 % y el tratamiento I con 12.37 %. El porcentaje de cenizas fue de 8.12 %, 8.34 % y 8.52 % para el tratamiento I, III y II, respectivamente. En cuanto a lípidos, se obtuvo un porcentaje de 5.26 % en el tratamiento I, seguido de 7.64 % para el tratamiento II y 10.09 % para el tratamiento III. El porcentaje de proteínas fue de 32.89 %, 34.53 % y 35.28 %, que corresponden al tratamiento III, II y I, respectivamente. El porcentaje de fibra cruda fue de 4.53 % para el tratamiento II, 6.86 % para el tratamiento III y 9.67 % para el tratamiento I; mientras que para carbohidratos totales el menor porcentaje fue para el tratamiento II con 37.01 %, seguido del tratamiento III con 37.77 % y el tratamiento I con 38.97 %. Los porcentajes de proteína, lípidos y carbohidratos con respecto al total de la dieta en cada uno de los tratamientos se encontraron dentro de los requerimientos nutricionales recomendados para L. vannamei de acuerdo con Martínez-Córdova et al. (2014).
Tabla 2 Composición químico-proximal de las dietas experimentales
| Composición proximal (% en peso) | Tratamientos | ||
|---|---|---|---|
| I | II | III | |
| Humedad | 12.37 | 12.30 | 10.91 |
| Cenizas | 8.12 | 8.52 | 8.34 |
| Lípidos (extracto etéreo) | 5.26 | 7.64 | 10.09 |
| Proteínas (N-6.25) | 35.28 | 34.53 | 32.89 |
| Fibra cruda | 9.67 | 4.53 | 6.86 |
| Carbohidratos totales | 38.97 | 37.01 | 37.77 |
Tratamientos: I) AC (35 % proteína); II) AC + 2.5 % de ACEV; III) AC + 5 % de ACEV
Bioensayo I.
Parámetros fisicoquímicos. Los parámetros fisicoquímicos evaluados se mantuvieron dentro de los intervalos óptimos para el cultivo de L. vannamei durante los 20 días de duración del bioensayo, según Brock & Main (1994).
Calidad de agua (amonio, nitritos y nitratos). Durante el cultivo, las concentraciones de los compuestos nitrogenados se encontraron dentro del intervalo óptimo para el cultivo del camarón blanco, de acuerdo a Boyd (2001) y SENASICA (2003).
Supervivencia y tasa de crecimiento específico (TCE). No se encontraron diferencias significativas en la supervivencia entre los tratamientos (p = 0.256); sin embargo, la supervivencia (fig. 1) en el tratamiento I fue de 100 %, mientras que en los tratamientos II y III con 2.5 % y 5 % de ACEV se obtuvieron valores del 93.33 % y 98.89 %, respectivamente.

Figura 1 Supervivencia de L. vannamei. Tratamientos: I) Control AC (35 % proteína); II) AC + 2.5 % ACEV; III) AC + 5 % de ACEV
El análisis estadístico no mostró diferencias significativas en la TCE (% día-1), entre tratamientos (p = 0.668); sin embargo, la TCE fue mayor en el tratamiento I con 1.44 ± 0.32 (%día-1), respecto al tratamiento II con 1.41 ± 0.13 (%día-1) y al tratamiento III con
1.28 ± 0.11 (%día-1) (fig. 2).

Figura 2. Tasa de crecimiento específica de L. vannamei. Tratamientos: I) Control AC (35 % proteína); II) AC + 2.5 % de ACEV; III) AC + 5 % de ACEV. Las barras indican el valor promedio ± desviación estándar y (P) análisis de varianza ANOVA
Conteo total de hemocitos (CTH). El valor promedio del conteo total de hemocitos por mililitro de hemolinfa en el tratamiento I fue de 3.83 x 106 ± 0.52 x 106 células /mL. En los tratamientos II y III fue de 4.11 x 106 ± 0.36 x 106 células /mL y 3.92 x 106 ± 0.50 x 106 células/mL, respectivamente. El análisis de varianza (ANOVA) no mostró diferencias significativas (p = 0.449) entre tratamientos (fig. 3).

Figura 3 Conteo total de hemocitos (hemocitos/mL) en L. vannamei. Tratamientos: I) Control AC (35 % proteína); II) AC + 2.5 % de ACEV; III) AC + 5 % de ACEV. Las barras indican el valor promedio ± desviación estándar y (P) análisis de varianza ANOVA.
Con base en los resultados obtenidos, a pesar de que entre tratamientos con ACEV no se encontraron diferencias significativas, se seleccionó el tratamiento II (2.5 % de ACEV) para el siguiente bioensayo, debido a que fue donde se utilizó la menor cantidad de ACEV y además los resultados de TCE y el CTH en este mismo tratamiento fue mayor que en los restantes.
Bioensayo II.
Parámetros fisicoquímicos. Los parámetros fisicoquímicos evaluados se mantuvieron dentro de los intervalos óptimos para el cultivo de L. vannamei durante los 27 días de duración del bioensayo, según Brock & Main (1994).
Calidad de agua (amonio, nitritos y nitratos). Durante el cultivo la concentración de los compuestos nitrogenados se encontraron dentro del intervalo óptimo para el cultivo del camarón blanco, de acuerdo a Boyd (2001) y SENASICA (2003).
Tasa de crecimiento específico (TCE). La TCE (%día-1) no presentó diferencias significativas (p = 0.644) entre los tratamientos (fig. 4 ). El tratamiento I presentó 0.60 ± 0.10 %día-1, el tratamiento II presentó 0.58 ± 0.08 %día-1; mientras que el tratamiento III presentó la mayor tasa de crecimiento específico por día con 0.73 ± 0 .29 (%día-1), y el tratamiento IV presentó 0.69 ± 0.10 %día-1. Estos resultados indican que el ACEV no tuvo un efecto en la TCE (%día-1).

Figura 4 Tasa de crecimiento específica de L. vannamei. Tratamientos: TI) AC + WSSV; TII) AC + 2.5 % de ACEV + WSSV; TIII) Control de AC; TIV) Control de AC + 2.5 % de ACEV. Las barras indican el valor promedio ± desviación estándar y (P) análisis de varianza ANOVA
Supervivencia y prevalencia del WSSV. La supervivencia (fig. 5), presentó diferencias significativas (p = 0.0030) entre el tratamiento I con respecto al resto de los tratamientos. En el tratamiento I (control-infectado con WSSV) la supervivencia fue menor con 83.3 %, seguido del tratamiento II (infectado con WSSV) con 93.3 %. En los tratamientos III y IV, la supervivencia fue del 100 %. Los resultados muestran que a pesar de estar infectados con el WSSV, los organismos del tratamiento II con 2.5 % de ACEV mostraron mayor supervivencia que en el tratamiento I también infectado con WSSV, por lo que pudiera considerarse un efecto benéfico del ACEV ante WSSV.

Figura 5 Supervivencia (%), prevalencia (%), infectados vivos (%), infectados muertos (%) de L. vannamei. Tratamientos: I) AC + WSSV; II) AC + 2.5 % de ACEV + WSSV; III) Control de AC; IV) Control de AC + 2.5 % de ACEV. Las barras indican el valor promedio ± error estándar y (P) análisis de varianza ANOVA. Las letras indican diferencias significativas entre tratamientos de acuerdo con la prueba de rangos múltiples Tukey
La prevalencia inicial de WSSV de camarones provenientes de la granja fue del 100 % (determinados por PCR anidada), y con una reinfección únicamente en los tratamientos I y II, la prevalencia fue 100 % (determinados por PCR sencilla). Sin embargo, al final del bioensayo se analizó la prevalencia de WSSV de todos los tratamientos en los cuales no se encontraron diferencias significativas (p = 0.2192).
La prevalencia final del WSSV en los camarones del tratamiento I fue del 100 % (determinados por PCR sencilla), en los camarones del tratamiento II fue del 96.67 %, (de los cuales 86.21 % fueron determinados por PCR sencillo y 13.79 % determinados por PCR anidado), donde el 93.33 % se encontraban infectados vivos, 3.33 % infectados muertos y el 3.33 % restante sin presencia de virus. En los camarones del tratamiento III la prevalencia fue del 100 % (determinados por PCR anidado) y en los camarones del tratamiento IV fue del 93.33 %, (de los cuales el 100 % fueron determinados por PCR anidado), donde el 93.33 % se encontraban infectados vivos y el 6.66 % estaban vivos, pero sin presencia de virus.
Se observó que en el tratamiento II no sólo se redujo la prevalencia a un 3.33 %, sino también la carga viral (determinada por PCR anidada); mientras que para el tratamiento IV la prevalencia disminuyó 6.67 % (determinado por PCR anidado). Los resultados muestran que los tratamientos con 2.5 % de ACEV presentaron un efecto en la disminución de la prevalencia y la carga viral de WSSV (fig. 5).
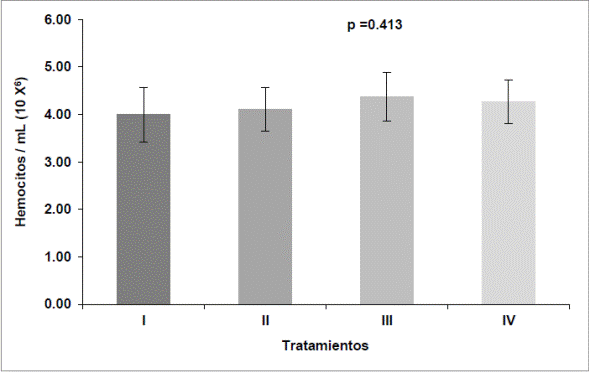
Conteo total de hemocitos (CTH). El análisis estadístico del conteo total de hemocitos no mostró diferencias significativas (p = 0.413) entre los tratamientos. El conteo total de hemocitos por mililitro de hemolinfa fue mayor en el tratamiento III con un promedio 4.37 x 106 ± 0.52 x 106 células /mL, seguido del tratamiento IV con 4.27 x 106 ± 0.46 x 106 células /mL, el tratamiento II con un promedio de 4.10 x 106 ± 0.46 x 106 células /mL y el tratamiento I con un promedio 3.99 x 106 ± 0.57 x 106 células /mL (fig. 6).
DISCUSIÓN
Debido al impacto negativo que han generado las enfermedades causadas por distintos agentes etiológicos como virus y bacterias, así como la resistencia que estos presentan a los antibióticos que se emplean para tratamiento y control de las enfermedades infecciosas (Lieberman et al., 2006), surge la necesidad de implementar nuevas estrategias que mejoren la inmunidad de las especies de importancia acuícola y que además aumenten la resistencia contra virus y bacterias, promoviendo también una resistencia al estrés mediante la suplementación en alimentos acuícolas con aditivos naturales inmunoestimulantes (Berger, 2000; Rendón & Balcázar, 2003).
De acuerdo con Turchini et al. (2009) y Turchini et al. (2011), una de las principales alternativas que se están aplicando como aditivo en dietas son los aceites vegetales, ya que ofrecen una amplia gama de ácidos grasos de cadena media (AGCM) con bajo peso molecular. De acuerdo con Kapilan & Reddy (2008) y Akinnuga et al. (2014), el aceite de coco está compuesto principalmente por AGCM; además de una gran variedad de compuestos fenólicos, los cuales según Nevin & Rajamohan (2009) mejoran la actividad de enzimas antioxidantes y eliminan el exceso de radicales libres en las células. Por otro lado, Lu et al. (2018) señalan que en el caso del ácido láurico, éste estimula el crecimiento y la salud de algunas especies acuáticas como Pelteobagrus fulvidraco. En el análisis de perfil de ácidos grasos del ACEV utilizado en este trabajo, el ácido láurico presentó una concentración de 49.47 % (g/100g de grasa), donde la alta concentración sugiere que este aceite podría ser utilizado como un tratamiento alternativo ante la problemática actual contra patógenos en los cultivos de camarón, ya que puede ser adicionado al alimento para combatir el WSSV o disminuir su carga viral.
De acuerdo con Niu et al. (2018), las sustancias que se apliquen en los sistemas de cultivo o en el alimento no deben alterar el valor nutricional o afectar negativamente el desempeño productivo de los organismos. Esto coincide con los presentes resultados sobre la composición químico-proximal, donde se muestra que al adicionar en el ACEV no se afectaron los valores nutricionales de las dietas experimentales y se encontraron dentro de los valores óptimos para el desarrollo de L. vannamei reportados por MartínezCórdova et al. (2014). Con respecto a la TCE, en el Bioensayo 1 y 2 no se observó afectación en los camarones al utilizar el ACEV en diferentes concentraciones. En el Bioensayo 1 se observó que a medida que aumentaba la concentración de lípidos (% en peso) la TCE mostró una tendencia a disminuir. De acuerdo con Cahu (1994), los niveles de lípidos óptimos recomendados para alimentos comerciales de camarón varían de 6 a 7.5 %, sin exceder 10 %; sin embargo, en los resultados de esta investigación se encontraron entre 5.26 % (AC), 7.64 % (2.5 % ACEV) y 10.09 % (5 % ACEV), a pesar de encontrarse dentro del nivel óptimo de lípidos totales (5-10 %), en una dieta para camarón. De acuerdo con Martínez-Córdova et al. (2014) y López-Marcos (2020), se pudiera considerar que las menores TCE se deben a un exceso en los niveles de lípidos (Cahu, 1994).
La literatura científica sobre el efecto de aceite de coco en L. vannamei es escasa; sin embargo los resultados de la TCE de este estudio son consistentes con los reportados por Apraku et al. (2017), quienes evaluaron la mezcla de aceite de coco virgen y el aceite de pescado sobre el crecimiento y la resistencia a Streptococcus iniae en tilapia del Nilo (Oreochromis niloticus), encontrando que el crecimiento no se vio afectado al sustituir parcial y completamente el aceite de pescado por el aceite de coco virgen. También, estos resultados concuerdan con otros trabajos, donde se han empleado aceites de origen vegetal, como el de Mozanzadeh et al. (2015); quienes señalan que no fue comprometido el rendimiento del crecimiento de juveniles Sparidentex, hasta alimentados con dietas alternativas de aceite de origen vegetal (aceite de canola y aceite de girasol), al reemplazar parcial o totalmente la dieta de aceite de pescado.
Respecto a la supervivencia, en el Bioensayo 1 no se encontraron diferencias significativas entre los tratamientos; mientras que en el Bioensayo 2, el 100 % de los organismos provenían de estanques de granjas camaroneras infectadas con WSSV (baja carga viral), pero adicionalmente se realizó una reinfección en los tratamientos I y II, resultando con una alta carga viral al final del bioensayo y la menor supervivencia (83.3 %) observada en el tratamiento I (AC con WSSV), en comparación con el resto de los tratamientos II (ACEV con WSSV), III (AC) y IV (ACEV). Estos resultados concuerdan con Raa (1996), quien menciona que la finalidad de emplear inmunoestimulantes en el sector acuícola es para mejorar la supervivencia y la inmunidad de los organismos cultivados. Lo anterior es consistente con el hecho de que al adicionar ACEV en el alimento de camarón, las tasas de supervivencia de los camarones retados con alta y baja carga viral (WSSV) fueron significativamente más altas. Lo anterior podría deberse a lo mencionado por Fife (2013), quien señala que al utilizar ácido láurico a través de la ingesta de aceite de coco diariamente, éste puede proteger y prevenir infecciones provocadas por diferentes virus, como el virus de la inmunodeficiencia humana (VIH), sarampión, los Herpesviridae, virus de la gripe, entre otras enfermedades.
Los hemocitos son los responsables de la coagulación, endurecimiento del exoesqueleto y eliminación de los materiales extraños (AftabUddin et al., 2017). En el bioensayo I de este estudio se obtuvo un mayor número en el conteo total de hemocitos en los tratamientos (II y III), que contenían el aditivo de ACEV con respecto al tratamiento I (AC); indicando que hubo un aumento en la respuesta inmune de los camarones alimentados con este aditivo. Al respecto, Sequeira et al. (1996) mencionan que la proliferación de hemocitos puede aumentar hasta tres veces, cuando los camarones son alimentados con un inmunoestimulante; sin embargo, aunque en el bioensayo II no se encontraron diferencias significativas entre los tratamientos, sí se observa una disminución en el CTH del tratamiento I y II (infectados con WSSV), respecto a los tratamientos III y IV. Estos resultados concuerdan con lo reportado por Niu et al. (2018), quienes alimentaron a los camarones con distintos valores dietéticos inmunoestimulates de macroalgas, y al realizar el desafío con WSSV el número de hemocitos se redujo significativamente. La disminución en el conteo total de hemocitos puede atribuirse a que estos migran hacia el lugar de infección (Söderhäll et al., 2003) o donde exista un daño tisular (Niu et al., 2018). La enfermedad de la mancha blanca ha causado mortalidades severas en cultivos de camarón en todo el mundo (Jiang et al., 2006), siendo responsable de grandes pérdidas económicas en esta industria ( Sahul et al., 2006), por lo que se vuelve necesario prevenir o controlar la enfermedad de la mancha blanca (Huynh et al., 2011).
En el desarrollo del bioensayo II, se observó que la prevalencia inicial fue de 100 % de WSSV (determinados por PCR anidado) con baja carga viral, lo que significó que todos los organismos provenían infectados de la granja. Cabe señalar que los tratamientos I y II fueron re-infectados con inóculo viral para llevar a cabo el experimento y al final del bioensayo se observó que en el tratamiento I la prevalencia final fue de 100 % (determinados por PCR sencilla) con alta carga viral, en el tratamiento III la prevalencia fue del 100 % (determinados por PCR anidado); mientras que en los tratamientos con ACEV, el tratamiento II (2.5 % ACEV + WSSV) y el tratamiento IV (2.5 % ACEV). La prevalencia disminuyó a 96.67 % y 93.33 %, respectivamente; sin embargo, se observó que en el tratamiento II no sólo disminuyó la prevalencia del virus (96.67 %), sino también la carga viral; de los cuales 86.21 % fueron determinados por PCR sencillo y 13.79 % por PCR anidado.
La disminución en la prevalencia y la carga viral en los tratamientos con ACEV, sugiere que su aplicación como suplemento dietético ejerce una actividad antiviral contra el WSSV y reduce cargas virales de una manera semejante a como lo han reportado Lieberman et al. (2006) y Fife (2013), señalando que el ACEV se encuentra compuesto por AGCM como: ácido láurico con alrededor de 48-50 % de éste en su composición, seguido del ácido mirístico con aproximadamente un 15 % (Fife, 2013; Ruiz et al., 2016), ácido caprílico (8 %) (Fife, 2013; Akinnuga et al., 2014) y ácido cáprico (7 %) (Fife, 2013). Estos compuestos han demostrado su eficacia contra bacterias, hongos y virus (Esquenazi et al., 2002). En el caso de los virus, Oyi et al. (2010) mencionan que un componente del aceite de coco denominado monocaprina, destruía al VIH y el virus herpes simplex (HSV) en un minuto. De igual manera, Fife (2013) reportó que los AGCM presentes en el aceite de coco pueden desactivar virus como el VIH, coronavirus asociado con el síndrome respiratorio agudo, virus del sarampión, virus de la rubéola, Herpesviridae, virus del sarcoma, virus sincitial respiratorio, virus humano limfotrópico (tipo 1), virus de la estomatitis vesicular, virus Visna, citomegalovirus humano (CMV), virus Epstein-Barr (VEP), virus de la gripe, virus de la hepatits C (VHC) y virus Coxsackie B4. Al respecto, Murray (1994) y Dayrit (2000) registraron una disminución en la carga viral de VIH hasta niveles indetectables en personas infectadas con este mismo virus y una notoria mejoría en su salud después de consumir coco. Por lo anterior, se sugiere que el ACEV compuesto por AGCM como el ácido laúrico ofrece la posibilidad de disminuir la carga viral, que a su vez puede ser utilizado como forma inmunoterapéutica y preventiva ante situaciones de infecciones por WSSV.
CONCLUSIONES
De acuerdo a los resultados obtenidos, la adición del ACEV 2.5 % en el alimento promovió una disminución en la prevalencia y la carga viral del WSSV en juveniles de L. vannamei; no mostró efectos negativos en la supervivencia y en la TCE de L. vannamei. Adicionalmente, no se registró una inmunosupresión o reducción de la respuesta inmune, ya que no se presentaron diferencias significativas en el CTH entre los tratamientos de ambos bioensayos.
Este trabajo de investigación es el primer reporte del efecto del ACEV de cocos nucifera en la supervivencia del camarón blanco (Litopenaeus vannamei) retado con el WSSV. Por lo anterior, se recomienda realizar estudios acerca del uso del ACEV en el alimento bajo diferentes esquemas de formulación y tiempos de aplicación en la alimentación del camarón. Además, resulta fundamental profundizar en el estudio de las respuestas inmunonutricias del ACEV al incluirlo en la formulación de un alimento.











 texto en
texto en