INTRODUCCIÓN
La paratuberculosis (PTB) o Enfermedad de Johne (EJ), es una enfermedad crónica infecciosa que ocasiona una enteritis granulomatosa en los rumiantes y eventualmente otras especies, con una amplia distribución mundial; causada por el Mycobacterium avium subsp. paratuberculosis (MAP) (Coelho et al., 2010). Clasificada por la Organización Mundial de Sanidad Animal (OIE) como una enfermedad transmisible, con impacto socioeconómico y en la salud pública, sugiriéndose la participación de MAP en la enfermedad de Crohn en humanos (OIE, 2017; Balseiro et al., 2019;Gioffré et al., 2015). Del MAP se han descrito tres diferentes cepas la tipo I (Sheep), la tipo II (Cattle) y la tipo III (Bisón o intermedia), de acuerdo a su preferencia por infectar diferentes especies de rumiantes y sus distintos requerimientos para su aislamiento bacteriano (Begg y Whittington, 2010; Windsor, 2015). La enfermedad se caracteriza por presentar signos de emaciación progresiva, edema submandibular y eventualmente la muerte de los animales. La principal vía de infección es la fecal-oral, con un periodo de incubación que oscila de uno a cuatro años, por lo que pueden llegar a observarse signos de la enfermedad a partir del año de vida (Chávez et al., 2004), una vez que MAP ingresa al intestino se aloja en los macrófagos constituyendo una infección granulomatosa donde se pueden observar cantidades variables de bacterias (Begg y Whittington, 2010; Windsor, 2015). El diagnóstico, prevalencia e impacto de la enfermedad son escasos y no concluyentes tanto en América Latina como en México (Chávez et al., 2004; Begg y Whittington, 2010; Fernández et al., 2014).
En México, se ha detectado la presencia de PTB en ovinos en diversos estados del país, como son, San Luis Potosí, Guanajuato, Querétaro, Ciudad de México, Estado de México y Veracruz (Estévez et al., 2006). Particularmente, en el Estado de Aguascalientes, la actividad de la ovinocultura como en otros estados del país ha crecido a partir de 1990 en más del 100%, con una producción cárnica de aproximadamente 612 toneladas en el 2018, siendo la zona Valle, conformado por los municipios de Aguascalientes, San Francisco de los Romo, Rincón de Romos, Jesús María, Pabellón de Arteaga y Asientos, en donde se concentra el 85% de la producción de carne ovina del Estado y de la actividad pecuaria en general (SIAP, 2018).
Es de suma importancia resaltar que en esta región no se cuenta con registros del diagnóstico e identificación de las enfermedades que son capaces de afectar a los rebaños ovinos y el efecto adverso que éstas pueden causar en la productividad. Pues en el Estado de Aguascalientes existen casos no cuantificados de animales adultos con emaciación progresiva y mortalidad, sin embargo, no se realiza un diagnóstico y es imposible determinar si esta la PTB.
Por lo anterior, el objetivo del presente trabajo es identificar la presencia de MAP a través de estudios anatomopatológicos, cultivo y PCR en ovinos con cuadro clínico sugerente a PTB, así como determinar la seroprevalencia contra MAP mediante ELISA en rebaños ovinos del Valle de Aguascalientes.
MATERIAL Y MÉTODOS
Diseño del estudio
Este estudio de tipo descriptivo-transversal fue realizado en el Estado de Aguascalientes, México, siendo los rebaños y animales de estudio seleccionados de acuerdo con el método no probabilístico “por conveniencia” (Trusfield, 2018). De esta manera, fueron seleccionados 16 rebaños ovinos con poblaciones que oscilaron entre 60 y 340 individuos, conformando una población total de estudio de 2,415 animales (Figura 1 y Tabla 1), donde se requería que el rebaño contara con signos clínicos de emaciación progresiva crónica sugerente a PTB en al menos un ejemplar mayor a un año; considerando a cada rebaño como unidad experimental.
Tabla 1 Resultados de seroprevalencia (ELISA) a paratuberculosis, necropsias realizada y resultado de aislamiento bacteriano, por rebaño en el Valle de Aguascalientes
| Numero de rebaño | Seroprevalencia % | Resultados positivos ELISA-PPA-3 | Animales mayores de 1 año | Ejemplares con signos clínicos sugerentes a PTB/Necropsia realizada | Aislamiento Bacteriano y PCR positivo | Ubicación por municipio |
|---|---|---|---|---|---|---|
| 14 | 91.3 | 168 | 184 | +/1 | - | Rincón de Romos |
| 6 | 84.4 | 287 | 340 | +/1 | + | Aguascalientes (sur) |
| 3 | 76.3 | 122 | 160 | +/0 | Nr | Rincón de Romos |
| 11 | 73.1 | 117 | 160 | +/1 | + | Asientos |
| 10 | 64.4 | 125 | 194 | +/1 | - | Jesús María |
| 9 | 61.4 | 72 | 140 | +/1 | + | Asientos |
| 4 | 58.6 | 99 | 169 | +/1 | + | Aguascalientes (sur) |
| 15 | 56.8 | 50 | 88 | +/1 | - | San Francisco de los Romo C |
| 13 | 54.5 | 36 | 66 | +/0 | Nr | Pabellón de Arteaga |
| 16 | 46.7 | 56 | 120 | +/0 | Nr | Aguascalientes (Nte) |
| 1 | 43.8 | 35 | 80 | +/1 | - | Jesús María |
| 8 | 28.3 | 17 | 60 | +/0 | Nr | Pabellón de Arteaga |
| 5 | 12.9 | 8 | 62 | +/0 | Nr | Aguascalientes (Nte) |
| 7 | 9.5 | 31 | 326 | +/0 | Nr | Aguascalientes (sur) |
| 12 | 8.1 | 8 | 99 | +/0 | Nr | San Francisco de los Romo |
| 2 | 4.8 | 8 | 167 | +/1 | + | San Francisco de Los Romo |
| 16 | 51.3 | 1239 | 2415 | 16/9 |
Nr: No se realizó
Toma de muestras
Suero sanguíneo. Se obtuvieron 5 mL de sangre por venopunción de la yugular, la cual fue captada en tubos sin aditivo para la obtención del suero; posteriormente las muestras fueron almacenadas a - 20°C hasta su empleo en la prueba ELISA.
ELISA. Los sueros previamente obtenidos, se analizaron mediante la prueba de inmunoensayo enzimático indirecto (ELISA) empleando el antígeno protoplasmático PPA3 (Allied, Mo.), el cual presenta una especificidad del 75% y una sensibilidad del 64% de acuerdo con el protocolo empleado por García (1992).
Obtención de muestras para estudio histopatológico y aislamiento de MAP. Tomando como referencia a Timoney (1988) y observando el curso clínico de los animales y las características epidemiológicas de los 9 rebaños, se logró establecer un diagnóstico presuntivo en 9 animales; los cuales presentaron signos de emaciación progresiva, pelo o lana hirsuta, edema submandibular, lesiones y heces blandas. Entendiendo así, que el 56.25% de los rebaños de estudio, presentaron al menos un caso sugerente a PTB. Posteriormente los 9 animales fueron sacrificados con una sobredosis de pentobarbital sódico (NOM-033-SAG/ZOO-2014) de acuerdo a los lineamientos establecidos en el “Comité de ética para el uso de animales en la docencia e investigación de la Universidad Autónoma de Aguascalientes”.
La confirmación de estos casos se realizó por medio de necropsia e identificación de lesiones, descartando así la presencia de posibles lesiones sugerentes a diagnósticos diferenciales de pseudotuberculosis (Corynebacterium pseudotuberculosis), alteraciones digestivas por presencia de cuerpos extraños, neoplacias, neumonías crónicas y parasitosis severa, (Straub, 2004; Windsor, 2014).
Posterior a ello, se tomaron muestras de secciones intestinales de íleon y yeyuno, las cuales mostraron engrosamiento de la mucosa intestinal que sugerían lesiones asociadas a paratuberculosis; estas secciones fueron fijadas en formalina amortiguada (pH 7.6) para su posterior procesamiento histológico, empleando las tinciones de Hematoxilina-Eosina (H-E) y de Ziehl-Neelsen (ZN), esta última con la finalidad de evidenciar la presencia de bacilos ácido alcohol resistentes (BAAR) (Estévez, 2006). De igual manera, se obtuvieron muestras para aislamiento bacteriano a partir de secciones de 30 cm de íleon y yeyuno que mostraban lesiones sugerentes de PTB (Chávez et al., 2004; Dennis et al., 2011), siendo depositadas en recipientes estériles de plástico para su conservación a -20ºC hasta su procesamiento en el laboratorio.
Cultivo Bacteriano a partir de intestino. A su vez, a las muestras tomadas de intestino se les realizó un raspado de la mucosa intestinal con bisturí estéril, procesándolas para descontaminación y concentración de las micobacterias, de acuerdo con la metodología descrita por Sánchez y Guerrero, 2006. Posteriormente, del material de la interfase obtenida, fue inoculado en los medios de cultivo de Löwentein-Jensen (L-Jm) con micobactina, colocando tres a ocho gotas de cada una de las muestras, distribuyéndose en toda la superficie del medio. De cada muestra, se inocularon en dos diferentes tubos con medio L-Jm, uno conteniendo micobactina y el segundo sin micobactina. Posteriormente fueron incubados a 37°C, manteniéndolos en posición inclinada y sin humedad. Se verificó el crecimiento bacteriano cada cuatro semanas hasta la semana doce, los medios donde no se observó crecimiento, continuaron en incubación hasta la semana 40 (De Juan et al., 2006; Whittington, 2010).
PCR IS900. La identificación molecular se realizó a partir del crecimiento de las colonias de MAP, por medio de PCR punto final, empleando los iniciadores IS900P3N (5’-GGG TGT GGC GTT TTC CTT CG-3’) e IS900P5N (5'-ATTTCGCCGCCACCGCCACG-3') (Chávez et al., 2004).
Estimación de la seroprevalencia. La prevalencia se estimó con base en la proporción de animales que resultaron positivos en la prueba de ELISA, con relación a la población total de animales adultos en cada uno de los rebaños. La información generada en el estudio se evaluó y contrastó mediante pruebas de Estadística Descriptiva, mediante “Análisis para una variable”, con apoyo del paquete “Statgraphics Centurion XV” TM (Fernández et al., 2002).
RESULTADOS
Seroprevalencia. El porcentaje de seroprevalencia promedio de los 16 rebaños, fue de 51.3%, con un valor mínimo de 4.8% y un valor máximo de 91.33% con un intervalo de confianza al 95.0% para la media de: [32.7173, 62.3415]. Los resultados de seroprevalencia individual para cada uno de rebaños se describen la Tabla 1. En los dieciséis rebaños en los que se realizaron las pruebas de ELISA (PPA-3), se identificaron casos positivos, obteniéndose una seroprevalencia calculada a “nivel de rebaño” del 100% (Tabla 1).
Estudio anatomopatológico. En los 9 animales a los que se les realizó la necropsia, presentaron emaciación, lana o pelo hirsutos, edema submandibular (Figura 1), presencia de ascitis, degeneración de la grasa, así como engrosamiento aparente de la mucosa intestinal a nivel de íleon y yeyuno (Figura 2), además de aumento de tamaño de linfonodos mesentéricos y fusión de éstos, no encontrándose evidencia de alteraciones o lesiones sugerentes a otra etiología diferencial a las caudas por PTB. A través del estudio histopatológico, se logró observar en 8 de los 9 animales estudiados (88.8%), la presencia de enteritis, linfadenitis granulomatosas con presencia de macrófagos, células gigantes y presencia de incontables Bacterias Acido-Alcohol Resitentes (BAAR) mediante la tinción de Ziehl-Neelsen (ZN). Determinándose como lesiones de tipo multibacilar (Figura 3). Mientras que en 1 de los 9 animales estudiados (11.2%) se observó la presencia de lesiones granulomatosas de tipo multifocal con escasa cantidad de bacilos (BAAR) en el interior de macrófagos, coincidente con una lesión tipo paucibacilar.
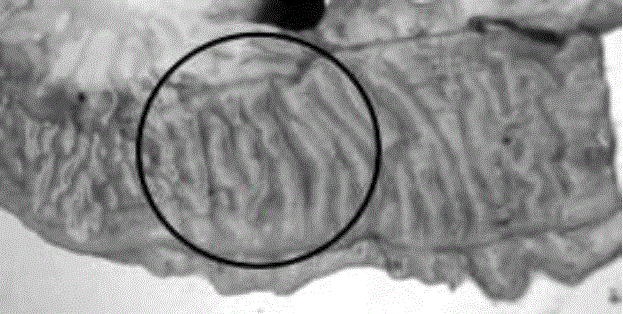
Figura 2 Lesiones macroscópicas correspondientes a engrosamiento intestinal característica de enteritis granulomatosa
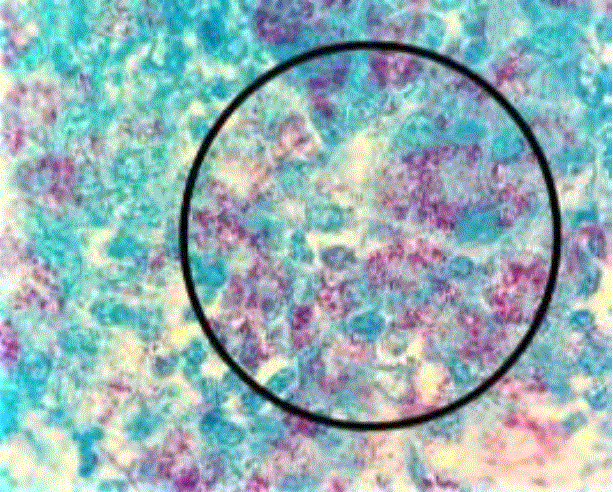
Figura 3 Lesiones Histopatológicas de ID de tipo multibacilar, tinción de Ziehl-Neelsen 400X donde se observan múltiples BAAR en mucosa intestinal
Aislamiento bacteriano. Después de 12 semanas de incubación se observaron en 5 casos (55.5%), desarrollo de colonias de color amarillo, cremosas, convexas y de forma circular característicos de MAP en los medios L-Jm adicionados con micobactina. Mientras que en 4 de los casos (44.5%), no se observó desarrollo de colonias hasta la semana 40. Todos los medios que no fueron adicionados con micobactina, no presentaron crecimiento.
PCR IS900. A partir de los cinco aislamientos bacterianos obtenidos se obtuvieron productos de amplificación de la secuencia IS900 correspondiente a 310 pares de bases (pb), confirmándose así la presencia MAP a partir de estos aislamientos obtenidos (Figura 4).

Figura 4 Fotografía de gel de agarosa al 2% teñido con bromurode etidio. Donde se observan productos de amplificación con un tamaño de 310 pb, a partir de ADN de colonias bacterianas obtenidas de tejido intestinal, donde se observa en el carril MPM el marcador de peso molecular 100 pb, C+ control positivo, carril 1 control negativo (agua), carriles 3 a 7 producto de amplificación obtenidos de los aislamientos 03, 04, 05, 06 y 09, que corresponden a un fragmento de inserción IS900 de MAP (*).
Es así como en el 100% de la muestra (16 rebaños de estudio) se obtuvo seropositividad a MAP; a su vez en el 31.25% de la muestra (5 rebaños) se confirmó la presencia de MAP por aislamiento bacteriano e identificación por PCR IS900 a partir de los animales que presentaron cuadro clínico al momento del estudio (Tabla 2).
Tabla 2 Resultados obtenidos “Por rebaño” correspondientes a los diferentes métodos de diagnóstico e identificación empleados
| Seropositividad a MAP | Animales con signos y lesiones a la necropsia sugerentes a PTB | Aislamiento Bacteriano a partir de lesiones en Intestino delgado y PCR IS900 positivo |
|---|---|---|
| 16/16 | 9/16 | 5/16 |
| 100% | 56.25% | 31.25% |
DISCUSIÓN
La seroprevalencia media obtenida en el presente estudio (51.3%) reporta ser elevada, en comparación a otros estudios realizados de medición de prevalencia tanto en el país como a nivel mundial, considerando que la enfermedad internacionalmente presenta una elevada prevalencia en diferentes especies de rumiantes, con un 20% y hasta un 40% (Whittington et al., 2019). En México, diversos estudios indican evidencias serológicas ante MAP como los reportados por Jaimes et al., (2008) en San Luis Potosí, México; donde los resultados de seroprevalencia en ovinos por el método de inmunodifusión en Agar-gel fue de un 44%. Mientras que en el estado Nayarit se reportó un 28.94% en ovinos, a través de pruebas de ELISA (Mejía et al., 2015). En Latinoamérica, escasos trabajos realizados en ovinos muestran una amplia variabilidad en la prevalencia a MAP, donde se reportan prevalencias desde un 4.3% promedio en ovinos (Fernández et al., 2014), hasta un 54.08 % de seroprevalencias a MAP en ovinos en Brasil, (Medeiros et al., 2012).
Ante los escasos estudios, y una amplia variación en cuanto a la metodología y la prueba diagnóstica empleada para la evaluación de la prevalencia a la PTB, Espechit et al. (2017) yWhittington et al., (2019) señalan que esto resulta en una gran variabilidad de los resultados, y por consecuencia, una desestimación de la presencia e impacto verdadero de la paratuberculosis.
A pesar de los resultados obtenidos de una elevada frecuencia, al momento del estudio sólo se encontraron casos clínicos (9/16) en el 56.25% de los rebaños estudiados, donde la totalidad de ellos muestran lesiones histopatológicas multibacilares o paucibacilares, características de la enfermedad, en donde si se considera que éstas se presentan en individuos mayores a un año de edad, con un tiempo prolongado de infección aunadas a la presentación de un cuadro clínico característico, altamente sugerente a PTB, se pueden llegar a considerar un diagnóstico definitivo de MAP en lo individual, difícilmente descartado por otras pruebas como cultivo y PCR como lo mencionan varios autores (Pérez et al., 1999; Dennis et al., 2011; Windsor, 2015; Whittingtong et al., 2019).
Considerando que los nueve animales a los que se les realizó la necropsia presentaron lesiones características a PTB, sólo en el 55.5% (5/9) se logró el aislamiento bacteriano a pesar de presentar lesiones de tipo multibacilar en ocho de los nueve. La dificultad del aislamiento de MAP, el medio de cultivo empleado considerando la posible variación del tipo de MAP presente, “S” o “C”, los que presentan una diferencia de requerimientos nutricionales para su crecimiento (Elguezabal et al., 2011; Whittington, 2011, Stevenson, 2015; Whittington et al., 2019), o al momento del proceso de la descontaminación bacteriana, donde se puede reducir el número de bacterias viables para su cultivo y aislamiento. El aislamiento y cultivo del microorganismo en ovinos es extremadamente difícil, siendo en rebaños ovinos que el cultivo fecal detecta menos de los casos clínicos y requiere más de 12 meses para su incubación según reportan Windsor (2015), así como Whittington, 2010.
La posterior confirmación e identificación de los aislamientos obtenidos de MAP por medio de PCR IS900, realizada a partir de los cinco cultivos obtenidos, confirmó la presencia de MAP. Algunos autores en la actualidad sugieren que la identificación de la bacteria por PCR sea realizada a partir de las muestras obtenidas de los tejidos, agilizando el tiempo de los resultados, sin depender directamente de los cultivos obtenidos, ya que los tiempos de diagnóstico se prolongan por las características propias del aislamiento de MAP, indicando que esta prueba presenta una similar eficacia con los cultivos (Kawaji et al., 2007; Nilsen et al., 2008; Whittington et al., 2019).
De acuerdo con autores como Kumthekar, et al., (2013) y Konbon (2018) el determinar el grado de infección de la enfermedad en los rebaños, permite establecer programas de control adecuados que impacten significativamente en el costo - beneficio; considerando principalmente la prueba - desecho. Pues ante la inviabilidad de desechar y considerando la poca disponibilidad de algunos productores para la vacunación de los rebaños, las medidas de control deben enmarcarse hacia un fortalecimiento de la bioseguridad.
Considerando así la separación temprana de los corderos y la eliminación de animales con signología inicial clínica de la enfermedad, puede ser una medida que impacte positivamente a la reducción de la prevalencia de la enfermedad (Robee, 2011; Windsor 2015). Haciendo hincapié en que profesionistas del sector salud animal y líderes del sector productivo tengan un conocimiento claro del grado de presencia e impacto de la enfermedad, tanto clínica, económicamente y de salud pública; logrando así propuestas de control (Roche, 2015; Windsor, 2015; Wittington et al., 2019)
CONCLUSIÓN
Se confirma la presencia del Mycobacterium avium subsp paratuberculosis como agente etiológico de la enfermedad clínica, además de observar la presencia elevada de frecuencia de animales seropositivos a MAP, en rebaños del Valle Central del estado de Aguascalientes, México. Lo cual la convierte en una patología de alto impacto en la producción ovina del estado.











 texto en
texto en 




