INTRODUCCIÓN
La Organización Mundial de la Salud señala que la tuberculosis bovina es una enfermedad infecto-contagiosa bacteriana crónica, zoonótica de alta morbilidad y mortalidad y es endémica de países en desarrollo; específicamente en México, tiene prevalencia en todo el país (OIE, 2020; PRONABIVE, 2015), donde es probable que se favorezca la transmisión natural en el ganado (Van der Heijden et al., 2017). La enfermedad produce grandes pérdidas económicas a causa de la disminución de la población de bovinos y leche; por ello precisa de constante control y prevención (Flores, 2012; Gooding y Brook, 2014; Ortíz, 2015; OIE, 2020). Mycobacterium bovis (M. bovis) y M. tuberculosis son la causa de la tuberculosis. Esta enfermedad forma nódulos o tubérculos en los ganglios linfáticos y diversos tejidos, de donde surge su nombre (Carriosa et al., 2015; Martínez et al., 2019).
Los signos clínicos pueden ser subagudos o crónicos; la tasa progresiva es variable, en algunos animales la bacteria se queda latente o tarda años en manifestarse; mientras que en otros pueden ser afectados gravemente en poco tiempo, y por ello es que debe notificarse de acuerdo al Código Sanitario para animales terrestres (OIE, 2020). Se transmite por contacto con individuos o tejidos infectados, por ingestión de alimentos o fluidos corporales contaminados (OIE, 2020; Herrera et al., 2008; Higareda-de Sales et al., 2015; Himsworth et al., 2010; Grange, 2001).
Una propuesta para erradicar la enfermedad es la vacunación, cuyo objetivo es mejorar la respuesta inmune frente a la tuberculosis, reducir la incidencia de la enfermedad activa; además de protección más duradera, mayor eficacia y seguridad, aplicabilidad a cualquier población y compatibilidad con el resto del calendario de vacunación; así como bajo costo (Barba et al., 2013).
Por su parte la prueba de micronúcleos (MN), detecta pérdida de fragmentos o cromosomas completos durante la mitosis, y en sangre periférica es una excelente herramienta económica, altamente sensible e informativa que no requiere de tamaños de muestra grandes para evaluar el posible daño al DNA. Además los modelos in vivo, tienen la característica de transformar sustancias donde se ha descrito que muchos de sus metabolitos pueden llegar a ser más tóxicos, que el compuesto original; así como también se puede evaluar la respuesta inmune por medio de activación de la médula ósea o mielosupresión (Cristaldi, 2004; Cedano et al., 2012; Torres-Bugarín et al., 2015; Castañeda et al., 2016).
Desde hace más de 100 años se ha utilizado la vacuna BCG (bacilo de Calmette-Guérin), derivada de una cepa atenuada de M. bovis; denominada bacilo de Calmette-Guérin, para la prevención de la tuberculosis bovina; dicha vacuna tiene eficacia variable (Cordero et al., 2013). Por ello es prioritario trabajar en la generación de nuevas vacunas, con base en los nuevos conocimientos sobre el genoma de M. tuberculosis y M. bovis, en conjunto con su respuesta inmunitaria (Cordero et al., 2013; Van der Heijden et al., 2017).
Nuevas estrategias en la generación de vacunas, cómo las del tipo de ADN, son herramientas susceptibles de evaluación y explotación para la prevención de la tuberculosis bovina. A este respecto, está descrito que los bovinos vacunados con una variante de ADN recombinante (ADNr), que codifica para los antígenos 85B, MPT64 y MPT83, mejoraron la respuesta inmune, y disminuyeron la carga de antígenos. Por lo anterior, Barba, et al., (2013) evaluaron la efectividad de vacunas de ADNr utilizando otro tipo de antígenos de M. bovis; para ello clonaron los genes que codifican para las proteínas PE11 y PPE68, en el vector de expresión eucariótico pVAX1. Para ello construyeron la vacuna de ADN, basada en un vector de expresión eucariota (pVAX1, Invitrogen, EE. UU.), de donde produjeron PE11 y PPE68 proteínas codificadas en un gen presente en RD1, una región ausente de M. bovis BCG, una cepa comúnmente utilizada como vacuna en humanos y en modelos bovinos experimentales.
Esta cepa contribuye a la reactividad cruzada y la confusión entre los animales vacunados e infectados, cuando se prueba. Usaron pVAX1-PPE68 y PE11 para vacunar Bovinos Holstein, y determinar su capacidad para inducir la producción de IFN-g in vitro, así como para generar anticuerpos en animales vacunados.
RD1 es una sección de ADN de 9.5 kb llamada región de deleción 1, está presente en las cepas virulentas de M. tuberculosis, pero se elimina en todas las cepas atenuadas de la vacuna M. bovis BCG. Esta región codifica al menos nueve genes. Algunos o todos los productos del gen RD1 pueden estar involucrados en la virulencia y la patogénesis (Daugelat, et al., 2003).
Si bien es necesario la construcción de nuevas vacunas, también es indispensable que estos nuevos tratamientos pasen por un proceso de evaluación, tanto de su eficacia terapéutica, como en posibles efectos tóxicos o genotóxicos, a corto o largo plazo.
Por tanto, el objetivo del presente estudio fue evaluar en becerras Holstein Friesian (Bos taurus), la genotoxicidad de vacunas recombinantes antituberculosa desarrolladas por Barba et al., (2013).
MATERIAL Y MÉTODOS
Tipo de estudio
Experimental, observacional, longitudinal, comparativo. Con número de registro CINV.020/15 ante la Coordinación de Investigación del Centro Universitario de Ciencias Biológicas y Agropecuarias de la Universidad de Guadalajara, Jalisco, México.
Organismos
Se trabajó con 13 becerras Holstein Friesian (Bos taurus) sanas, con edad promedio de 9 meses, del rancho de Producción Cofradía, Universidad de Guadalajara, Jalisco, México.
En investigación biomédica, trabajar con animales de uso poco común, representa dificultades, como: el tamaño y número ideal de animales, así como la manutención y cuidado. Como lo señala la OCDE, los bovinos son una especie de uso poco común en investigación biomédica; por ética, metodología y alto costo se debe respetar el principio de utilizar el mínimo número de animales. En el caso particular donde se realizó el estudio, no fue posible utilizar el número ideal de becerras, por la logística del cuidado, alojamiento y alimentación (OCDE, 1999).
Grupos de estudio
Se formaron 5 grupos, a los que se les administró una dosis de 1.0 mL vía intramuscular, de uno de los siguientes compuestos:
Grupo 1) [n=3] Control Solución salina estéril al 0.9% (p/v) (CSS).
Grupo 2) [n=2] Control Vector sin inserto pVAX1(CV).
Grupo 3) [n=3] Vacuna recombinante codificada para PE11: 0.5 mg/mL de plásmido M. bovis (VR1).
Grupo 4) [n=3] Vacuna recombinante codificada para PPE68: 0.5 mg/mL de plásmido M. bovis (VR2).
Grupo 5) [n=2] VR1+VR2 (PE11: 0.25 mg/mL+PPE68:0.25 mg/mL).
Características de las vacunas recombinantes
-
Vector pVAX1 (Invitrogen Thermo Fisher Scientific Cat. No. V26020)
Este vector fue diseñado de acuerdo con las pautas de la FDA, las secuencias de DNA eucariotas se limitan a las requeridas para la expresión con el fin de minimizar la posibilidad de integración cromosómica (Barba et al., 2013).
-
Preparación de las vacunas PE11 y PPE68
Éstas se prepararon en el Centro de Investigación y Asistencia en Tecnología y Diseño del Estado de Jalisco (CIATEJ), donde se amplificaron las regiones codificantes de los genes PE11 y PPE68, a partir de DNA genómico de M. bovis; mediante reacción en cadena de la polimerasa con oligonucléotidos, específicos y diseñados expresamente para este proyecto. La identidad y fidelidad de la secuencia amplificada se verificó por restricción con las endonucleasas tipo II (XbaI y HindIII) y secuenciación. Luego éstos se insertaron en el vector de expresión eucariótico pVAX1. El ADN plasmídico se purificó por medio de un kit comercial Quiagen Plasmid Plus Midi (Barba et al., 2013).
-
Proteínas PE11 y PPE68
Estas familias de proteínas de estructura globular son las que confieren mayor variabilidad a M. tuberculosis. La proteína PE11 (motivos Prolina-Ácido Glutámico a nivel del extremo N-terminal), se caracterizan por ser rica en prolina y ácido glutámico, y la proteína PPE68 (prolina, prolina, ácido glutámico) se define por repetidos en tándem (MPTRs) (Fontalvo Rivera y Gómez Camargo, 2015).
-
Generación de vacuna recombinantes
Los plásmidos recombinantes transformados en Escherichia coli DH5α, y que contenían a las proteínas PE11 o PPE68, fueron obtenidos por medio del kit comercial Quiagen Plasmid Plus Maxi kit, y se mezclaron con solución salina isotónica (SSI); hasta ajustar a un volumen de 0.5 mL, con concentración de 500 µg/mL (vacuna administrada). Se amplificaron mediante PCR los genes PE11 y PPE68, con la ayuda de la enzima Phusion de alta fidelidad (Finnizymes, EE. UU.) y el DNA genómico AN5 de M. bovis como plantilla, y el par de cebadores MbPPE68-5FH3 (5´- GGAGAAGCTTGTCACCATGCTGTGG-3) + MbPPE683RXb3RXb (5´- GATCCGCTCTAGATTACCTGCCTCCTG-3´). Barba y sus colaboradores (Barba 2013)et al.,2013
Toma y procesamiento de muestras
A cada becerra se le tomaron 5 muestras de sangre periférica, la primera previa al tratamiento; de la 2da a la 4ta cada 24 horas, y la última a los 90 días posteriores. La toma de muestra se realizó de la yugular, mediante punción con aguja número 18 y se realizaron dos frotis por muestra, los cuales se dejaron secar al aire libre y se fijaron en etanol al 96% por 10 minutos. El segundo frotis fue con finalidades de respaldo. Posteriormente se tiñeron con naranja de acridina, tinción específica para ácidos nucleicos (Hayashi, 1990) y se resguardaron hasta su análisis en cajas para mantenerlas libres de polvo y de exposición a la luz (Torres-Bugarín et al., 2015).
Análisis de muestras
El técnico responsable del análisis de las muestras desconocía la información relacionada con ellas, quien por muestra contabilizó 10,000 eritrocitos totales (ET), para identificar los valores de eritrocitos micronucleados (EMN), por medio de un microscopio equipado con fluorescencia (marca Zeiss ®) bajo el objetivo 100X. Se consideró como EMN cuando éste presenta en su citoplasma una estructura, pequeña, redonda u ovalada, bien definida de color amarillo brillante (tono característico del ADN por la tinción con naranja de acridina, que es específica para ácidos nucleicos), y que al enfocar y desenfocar el objetivo, éste se encuentre en el mismo plano de la célula; tal como se observa en la figura 1 (Torres-Bugarín et al., 2015).

Figura 1 Frotis de sangre periférica. Eritrocito normocromático micronucleado (EMN). Tinción naranja de acridina. Microscopio Binocular Carl Zeiss Mod. Axioscope A1 ® Fluorescencia IVFL Filtro de450 a 490 nanómetros, Cámara Axiocam MRc3 Rev1, Objetivo Planocromático 100x/1.25. Imagen capturada a 1,000 aumentos reales.
Análisis estadístico
Para la comparación de los valores de EMN se hicieron evaluaciones previas de índices de sesgo, curtosis y homoscedasticidad, para discriminar entre el uso de ANOVA o de Kruskal Wallis y proceder a su análisis. Se consideró como significativo el valor de P<0.05 y dado el caso, se practicaron pruebas de LSD, para la localización de grupos homogéneos. Se utilizó el programa STATGRAPHICS Centurion, ver. 15 (StatPoint, USA).
Consideraciones éticas
Todos los animales fueron tratados conforme a los procedimientos establecidos por la NORMA Oficial Mexicana NOM-062-ZOO-1999, especificaciones técnicas para la producción, cuidado y uso de los animales de laboratorio (NOM-062-ZOO-1999; OCDE, 1999).
RESULTADOS
En la tabla 1, se puede observar el tamaño de muestra, los valores individuales y medias y errores estándar de valores basales de EMN. Se destaca que VR2 y VR1+VR2, presentaron frecuencia de EMN con efecto dosis respuesta (P=0.02, Kruskal Wallis).
Tabla 1 Valores de eritrocitos micronucleados (EMN) en sangre periférica de becerras Holstein expuestas a las vacunas de prueba recombinante a través del tiempo
| Toma de muestras | Valores de EMN/10,000 eritrocitos totales | ||||
|---|---|---|---|---|---|
| CSS, (n=3) | CV, (n=2) | VR1, (n=3) | Vr2 (n=3) | VR1+VR2,(n=2) | |
| Dia 1 Valores basales | 2.6±1.98 (n=3) | ||||
| Día 2 | 2, 2, 5 | 1, 2 | 1, 3, 4 | 1, 1, 3 | 1, 2 |
| Día 3 | 1,1,3 | 1, 1 | 2, 2, 2 | 1, 1, 2 | 2, 2 |
| Día 4 | 1, 3, 4 | 1, 2 | 0, 2, 3 | 1, 1, 2 | 2, 1 |
| Día 90 | 1, 2, 3 | 1, 2 | 0, 2, 3 | 0, 1, 2 | 2, 2 |
| Promedio general | 2.4 ± 0.3 | 1.4 ± 0.2 | 2.5 ± 0.5 | 1.3 ± 0.2 | 2.0 ± 0.3 |
Se muestran valores individuales y promedio ± error estándar. EMN: eritrocitos micronucleados; CSS: control solución salina; CV: control vehículo; VR1: vacuna recombinante (PE-11); VR2: vacuna recombinante (PPE-68); VR1+VR2: vacuna recombinante (PE-11+PPE-68); n: tamaño de la muestra.
Al analizar los valores de EMN de todos los organismos en los diferentes grupos y días de muestreo, se identificó que los datos no cumplen con el principio de varianzas homogéneas y normalidad, por ello se aplicó la prueba Kruskal Wallis, con la que se encontró que los valores de EMN muestran aparente disminución a lo largo del tiempo, pero sin significancia estadística (P=0.70), (Figura 2).
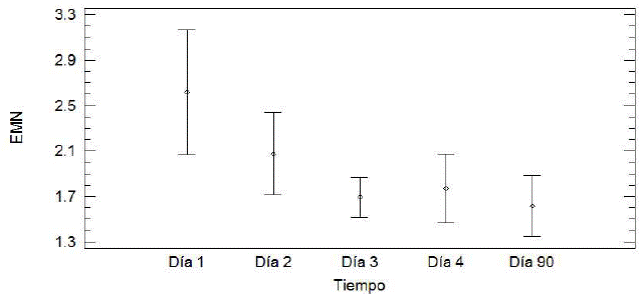
Figura 2 Valores de eritrocitos micronucleados (EMN/10,000 eritrocitos) en sangre periférica de las becerras Holstein Freisan en los diferentes grupos de estudio y muestreadas en diferentes días. Los gráficos muestran media y error estándar.
En la tabla 1 y figura 3, se puede observar el efecto dosis respuesta (P=0.02, Kruskal Wallis) sobre las frecuencias de EMN de la aplicación de la VR2. Además, se debe destacar que los grupos CSS y VR1, así como los grupos CV y VR2 se comportan de manera muy similar (P>0.05); mientras que el grupo VR1+VR2 presenta valores de EMN intermedios entre VR1 y VR2 (P>0.05), ver figura 3.
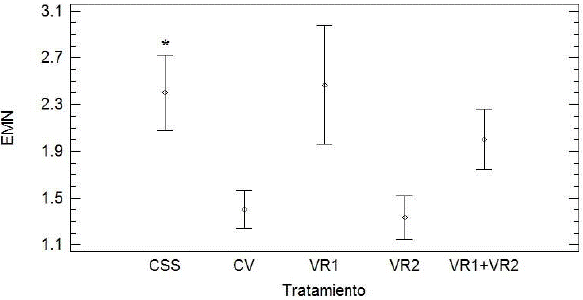
Figura 3 Valores de eritrocitos micronucleados (EMN/10,000 ET) de sangre periférica de becerras Holstein Freisan tratadas. CSS: Solución salina, CV: Vector sin inserto (pVAX1), VR1: Vacuna recombinante codificada para PE11 (PE11/0.5 mg/mL de plásmido Micobacterium bovis (M. bovis), VR2: Vacuna recombinante codificada para PPE68 (PPE68/0.5 mg/mL de plásmido M. bovis, VR1+VR2 (PE11/0.25 mg/mL + PPE68/0.25 mg/mL). Los datos muestran media y errores estándar. CV, VR2 y VR1+VR2 vs CSS, (P=0. 02, Kruskal Wallis)*.
DISCUSIÓN
La raza vacuna Holstein Freisan como bioindicadora de genotoxicidad
Previo a evaluar la genotoxicidad de un agente mediante la prueba de MN en sangre periférica en un organismo que no esté probado como bioindicador de genotóxicos, se debe contar con los valores espontáneos de dicha especie (Zúñiga-González et al., 2001). En la situación específica del ganado vacuno, el valor espontáneo de EMN/10,000 eritrocitos descrito es de 2.4 ± 1.7 (promedio y error estándar) (Zúñiga et al., 1996); y los estudios experimentales de genotoxicidad son escasos. Sólo se localizó una investigación en la que describe el comportamiento de la raza Latvian Brown adultos, expuesta a radiaciones electromagnéticas, y se señala que los valores de EMN fueron de 0.6/1,000 vs 0.1/1,000 eritrocitos, en los animales no expuestos (Balode, 1996). Para el caso específico de la raza Holstein Friesian, no se tenían antecedentes, pero este grupo de trabajo encontró en animales Friesian de 9 meses de edad, valores espontáneos de EMN de 2.6 ± 1.98 /10,000 eritrocitos (promedio y error estándar); valor muy similar al descrito previamente por Zúñiga et al., (1996); sin embargo, en este último trabajo no se especificó sexo, raza o edad de los bovinos estudiados. Los valores encontrados de EMN en estos animales, supondría baja eficiencia, como bioindicador de genotóxicos, lo cual podría mejorar si se trabajara con becerras más jóvenes (Zúñiga et al., 2001). Estos resultados motivaron a evaluar los valores espontáneos de EMN y eritrocitos policromáticos (EPC) en terneras Holstein Freisan de 24-48 h de edad; de tal manera que se realizó la toma de muestras de sangre periférica a organismos recién nacidos de diferentes razas, como se observa en la tabla 2. Efectivamente, se corroboró que la edad de los animales determinan los valores de EMN y EPC, y así se pudo determinar que los animales más jóvenes presentan los valores más altos, y como se observa en la tabla 2, este patrón que se repite en terneros de las razas Simmental y Pardo Suizo (Villa, et al., 2015).
Tabla 2 Eritrocitos policromáticos y micronucleados espontáneos en diferentes razas de becerros
| Razas | n | Edad | EMN/10,000 ET | EPC/1000 ET | Referencia |
|---|---|---|---|---|---|
| 13 | 9 m | 1.6 ± 0.3 | 0 | Este trabajo | |
| Holstein Friesian | 13 | 6 m | 2.6 ± 0.5 | 0 | Este trabajo |
| 5 | 24-48 h | 7.4 ± 1.0 | 7.4 ± 2.3 | Villa, et al., 2015 | |
| Pardo Suizo | 5 | 24-48 h | 7.8 ± 0.7 | 9.0 ± 3.9 | Villa, et al., 2015 |
| Simmental | 5 | 24-48 h | 6.4 ± 0.7 | 11.8 ± 4.3 | Villa, et al., 2015 |
n: tamaño de muestra; h: horas; m: meses; EPC: Eritrocitos policromáticos; EMN: micronucleados; promedio y error estándar.
Este fenómeno se ha observado en otras especies, ya que los valores espontáneos de EMN en sangre periférica de muchas especies, como la rata, ardilla y el humano, depende de la maduración del bazo, y éste madura con la edad (Zúñiga-González et al., 2001; Batista-González et al., 2006).
En el presente estudio se puede observar que la frecuencia de EMN tiende a disminuir con la edad (tabla 2), lo cual concuerda con lo ya descrito (Zúñiga-González et al; 2001). Por tal razón es que se recomienda el uso de animales jóvenes, y este trabajo es un antecedente en investigaciones con vacunos; en donde se puede observar claramente que la edad de los bovinos es un factor a considerar en los valores de EMN y de EPC.
Efecto genotóxico en la respuesta inmune de las vacunas recombinantes de prueba El objetivo del proyecto de Barba et al., (2013), fue proponer nuevas vacunas recombinantes para el control de la tuberculosis bovina. Después del diseño de las vacunas de prueba, se encontraron con la limitación de la disponibilidad de animales, por lo que se decidieron los tamaños de muestra reducidos, con el propósito de evaluar los grupos controles y experimentales necesarios. Por ello, en el presente trabajo exploratorio en el que se describe el efecto genotóxico, no fue posible ajustar el tamaño de muestra óptimo.
Al analizar el efecto genotóxico de las vacunas recombinantes antituberculosas, se identificó que los valores de EMN fueron menores con efecto dosis respuesta en los grupos tratados con VR2; esto puede interpretarse como un efecto citoprotector o antigenotóxico; sin embargo, se deben de tomar estos resultados con cautela, ya que hay dos puntos a considerar:
El primero de ellos fue el tamaño de muestra, que, aunque si bien la prueba de MN es altamente sensible y no se requiere de tamaños de muestra grande; lo ideal sería haber trabajado con más de cinco animales por grupo, pero por el costo, tamaño y
edad de estos animales, sólo se tuvo disponibilidad a dos o tres becerras por grupo; y esto pudo haber sesgando los resultados.
El segundo punto es que para determinar genotoxicidad mediante la prueba de micronúcleos en eritrocitos de sangre periférica, se debe considerar la actividad mitótica de la médula ósea, la cual se evalúa mediante la presencia o ausencia de EPC en sangre periférica. Los EPC son eritrocitos jóvenes que tienen como máximo 24 h de haber salido a circulación; esto debido a que la formación de MN se lleva a cabo durante la etapa de anafase -telofase de la división celular; y si ésta no ocurre, los MN no pueden formarse. Sin embargo, si hay división celular en médula ósea (mieloproliferación), se podrá observar sin dificultad alguna el efecto micronucleogénico o genotóxico de las substancias de prueba; en oposición; si éste último, inhibe la división celular (mielodepresión); esto es, si hay citotoxicidad, entonces no será posible observar el incremento de EMN en sangre periférica (efecto genotóxico).
Por tanto, volviendo a la figura 3, donde se observa que los valores de EMN en los grupos VR2 y VR1+VR2 es menor que en el grupo CSS (P=0.02); lo que en realidad pudo haber ocurrido, es que el uso de la VR2 está afectando de manera importante la medula ósea de las becerras, al punto de haber inducido mielodepresión por la actividad inmunológica generada. Sin embargo, en este estudio no se tiene manera de corroborar este efecto mediante la técnica clásica, por cuantificación de eritrocitos policromáticos en sangre periférica, ya que las becerras con edad promedio de 6 a 9 meses, no presentan este tipo de células (tabla 2).
Barba et al., (2013), paralelamente demostraron que la vacuna de ADN pVAX1-PPE68 (VR2) construida y evaluada en bovinos Holstein Freisan, indujo la producción de citocinas IFN-γ (proteínas producidas por los inmunocitos; en respuesta a un antígeno, generalmente viral) en animales vacunados por encima de los niveles de fondo, pero fue capaz de inducir la producción de anticuerpos dirigidos contra proteínas que reaccionan de forma cruzada en extractos celulares completos de M. bovis BCG; a diferencia de la vacuna recombinante pVAX1-PE11 (VR1), la cual no indujo respuesta inmune mediada por IFN-γ, al menos a niveles detectables por el kit comercial utilizado (Barba et al., 2013). Entonces, dicho de otra manera, sólo la vacuna VR2 produjo respuesta inmune y además modificación en la frecuencia de células micronucleadas (solo la vacuna VR2 tuvo efecto sobre este biomarcador); incluso cuando la dosis administrada fue por la mitad, la respuesta fue 50 %, menos en relación al grupo tratado con solución salina (CSS), como se observa en la figura 3. Lo que indica que la VR2, produce efecto sobre médula ósea, a tal grado que repercute en la formación de EMN. De esto se desprende que lo más probable es que la actividad inmunológica inducida por la vacuna VR2, también causa mielodepresión.
Este estudio, si bien preliminar; además de haber mostrado efecto dosis respuesta de las vacunas recombinantes antituberculosa, también abre una gran interrogante, ¿las vacunas recombinantes antituberculosas pueden tener como efecto secundario la mielodepresión? Es de destacar que la versatilidad de la prueba de micronúcleos en eritrocitos de sangre periférica, también permite evaluar el efecto mielodepresivo de vacunas recombinantes.
CONCLUSIONES
En este trabajo, aunque preliminar, arrojó resultados muy valiosos, se detectó efecto dosis respuesta de VR2 en la formación EMN; sin embargo, los resultados podrían estar enmascarados por posible mielodepresión (citotoxicidad), efecto que no se corroboró, debido a que los bovinos a esta edad promedio de 9 meses ya no presentan eritrocitos policromáticos en sangre periférica; se sugiere trabajar con bovinos de menos de un mes de nacidos y mayor número de animales. Estos hallazgos motivan a continuar investigando sobre la inducción de la inestabilidad genómica y citotoxicidad de las vacunas en general, y en particular las antiberculosas, ya que se desconoce su rol en medula ósea y en la integridad del material genético, tanto en organismos experimentales como de granja.











 texto en
texto en 


