INTRODUCCIÓN
La actividad ovárica responde a la adecuada secreción de la LH y de la FSH en la adenohipófisis, por la secreción de la GnRH en el hipotálamo. Esta comunicación endócrina también ocurre por la acción de compuestos que actúan como neurotransmisores, a partir del suministro de aminoácidos neuroestimuladores que favorecen la secreción pulsátil de la GnRH y la LH (Mahesh y Brann, 2005), como el glutamato (GLU; Brann y Mahesh, 1997), el aspartato (ASP; Boni et al., 2006) y la arginina (ARG; Recabarren et al., 1996).
La acción de los aminoácidos como glutamina, prolina, y glicina regulan las funciones de la salud, supervivencia, crecimiento, desarrollo, lactancia y la reproducción (Wu, 2010); o inciden en la expresión génica, la fertilidad, neurotransmisión y la inmunidad en los animales (Wu, 2014). Además, GLU, glutamina, glicina, triptófano, tirosina, D-alanina, D- aspartato y D-serina, regulan el desarrollo y la función neurológica (Fernstrom, 2012). Los neurotransmisores conforman las redes neuronales y controlan funciones celulares y sinápticas en el sistema nervioso central (SNC), la neurotransmisión excitadora e inhibitoria está mediada en gran parte por el GLU y el ácido gamma-aminobutírico (GABA), que son neurotransmisores excitadores e inhibidores, respectivamente (Mayor y Tymianski, 2017).
El GLU regula la expresión del comportamiento sexual, específicamente en el área preóptica medial, mediante la acción de la dopamina, debido a su acción sobre las neuronas GnRH (Iremonger et al., 2010). En el macho, para regular las secreciones de testosterona, la cual se requiere como mediador de las concentraciones basales de dopamina para aumentar la habilidad copulatoria (Will et al., 2014).
Se ha reportado que en roedores aumenta la actividad neuronal que facilita la erección del pene y el comportamiento de apareamiento (Li et al., 2013). En el control de la reproducción en la oveja, se observa que la actividad ovárica responde a los cambios neuronales en el cerebro y resulta de las alteraciones complementarias en el control de la función hipotalámica, específicamente en la regulación y secreción de la GnRH (Weems et al., 2015). La GnRH, es el primer mensajero responsable en el inicio, restablecimiento y la ciclicidad de la actividad reproductiva en ovejas y cabras, y está regulada por distintos neurotransmisores (Meza-Herrera, 2012). El control de la secreción pulsátil de la GnRH por el hipotálamo y su respuesta ovárica en la secreción de la LH y de la FSH por la adenohipófisis, se favorece por la acción de compuestos que actúan como neurotransmisores (Brann y Mahesh, 1995) y se mejora con el suministro de aminoácidos neuroestimuladores (AANE). Se ha descrito que los neurotransmisores y los neuromoduladores, presentan propiedades estimuladoras e inhibitorias, las cuales dependen de la composición del neurocircuito, el estado de desarrollo y ambiente hormonal (Terasawa y Fernández, 2001); dicha clasificación se basa en las características del control de la liberación pulsátil de la GnRH en el animal adulto; y con base en esta clasificación, se pueden describir a los AANE como estimuladores o inhibitorios. Los principales neurotransmisores del SNC son los AANE (Urbanski et al., 1994), los cuales tienen especificidad en la activación de las neuronas postsinápticas del SNC.
La neurotransmisión de los AANE es un componente esencial en la transmisión neuroendócrina, la cual regula la secreción de las hormonas hipofisiarias. Los AANE como ASP y GLU; se encuentran en gran cantidad en áreas presinápticas de una variedad de núcleos hipotalámicos, como: núcleo arcuato, supraquiasmático, supraóptico, paraventricular y el área preóptica (Brann y Mahesh, 1994).
Estudios en ovinos consideraron prácticas de manejo para mejorar la eficiencia productiva de los rebaños de manera técnica y económica, en los cuales se pretende eliminar la manipulación farmacológica de los animales (Martin et al., 2004). Estas metodologías se basan en el conocimiento de los eventos reproductivos, factores socio- sexuales y efectos de la nutrición (Hawken y Martin, 2012; Scaramuzzi et al., 2013); o la alimentación focalizada, a partir de complementos energéticos y proteínicos destinados en los momentos críticos de la reproducción (Somchit-Assavacheep, 2011).
Por lo anterior, el objetivo de la presente revisión de literatura, es describir la función neuroestimuladora de los aminoácidos y conocer la respuesta neuroendócrina en el eje hipotálamo-hipófisis-ovarios en ovejas, para mejorar las variables productivas y reproductivas.
L-ARGININA Y SU ACCIÓN NEUROENDÓCRINA EN LA REPRODUCCIÓN
El aminoácido L-Arginina (ARG) se aisló por primera vez en 1886, a partir de las semillas de la leguminosa Lupinus sp. (Wu y Morris, 1998). Se sintetiza a partir de la glutamina, glutamato (GLU) y prolina intestinal, mediante el eje renal en la mayoría de los mamíferos (Wu, 1998); participa en el metabolismo como sustrato para la síntesis de proteínas, debido a que es un intermediario en el ciclo de la urea que se realiza en el hígado, y como precursor para la síntesis de varias moléculas metabólicas, como el óxido nítrico (ON) y las poliaminas (Kim et al., 2007). En la ruta de la arginasa, las poliaminas son sintetizadas de la ornitina para participar en la embriogénesis y en el crecimiento placentario (Reynolds y Redmer, 2001).
En 1987, la comunidad científica descubrió que el cuerpo humano produce ON (Tsikas, 2007). Se sabe que el ON es un regulador en el proceso reproductivo de la hembra (Tamanini et al., 2003), como el desarrollo y el crecimiento de la placenta, mantenimiento de la gestación y la fisiología del parto (Kwon et al., 2004), la función ovárica, desarrollo folicular ovárico y la ovulación; además, participa en la regulación de la presión sanguínea, respuesta inmune, agregación de plaquetas y la neurotransmisión.
La ARG es el único substrato de todas las isoformas del óxido nítrico sintetasa (ONS; Wiesinger, 2001). La producción del ON es mediante la oxidación del grupo amino de ARG, la cual utiliza oxígeno molecular como co-sustrato, y como producto secundario de la reacción; se obtiene L-Citrulina (CIT; Tsikas, 2007). La CIT puede reciclarse a ARG mediante la arginosuccinato sintetesa y la arginosuccinato liasa, lo cual forma el ciclo CIT-ON (Mori y Gotoh, 2004).
El mecanismo de acción del ON como regulador de dichos procesos, responde a que éste estimula a la enzima guanilato ciclasa soluble, para sintetizar guanosín monofosfato cíclico (cGMP), el cual se encarga de dicha regulación (figura 1).
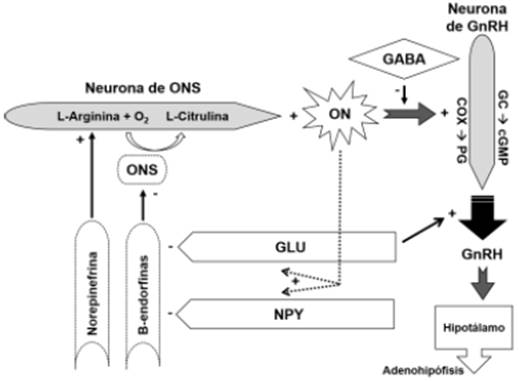
Efecto positivo [+], efecto negativo [-], GABA: Ácido gama aminobutírico, GC: Guanilil ciclasa, cGMP: Guanidín metil fosfato cíclico, COX: Ciclooxigenasas, PG: Prostaglandina, Glu: Glutamato, NPY: Neuropéptido Y, ONS: Óxido nítrico sintetasa (Modificado de Faletti et al., 1999).
Figura 1 Acción del óxido nítrico (ON) en el control y liberación de la hormona liberadora de gonadotropinas (GnRH).
En el hipotálamo, las neuronas del ON están próximas a las de la GnRH, lo cual sugiere que el ON puede ser un regulador en la secreción de la GnRH. Dichas neuronas se localizan en varios núcleos hipotalámicos (núcleo preóptico, núcleo hipotalámico ventromedial y núcleo acuarto); y también en otros sitios (órgano vascular de la lámina terminal, área preóptica y la eminencia media), relacionados en la regulación de la secreción de la GnRH (Grossmann et al., 1994). Se sabe que el ON controla la acción de las hormonas y de los neurotransmisores indispensables para regular la reproducción, por relacionarse en el control de la LH y en la ovulación. Además, varios neurotransmisores inhibitorios y estimuladores afectan las neuronas de la ONS en el hipotálamo y controlan la secreción del ON (Dixit y Parvizi, 2001).
La suplementación con ARG en animales de producción, mejora las variables productivas y reproductivas. Incluir 1.0% de clorhidrato de arginina (L-Arginina HCl, Ajinomoto) en la dieta de cerdas Camborough 22 gestantes (30 a 114 d), incrementa 24% el peso de los lechones al nacimiento y aumenta 22% el tamaño de la camada (Mateo et al., 2007). En ovejas Suffolk prepúberes (2 meses de edad), la infusión de 200 ml de ARG (350 mM, pH 7.4) vía intravenosa por venopunción en yugular durante 60 min, aumenta la concentración media de la LH durante 285 min después de la infusión con amplitud >1 ng ml-1 en 13 de 17 pulsos de LH; lo cual sugiere que la infusión de ARG estimula la secreción de la LH en ovejas prepúberes (Recabarren et al., 1996).
En protocolos de sincronización del estro con esponjas intravaginales, en ovejas Awassi adultas (3.5 a 4.0 años de edad), suplementar ARG (0.5 g kg-1 de peso corporal) durante 15 días a partir del retiro de la esponja, aumenta la cantidad de cuerpos lúteos (CL; 2.38±0.67), las concentraciones de E2 (5.92±0.33 pg mL-1) y de P4 (4.21±0.83 ng mL-1); en comparación con la respuesta de las ovejas testigo: 100±0.58 CL, 4.56±1.06 pg mL-1 de E2 y 1.79± 0.31 ng ml-1 de P4, lo cual mejora la tasa de parición y de partos gemelares, debido al incremento en la tasa ovulatoria (Al-Dabbas et al. 2008).
En ovejas de pelo adultas sincronizadas con 40 mg de acetato de fluorogestona impregnado en esponjas intravaginales (Cronolone-Chrono-Gest, Intervet®) por 12 d, la suplementación con ARG (300 mg kg-1 de peso corporal) durante 3 d previos al retiro de la esponja, mejora la presentación de estros (PE; 100%), la tasa ovulatoria (TO; 1.7±0.13) y la prolificidad (PROL; 1.4±0.16); en comparación con la respuesta de las ovejas sincronizadas solo con progesterona oleosa (PE: 28.6±18.4%, TO: 1.4±0.25 y PROL: 1.5±0.5), lo cual mejora los protocolos de sincronización del estro con progestágenos, debido a los efectos positivos de la suplementación con ARG en la eficiencia reproductiva en ovejas de pelo (Bulbarela-García et al., 2009).
En ovejas Rambouillet, tratadas con 27 mg de L-Arginina HCl/kg de peso vía intravenosa durante el reconocimiento materno de la gestación, se observó que la tasa de gestación se mejoró en 24%; lo cual sugiere que la ARG se relaciona con la síntesis del ON, y que realizar el tratamiento previo al reconocimiento materno de la gestación en ovejas se mejora la supervivencia embrionaria temprana, mediante la síntesis de poliaminas y de ON (Saevre et al., 2011).
ASPARTATO Y SU ACCIÓN NEUROENDÓCRINA EN LA REPRODUCCIÓN
El ácido D-aspártico es un neurotransmisor que actúa vía el receptor de GLU para estimular la secreción de la GnRH; se encuentra de manera natural en hipófisis, tiroides, ovario, adrenal y pineal; en el cerebro, en órganos excretorios como hígado y riñón, en músculo y los tejidos profundos. En la actualidad, se ha demostrado que este D- aminoácido puede ser convertido a ácido N-metil-D-aspártico (NMDA), un neuromodulador relacionado con la actividad sexual, el cual causa la liberación de hormonas hipotalámicas e hipofisarias, y posiblemente la administración del ácido D- aspártico, aumente las concentraciones de NMDA en el sistema nervioso; debido a que el ácido D-aspártico está presente en forma natural y se almacena en la hipófisis, cerebro y la glándula pineal (Boni et al., 2006).
El NMDA se biosintetiza de manera endógena a partir de D-Aspartato, por una enzima dependiente de S-adenosilmetionina, NMDA sintasa, y es un potente agonista de la actividad de los ácidos aspártico y glutámico, los cuales tienen una actividad neuromoduladora que provoca la liberación de hormonas de la hipófisis, in vivo (D´aniello et al., 2000a; 2000b) e in vitro (Barb et al., 1993), y pertenece al grupo de receptores ionotrópicos de GLU.
Estienne et al.(1989 a) administraron vía intravenosa NMDA (12 mg kg-1 de peso corporal; mezcla racémica, Sigma Chemical co., St. Louis, MO) en carneros Hampshire castrados (4 meses de edad y 28.1±1.3 kg de peso) y observaron un incremento de la hormona de crecimiento (GH; 185.1±20.7 ng ml-1), en lugar de la secreción de la LH a los 15 minutos después de inyectar la dosis, la cual estuvo en el rango que estimuló la secreción de la LH en monos; por lo tanto, concluyeron que es posible que el carnero sea menos sensible a la NMDA y requiera mayor dosis para evocar la secreción de la LH.
Por el contrario, en ovejas oavarioectomizadas, Estienne et al. (1989 b) demostraron que el suministro de estradiol vía subcutánea (1 pg ml-1 de E2; implante Silastic, tubo de polietileno; Portex Ltd, Hythe, Kent) disminuye la concentración sérica de la LH. No obstante, la aplicación intravenosa de 6, 12 o 24 mg NMDA kg-1 de peso corporal (disuelta en solución salina al 0.9%) aumenta las concentraciones medias de LH en un 326% (P < 0.03), 1125% (P < 0.02) y 441% (P < 0.0001).
Por lo anterior, estos resultados demuestran que el E2 exógeno suprime la secreción de la LH en ovejas ovarioectomizadas de una manera antagonizada, por efecto del NMDA. Se ha reportado que si se mejora la nutrición en ovejas se puede incrementar la concentración plasmática de ácido D-aspártico en el cerebro, para estimular un aumento en la secreción de la GnRH, debido al efecto del NMDA en las concentraciones de las hormonas hipofisarias y los efectos positivos del ácido D-aspártico en la tasa ovulatoria y en las concentraciones de las hormonas hipofisarias. Así, aplicar ácido D-aspártico (vía endovenosa) durante cinco días en la fase lútea del ciclo estral, no afecta la tasa ovulatoria, pero reduce las concentraciones plasmáticas de la LH y la FSH en ovejas ciclando (Downing et al., 1996). Por lo tanto, la disminución de la secreción de las gonadotropinas en ovejas ciclando tratadas con ácido D-aspártico, se debe a la respuesta en el hipotálamo o en la adenohipófisis; las cuales no están relacionadas con las secreciones de la retroacción ovárica, aunque es posible que estos cambios disminuyan la secreción de la GnRH.
GLUTAMATO Y SU ACCIÓN NEUROENDÓCRINA EN LA REPRODUCCIÓN
El GLU actúa en el control de las funciones cerebrales, por encontrarse en gran cantidad en las sinapsis del cerebro, y por los numerosos subtipos de receptores de GLU encontrados en el SNC (Brann y Mahesh, 1997). El GLU y el ASP se clasifican como AANE predominantes del SNC en los mamíferos (Kalb, 1995); debido a que los receptores para GLU se encuentran distribuidos en el hipocampo, corteza cerebral y el cerebelo; dicho aminoácido influye en diversos procesos fisiológicos (Brann, 1995), como en el control de la secreción de las gonadotropinas y en la ovulación de la hembra (Brann y Mahesh, 1997).
Se ha reportado que la administración de agonistas de GLU estimula la liberación de la GnRH y la LH; mientras que los receptores antagonistas de GLU, disminuyen la inducción esteroidea y el aumento preovulatorio de la LH (Dhandapani y Brann, 2000). Así, los receptores de los AANE son receptores neurotransmisores estimuladores más abundantes en el SNC, también denominados “receptores para GLU” desde que se conoce por ser el mayor ligando endógeno. Brann y Mahesh (1997) reportaron dos grupos de receptores:
Ionotrópicos: receptores acoplados a canales iónicos, divididos en los subtipos N- metil-D-aspartato (NMDA), kainato y ácido propiónico DL-α-metil-3-hidroxi-4-isoxazol (AMPA), donde su principal modo de acción es por la modulación de los canales de los iones Na+, K+ y Ca2+.
Metabotrópicos: receptores acoplados a proteínas G, que modulan la producción de mensajeros secundarios como el inositol fosfato y/o adenilato ciclasa.
El GLU existe en cuatro formas distintas: transmisor, metabólico, glial y precursor del GABA. El GLU se relaciona en los procesos críticos como la pubertad, pulsatilidad de las hormonas y el comportamiento sexual; también se conoce por liberar el neurotransmisor ON, el cual estimula potentemente a la GnRH, mediante la activación de una enzima contenedora de hemo, guanilato ciclasa (Dhandapani y Brann, 2000). Se ha reportado que el GLU estimula la secreción de la LH (Brann y Mahesh, 1997) y que los agonistas de receptores de GLU ionotrópicos, incrementan la secreción de la LH después de inyecciones sistémicas o intracerebroventriculares en ratas (Zamorano et al., 1998), mediante la estimulación de la secreción de la GnRH. La acción de estos receptores subyace en la rápida transmisión sináptica estimulatoria mediada por el GLU en el SNC (Brann y Mahesh, 1994).
Estudios recientes indican que la glutamina, el GLU y la ARG desempeñan funciones importantes en la regulación de la expresión génica, señalización celular, respuestas antioxidantes y la inmunidad. Además, el GLU, la glutamina y el ASP son combustibles metabólicos importantes para el intestino delgado y, junto con la glicina, regulan la función neurológica (Wu, 2013). En la función reproductiva, la suplementación con ARG durante el reconocimiento materno de la gestación en ovejas favorece la supervivencia embrionaria (Crane et al., 2016) y mejora las tasas de gestación y de parición (Luther et al., 2009). El NMDA y la LH aumentan después de la administración de ASP, lo cual sugiere una función de este aminoácido en la actividad reproductiva en las ovejas (Boni et al., 2006). El GLU es un mediador primario de la transmisión sináptica excitadora en el SNC y sus receptores están localizados en una variedad de núcleos hipotalámicos; algunos de los cuales son críticos para la reproducción y en la función neuroendocrina, por su relación con la pubertad, la neurogénesis y el comportamiento reproductivo en la hembra (Meza-Herrera et al., 2011).
CONCLUSIÓN
La acción de los aminoácidos neuroestimuladores estimulan la secreción de las gonadotropinas adenohipofisiarias, y por lo tanto, regula el control de los eventos fisiológicos gonadales. Este conocimiento se puede aplicar para aumentar la eficiencia reproductiva en ovejas y mejorar las variables productivas y reproductivas.











 texto en
texto en 



