INTRODUCCIÓN
El estado de Tamaulipas posee muchos recursos multiflora que podrían ser utilizados para el desarrollo de la apicultura, particularmente en la Sierra Madre Oriental (Villegas et al., 2003); además, en el centro del estado existe una importante área citrícola (SDR, 2017).
Sin embargo, la africanización de los núcleos ha propiciado la disminución de la producción de miel; asimismo, las enfermedades, parasitosis, la falta de capacitación de los productores y los fenómenos climáticos también han disminuido el potencial productivo de las abejas (Guzmán-Novoa et al., 2004; Medina-Flores et al., 2015; Urbina- Romero et al., 2019). De igual modo, la introducción de nuevas plagas como el escarabajo de la colmena (Aethina tumida), reportado en el país recientemente por la SAGARPA (2007).
La llegada de las abejas africanizadas en 1987, trajo consigo cambios significativos en la manera de hacer apicultura en el país; estos híbridos heredaron características indeseables de sus progenitores africanos (Apis mellifera scutellata), como el comportamiento defensivo, la tendencia a enjambrar y la migración (Medina-Flores et al., 2015; Urbina-Romero et al., 2019). Las consecuencias directas de este comportamiento defensivo fue el abandono de la actividad de productores, reducción del número de colmenas, incremento en los costos de producción por la adquisición de equipos de protección y el intercambio periódico de reinas fecundadas (SAGARPA, 2016).
Sin embargo, las abejas africanizadas poseen características deseables para la actividad apícola, entre ellas la adaptación a los climas tropicales que se traduce en el crecimiento rápido de sus poblaciones y resistencia a ciertas enfermedades y parasitosis (Vázquez- Castro et al., 2006; Medina-Flores et al., 2015).
Por otro lado, la reacción en cadena de la polimerasa (PCR), ésta asociada al polimorfismo en la longitud de los fragmentos de restricción (RFLP), los cuales son una herramienta versátil, rápida y de bajo costo para detectar polimorfismos de un nucleótido simple (SNPs) de genes asociados a características de producción; así como para evaluar la variabilidad genética entre y dentro de poblaciones (Sifuentes et al., 2006). Se ha comprobado que el polimorfismo en el ADN nuclear (ADNn) y ADN mitocondrial (ADNm) son marcadores moleculares muy útiles en el estudio de genética de poblaciones (Clarke et al., 2001).
Asimismo, el polimorfismo del ADNn se utilizó para discriminar grupos de abejas pertenecientes a las subespecies africanas y europeas (Esquivel-Rojas et al., 2015). Por su parte, Medina-Flores et al. (2015) encontraron en un estudio realizado en Zacatecas, México, que las diferencias en las frecuencias de los morfotipos africanos y europeos fueron significativas, tanto intrarregión como entre las tres regiones.
El presente estudio tuvo como objetivo caracterizar las poblaciones de abejas de Apis mellifera de apiarios comerciales en el estado de Tamaulipas, usando técnicas de análisis moleculares para identificar la variabilidad del ADNm y la presencia de genes europeos y africanos.
MATERIAL Y MÉTODOS
Se colectaron 103 muestras provenientes de apiarios comerciales del estado de Tamaulipas; los productores reemplazan sus reinas aproximadamente cada dos años (SAGARPA, 2016), con abejas reinas certificadas (no africanizadas); algunos recurren a la alimentación artificial de las abejas durante las épocas de frío y de sequía, con productos como jarabe de fructuosa y torta de soya.
Las muestras (abejas), se mantuvieron en alcohol etanol absoluto al 95% a temperatura ambiente hasta la extracción del ADN. La extracción de ADN completo se realizó en el Laboratorio de Biología Molecular de la Facultad de Medicina Veterinaria y Zootecnia de la Universidad Autónoma de Tamaulipas, de acuerdo al protocolo propuesto por Crozier y Crozier (1993). Para la extracción del ADN se congelaron cuatro abejas con Nitrógeno líquido (N2), se maceraron en mortero estéril y las muestras se digirieron a 55° C por 16 hrs en 295 µL de solución Master-Mix (Proteinasa K, RNase A Solution, EDTA 0.5 M, pH 8.0; Nuclei Lysis Solution). Para purificar el ADN se agregó al tubo Eppendorf® de 1.5 mL con la muestra, 250 µL de Wizard® SV Lysys Buffer, se centrifugaron a 13000 Xg por un minuto; se transfirió al tubo colector con minicolumna con filtro, se agregaron 650 µL de Wizard® SV Wash Solution (cuatro veces), centrifugando a 13000 Xg por un minuto. Posteriormente se desechó el tubo de minicolumna y se colocó el filtro con el ADN en un tubo nuevo Eppendorf® de 1.5 ml, se añadieron 250 µL de H2O estéril desionizada libre de nucleasas incubándose por dos minutos a temperatura ambiente. La muestra se centrifugó a 13000 Xg por dos minutos y el ADN obtenido se congeló a -20° C hasta su utilización.
La PCR fue desarrollada conforme al protocolo descrito por Esquivel-Rojas et al. (2015), pero con 100 ng de ADN, 50 nm de cada iniciador y 25 µL de Mastermix®, que incluye 1 U de Taq polimerasa y 10 µL de H2O estéril libre de nucleasas.
La región de 485 pb del gen Citocromo b, se amplificó empleando los iniciadores Cytb-b F: TAT GTA CTA CCA TGA GGA CAA ATA TC y Cytb-R ATT ACA CCT CCT AAT TTA TTA GGA AT. La mezcla fue desnaturalizada a 94º C por un minuto, seguida por 30 ciclos, 94º C por un minuto, 60º C por un minuto y 72º C, 30 segundos; finalmente a 72º C por 7 min, empleando un Termociclador Nyx Technik®. Para la PCR-RFLP se utilizaron 50 µg de producto de PCR que fue digerido con 1.5 U de Bg/II en un volumen final de 25 µL. Se incubó por 16 hrs y los productos de la digestión fueron separados por electroforesis en un gel de agarosa 1% en solución TBE 1X; se utilizó un marcador estándar de 50 pb. La tinción de los geles se realizó con bromuro de etidio y la captura de las imágenes se realizó con el fotodocumentador DigiDoc-IT System® y el software Launch Doc-ITLS Acquisition®. Se visualizó un patrón de dos fragmentos (194 y 291 pb) correspondiente al mitotipo europeo (E) y un fragmento único sin digerir de 485 pb que corresponde al mitotipo africano (Crozier y Crozier, 1993).
Para la detección del sitio polimórfico L2S1int, se diseñaron los iniciadores F: GGCGTCCAGGTAACCGTCTCC y R: CGGTTGGAGGCGAACGGAAA para obtener un fragmento de 830 pb. Las condiciones de PCR son las recomendadas por Suazo y Hall (2002), utilizando la enzima de restricción AVAI para identificar el alelo africano. Dado que los análisis en este fragmento no fueron concluyentes para identificar las características moleculares esperadas, los resultados no se incluyen en el presente manuscrito.
Para el análisis estadístico y determinar el equilibrio de Hardy-Weinberg, el déficit de heterocigotos y el índice de contenido polimórfico del locus utilizado para la caracterización de las poblaciones, se emplearon los softwares Cervus v3.03® y GENEPOP v4.0.10®.
RESULTADOS
El método molecular empleado en el presente trabajo estuvo basado en la PCR-RFLP de ADNn y ADNm; por un lado, se amplificó el fragmento nuclear de subalelo L2S1int de 830 pb empleando la enzima de restricción AvaI. Asimismo, se amplificó el fragmento mitocondrial de 485 pb del gen mitocondrial del citocromo b utilizando la enzima Bg/II; ya que estos dos loci contienen los cambios en las secuencias que permiten la discriminación de la subespecie africana Apis mellifera scutellata y las subespecies no africanas.
En la figura 1 se muestran los geles de agarosa con los productos de la PCR del ADNm, sometidos a electroforesis y teñidos con bromuro de etidio (EtBr). Se observó el fragmento amplificado del gen del citocromo b con un tamaño de banda de 485 pb (A) y el segmento amplificado del subalelo L2S1int un fragmento de 830 pb (B).
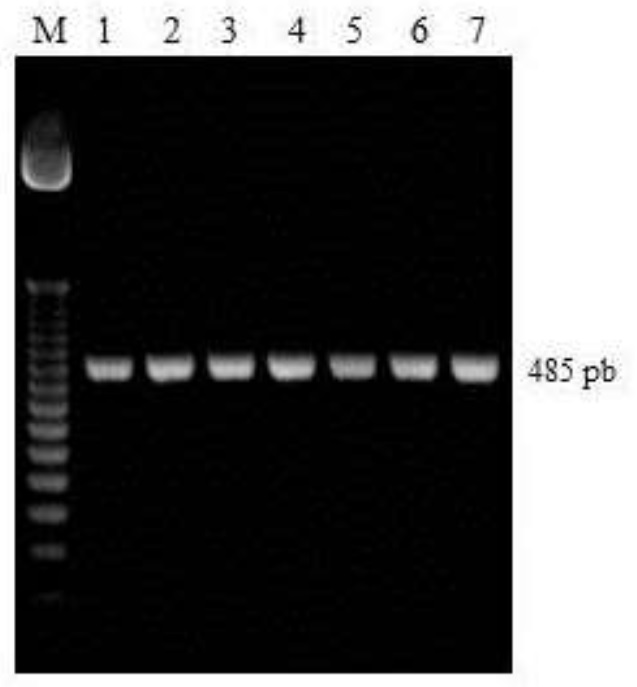
Carriles: 1, marcador molecular de 50 pb y Carriles 2-8, segmento del gen del citocromo b amplificado (A).
Figura 1 Electroforesis del gel de Agarosa 1.7% con el fragmento amplificado de 485 pb del gen del citocromo b. Carriles: 1, marcador molecular de 50 pb y Carriles 2-8, segmento del gen del citocromo b amplificado (A).
En el presente trabajo se observó que el polimorfismo del gen mitocondrial del Citocromo b detectado con la enzima Bg/II, discrimina el haplotipo mitocondrial de A. m. scutellata; ancestro de las abejas africanizadas, del haplotipo de A. m. mellifera, A. m. ligustica, A. m. cárnica y A. m. caucasica (figura 2).
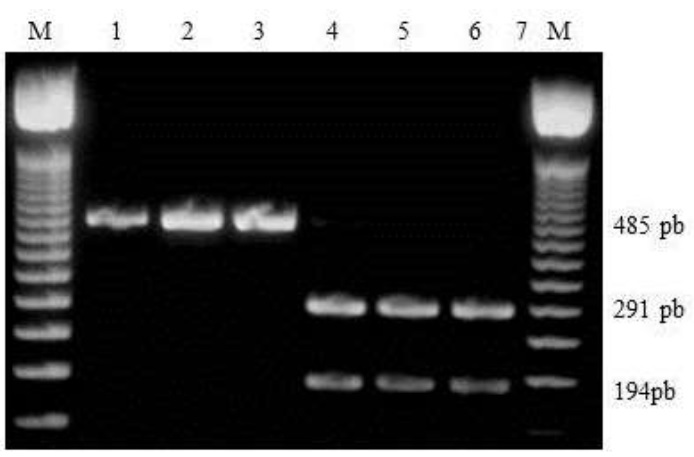
Electroforesis del gel de Agarosa 1.7%. Fragmento de 485 pb característico de abejas africanizadas (carriles 2-4). Segmentos de 194 Fragmento 291 pb característico de abejas no africanizadas (carriles 5-7).
Figura 2 Patrones de RFLP del segmento del gen del citocromo b/ Bg/II.
El análisis electroforético de los geles de agarosa 1.7% con el ADNm de las muestras, mostró fragmentos de bandas de ADNm de genotipos africano y europeo (figura 3). Los fragmentos que mantuvieron el tamaño de 485 pb son característicos de las abejas africanas, (debido a que carecen del sitio de corte para la enzima Bg/II en el gen del citocromo b); mientras que en los individuos que tuvieron el sitio de restricción se produjeron fragmentos de 194 y 291 pb, correspondientes a abejas no africanas.

Electroforesis del gel de Agarosa 1.7%. Segmentos de 485 pb característico de abejas africanizadas (carriles 2-13, 15 y 18). Segmentos de 194 y 291 pb característico de abejas europeas (carriles 14, 16, 17).
Figura 3 Patrones de RFLP del segmento del gen del citocromo b obtenidos con la endonucleasa Bg/II.
Se observó que las poblaciones tienen un grado de africanización superior al 55% (cuadro 1), a excepción de Jaumave.
Cuadro 1 Número y frecuencias (porcentaje) de la distribución de los patrones de ADNm europeo y africano en las poblaciones de abejas de Tamaulipas
| Localidad | N | Europeo (E) | Africano (A) | E-A |
| Victoria | 15 | 5(33.3) | 9(60.0) | 1(6.7) |
| Altamira | 24 | 2( 8.3) | 22(91.7) | |
| Llera | 23 | 5(21.7) | 18(78.3) | |
| Güémez | 24 | 8(33.3) | 14(58.3) | 2(8.3) |
| Padilla | 12 | 5(41.7) | 7(58.3) | |
| Jaumave | 5 | 2(40.0) | 2(40.0) | 1(20.0) |
| Total | 103 | 27(26.2) | 72(69.9) | 4(3.9) |
Por otro lado, las frecuencias genotípicas y alélicas en las poblaciones de abejas de las regiones de Tamaulipas se presentan en el cuadro 2.
Cuadro 2 Frecuencias genotípicas y alélicas en las poblaciones de abejas de Tamaulipas
| Población | N | Frecuencias Genotípicas | ||
| Europeo (E) | Africana (A) | E/A | ||
| Victoria | 15 | 0.333 | 0.600 | 0.067 |
| Altamira | 0.083 | 0.917 | ||
| Llera | 23 | 0.217 | 0.780 | |
| Güémez | 24 | 0.333 | 0.583 | 0.083 |
| Padilla | 12 | 0.417 | 0.583 | |
| Jaumave | 5 | 0.400 | 0.400 | 0.100 |
E/A= europeo/africano
Los análisis realizados para las frecuencias genéticas de las poblaciones indicaron que no están en equilibrio de Hardy-Weinberg, probablemente debido a que existe déficit de heterocigotos.
DISCUSIÓN
El método molecular empleado permitió la discriminación de la subespecie africana Apis mellifera scutellata y las subespecies no africanas (Zamora et al., 2008 Esquivel-Rojas et al., 2015). El polimorfismo del gen mitocondrial del citocromo b detectado con la enzima BglII, discrimina el haplotipo mitocondrial de A. m. scutellata; ancestro de las abejas africanizadas, del haplotipo de A. m. mellifera, A. m. ligustica, A. m. cárnica y A. m. caucasica (Pinto et al., 2003 Genchi-García et al., 2018).
El análisis electroforético de los geles de agarosa 1.7% con el ADNm de las muestras, mostró fragmentos de bandas de ADNm de genotipos africano y europeo. Los fragmentos que mantuvieron el tamaño de 485 pb son característicos de las abejas africanas, (debido a que carecen del sitio de corte para la enzima BglII en el gen del citocromo b); mientras que en los individuos que tuvieron el sitio de restricción, se produjeron fragmentos de 194 y 291 pb, correspondientes a abejas no africanas.
El patrón observado en este trabajo coincide con el patrón para discriminar haplotipos africanos de no africanos en áreas africanizadas (Pinto et al., 2003 Tibatá et al., 2018). Se observó que las poblaciones tienen un grado de africanización; resultados similares fueron reportados por Esquivel-Rojas et al. (2015), Medina-Flores et al. (2015), Quezada- Euán (2007) y Zamora et al. (2008), al realizar la evaluación del polimorfismo de las poblaciones africanizadas en México.
Los resultados obtenidos con las modificaciones al protocolo de purificación de ADNm, permitieron conocer la estructura genética de las abejas melíferas en el centro de Tamaulipas. La caracterización de las poblaciones mostró que 69.9% de las colonias evaluadas tuvieron en su ADNm, el sitio de restricción para el haplotipo africano; como se señala en la literatura (Quezada-Euán, 2007; Zamora et al., 2008 Esquivel-Rojas et al., 2015; Medina-Flores et al., 2015). Mientras que el 26.2% de los apiarios muestreados tuvieron en su ADNm el haplotipo, que los caracteriza como de origen materno europeo. Un 4% de las muestras presentaron haplotipo mixto europeo-africano; esto pudo deberse a que los zánganos son silvestres y presentan una alta proporción de genes africanos. Sin embargo, los apicultores de Tamaulipas tienen como estrategias introducir reinas cada año o año y medio, pero certificadas ante la Secretaría de Agricultura, Ganadería, Desarrollo Rural, Pesca y Alimentación (SAGARPA), de no ser portadoras del gen africano (SAGARPA, 2016).
En los sitios muestreados el haplotipo africano representó un alto porcentaje de las colonias, confirmando la reducción de alelos tipo europeo en las poblaciones apícolas de México, Colombia y Brasil (Quezada-Euán, 2007); y la dominancia de genes nucleares y mitocondriales africanos en el genoma de las colonias domésticas, a partir de la llegada de la abeja africanizada a México.
Las poblaciones de Altamira están compuestas casi en su totalidad de abejas con mitotipo de origen africano, probablemente porque los productores no realizan el cambio anual con reinas de origen europeo. Estos resultados sugieren que las prácticas apícolas, como el cambio anual de reinas no ha sido suficiente para revertir la frecuencia de genes africanos en las poblaciones locales. Además, las condiciones climáticas tropicales de la región, han facilitado el desplazamiento de los genes europeos.
Se observó que las poblaciones tienen un alto grado de africanización, a excepción de Jaumave; lo que indica que aún es necesario seguir introduciendo reinas certificadas europeas (SAGARPA, 2016).
Quezada-Euán (2007) reportó para Chiapas y Tabasco 95.0% de africanización; Uribe et al. (2003) y Zamora et al. (2008) reportaron 13.7, 48.0, 50.0 y 21.0%, de haplotipos derivados de abejas africanas en Sonora, Baja California Sur y Baja California Norte, respectivamente. De igual modo, Quezada-Euán (2007) reportó que la proporción de africanización en Michoacán y Jalisco fue 56.0 y 40.0%, respectivamente. Mientras que en Yucatán, se incrementó de 61.0 a 73.0%. Alaniz-Gutiérrez et al. (2016) observaron que los morfotipos africanos en Ensenada y Mexicali, Baja California se encuentran por arriba del 85.0%.
CONCLUSIÓN
Se puede concluir que las poblaciones de Apis mellifera L. de Tamaulipas, están constituidas por genes característicos A. mellifera scutellata y en menor proporción por genes de las subespecies europeas como A. mellifera ligustica. Los resultados del análisis de los marcadores moleculares mostraron que las poblaciones de Tamaulipas son heterogéneas con introgresión de genes africanos en las poblaciones europeas.











 text in
text in 



