INTRODUCCIÓN
El selenio (Se) es un micronutriente esencial necesario para el funcionamiento adecuado del organismo, la deficiencia en este mineral produce patologías (Huang et al., 2012; Ahsan et al., 2014). Los niveles de selenio regulan procesos de inflamación e inmunidad (Huang et al., 2012). Existen dos tipos de respuesta ante la invasión de agentes extraños al organismo: La respuesta inmune innata (natural); es una respuesta rápida, no específica, compuesta de barreras mecánicas, mucosas y células productoras de citocinas y quimiocinas. La inmunidad innata actúa organizadamente hasta la activación de la inmunidad adaptativa. La inmunidad adquirida (adaptativa) es una respuesta rápida, con memoria inmunológica, mediada por células T y B, las cuales para su activación requieren de la presentación y procesamiento de antígenos. La inmunidad adaptativa se divide en dos áreas, la inmunidad humoral mediada por linfocitos B y la inmunidad celular mediada por los linfocitos T. Las respuestas innatas y adquiridas generalmente funcionan juntas para eliminar patógenos. Las células de respuesta innata utilizan células fagocíticas (neutrófilos, monocitos y macrófagos), células que liberan mediadores inflamatorios (basófilos, mastocitos y eosinófilos) y células asesinas naturales (Delves y Roitt, 2000).
De acuerdo a Martínez et al., (2011) durante la gestación normal en la mucosa uterina se encuentra gran número de leucocitos (neutrófilos, macrófagos, células asesinas naturales y células dendríticas); células que cumplen múltiples funciones como: fagocitosis, producción de citocinas, producción de metabolitos del oxígeno (óxido nítrico (ON), anión superóxido), liberación de prostaglandinas, proteínas de fase aguda y péptidos antimicrobianos.
Investigaciones hechas en los últimos años involucran aspectos del sistema inmune (en selección, maduración y activación de algunos eventos de células inmunes), estos estudios muestran variaciones en las concentraciones de leucocitos según los eventos fisiológicos de enfoque, como son: gestación, lactancia, edad, raza, efecto del estrés e incluso la ubicación geográfica de la explotación animal; así como el estado de salud (Hoffmann y Berry, 2008).
La cantidad de nutrientes transferidos a la descendencia depende del estado nutricional de la madre y la eficiencia del mecanismo de transporte transplacentario y mamario; el paso de oligoelementos y otros nutrientes a través de la placenta es necesario para: el desarrollo embrionario, crecimiento fetal y funciones fisiológicas de la madre y el feto durante la gestación. El selenio pasa eficientemente a través de la barrera placentaria hacia tejidos fetales y también se transfiere al calostro y la leche (Rock et al., 2001; Stewart et al., 2012; Erdogan et al., 2017). La deficiencia nutricional de selenio causa: problemas de fertilidad, aborto, retención placentaria, enfermedad del músculo blanco, debilidad neonatal (Spears, 2011), mortalidad, crecimiento, desarrollo e implantación del embrión inadecuada (Sharma y Agarwal, 2004) y baja inmunidad (Rayman, 2012). Dichos problemas se pueden prevenir adicionando selenio a la dieta de los animales.
Existen diversa formas y fuentes de selenio; orgánicas (selenometionina, selenocisteína) e inorgánicas (selenito y selenato de sodio). El orgánico tiene mayor biodisponibilidad, es tres veces menos tóxico que el inorgánico; es citoprotector, debido a que se incorpora a los tejidos de reserva (Yue et al., 2009; Lyons et al., 2007). Sin embargo, a pesar de que diversos autores mencionan los beneficios del selenio en la inmunidad celular, no existe información precisa sobre el efecto del mineral en la presencia de células del paquete celular blanco; encargadas de respuesta inmune en ovejas en proceso de gestación.
Por lo tanto, el objetivo del estudio fue evaluar la respuesta de leucocitos durante el desarrollo embrionario de ovejas con aplicación oral de selenio orgánico otorgado antes de ser inseminadas.
MATERIAL Y MÉTODOS
La investigación se realizó en el municipio de San Andrés Chiautla, Estado de México; con coordenadas geográficas 19°36'19" N y 98°54'38" O, y altitud de 2260 msnm. El clima es templado-semiseco, registrando temperatura media anual de 19°C, con máxima de 32°C y mínima de 6°C (Inafed, 2018). Se utilizaron 27 ovejas locales (raza indefinida) multíparas con peso entre 35 y 38.2 kg, condición corporal de 2.5 (escala de 1 a 5), con edad promedio de 2.5 años. Las ovejas se asignaron al azar en dos grupos, 11 para el grupo testigo (sin selenio; S-Se) y 16 con adición de levadura enriquecida con selenio (selenio orgánico; C-Se) en dosis de 0.3 ppm; requerimiento de acuerdo al NRC, considerando que el lugar donde se realizó el experimento es deficiente en selenio (Targetmap, 2013). Durante todo el experimento las ovejas se mantuvieron en estabulación permanente y se alimentaron con dieta a base de alfalfa achicalada y rastrojo de maíz.
La administración oral de selenio orgánico (C-Se), fue por periodo de siete días antes de la Inseminación Artificial (IA), y al grupo S-Se se les administró placebos. Antes del inicio del tratamiento se desparasitaron (Ivermetina dosis: 1ml) y se aplicó vitamina (Complejo B); se sometieron a protocolo de sincronización de estro con esponjas intravaginales Cronolone (Chronogest® CR), impregnadas con 20 mg de progestágeno durante 14 días. Al retirar las esponjas, se aplicaron 400U I de eCG (Folligon®) y la Inseminación Artificial (IA) se realizó 55 horas después del retiro de esponjas, por el método de endoscopía.
Se tomaron muestras sanguíneas para realizar frotis; antes del tratamiento con selenio orgánico, antes de desparasitar a las ovejas (39 días antes de la IA) y un día antes de iniciar el tratamiento con selenio, durante los días -5, -3 y -1; considerando el día cero como el día de la Inseminación Artificial (IA) y después; los días 1, 3, 5, 7, 9, 11, 13, 19, 23, 28 y 42; este último periodo de muestreo se consideró como correspondiente al desarrollo embrionario de la oveja.
La técnica que se realizó para este estudio es la que utiliza el módulo de reproducción del Colegio de Postgraduados. Los frotis sanguíneos se realizaron colocando una gota de sangre en el centro del portaobjetos y se hizo el barrido de la muestra de forma uniforme para formar una capa delgada de tejido sanguíneo; se secó a temperatura ambiente por 10 minutos aproximadamente; posteriormente se aplicó etanol al 96% para fijar la muestra, se tiñeron con Hematoxilina Gill No.3 (Sigma-Aldrich) por 5 minutos; posterior a ello se realizó un lavado con agua destilada.
El conteo diferencial de leucocitos se realizó con microscopio óptico a resolución 40x con cinco repeticiones (campos microscópicos) por muestra. Se realizó el diagnóstico de gestación 35 días posteriores a la Inseminación con ecógrafo portátil marca Draminski modelo 4Vet mini, con transductor abdominal 7.5 MHz; la exploración de estructuras propias de gestación se hizo a nivel de la fosa iliaca. Para el diagnóstico las ovejas fueron dietadas 12 horas antes de realizar la ecografía.
Las variables dependientes evaluadas fueron cantidad diferencial de glóbulos blancos (Linfocitos, Neutrófilos, Monocitos, Basófilos y Eosinófilos). Las ovejas se distribuyeron de manera aleatoria para cada tratamiento; incluyendo a la oveja como efecto aleatorio. Se utilizó un modelo mixto mediante el procedimiento MIXED (SAS, 2002), con el siguiente modelo: Y ijk = μ + T i + Tiempo j + T*Tiempo ijk + ε ijk ; en donde: Y ij : variable dependiente analizada, μ: media general de la población, T i : i-ésima tratamiento, P j : j-ésimo tiempo, T*Tiempo ij : interacción entre el tratamiento y el tiempo de muestreo, ε ijk : error aleatorio. En los casos de significancia estadística (p ≤ 0.05), las medias se compararon con la prueba de Tukey.
RESULTADOS Y DISCUSIÓN
En el presente estudio la adición del selenio orgánico a las ovejas no mostró diferencias significativas (p ≥ 0.05) en linfocitos (figura 1a); mientras que se presentó efecto significativo por tratamiento (p ≤ 0.05) en neutrófilos el día 9 del desarrollo embrionario (5.91 ± 0.89 S-Se y 2.11 ± 0.46 C-Se, respectivamente (figura 1b)). No se encontró diferencia significativa (p ≥ 0.05) en linfocitos entre tratamiento; en contraste con los resultados encontrados por Broome et al., (2004), quien al adicionar selenio observó aumento en cantidad de linfocitos. El día -8 que corresponde un día antes del inicio del tratamiento y el día -5 durante el tratamiento; muestran el menor número de células blancas en el tiempo. El día uno corresponde un día después de la inseminación, y en el día tres se da la fecundación del óvulo; observando así una disminución de linfocitos y neutrófilos en ambos eventos fisiológicos. Considerando que los neutrófilos son células fagocíticas (junto con monocitos y macrófagos), se enlazaría con la posibilidad de menor rechazo de espermatozoides.
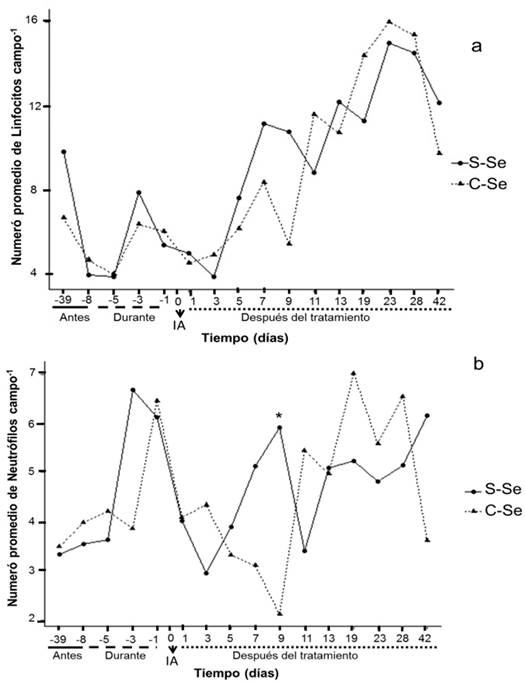
S-Se: sin selenio, C-Se: levadura enriquecida con Selenio orgánico, dosis (0.03 ppm); -39, -8: días antes del inicio del tratamiento; -5, -3, -1: muestras durante el tratamiento; 1: inicio de la gestación; 1, 3, 5, 7, 9, 11, 13, 19, 23, 28 y 42: días del desarrollo embrionario de la oveja. IA: Inseminación Artificial. *: Indica diferencias significativas (P<0.05).
Figura 1a y 1b Comportamiento de linfocitos y neutrófilos en el tiempo en ovejas locales (raza indefinida)
Los linfocitos T son considerados moduladores de la respuesta inmunológica de la madre, ya que regulan el proceso de implantación durante el primer trimestre de embarazo, existiendo un incremento de células T (Martínez et al., 2011). Resultados que coinciden en este estudio al incrementar la cantidad de linfocitos a partir del día 11 del desarrollo embrionario, donde días después empieza la implantación (figura 1a). En abortos espontáneos se ha observado disminución en el número de las células T reguladoras (Guerin et al., 2009).
Las células blancas que presentaron mayor porcentaje en esta investigación fueron los linfocitos (55.06 %), neutrófilos (29.22 %) y monocitos (8.26 %); y en menor cantidad los basófilos y eosinófilos con 0.70 % y 4.46 %, respectivamente. Respecto a los tratamientos se muestra ligera elevación de valores promedios en la adición de selenio orgánico (C-Se) con 58.0 %, y sin selenio (S-Se) un 41.95 %, no obstante no hubo diferencias estadísticas (p ≥ 0.05); esto puede deberse a eventos externos e internos del animal, como fisiología normal o patológica. Estos resultados concuerda con Yue et al., (2009) y Brown et al., (2000), que al evaluar diferentes grupos de tratamiento con selenio, no se presentaron diferencias significativas en las variables evaluadas. Brown et al. (2000), menciona que a pesar de la variación numérica de los valores, la no diferencia es debida a variación en respuestas interindividuales.
En cuanto a los basófilos, se observó diferencia significativa (p≤0.05) entre tratamiento y en el tiempo; el día -3 mostró disminución del valor promedio de células basófilas para el tratamiento con selenio orgánico (1.05 ± 0.23), en comparación con el grupo testigo S-Se (1.85 ± 0.31). El día 5, 7 y 9 del desarrollo embrionario se observó disminución de basófilos y eosinófilos (figura 2a, b). Estos días corresponde al momento de la formación del blastocisto (5-6 días) y empieza una etapa inflamatoria, de acuerdo a lo descrito por Delves y Roitt (2000), estas células (basófilos y eosinófilos) son mediadores inflamatorios. Canalejo et al., (2007) no encontraron diferencias en basófilos, eosinófilos y linfocitos durante el tiempo de gestación a pesar de ser ésta una etapa con presencia de inflamación de tejido uterino. En enfermedades como la inflamación alérgica, los números de eosinófilos aumentan notablemente en la sangre y los tejidos, donde se localiza la inflamación (Davoine y Lacy, 2014).
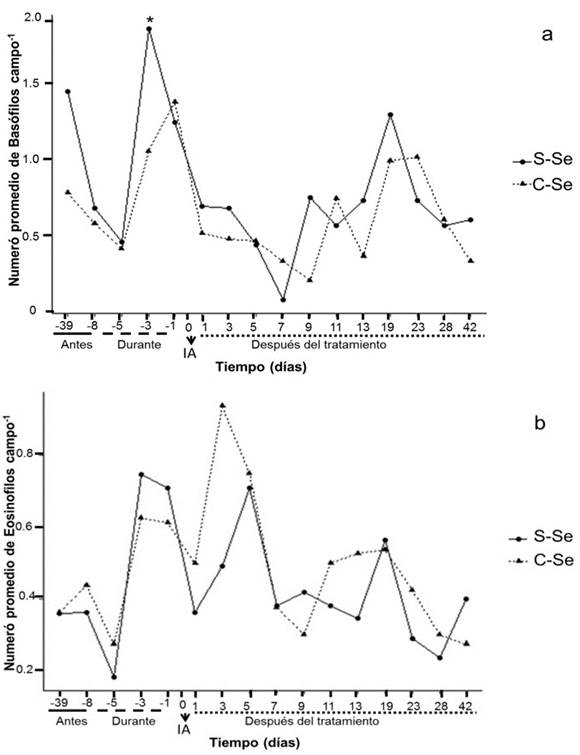
S-Se: sin selenio, C-Se: levadura enriquecida con Selenio orgánico, dosis (0.03 ppm); -39, -8: días antes del inicio del tratamiento; -5, -3, -1: muestras durante el tratamiento; 1: inicio de la gestación; 1, 3, 5, 7, 9, 11, 13, 19, 23, 28 y 42: días del desarrollo embrionario de la oveja. IA: Inseminación Artificial *: Indica diferencias significativas (P<0.05).
Figura 2a y 2b Comportamiento de basófilos y eosinofilos en el tiempo en ovejas locales (raza indefinida).
A partir del día 11 del desarrollo embrionario los valores de las células blancas aumentan (figura 1 y 2), considerando que los días posteriores se presentan procesos fisiológicos; en el día 13 ocurre la implantación embrionaria en las ovejas y el establecimiento de placentomas, se registra de 30-80 días (Byers y Kramer, 2010). El aumento registrado en las células blancas posterior a los eventos fisiológicos aquí comentados puede no tener causa directa sobre el embrión, dado que para este momento la barrera placentaria se está desarrollando y sirve de protección directa al embrión.
CONCLUSIONES
Se concluye que la administración de selenio orgánico (0.3 ppm), disminuye el número de neutrófilos y basófilos, después de formarse el blastocisto y cuatro días después de iniciado el tratamiento. Las diferencias estadísticas por tiempo se deben a factores fisiológicos del desarrollo embrionario. No se encontró diferencias estadísticas en linfocitos, monocitos, eosinófilos.











 texto en
texto en 



