INTRODUCCIÓN
A nivel mundial los sistemas de producción de ovinos enfrentan serios problemas de salud que limitan la productividad de los animales y generan pérdidas económicas importantes en la cadena de producción de alimentos (Rios-de Alvarez et al., 2012; Roeber, Jex y Gasser, 2013; Kumarasingha et al., 2016). Se ha estimado que el costo anual del tratamiento contra algunos parásitos es superior a 103 millones de dólares (Peter y Chandrawathani, 2005).
En la producción de pequeños rumiantes los nematodos gastrointestinales con mayor prevalencia son Cooperia sp, Teladorsagia (Ostertagia) circumcincta, Trichostrongylus sp ,Oesophagostomum sp y Haemonchus contortus; siendo este último el nematodo más patogénico y que produce los mayores índices de mortalidad y morbilidad (Cala et al., 2012; Zapata, Velásquez, Herrera, Ríos, y Polanco, 2016). Dependiendo de la carga parasitaria, edad y estado fisiológico, los animales afectados pueden presentar anorexia, diarrea, pérdida de peso, anemia y edema; signología asociada a que Heamonchus contortus es un parásito hematófago. Todas estas alteraciones se traducen en pérdida de peso, disminución de la fertilidad, producción de lana, leche, y en casos muy severos la muerte del animal (Cala et al., 2012; Carvalho et al., 2012; Roeber et al., 2013).
Tradicionalmente se han utilizado fármacos antihelmínticos para el tratamiento y prevención de la Hemoncosis en pequeños rumiantes; sin embargo, la administración generalizada e indiscriminada de estos productos ha resultado en la generación resistencia por parte del parásito; reportada por primera vez en 1964 (Carvalho et al., 2012). Debido a los problemas de resistencia a antihelmínticos comerciales, constantemente se están buscando nuevas estrategias funcionales y económicas para el control de los nematodos (Cala et al., 2012; Carvalho et al., 2012), como: implementar programas de nutrición adecuados, la selección de animales resistentes, el manejo integral de las praderas, el uso de hongos nematófagos y nuevos compuestos antihelmínticos derivados de las plantas (Katiki, Chagas, Bizzo, Ferreira y Amarante, 2011); ya que existen evidencias de que las plantas poseen compuestos bioactivos como terpenos compuestos fenólicos, glicósidos y alcaloides con actividad antihelmíntica comprobada (Eguale, Tadesse, y Giday, 2011; Kamaraj y Rahuman, 2011; Zabre et al., 2017; Hernández-Alvarado et al., 2018).
Cassia fistula es una leguminosa ornamental distribuida en países como India, Brasil, México, entre otros (Zhao et al., 2013; Antonisamy, Agastian, Kang, Kim y Kim, 2017); sus flores, frutos, semillas y hojas han sido utilizadas en medicina tradicional para el tratamiento de: diarrea, gastritis, fiebre, enfermedades de la piel, lepra, tiña, infecciones fúngicas de la piel, dolor abdominal, ictericia y náuseas; además de atribuírsele propiedades cicatrizantes, hipoglucémicas, antinflamatorias, hepatoprotectoras, antimicrobianas y antihelmínticas (Zhao et al., 2013; Antonisamy et al., 2017; Srividhya, Hridya, Shanthi, & Ramanathan, 2017). Tomando como base esta información se ha planteado el presente experimento con el objetivo de determinar la actividad antihelmíntica del extracto hidroalcóholico de vainas de Cassia fistula, sobre nematodos gastrointestinales de ovino in vitro.
MATERIAL Y MÉTODOS
Localización
La presente investigación fue realizada en el Instituto de Ciencias Agropecuarias de la Universidad Autónoma del Estado de Hidalgo, en el laboratorio de Bacteriología del Área Académica de Medicina Veterinaria y Zootecnia; ubicada en el municipio de Tulancingo de Bravo, Hidalgo, México.
Obtención de extractos
Se recolectó 1 kg de vainas de Lluvia de Oro (Cassia fistula), las cuales fueron secadas a la sombra a temperatura ambiente; posteriormente se maceraron y mezclaron 250 g de la vaina seca con 1500 ml de solución hidroalcóholica (30 % metanol y 70% de agua destilada), dejando reposar 72 horas. Pasado este tiempo se procedió a la filtración para separar el material sólido del líquido; finalmente se concentró con un rotoevaporador (Büchi R-300, Suiza), para eliminar el solvente y concentrar los metabolitos secundarios.
Posteriormente se procedió a diluir el extracto con agua destilada estéril, para obtener concentraciones de 200, 100, 50, 25, 12.5 y 6.26 mg/ml, para la evaluación del extracto sobre la inhibición de la eclosión de huevo y sobre la mortalidad de larvas de nematodos gastrointestinales in vitro.
Evaluación de la actividad del extracto sobre la inhibición de la eclosión de huevo de nematodos gastrointestinales
Para esta evaluación se colectaron 20 muestras de heces de ovinos Sulffork-Hampshire, de una unidad de producción ovina ubicado en el municipio de Tepeapulco en el Estado de Hidalgo, directamente del recto de cada animal, las cuales fueron identificadas y trasportadas a temperatura de refrigeración al laboratorio de bacteriología; donde se les realizaron las técnicas de flotación y Mac Master, para determinar la presencia de nematodos gastrointestinales y la cantidad de huevos por gramo de heces presentes en ellas, de acuerdo a la metodología descrita por Rivero-Pérez y colaboradores (Rivero-Pérez et al., 2018).
Recuperación de huevo de nematodos gastrointestinales
Una vez realizadas las técnicas de flotación y Mac Master, aquellas muestras que presentaron más de 1000 huevos por gramo de heces, fueron mezcladas vigorosamente, para posteriormente tomar aproximadamente 30 g de heces que fueron lavadas en tamices de 200,100, 75 y 37 micras. Para concentrar los huevos en el último tamiz, se recuperó el concentrado y se agregó a un tubo falcón de 15 ml, en el que previamente se agregaron 6 ml de solución salina saturada; luego se centrifugaron a 3000 rpm/ 3 minutos, obteniéndose el concentrado de huevos. Este concentrado se agregó a otro tubo con agua destilada, volviendo a centrifugar por 3 veces, para eliminar el exceso de solución salina y materia orgánica; hasta obtener una solución con huevo limpio (von Son-de Fernex et al., 2015).
Una vez obtenida la solución con el huevo limpio, se determinó la concentración de huevos en 50 µl (contando al microscopio óptico la cantidad de huevos en 10 alícuotas de 5 µl); cabe resaltar que para poder realizar el bioensayo, se requiere una concentración de 150-200 huevos en 50 µl.
Evaluación del extracto sobre la inhibición de la eclosión de huevo de nematodos gastrointestinales
En una placa de 96 pozos, se colocaron 50 µl de una solución de agua destilada con 150 huevos/pozo y se agregaron 50 µl de cada extracto a las diferentes concentraciones (200, 100, 50, 25 y 12.5 mg/ml), para conseguir un volumen final de 100 µl/ pozo; se utilizó como control positivo Ivermectina (5mg/ml) y como control negativo agua destilada. Se incubó a 30º C por 48 horas en una cámara húmeda. Transcurrido el periodo de incubación se procedió a la lectura de la placa, observando 10 alícuotas de 10 µl en el microscopio, con el objetivo 4x y determinando la cantidad de huevos y larvas en cada alícuota. Esta información se utilizó para determinar el porcentaje de inhibición de la eclosión de huevo mediante la siguiente formula:
Donde L1 es igual a larva 1.
Evaluación de la actividad del extracto de Cassia fistula sobre larvas de nematodos gastrointestinales
Recuperación de larva de nematodos gastrointestinales
Con las muestras de heces restantes de aquellos animales que presentaron más de 1000 nuevos por gramo de heces, se realizó un coprocultivo; el cual consiste en mezclar las heces con agua destilada y espuma de poliuretano (1.5 x 1.5x 0.5cm); para posteriormente incubarlas por 10 días a temperatura ambiente (15 a 20°C). Transcurrido el tiempo de incubación se procedió a montar la técnica de Bearman, para recuperar las larvas L3 de nematodos gastrointestinales; las cuales se lavaron con solución salina saturada, hasta eliminar la mayor cantidad de materia orgánica.
Una vez recuperadas las larvas, se procedió a realizar el desenvaine de las mismas, mezclando 2 ml de una solución de hipoclorito de sodio al 3% (para favorecer el desenvaine de las larvas), con 3 ml de la suspensión de larvas por un minuto (durante este tiempo se agitó en el vortex y se verificó al microscopio que las larvas perdieran su vaina). Pasado este tiempo, las larvas fueron lavadas 3 veces con 3 ml de agua destilada, para eliminar los restos de hipoclorito de sodio. Posteriormente se determinó la cantidad de larvas en 50 µl de agua destilada (contando al microscopio óptico la cantidad de larvas en 10 alícuotas de 5 µl). Cabe resaltar que para poder realizar el bioensayo se requiere una concentración de 150-200 larvas en 50 µl.
Evaluación del extracto hidroalcóholico de Cassia fistula sobre larvas de nematos gastrointestinales
Una vez obtenida la larva desenvainada, en una placa de 96 pozos se colocaron 50 µl de una solución de agua destilada con 150-200 larvas, posteriormente se agregaron 50 µl de cada extracto a las diferentes concentraciones (200, 100, 50, 25 y 12.5 mg/ml) con cuatro repeticiones cada una, utilizando como control positivo Ivermectina (5mg/ml) y agua destilada como control negativo; la placa se incubó en una cámara húmeda a 30º C por 72 horas. Transcurrido este tiempo se realizó la lectura de la placa, colocando 10 alícuotas de 10 µl para diferenciar, así como contabilizar larvas vivas y muertas (vivas en movimiento y muertas sin movilidad), al microscopio óptico marca Motic con el objetivo 4x. Los datos obtenidos se utilizaron para determinar el porcentaje de mortalidad, usando la siguiente ecuación:
RESULTADOS
Se determinó la presencia de huevos de Haemonchus contortus, Cooperia spp, Ostertagia spp, Chavertia ovina, Moniezia y Strongyloides spp, en el 85% de las muestras colectadas.
Por medio de la técnica de Mc Master, se determinó un promedio de 1795 huevos por gramo de heces del total de las muestras colectadas; las cuales fueron utilizadas para la evaluación de la actividad del extracto hidroalcóholico de Lluvia de Oro, sobre la inhibición de la eclosión y la mortalidad larvaria en nematodos de campo.
Al realizar la prueba de inhibición de la eclosión, se observó que las concentraciones evaluadas 50, 25 y 12.5, 6.25 mg/ml, presentan porcentajes de inhibición de la eclosión muy similares (21.95, 25.03, 30.14 y 26.24 %, respectivamente), sin presentar diferencias estadísticas significativas entre ellas, pero sí con respecto a los controles positivo y negativo (P=0.0001); en comparación con ivermectina que produjo un 100% de inhibición de la eclosión de los nematodos gastrointestinales presentes. Al parecer el extracto hidroalcóholico de Lluvia de Oro no es muy funcional, sin embargo se debe recordar que es un extracto, no un compuesto puro como el control positivo (ivermectina). Por otro lado, al comparar los % de IEH del extracto a sus diferentes concentraciones con el control negativo, se observa que sí hay diferencias estadísticas significativas, lo cual nos lleva a establecer que aunque el efecto producido por el extracto no va más allá del 30%, sí es un efecto considerable (Figura 1).
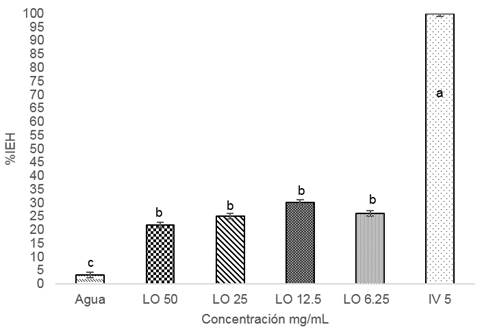
%IEH; porcentaje de Inhibición de la eclosión de huevos
LO; extracto hidroalcóholico de Cassia fistula
IV5; Ivermectina a 5 mg/mL
Diferentes literales en las barras indican diferencias estadísticas significativas (P≤0.05)
Figura 1 Porcentaje de inhibición de la eclosión de huevo de nematodos gastrointestinales de ovino con el uso de extracto hidroalcóholico de Cassia fistula.
Por otro lado, al evaluar el mismo extracto sobre la mortalidad larvaria de nematodos gastrointestinales, se observa que el efecto se mantiene con porcentajes de mortalidad muy cercanos a los porcentajes de inhibición de la eclosión, sin existir diferencias estadísticas significativas entre las concentraciones de extracto evaluadas; pero sí con respecto al control positivo y el control negativo (P=0.0001), entre las concentraciones evaluadas 50, 25, 12.5 y 6.25 mg/ml (Tabla 1). Como era de esperarse ivermectina mantienen su actividad produciendo porcentajes de mortalidad de 98.23%.
Tabla 1 Porcentaje de mortalidad ± de larvas de nematodos gastrointestinales de ovino con la aplicación de extracto hidroalcóholico de Cassia fistula.
| TRATAMIENTO | CONCENTRACION | % MORTALIDAD |
|---|---|---|
| Agua | 0 | 2,73c ± 0.9 |
| LO | 50 mg/mL | 29,65b ± 2.0 |
| LO | 25 mg/mL | 27,12b ± 1.9 |
| LO | 12.5 mg/mL | 25,81b ± 1.6 |
| LO | 6.25 mg/mL | 25,67b ± 1.2 |
| Ivermectina | 5 mg/mL | 98.23a ± 1.5 |
LO; extracto hidroalcóholico de Cassia fistula
Diferentes literales en las filas indican diferencias estadísticas significativas (P≤0.05)
DISCUSIÓN
Al realizar el análisis coproparasitoscópico de las muestras de heces colectadas, se determinó la presencia de Haemonchus contortus, Cooperia sp, Ostertagia sp, Chavertia sp y Strongyloides sp; resultados con coinciden con los reportadas por Zapata y colaboradores; quienes determinaron que estos géneros son los más abundantes en los sistemas de semiconfinamiento en ovinos. Además se pudo comprobar que se encuentran en cantidades que superan los 1700 huevos por gramo de heces, es decir presentan una carga elevada; esta situación se puede deber a que no hay antecedentes de desparasitación en la unidad de producción; además que son ovinos que salen a pastorear, lo cual aumenta el riesgo de poder infestarse con estos parásitos (Roeber et al., 2013; Zapata et al., 2016).
La evaluación del extracto hidroalcóholico de vainas de Cassia fistula, sobre la inhibición de la eclosión de huevos de los nematodos obtenidos después del lavado de heces; permitió determinar que LO inhibe la eclosión de huevos entre un 21 y 30% a las diferentes concentraciones evaluadas (50, 25 y 12.5, 6.25 mg/ml). Este efecto se podría deber principalmente al contenido de fenoles, flavonoides, taninos, alcaloides, proantocianidinas, terpenos y glicósidos; identificados en las semillas, pulpa y vainas; los cuales han sido identificados en otras plantas que han demostrado actividad inhibitoria de la eclosión de huevos y nematodos gastrointestinales (Duraipandiyan, Ignacimuthu y Gabriel Paulraj, 2011; Katiki et al., 2011; Cala et al., 2012; Carvalho et al., 2012; Rajagopal, Premaletha, Kiron y Sreejith, 2013; Hernández-Alvarado et al., 2018).
El posible mecanismo de acción por el cual los metabolitos secundarios presentes en las plantas inhiben la eclosión de huevos de nematodos, consiste en inhibir o retrasar el crecimiento y maduración de los parásitos; reduciendo o suprimiendo su apetito y alterando su capacidad reproductiva (Carvalho et al., 2012).
Por otro lado, la evaluación del extracto sobre el porcentaje de mortalidad larvas de nematodos gastrointestinales; reveló que el extracto hidroalcóholico produce porcentajes de mortalidad larvaria entre 25 y 29%. Al comparar estos resultados con los obtenidos por Duraipandiyan y colaboradores en 2011, quienes evaluaron extracto de acetato de etilo obtenido a partir de flores de Cassia fistula; determinaron porcentajes de mortalidad larvaria sobre Spodoptera litura de 67.5% y de 36.25% sobre Helicoverpa armigera, a 1000 ppm. Sin embargo estos resultados no pueden ser totalmente comparables con el presente experimento, ya que se trabajó con extracto de acetato de etilo obtenido a partir de flores de Cassia fistula, las cuales presentan metabolitos secundarios (glicósidos, fistulan, kaempferol, etc.) a diferentes concentraciones a los encontrados en las semillas, pulpa y vaina de la misma planta, y con nematodos que afectan a plantas; no con nematodos gastrointestinales de animales (Duraipandiyan et al., 2011; Rajagopal et al., 2013).
En un estudio realizado con extracto metanólico de pulpa de fruta y semillas, para evaluar el efecto de este extracto sobre la mortalidad de larvas de Pheretima posthuma, se observó que el extracto además de producir la muerte de las larvas, también presente un afecto de inhibición de la motilidad; sin embargo no se establecen los porcentajes de mortalidad observados, solo el tiempo en el que se observa inhibición de la motilidad (17 a 82 minutos) y mortalidad (24 a 118 minutos); así como la correlación que existe entre la dosis y el tiempo en el cual se presenten ambos efectos (Irshad, Man y Rizvi, 2010).
Se ha propuesto que los metabolitos secundarios de las plantas presentan diversos mecanismos, con los cuales inhiben la motilidad o matan a los parásitos en su fase larvaria, como la afinidad de los compuestos fenólicos por las glicoproteínas (prolina) de la cutícula del parásito, a la cual se unen, inhiben su motilidad, alimentación, reproducción y finalmente producen su muerte, o la acción membranolítica de las saponinas; entre otros (Irshad et al., 2010; Hernández-Alvarado et al., 2018).
CONCLUSIÓN
Se concluye que el extracto hidroalcóholico de vainas de Cassia fistula, presenta actividad antihelmíntica frente a nematodos gastrointestinales de ovino; tanto inhibiendo la eclosión de huevos, como causando la mortalidad de larvas; por lo que podría ser una alternativa natural y efectiva para el control y tratamiento de nematodos en pequeños rumiantes.











 text in
text in 



