Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Abanico veterinario
On-line version ISSN 2448-6132Print version ISSN 2007-428X
Abanico vet vol.8 n.3 Tepic Sep./Dec. 2018
https://doi.org/10.21929/abavet2018.83.10
Artículos de casos clínicos
Bovinos intoxicados por Melochia pyramidata en Colima, México
1Facultad de Medicina Veterinaria y Zootecnia, Universidad de Colima. México.
2Centro Universitario de Investigación y Desarrollo Agropecuario, Universidad de Colima. México.
3Departamento de Patología. Facultad de Medicina Veterinaria y Zootecnia, Universidad Nacional Autónoma de México.
4Facultad de Medicina Veterinaria y Zootecnia, Universidad Autónoma de Nuevo León. México.
Con el propósito de describir las condiciones patológicas de bovinos intoxicados por consumir huinar (Melochia pyramidata) en Colima, México, se presentan tres casos de animales con signos de incoordinación, ataxia, parálisis del tren posterior, postración y muerte, sospechosos de rabia paralitica bovina. Se realizaron estudios complementarios de hematología, necropsia, histopatología e inmunofluorescencia, además se colectaron plantas de M. pyramidata para determinar la presencia de alcaloides. Macroscópicamente se observó edema en múltiples órganos, luego, se detectó leucocitosis por neutrofilia y anemia normocítica normocrómica en sangre. Histopatológicamente el cerebro, cerebelo, médula oblonga y espinal, así como nervios periféricos, presentaron degeneración axonal y áreas de desmielinización. En prueba histológica sin evidencia de lesiones, negativo a virus rábico en prueba de inmunoflorescencia y se detectó la presencia de alcaloides en M. pyramitada. Por lo tanto, el consumo de alcaloides a través de Melochia pyramidata provoca enfermedad nerviosa en bovinos que ayuda en el diagnóstico diferencial de rabia paralitica bovina. Finalmente, la descripción de este caso puede ayudar a identificar la flora tóxica del occidente de México.
Palabras clave: plantas tóxicas; intoxicación; huinar; Melochia pyramidata; bovinos
With the purpose of describing the pathological conditions of bovines intoxicated by consuming huinar (Melochia pyramidata) in Colima, Mexico, there are three cases of animals with signs of incoordination, ataxia, and paralysis of the posterior train, prostration and death, suspects of bovine paralytic rabies. Complementary studies of hematology, necropsies, histopathology, and immunofluorescence were performed and M. pyramidata plants were collected for the detection of alkaloids. Leukocytosis was detected by neutrophilia and normocytic normochromic anemia. The macroscopic findings were the presence of edema in multiple organs. Histopathologically the brain, cerebellum, spinal and oblongata cord, as well as peripheral nerves, presented axonal degeneration and areas of demyelination. In histological test without evidence of lesions, negative to rabies virus in immunofluorescence test and the presence of alkaloids was detected in M. pyramitada. Therefore, the consumption of alkaloids through Melochia pyramidata causes nervous disease in cattle that helps in the differential diagnosis of bovine paralytic rabies. Finally, the description of this case can help identify the toxic flora of western Mexico.
Keywords: toxic plants; huinar; Melochia pyramidata; cattle; toxicity
INTRODUCCIÓN
México cuenta con 197 millones de hectáreas, el 27% de la superficie es de zonas tropicales, que tienen ganadería destinada a la producción de carne y doble propósito (carne-leche). El sistema de producción en el trópico seco es de vaca-becerro, desarrollo en pradera, engorda en pastoreo y corral; mientras en el trópico húmedo el sistema es vaca-becerro (doble propósito), engorda en pastoreo y en corral.
La producción de carne de bovino en nuestro país se concentra en Jalisco (14%), Veracruz (14%), Sonora y Tamaulipas (5%), Chiapas, Tabasco, Durango y Chihuahua (4%). Colima ocupa el lugar 26° a nivel nacional (SAGARPA, 2014). A pesar de la importancia de la actividad ganadera, la problemática asociada a la intoxicación del ganado por vegetales, ha sido poco estudiada en México; y es causa de pérdidas económicas que afectan seriamente a los productores (enfermedades, defectos físicos, abortos y muerte).
Entre los principales químicos que contienen las plantas que intoxican al ganado, se encuentran: alcaloides, glucósidos (cianogénicos o saponinas), aceites irritantes, ácidos orgánicos, minerales (nitratos, selenio y molibdeno), resinas o resinoides, fitotoxinas y principios tóxicos que ocasionan fotosensibilidad; algunas plantas contienen dos o más principios tóxicos. Las principales especies que contienen alcaloides tóxicos para el ganado bovino, son: Hierba ceniza (Senecio longilobus), Chilicote ó colorín (Erythrina flabeliformis), Lupinos (Lupinus sparsiflorus, L. concinnus), Espuelita (Delphinium scaposum), Toloache (Datura meteloides), Juan loco (Nicotiana glauca), Tabaco de coyote (Nicotiana trigonophylla), Hierba loca (Astragallus spp.), Cardo (Argemone mexicana), Garbancillo (Crotalaria pumila), Huinar y escobilla silvestre ó escobilla morada (Melochia pyramidata) (Sáenz, 1964; Breuer et al.,1982; Bruneton, 2001; Tokarnia, 2002; Haraguchi, 2003).
El huinar (M. pyramidata), es una hierba perenne y pertenece a la familia Sterculiaceae, es una planta de 1 hasta 1.5 metros de altura, muy ramificada; posee flor de color morada, y de ahí se deriva uno de sus nombres comunes. Los tallos son de consistencia suave pero muy resistentes; las hojas tienen de 3-7 cm de largo, son delgadas, de color verde, con pelos estrellados y esparcidos; los bordes son dentados y el tallito de la hoja es liviano. Las flores casi siempre son pediceladas, dispuestas en cimas frecuentemente umbeladas que salen de las axilas de las hojas; el cáliz es lobulado de 3 a 4 mm de largo, los pétalos son de color entre violeta y rosado, miden de 6 a 8 mm. Los frutos son cápsulas más anchas que largas, y tienen entre 5-6 mm de longitud, su forma es piramidal. La escoba morada tiene amplio rango de distribución; se encuentra hasta en alturas de 1200 metros, en sitios libres de vegetación alta y densa, como superficies destinadas a cultivos anuales, huertas en descanso periódico, tierras pobres no cultivadas, bordes de caminos y carreteras (Breuer et al., 1982; Baudilio, 2009). En México M. pyramidata se ha encontrado en los estados de Campeche, Colima, Quintana Roo, San Luis Potosí, Sinaloa, Sonora, Tabasco, Veracruz y Yucatán (Avendaño y Flores, 1999).
Las partes aéreas de la planta contienen Melochinina, del grupo de los alcaloides piridínicos y producen parálisis, braquicardia, hipotensión y muerte. Causa parálisis del tren posterior, fotofobia notable, ulceraciones en mucosas, estreñimiento severo y muerte (Breuer et al., 1982). Sin embargo, los estudios referentes a esta planta tóxica son escasos, no se conoce la patogenia de sus efectos, los signos y las lesiones que produce sobre el ganado. En México no existen reportes publicados de las lesiones asociadas al consumo de M. pyramidata.
El objetivo fue describir tres casos de bovinos intoxicados por Melochia pyramidata en el Estado de Colima, México.
MATERIAL Y MÉTODOS
Los casos se presentaron en septiembre de 2017 en el municipio de Armería, Colima (localizado entre los paralelos 18°51’ y 19°09’ de latitud norte; los meridianos 103°53’ y 104°08’ de longitud oeste; altitud entre 0 y 1200 m) (INEGI, 2009). La unidad productiva estaba compuesta por 200 animales cruza de Cebú, en condiciones corporales pobres (2/5). Los animales pastaban en praderas de temporal con pasto Guinea, sin suplemento alimenticio adicional. En todas las praderas había plantas de huinar morado, con evidencia de consumo de sus hojas y sus tallos.
Tres animales presentaron signos clínicos de origen nervioso, manifestados en forma inicial por la dificultad para levantar los miembros pélvicos durante la marcha e incoordinación (ataxia). La marcha se fue agravando hasta presentar parálisis del tren posterior (derrengados) y postración; los animales no mostrarón pérdida del sentido y de apetito, consumiendo forraje verde y agua. Las constantes fisiológicas se encontraban normales (frecuencia respiratoria 36/minuto, frecuencia cardiaca 52/minuto y temperatura 38°C). De cada animal enfermo se colectaron 5 ml de sangre periférica en tubo vacutainer con anticoagulante, para pruebas de hematología. Entre 3 y 5 días los animales se postraron sin dejar de comer forraje verde y agua; finalmente murieron. Los cadáveres se remitieron al Laboratorio de Patología de la Facultad de Medicina Veterinaria y Zootecnia de la Universidad de Colima, para su estudio post-mortem.
En la necropsia, el hemisferio cerebral derecho de cada animal se colocó en un frasco estéril y fue remitido al Comité Estatal para el Fomento y Protección Pecuaria de Colima, para diagnóstico de rabia por inmunofluorescencia directa. En la revisión del aparato digestivo, el rumen se encontró pletórico con forraje de Guinea, entremezclado con hojas de huinar semidigeridas. Asimismo, las muestras de varios órganos fueron fijadas en formalina bufferada-neutra al 10% para histopatología. Los tejidos fijados fueron procesados para su inclusión en parafina, cortados a 5 µm de grosor y teñidos con Hematoxilina-Eosina (HE). También las muestras de cerebro, cerebelo, médula oblonga, segmento toraco-lumbar de médula espinal y nervios ciáticos, fueron teñidas con la tinción de Luxol fast blue (Prophet et al., 1995). Las plantas (hojas, tallos y flores) de M. pyramidata se remitieron al laboratorio de toxicología de la FMVZ-UNAM para determinar alcaloides, por el método de extracción, purificación y fraccionamiento del extracto para ácidos, básicos y neutros (Repetto y Repetto, 2009).
RESULTADOS
Las plantas recolectadas presentraron tallos color café, resistentes; sus hojas midieron de 3 a 7 cm de largo, delgadas, de color verde, con pelos estrellados y de bordes dentados. Las flores eran moradas y pediceladas, dispuestas en cimas frecuentemente umbeladas que salen de las axilas de las hojas; el cáliz era lobulado de 3 a 4 mm de largo; los pétalos eran de color entre violeta y rosado y midieron de 6 a 8 mm, (figuras 1-3).
En los estudios de hematología se determinó leucocitosis por neutrofilia, anemia normocítica normocrómica, y los frotis sanguíneos fueron negativos para la presencia de Babesia sp y Anaplasma sp. En la necropsia de los 3 bovinos, todo el tejido subcutáneo exhibía edema (anasarca). La cavidad toráxica y abdominal estaban ocupadas por cantidades variables de líquido blanco-traslúcido (hidrotórax y ascitis respectivamente), el cual también era visible dentro del saco pericárdico (hidropericardio). El tejido adiposo pericárdico era escaso, suave y con aspecto de gelatina (atrofia serosa de la grasa). Asimismo, se encontró dilatación del ventrículo derecho y áreas pálidas dentro del miocardio, (figuras 4-6). Los cambios degenerativos y vasculares encontrados son consecuencias de la condición corporal y desnutrición de los animales. El resto de los órganos no presentó lesiones macroscópicas evidentes.
En el estudio histopatológico las lesiones fueron restringidas en cerebelo, médula oblonga, médula espinal, nervios periféricos y corazón. En el cerebro, cerebelo y médula oblonga, el neurópilo mostró múltiples vacuolas claras correspondientes a desmielinización (espongiosis) y en ellas, algunos axones se observaban intensamente eosinofílicos, tortuosos y tumefactos (degeneración axonal). En la porción ventral de la médula espinal, la sustancia blanca mostraba áreas similares a las descritas en cerebelo y médula oblonga. Los axones de nervios periféricos se observaban tortuosos, tumefactos (degeneración axonal) y rodeados por múltiples vacuolas claras (desmielinización), (figuras 7-11). Las áreas de desmielinización descrita en cerebelo, médula oblonga, médula espinal y nervios periféricos fueron evidentes mediante la tinción de Luxol fast blue, (figuras 13-15). En las secciones de corazón, a nivel del miocardio se aprecian algunas zonas cuyos cardiomiocitos estaban retraídos, eosinofílicos, con pérdida de sus estriaciones y vacuolización del sarcoplasma (necrosis), (figura 12). El análisis de Inmunofluorescencia para la determinación del virus rábico fue negativo. En los estudios de toxicología se determinó las presencia de tres alcaloides diferentes (sin determinar su tipo) en los tallos, hojas y raíz de M. pyramidata.
DISCUSIÓN
En México no se encontraron registros documentados y precisos sobre la intoxicación por huinar en ganado bovino, sin embargo, en el estado de Colima es un problema frecuente por la pérdida de animales. No es fácil obtener información acerca de los casos de intoxicación en el ganado, y se debe a que los informes son confusos e incompletos; además por la dificultad para identificar la flora tóxica de la región, por ganaderos y veterinarios (Avendaño y Flores, 1999).
Las características de la planta fueron consistentes con M. pyramidata y resultaron similares a las descritas por otros autores (Breuer et al., 1982; Baudilio, 2009). En este caso se encontró evidencia de huinar semidigerida en el rumen, además a la revisión del potrero se determinó presencia y consumo de hojas y tallos. Esto se debe a que en época de secas los potreros son pobres en forraje, hay sobrepastoreo, por lo que la presencia y disponibilidad de la planta, así como la falta de suplementos alimenticios favorecen el consumo de esta planta (Avendaño y Flores, 1999; Bruneton, 2001; Haraguchi, 2003).
La enfermedad del ganado bovino por intoxicación de la escoba silvestre o huinar se conoce con el nombre de derrengue o derriengue. Aparece con mayor frecuencia en los meses de febrero, marzo y abril, cuando el pastoreo se torna más difícil, debido a la escasez de alimentos y de agua. Cuando en la pradera el pasto es escaso, por la falta de alimento adecuado, el ganado puede ingerirla e intoxicarse y hay que diferenciarla de: enfermedades infecciosas: bacterianas (listeriosis, meningoencefalitis trombótica, tétanos, botulismo), virales (rinotraqueitis infecciosa bovina, rabia, fiebre catarral maligna), parasitarias (babesiosis); enfermedades metabólicas (polioencefalomalacia, hipomagnesemia, desbalance metabólico Ca-P y cetosis); enfermedades tóxicas: plantas tóxicas (Cynodon dactylon, Phalaris, Condalia microphylla), encefalopatía hepatóxica, micotoxinas (Neothyphodium lolii, Claviceps paspali, Diplodia maydis); metales pesados y sustancias orgánicas (intoxicación con plomo, intoxicación con organofosforados e intoxicación con urea); además de lesiones traumáticas (Cantile y Youssef, 2016; Miller y Zachary, 2017).
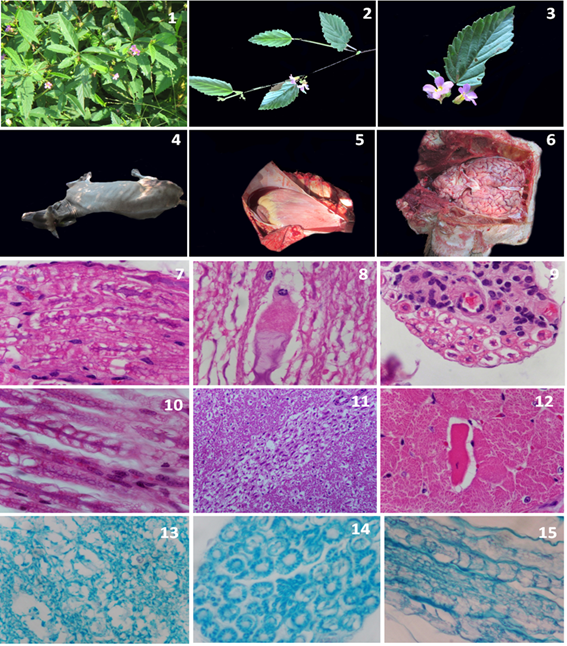
Figuras 1-3. Características de M. pyramidata. En ella se puede apreciar la planta con tallo café; hojas verdes, delgadas y bordes dentados. De igual manera las flores son moradas y pediceladas, y muestran pétalos de color entre violeta y rosado. Figura 4. En esta imagen se puede apreciar uno de los animales remitidos, sin alteraciones externas. Figura 5. Obsérvese el hidropericardio y la degeneración epicárdica. Figura 6. Macroscópicamente el encéfalo no mostró alteraciones significativas. Figuras 7-11. Fotomicrografías correspondientes a encéfalo y uno de los nervios periféricos, en donde la sustancia blanca presenta vacuolización marcada (espongiosis) y degeneración axonal. Hematoxilina-Eosina (HE)/10 y 40X. Figura 12. Fotomicrografìa de corazón la cual muestra algunos cardiomiocitos degenerados y necróticos. HE/10X. Figuras 13-15. Tinción especial de Luxol fast blue, en la que se evidencia las zonas de desmielinización descrita en encéfalo y nervios periféricos. 10 y 40X.
La parálisis o derrengue en el ganado bovino causado por la ingestión del huinar, es consecuencia de la presencia de alcaloides, como meloquinina (6-[(11R)-11-hydroxydodecyl]-3-methoxy-2-methyl-1H-pyridin-4-one), que se asemeja al Piericidin A (inhibidor de NADH deshidrogenasa). El efecto de la meloquinina es a nivel celular, dañando a la mitocondria, inhibiendo la cadena respiratoria y la síntesis de energía. La melochinina se absorbe en el aparato digestivo, se metaboliza y se distribuye a nivel plasmático, provocando parálisis del intestino, causando timpanismo. Otros efectos de este alcaloide son sobre el músculo cardiaco, células nerviosas y la retina; provocando fotofobia, ceguera y la hemeralopía o ceguera diurna, como ha sido reportado (Baudilio, 2009). Posteriormente afecta a los nervios de las extremidades posteriores, provocando una degeneración de las fibras nerviosas, originando parálisis por daño neuromuscular, provocando una despolarización lenta por velocidad reducida en los canales de Na y Ca (Breuer et al., 1982; Bruneton, 2001; Haraguchi, 2003; Cristóbal, 2007; Armién et al., 2009; Baudilio, 2009). No se observó reacción inflamatoria y enfermedad del músculo blanco, por lo que se descartó deficiencia de vitamina E o selenio. Las necrosis de las fibras cardiacas fueron asociadas a la presencia del alcaloide sobre los canales de Na y Ca (Armién et al., 2009; Baudilio, 2009).
En algunos informes de bovinos intoxicados por escoba silvestre o huinar, no se detectaron lesiones histológicas del tejido nervioso, debido a la incorporación de la meloquinina en la membrana celular, que no conducen necesariamente a lesiones microscópicas detectables (Haraguchi, 2003); contrariamente a este estudio, donde las lesiones fueron degeneración y desmielinización de los nervios y médula espinal, quizá debido al consumo excesivo de la planta.
En Colima es frecuente la intoxicación por huinar en ganado bovino, causando su muerte. El informe de estos tres casos, puede ayudar a los ganaderos y veterinarios a identificar la flora tóxica de la región, conocer sus efectos, signos, lesiones y considerarlo como un diagnóstico diferencial de las enfermedades que afectan el sistema nervioso.
BIBLIOGRAPHY
ARMIÉN AG, Peixoto PV, Tokarnia HC. 2009. Poisonus plants affecting livestock in Central America, with emphasis in Panamá. En: Riet CF, Pfister J, Schild AL, Wierenga T, Poisoning by plants, mycotoxins and related toxins. CAB International. Pag. 60-67. ISBN: 978-1-84593-833-8 [ Links ]
AVENDAÑO RS, Flores GJ. 1999. Registro de plantas tóxicas para ganado en el estado de Veracruz, México. Veterinaria México. 30(1):79-94. http://www.redalyc.org/articulo.oa?id=42330111 [ Links ]
BAUDILIO RJ. 2009. Revisión taxonómica del género de Melochia (Sterculiaceae) en Venezuela. Acta Botánica Venezuelica. 32(1):1-61. ISSN: 0084-5906 [ Links ]
BREUER H, Rangel M, Medina E. 1982. Pharmacological properties of melochinine, an alkaloid producing Central American cattle paralysis. Toxicology. 25(2-3):223-242. doi.org/10.1016/0300-483X(82)90032-4 [ Links ]
BRUNETON J. 2001. Plantas tóxicas. Vegetales peligrosos para el hombre y los animales. Editorial Acribia. Zaragoza, España. Pag. 540. ISBN: 8420009350 [ Links ]
CANTILE C, Youssef S. 2016. Nervous system. En: Kennedy, Jubb, and Palmer’s, Pathology of domestic animals. Elsevier. St. Louis, Missouri. Pag. 250-406. ISBN: 978-0-7020-5317-7. [ Links ]
CRISTÓBAL CL. 2007. Sterculiaceae de Paraguay. I. Ayenia, Byttneria, Guazuma, Helicteres, Melochia y Sterculia. Bonplandia. 16(1-2):5-142 https://issuu.com/bonplandia/docs/2007bonplandia16_3_4_ [ Links ]
HARAGUCHI M. 2003. Plantas tóxicas de interesse pecuária. Biológico (São Paulo). 65(1/2):37-39. http://www.biologico.agricultura.sp.gov.br/uploads/docs/bio/v65_1_2/haraguchi.pdf [ Links ]
INEGI (Instituto Nacional de Estadística y Geografía). 2009. Prontuario de información geográfica municipal de los Estados Unidos Mexicanos Armería, Colima Clave geoestadística 06001. Pag.1-9. http://www3.inegi.org.mx/contenidos/app/mexicocifras/datos_geograficos/06/06001.pdf [ Links ]
MILLER DA, Zachary FJ. 2017. Nervous system. En: Pathologic basis of veterinary disease. Elsevier. St. Louis, Missouri. Pag. 805-907. ISBN: 978-0-323-35775-3. [ Links ]
PROPHET EB, Mills B, Arrington JB, Sobin LH. 1995. Métodos histotecnológicos. Registro de patología de los Estados Unidos de América. Washington, D.C. Pag. 280. ISBN: 1-881041-21-2. [ Links ]
REPETTO JM, Repetto KG. 2009. Sistemáticas analíticas toxicológicas. En: Repetto JM, Repettpo KG, Toxicología fundamental. Diaz de Santos, España. Pag. 521-542. ISBN: 978-84-7978-898-8. [ Links ]
SAGARPA (Secretaría de Agricultura, Ganadería, Desarrollo Rural, Pesca y Alimentación). 2014. Atlas Agroalimentario. México. Pag.1-193. ISBN: 978-607-9350-03-1. [ Links ]
TOKARNIA HC, Döbereinerb J, Vargas PP. 2002. Poisonous plants affecting livestock in Brazil. Toxicon. 40:1635-1660. doi.org/10.1016/S0041-0101(02)00239-8 [ Links ]
Recibido: 18 de Febrero de 2018; Aprobado: 22 de Junio de 2018











 text in
text in 


