Introducción
La producción mundial porcina crecio 1.6% del 2007 al 2016, en el 2017 se ubicó en el maximo histórico de 111 millones de toneladas de carne, que representa un incremento anual de 2.6% (FIRA, 2017). En el 2016 China fue el principal productor de carne de cerdo (47.9%), seguido por la Unión Europea (21.6%), Estados Unidos (10.4%) y Brasil (3.4%); en conjunto aportaron el 83.4% de la producción total (USDA-ERS, 2017).
Por su parte, México solo aportó el 1.3% de la producción mundial, y se ubica en el noveno lugar, con una producción de 1.45 millones de toneladas (FIRA, 2017). El 76.5% de la producción nacional (millones de toneladas) se concentró en los estados de Jalisco (20.7%), Sonora (17.3%), Puebla (11.9%), Yucatán (9.8%), Veracruz (8.8%) y Guanajuato (8.1%) (USDA-FAS, 2017).
Actualmente las importaciones representan el 32% del consumo nacional, observandose un desabasto de la producción nacional. En este contexto, el estado de Oaxaca tiene una baja producción (27.9% de carne) y un bajo número de cabezas de ganado porcino (201 125 cerdos) (FND, 2014, SIAP, 2016). La industria del cerdo del estado presenta problemas de índole reproductivo, por lo cual es común el uso de protocolos de sincronización estral con hormonas exógenas para incrementar la productividad de la cerda (Hemsworth y Tilbrook, 2007). Existen estudios donde mencionan que más del 90% de las cerdas sincronizadas con hormonas sintéticas (PG-600®) que contienen gonadotropina sérica liofilizada y gonadotropina coriónica liofilizada, entran en celo en un menor tiempo (Casida, 1935; Estienne et al., 2001; Breen et al., 2006; Ulguim et al., 2018). No obstante, esta tecnología reproductiva incrementa los costos de producción. Por lo tanto, las biotecnologías que permitan disminuir total o parcialmente el uso de hormonas en la industría porcícola son requeridas. Así, se ha encontrado que la combinación de hormanas con el estímulo del macho provoca una mejora en la respuesta sexual de las cerdas durante el empadre (Signoret, 1974; Hughes et al., 1990, Weaver et al., 2014).
Estudiar el comportamiento sexual del semental durante el empadre es importante, ya que su actividad es indicativo de que posee o no niveles plasmaticos de testosterona adecuados y una alta libido, consecuentemente si los espermatozoides son aptos para fecundar a la hembra (Hemsworth y Tilbrook, 2007). Existe poca evidencia del comportamiento sexual de los verracos usados comercialmente, aunque algunos estudios mencionan que estos machos son eliminados cuando tienen problemas para copular y por la baja calidad espermatica (Melrose, 1966; Rasbech, 1969; Hemsworth y Tilbrook, 2007; Kaneko y Koketsu, 2012). Cabe destacar que el comportamiento sexual del macho es muy variado, aunque la caracteristica esencial es el empuje pelvico y la penetración con eyaculación. Otros componentes del verraco son embates hacia la región posterior y los flancos; por su parte en los machos cabrios y carneros es importante el olfateo anogenital, flehmen, movimiento de la lengua y vocalizaciones (Booth, 1988; Ladewing et al., 1980; Fraser y Broom, 1997; Fernández et al., 2018). En conjunto el comportamiento sexual del macho es esencial para estimular a la hembra idependientemente de que se usen o no hormonas sintéticas.
En la literatura se cuenta con información del uso del verraco para adelantar la pubertad en cerdas virgenes (Brooks y Cole, 1970; Kaneko y Koketsu, 2012); pero no para estimular al estro a las cerdas multíparas al destete. Con esta alternativa al igual a lo planteado en ovinos (Martin et al., 2004), caprinos (Shelton, 1960) y bovinos (Roberson et al., 1987) se puede acuñar el concepto: verde, limpio y etico; y con esto disminuir el uso de hormonas sinteticas e incrementar el bienestar animal en cerdos (Montossi et al., 2014). Por lo antes mencionado, el objetivo del presente estudio fue evaluar si la bioestimulación del verraco es suficiente para estimular la respuesta sexual de las cerdas multíparas al destete.
Material y Métodos
Área de estudio
El presente estudio se realizó en la comunidad de “Rio Grande” municipio de Villa de Tututepec, distrito de Juquila del estado de Oaxaca, México. El clima de esta región es tropical, la temperatura media anual es de 27°C, precipitación de 1,309 mm y coordenadas:16°00’41’’LN, 97°30’13’’LO (García, 1973).
Animales y tratamientos
En el experimento se usaron en total 10 cerdas de entre 3 y 4 partos de raza Landrace x Yorkshire con 30 d de paridas; asimismo se usaron dos machos de raza Duroc. Las hembras fueron divididas en dos grupos: un grupo testigo (GT; n = 5) y un grupo bioestimulado (GB; n = 5); ambos grupos permenecieron sin macho durante un mes previo al inicio del estudio. Al inicio del experimento el GB fue separado a más de 300 metros de distancia del GT. Además, al GT se le aplicó un protocolo de sincronización de estro, mientras el GB permanecieron intactas. El protocolo consitio en la aplicación de una dosis de PG-600® (Intervet America Inc.; la hormona contiene 400 UI de gonadotropina sérica liofilizada y 200 UI de gonadotropina coriónica liofilizada) vía intramuscular (i.m.), 24 h despues de la aplicación de la hormona (día uno) se introdujo un macho en ambos grupos de hembras. En ese momento y durante 6 días consecutivos fueron registradas las variables de comportamiento sexual de las hembras (respuesta al estro, longitud del estro, vocalizaciones y aproximaciones laterales) y los machos (intentos de monta, monta con penetración, olfateos anogenitales, aproximaciones laterales y vocalizaciónes). El comportamiento sexual de ambos sexos fue observado y registrado durante una hora por grupo por una persona previamente capacitada.
Alimentación y alojamiento
Durante la fase experimental se alimentó a los animales con una dieta formulada y mezclada manual (Tabla 1), proporcionado en la mañana (07:00 h; 4.00 kg) y en la tarde (17:00 h; 4.00 kg), asimismo se les proporcionó agua a libre acceso. Los animales fueron alojados en corrales de 2.5 m de ancho por 6 m de largo, techados con lamina de asbesto, piso de concreto, provistos de bebederos y comederos.
Tabla 1 Ingredientes de la dieta ofrecida a las cerdas reproductoras durante el experimento.
| Ingredientes | Valor en kilogramos |
|---|---|
| Maíz | 63.50 |
| Soya | 12.00 |
| 1DDG | 6.00 |
| Salvado de trigo | 17.00 |
| Minerales | 1.50 |
| 100.00 |
Mezcla de ingredientes para la dieta. 16% de proteína cruda (PC).
1DDG: granos de destilería.
Analisis estadisticos
Todos los datos presentados en el presenta manuscrito fueron analizados con el programa estadístico SYSTAT 13, bajo un diseño completamente al azar en el cual cada animal fue considerado como una unidad experimental. Los datos de las variables de comportamiento sexual de las hembras, los machos, y los días de observación fueron analizados con la prueba de Krukal-Wallis de estadistica no parametrica. Para comparar las medias se usó la prueba de U de Mann-Whitney (Siegel y Castellan, 1994).
Resultados y Discusión
Respuesta sexual de las hembras
En general, independientemente del grupo experimental el 70% de las cerdas respondieron al estro. En efecto, el porcentaje de hembras que respondieron al estro fue mayor en el GT (5/5, 100%), que en el GB (2/5, 40%; P < 0.05). Las vocalizaciones y aproximaciones laterales fueron superiores en el GT (29.8 ± 0.21 y 27.6 ± 0.18 ocasiones) en los días 3 (17.2 ± 0.57), 4 (20 ± 0.56) y 5 (29.8 ± 1.8 ocasiones), que en el GB (7.8 ± 2.04 y 11 ± 2.28 ocasiones) días 1 (5.8 ± 1.16), 3 (4 ± 0.94) y 5 (1.2 ± 0.26 ocasiones; P < 0.05). Por su parte, la longitud del estro en las hembras de ambos grupos fue similar (44 vs. 49 h; P > 0.05).
Los resultados del presente estudio son consistentes a los reportados en otras investigaciones donde demuestran que la mayoria de las cerdas multíparas sincronizadas con PG-600® respondieron al estro en las primeras 48 h después de la aplicación de la hormona (Estienne et al., 2001; Breen et al., 2006; Ulguim et al., 2018). Contrario a estos resultados fueron reportados por Trujillo et al., (1997) ya que solamente el 23.33% de las hembras presentaron estro.
Por su parte, la longitud del estro fue similar al observado de manera natural (36 h; Soede et al., 2011), pero diferente al reportado por otros autores cuando sincronizan el estro con progestágenos (Degenstein et al., 2008). En el caso de las vocalizaciones en los cerdos como en los caprinos son muy importantes a la hora del cortejo para desencadenar una respuesta sexual (Booth, 1988; Vielma et al., 2009; Martínez et al., 2014). De la misma manera las aproximaciones laterales son indicativo de una alta libido en los machos, y muy importante durante la bioestimulación sexual en ovinos y caprinos (Delgadillo et al., 2009; Fernández et al., 2018). Por ejemplo, en cerdas las vocalizaciones del macho actúan sinérgicamente con las señales olfativas y táctiles (aproximaciones laterales) en la inmovilización de la hembra para facilitar la copula, en el ciervo rojo se ha demostrado que las vocalizaciones del macho adelantan el momento para que las hembras entren en estro (Davies, 1986; Signoret, 1974; Tilbrook y Hemmsworth, 1990; Garcia et al., 2013).
Los resultados que reportan estas investigaciones son consistentes con los del presente estudio para el caso de las vocalizaciones y las aproximaciones laterales. En el caso del GT del presente estudio fueron superiores en los días mientras las hembras se acercaban al momento de celo, esto se debe probablemente a las feromonas liberadas por las hembras. Contrariamente en el GB ocurrieron en los primeros 3 días de contacto, evidentemente se presentó en las únicas hembras que presentaron estro. Estos resultados son interesantes ya que la presentación de estro permite un mayor estimulo del macho y sinérgicamente este potencializa el estímulo de la cerda para que despliegue un intenso comportamiento sexual.
Comportamiento sexual de los machos
El comportamiento sexual fue mayor en el verraco expuesto al GT de hembras que al GB (P < 0.05). En efecto, existió un incremento en los días 3 y 5 en las aproximaciones laterales, olfateos anogenitales, vocalizaciones y montas sin y con eyaculación en el macho expuesto a las hembras del GT que, al GB, olfateos anogenitales y vocalizaciones (P < 0.05; Figura 1).
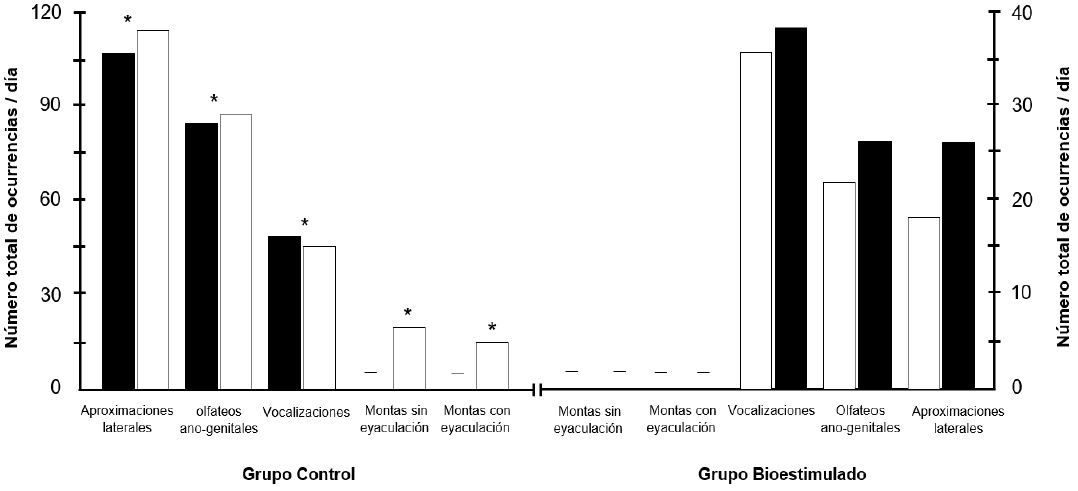
El grupo testigo a lado izquierdo y el grupo bioestimulado a lado derecho, el - indica cero comportamiento, el * representa diferencia significativa entre grupos (P < 0.05).
Figura 1 Comportamiento sexual desplegado por el verraco durante los días 3 (■) y 5 (□) de contacto entre los dos sexos, para cada variable (aproximaciones laterales, olfateos anogenitales, vocalizaciones y montas sin y con eyaculación).
El comportamiento sexual del macho es muy variado, aunque la caracteristica esencial es el empuje pelvico y la penetración con eyaculación. Otros componentes como el olfateo anogenital, flehmen, movimiento de la lengua y vocalizaciones son indicativos de machos cabrios y carneros (Ladewing et al., 1980; Fraser y Broom, 1997; Martínez et al., 2014; Damián et al., 2018). En efecto, estos resultados son similares al comportamiento sexual desplegado por los machos cabríos foto-estimulados cuando son expuestos a cabras anestricas. El número de aproximaciones laterales y olfateos anogenitales se incrementa en los primeros días de contacto entre ambos sexos (Ponce et al., 2014; Fernández et al., 2018).
En el caso del verraco esto ocurrió así ya que el comportamiento sexual fue más intenso en los días 3 y 5 después de la introducción; el alto comportamiento sexual desplegado por los machos del GT en estos primeros días probablemente se debió a la motivación olfatoria que percibió el macho debido a la liberación de feromonas por las hembras ya que coincidió con la presentaron del estro en todas las cerdas (Booth, 1988; Petrulis, 2013). Asimismo, las vocalizaciones son similares a los reportados en cerdas sincronizadas puestas en contacto con un verraco (Signoret, 1974). Esto fue porque en ese momento existió una mayor interacción social entre los dos sexos, por lo tanto, tuvieron buen estimulo auditivo que les permitió responder de esta manera. Los hallazgos encontrados en el presente estudio son sobresalientes ya que la presencia del macho potencializa la respuesta sexual de las hembras siempre y cuando estas se sincronicen previamente con hormonas exógenas. Sería interesante buscar alternativas para incrementar la respuesta de las cerdas ante el estímulo del macho, esto con el fin de disminuir la aplicación de hormonas sintéticas e incrementar el bienestar animal.











 text in
text in 


