Introducción
Las biotecnologías reproductivas aplicadas en pequeños rumiantes se describieron por primera vez en 1974. La aspiración de ovocitos por laparoscopía (AOL) es una biotecnología reproductiva, que consiste en aspirar las células germinales de un animal genéticamente superior (donante), para producir embriones in vitro y transferirlos a otro animal receptor (Lv et al., 2010). Esta biotecnología se considera como uno de los métodos más eficientes para la transferencia de embriones (TE), la cual ha demostrado producir mayor cantidad de crías a partir de hembras con genética y productividad sobresaliente (Baldassarre, 2007).
La eficiencia reproductiva de las cabras depende de las biotecnologías aplicadas, ya que son esenciales para sostener su producción mundial (Souza-Fabjan et al., 2014); es por ello que la AOL como biotecnología, tiene una función clave en la reproducción animal, mediante diferentes programas de mejoramiento genético (Shin et al., 2008). Aunque su aplicación en los protocolos de reproducción asistida en pequeños rumiantes se ha limitado, debido a los altos costos para realizar este tipo de investigación (Freitas et al., 2016). Para obtener ovocitos de alta calidad en la TE en cabras, la AOL se ha usado exitosamente (Leoni et al., 2009), ésta es una técnica mínimamente invasiva, representa bajo riesgo para el desarrollo de adherencias y permite varias recolecciones de ovocitos del mismo animal en un corto período (Avelar et al., 2012; Souza-Fabjan et al., 2013). Por lo anterior, el objetivo de la presente revisión de literatura fue describir los diferentes protocolos utilizados en la técnica de aspiración de ovocitos por laparoscopía para la trasferencia de embriones en cabras.
Sincronización del estro y superovulación en cabras
La sincronización de las cabras donantes y receptoras es importante para realizar la técnica de la aspiración de ovocitos por laparoscopía. Los protocolos difieren en las hormonas exógenas utilizadas, pero resultan similares en la duración y la aplicación (Souza-Fabjan et al., 2014).
La superovulación se logra con hormonas exógenas que promueven el desarrollo y el crecimiento folicular. Para mejorar la recolección de ovocitos durante la AOL en la TE se requiere previa sincronización en la hembra receptora y donadora; además de superovular a la hembra donadora. La sincronización manipula el ciclo estral y la superovulación genera mayor cantidad de ovocitos para la recolección y la evaluación. La sincronización del estro (receptora-donadora) se realiza mediante dispositivos intravaginales impregnados de P4 (Abecia et al., 2012).
Los protocolos de sincronización y de superovulación difieren según los medios de aspiración y los anestésicos a utilizar (Souza-Fabjan et al., 2014; Tabla 1).
Tabla 1 Comparación de los fármacos, dosis, materiales y otros valores usados para la técnica de aspiración de ovocitos por laparoscopía.
| Calibre de la aguja | Anestésico usado | Medio de aspiración | Presión del vacío en la bomba | Velocidad del fluido | Autor |
|---|---|---|---|---|---|
| 20G | Ketamina (5 mg kg-1), diazepam (0.35 mg kg-1) e isoflurano inhalado. | TCM 199 suplementado con heparina (0.05 mg mL-1) y suero fetal bovino 1%. | -- | 50 a 70 gotas min-1 | Baldassarre, 2007 |
| 22G | Xilacina (0.5 mg 10 kg-1) y ketamina (25 mg 10 kg-1). | TCM 199 suplementado con HEPES (10 mM), heparina (20 UI mL-1) y gentamicina (40 mg mL-1). | 30 mm Hg | 7 a 7.5 mL min-1 | Avelar et al., 2012 |
| 22G | Tiopental (20 mg kg-1) e isoflurano inhalado al 3%. | TCM 199 suplementado con HEPES (10 mM), piruvato sódico (0.022 mg mL-1), penicilina (10000 UI), sulfato de estreptomicina (10000 mg mL-1), anfotericina B (25 mg mL-1), FCS al 10% y heparina (20 UI mL-1). | 30 mm Hg | 7 a 7.5 mL min-1 | Souza-Fabjan et al., 2013 |
| 18G | Xilacina (0.5 mg 10 kg-1) y ketamina (25 mg 10 kg-1). | TCM 199 suplementado con HEPES (10mM), heparina (10 UI mL-1), gentamicina (4mg/mL) y BSA (1mg mL-1). | 50 mm Hg | -- | Souza-Fabjan et al., 2014 |
G: Grosor de la aguja. TCM: Medio de tejido de cultivo, por sus siglas en inglés: Tissue Culture Medium. HEPES: Solución amortiguadora, Sulfonato de N-2 hidroxietilpiperazina-N’-2-etano. FCS: Suero fetal de ternera, por sus siglas en inglés: Fetal calf serum. BSA: Albúmina de suero bovino, por sus siglas en inglés: Bovine serum albumin.
Baldessarre (2007) evaluó diferentes protocolos para sincronizar hembras donadoras con esponjas intravaginales impregnadas de 60 mg de acetato de medroxiprogesterona (AMP; Veramix®, Laboratorios Upjohn, Canadá) durante 10 días, y 48 h previas a la AOL, aplicó 125 μg de cloprostenol (Estrumate®, Laboratorios Malinkrodt, Canadá). Para la superovulación, comparó dos protocolos; en el primero, inyectó hormona folículo estimulante (FSH; Folltropin®, Bioniche, Canadá) y en el segundo, combinó FSH con gonadotropina coriónica equina (eCG; Pregnecol®, Bioniche, Canadá), la cual suministró en dosis única 36 h antes de realizar la AOL (protocolo “OneShot”; Baldessarre, 2007). Los resultados fueron similares (P > 0.001) entre los tratamientos de inyecciones múltiples y los tratamientos “OneShot” para la AOL (cabras de 60 a 90 d y de 90 a 150 d de edad: 84% y 80 % de recuperación, respectivamente). Sin embargo, para las hembras jóvenes, los protocolos fueron idénticos a los utilizados en las adultas, debido a que no estaban ciclando y, por lo tanto, no se les sincronizó el estro (esponja intravaginal + luteolítico; Baldessarre, 2007).
Avelar et al. (2012) sincronizaron cabras donadoras mediante una esponja intravaginal con 60 mg de AMP (Syntex, Buenos Aires, Argentina) durante 11 d, y en el día ocho, inyectaron 50 µg de d-cloprostenol (Ciosin, Coopers, São Paulo, Brazil). Para la estimulación ovárica, las cabras se dividieron en tres tratamientos: 1) 120 mg de NIH-FSH-P1 (FSH porcina estándar, por sus siglas en inglés: National Institute of Health porcine FSH standard; Folltropin-V, Vetrepharm, Belleville, Canada), suministrados en cinco inyecciones (5D) vía intramuscular (30, 30, 20, 20, y 20 mg, respectivamente) con intervalos de 12 h; 2) 120 mg de NIH-FSH-P1 divididos en tres inyecciones (3D) con intervalos de 24 h (60, 40 y 20 mg, respectivamente); y 3) una sola inyección (1D) de 70 mg de NIH-FSH-P1 más 200 UI de eCG (Novormon, Syntex, Buenos Aires, Argentina), 36 h antes de retirar la esponja.
Los resultados fueron similares (P > 0.05) entre tratamientos para la cantidad de folículos observados en cada ovario; sin embargo, el mayor porcentaje (P < 0.05) de recuperación de ovocitos se obtuvo con el tratamiento 5D (84.1%, 211/251 hembras), con respecto a la de los tratamientos 3D (68.2%, 182/267 hembras) y 1D (72.4%, 184/254 hembras), respectivamente (Avelar et al., 2012).
El porcentaje de recuperación de ovocitos difiere entre autores, de acuerdo con la cantidad de hembras utilizadas por protocolo y la respuesta por animales o población (Tabla 2).
Tabla 2 Variables de respuesta obtenidas con la técnica de aspiración de ovocitos por laparoscopía en cabras.
| Número de hembras | Raza | Edad de las hembras donantes | Folículos aspirados | Ovocitos recuperados | Porcentaje de recuperación | Autor |
|---|---|---|---|---|---|---|
| 20 | - | 2 a 3 meses | 59.3 ± 28 | 49.7 ± 24* | 84% | Baldassarre, 2007 |
| 36 | - | 3 a 5 meses | 34.4 ± 20 | 27.4 ± 14* | 80% | Baldassarre, 2007 |
| 23 | - | 5 meses | 39.0 ± 4.5 | 28.4 ± 3.5* | 73% | Baldassarre, 2007 |
| 21 | - | >1 año | 19.0 ± 1.4 | 15.9 ± 1.5* | 84% | Baldassarre, 2007 |
| 16 | Canindé | 5 meses | 772 | 577** | 74.7% | Avelar et al., 2012 |
| 15 | Canindé | 2 a 4 años | 245 | 182** | 74.3 % | Souza-Fabjan et al., 2013 |
Media ± desviación estándar.
*Resultados por animal.
**Resultados de población.
Souza-Fabjan et al. (2013) sincronizaron cabras nulíparas y multíparas, mediante esponjas intravaginales impregnadas con 60 mg de AMP (Progespon, Syntex, Buenos Aires, Argentina) durante 11 d. En el día ocho, suministraron 75 μg de d-cloprostenol (Prolise; Pfizer Animal Health, São Paulo, Brazil), y 36 h antes de retirar la esponja, aplicaron una sola dosis de 70 mg de FSH porcina (FSHp; Folltropin-V; Vetrepharm, Ontario, Canada) más 200 UI de gonadotropina coriónica equina (eCG; Novormon; Syntex). La recolección de ovocitos se realizó seis días posteriores al término del tratamiento. No se encontraron diferencias (P > 0.05) para la respuesta del estro (40.0% vs. 84.7%), el inicio del estro (62.0 ± 15.5 vs. 50.7 ± 19.2 h; media ± E.E.), la duración del estro (25.0 ± 16.1 vs. 30.0 ± 15.1 h) y el porcentaje de ovulación (60.0% vs. 85.7%) en los animales de estudio (Souza-Fabjan et al., 2013).
Souza-Fabjan et al. (2014) sincronizaron cabras con esponjas intravaginales impregnadas con 45 mg de acetato de fluorgestona (AFG; Chronogest CR; Intervet Schering-Plough Animal Health, Angers, France) durante 11 d; y en el día ocho, inyectaron una dosis de prostaglandinas (Cloprostenol 50 μg; Intervet Schering-Plough Animal Health); al mismo tiempo, estimularon con 16 mg de FSHp (Stimufol, highly purified porcine FSH, kindly provided by Prof. J-F Beckers, Liège, Belgium) en intervalos de 12 h con dosis decrecientes (4, 4, 3, 3, y 2 mg, respectivamente). Con este protocolo, los autores encontraron similitudes entre los ovocitos obtenidos por AOL y aquellos provenientes de rastro para calidad intrínseca y la competencia de desarrollo mediante activación partenogenética; no obstante, sugirieron que los ovocitos obtenidos por AOL, son menos competentes para la fertilización en condiciones de maduración y fertilización in vitro (Souza-Fabjan et al., 2014).
Anakkul et al. (2013) sincronizaron cabras receptoras y donadoras, mediante esponjas intravaginales con 65 mg de acetato de mexodroxiprogesterona (AMP; Ovejero®, España) durante 13 d, y una inyección de eCG (Folligon®, Intervet Schering-Plough Animal Health, Holanada). En las receptoras en estro, administraron una sola dosis de 200 UI de hCG (Chorulon®, Intervet Schering-Plough Animal Health, Holanada) para inducir la ovulación. Además del análogo de P4 (Sincro-gest esponjas; 65 mg de Medroxyprogesterona, Ovejero®, España) en las donadoras, estimularon desarrollo folicular con siete dosis de FSH (50, 25, 25, 25, 25, 25 y 25 mg, respectivamente; Folltropin V®, Bioniche Animal Health, Vetrepharm, Canada) en intervalos de 12 h.
La primera dosis la aplicaron en el día 10 del tratamiento. Para la sexta y séptima dosis, inyectaron 125 μg mL-1 de cloprostenol (Estrumate®, Schering-Plough Animal Health, NJ, USA). Detectaron el estro cada 6 h y para inducir la ovulación, aplicaron 200 UI de hCG (Chorulon®, Intervet Schering-Plough Animal Health, Holanda). Treinta embriones de 11 donadoras (Black Bengal: BB=7, 50%; Australian Melaan: AA= 4, 0%, porcentajes de recuperación en tres donadoras) se transfirieron en 30 hembras receptoras. Se obtuvo 30% de gestación (9/30) de donde nacieron nueve crías y una de ellas presentó color negro.
Los resultados sugieren que la inseminación artificial y la TE por laparoscopía, pueden combinarse para mejorar el potencial genético que codifique el color negro de la piel (Anakkul et al., 2013).
Perera et al. (2008) sincronizaron cabras donadoras con dispositivos vaginales (45 mg, Cronolone, Intervet) durante 17 d; aplicaron 2.5 ml de FSHp (Folltropin-V, 20 mg/ml NIH-FSH-P1, BIONICHE, Canada); y de FSH ovina (FSHo; Ovagen™,0.88 mg/mL NIADDK-oFSH-17-Standard, ICPbio Limited, Nueva Zealanda) en el día ocho. Además, inyectaron 300 UI de eCG (Folligon, Intervet International BV, Boxmeer-Holanda), durante la noche del día ocho. Estimularon la foliculogénesis y la maduración folicular con inyecciones de 1.25 ml de FSHp o FSHo por la mañana y la noche del día nueve y 10. En la mañana del día nueve, inyectaron 197 mg de prostaglandina F2α (PGF2α; cloprostenol sodium; PGF Veyx fort, Veyx Pharma, Schwarzenborn) y retiraron los dispositivos vaginales en la noche del día 10. En la mañana del día 11, aplicaron 1.25 ml de FSHp y FSHo, y por la noche aplicaron 1 ml de hormona liberadora de hormona luteinizante (LHRH; 50 μL/ml, Depherelin Veyx Pharma, Schwarzenborn). Después de esta inyección, mantuvieron durante 48 h a las cabras en contacto con un macho cabrío para la monta natural (Figura 1).
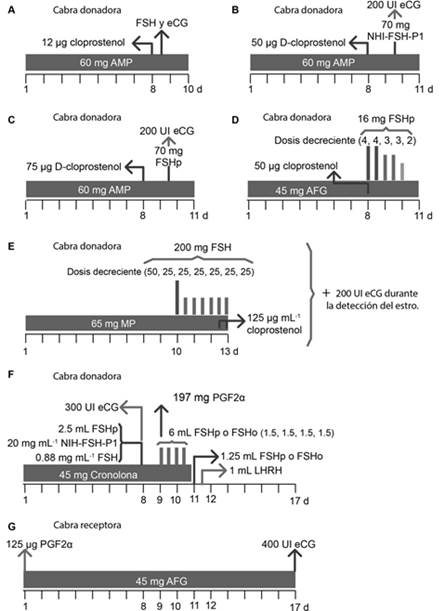
(A) Baldessarre, 2007; (B) Avelar et al., 2012; (C) Souza-Fabjan et al., 2013; (D) Souza-Fabjan et al., 2014; (E) Anakkul et al., 2013; (F) y (G) Perera et al., 2008. AMP: acetato de medroxiprogesterona, AFG: acetato de fluorgestona, MP: mexodroxiprogesterona, FSH: Hormona folículo estimulante, NHI-FSH-P1: Hormona folículo estimulante porcina estándar, FSHp: Hormona folículo estimulante porcina, FSHo: Hormona folículo estimulante ovina, eCG: Hormona gonadotropina coriónica equina, hCG: Hormona gonadotropina coriónica humana, PGF2α: Prostaglandina F2 alfa.
Figura 1 Protocolos de sincronización y superovulación en cabras.
No se encontraron diferencias significativas en la cantidad de embriones por animal en ambos protocolos (FSHp: 4.3 ± 2.0 y FSHo: 4.25 ± 2.0, respectivamente). Posiblemente los protocolos son adecuados; no obstante, se requiere perfeccionar la técnica de AOL (Perera et al., 2008).
Aspiración de ovocitos por laparoscopia (AOL)
La laparoscopía permite la visión y la manipulación de la cavidad abdominopélvica mediante el laparoscopio, el cual se introduce por una pequeña incisión y que consta de una fuente de luz transmitida por una fibra óptica; por medio de la cual se proyecta a un monitor (Baldassarre, 2007). Para realizar la técnica AOL se requiere que las hembras donantes estén en ayuno, por lo menos 24 h previas para reducir el riesgo de punciones accidentales en los intestinos, en el rumen o en la vejiga urinaria durante el procedimiento. La hembra se depila y se desinfecta con alcohol yodado en la zona abdominal, se coloca en una camilla decúbito dorsal para inclinarla hasta un ángulo de 30 a 45°, de tal forma que las vísceras se desplacen en sentido craneal y permitan visualizar el tracto reproductivo de la hembra (Alexander et al., 2010). La AOL requiere personal altamente calificado, un equipo de laparoscopía compuesto por un laparoscopio de 5 mm de diámetro, una pinza de sujeción atraumática y una pipeta de aspiración de 3.5 mm de diámetro, con sus respectivos trócares (Baldassare, 2007).
El endoscopio se inserta 2 a 3 cm craneal a la glándula mamaria, y 2 a 3 cm a la izquierda de la línea media en la cavidad abdominal mediante un primer trócar; un segundo trócar se inserta en el lado derecho del abdomen (opuesto al primero) para introducir el aplicador-palpador, con el cual se localiza el útero. Enseguida, un tercer trócar se inserta en la línea media, con el fin de pasar la aguja de recuperación de ovocitos (Souza-Fabjan et al., 2014). Una vez que los tres trócares se insertaron y se introdujo el laparoscopio, la pinza de sujeción atraumática y la pipeta de aspiración, se procede con la punción folicular (Cortez-Romero et al., 2011; Figura 2).
Para realizarla, el ovario se descubre levantando la fimbria con la pinza de sujeción atraumática y jalando en diferentes direcciones, para exponer las distintas áreas en su superficie. El procedimiento se repite en ambos ovarios y antes de retirar el equipamiento se lavan ambos ovarios con solución fisiológica heparinizada a 37°C (Baldassare, 2007).
El método de transferencia de embriones requiere la sincronización entre la donadora y la receptora, asegurando que el embrión es recolectado en el estado apropiado de desarrollo (mórula o blastocisto temprano), y después transferido a la receptora en el estado adecuado del ciclo estral. Los métodos laparoscópicos de recolección y transferencia de embriones han reemplazado a los métodos de laparotomía quirúrgica, reduciendo el riesgo de complicaciones postoperatorias del tracto reproductivo (Garza-Arredondo et al., 2015).
La técnica de laparoscopía es conveniente para ovarios con un pequeño número de folículos, y tiene la ventaja de poder repetir aspiraciones a intervalos cortos. Para ovarios que presentan un gran número de folículos después de la estimulación por gonadotropinas, la laparotomía abdominal bajo anestesia general hace más eficiente la aspiración, y es mayor la tasa de recuperación de los ovocitos (Córdova-Izquierdo et al., 2008).
Conclusiones
La cantidad de folículos aspirados y ovocitos recuperados varía debido al número de animales utilizados, la edad, raza y prolificidad de las hembras.
La cantidad y el porcentaje de ovocitos recuperados, difiere según la edad de la hembra donante y la velocidad del fluido utilizado para la aspiración de los ovocitos; ya que, a menor edad, se obtiene mayor cantidad de ovocitos, y a menor velocidad de aspiración, resulta mayor porcentaje de ovocitos con mejor calidad para la transferencia de embriones en cabras.
El uso de AOL tiene una ventaja adicional con respecto a los protocolos tradicionales, debido a que su aplicación en la producción in vitro de embriones, mediante ovocitos recolectados por laparoscopía, es muy importante para impulsar la reproducción asistida en caprinos. Por el contrario, una desventaja es que la técnica implica entrenamiento, infraestructura y equipamiento costoso y altamente especializado.











 texto en
texto en 



