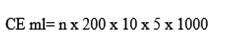Introducción
La recolección de semen bovino mediante la utilización de métodos convencionales como vagina artificial y electroeyaculación, ha permitido el establecimiento de bancos de germoplasma provenientes de machos reproductores seleccionados; sin embargo, cuando un toro u otro animal mueren inesperadamente, su material genético se pierde. No obstante, el hecho de recuperar espermatozoides de un macho recientemente muerto o sacrificado, implica que existe interés en utilizar sus gametos con fines de conseguir crías en algún momento. Una forma de preservar el germoplasma de estos animales es la colecta de espermatozoides del epidídimo (Martins et al., 2009). Este procedimiento post-mortem es considerado una importante herramienta en la utilización de espermatozoides de animales en peligro de extinción.
Los espermatozoides colectados del epidídimo pueden ser criopreservados o utilizados de inmediato en la fecundación in vitro (Martins et al., 2007) o en la inyección intracitoplasmática en los oócitos (James et al., 2002); esta circunstancia puede presentarse en eventos no predecibles como accidentes, intoxicaciones o enfermedades que súbitamente pueden desencadenar en la orquiectomía, la muerte o eutanasia de toros de valor genético o sentimental (Armas et al., 2011). En estos casos, los propietarios no sólo deben afrontar la pérdida del animal, sino también la pérdida del material genético deseable.
En ese sentido, es posible obtener espermatozoides hasta cierto tiempo después de la muerte del animal, los cuales son recuperados de la cola del epidídimo con motilidad y capacidad fecundante (Yu y Leibo, 2002); esto se debe, principalmente a que en el epidídimo se realizan dos eventos importantes: la maduración y el almacenamiento espermático. La maduración o desarrollo progresivo de la capacidad fecundante de los espermatozoides ocurre en la cabeza y el cuerpo del epidídimo y el almacenamiento ocurre en la cola del mismo. Es así, que la obtención de espermatozoides epididimarios, potencialmente fecundantes que se encuentran almacenados en la cola del epidídimo puede ser la única opción para preservar el material genético de un macho de alto valor genético, luego de su muerte u orquiectomía por motivos médicos (Tittarelli et al., 2007).
El sitio principal de almacenamiento de esperma en el tracto reproductivo masculino es la cola del epidídimo. Esta parte tiene una luz relativamente amplia en la que las altas concentraciones de espermatozoides se almacenan. Un trastorno funcional del epidídimo puede originar una composición anormal del plasma del epidídimo, disminución de motilidad de los espermatozoides anormales y cuadros clínicos de los espermatozoides (Oyeyemi y Ubiogoro, 2005).
Es importante establecer un método que permita recolectar espermatozoides de sementales reproductores que hayan muerto por causas naturales o accidentes, de manera tal, que pueda obtenerse descendencia de esos toros. Así que podría implementarse la recolección de espermatozoides de la cola del epidídimo para propagar la calidad genética de toros post-mortem, puesto que los espermatozoides que se encuentran allí tienen capacidad fecundante (Soler et al., 2005).
Por lo anteriormente mencionado y teniendo en cuenta la importancia de la recuperación de espermatozoides que se perderían por la muerte de los animales, el objetivo del presente trabajo se fundamenta en la obtención de espermatozoides de la cola del epidídimo de toros post-mortem para evaluar su viabilidad; así como evaluar los protocolos de lavado retrogrado y de desmenuzamiento del epidídimo para la obtención de semen; evaluando la viabilidad espermática según protocolos de recolección desde la obtención de los testículos en la plaza de rastro, hasta la obtención de los espermatozoides en el laboratorio; valorando el periodo de conservación en refrigeración a fin de determinar el protocolo o método más eficiente de recolección de espermatozoides epididimarios.
Material y Métodos
Lugar de estudio y animales
Para el presente trabajo se utilizaron un total de 50 pares de testículos de toros diagnosticados saludables en el examen ante-mortem, de diferentes tipos raciales y edades, éstos fueron faenados en el Camal Municipal del Cantón Loja, en tanto que el procesamiento de las muestras se llevó a cabo en el Laboratorio de Reproducción Animal, ubicado en la Quinta Experimental Punzara de la Universidad Nacional de Loja, Ecuador.
Recolección y transporte de muestras
Se recolectó los testículos de 50 toros, de diferentes razas y con edad estimada entre dos y cuatro años, durante 10 visitas al Camal Municipal de Loja. Los pasos seguidos para la recolección de los testículos fueron: recolección de las bolsas escrotales con sus testículos incluidos; cada bolsa escrotal fue identificada con el número correspondiente al orden en que fueron recolectadas, además de la fecha y hora de la recolección; cada bolsa escrotal fue limpiada con toallas de papel, los testículos/epidídimos fueron ligados en el cordón espermático; se colocó cada una de ellas dentro de bolsas plásticas selladas e identificadas para luego ser transportadas desde el sitio de recolección hasta el laboratorio en un plazo máximo de 30 minutos, a temperatura inicial de 35ºC. Para lograr esta temperatura se usó bolsas térmicas con agua atemperada a 37ºC.
Una vez en el laboratorio, cada testículo fue colocado en una placa Petri, donde se realizó un lavado externo de la cola del epidídimo con solución salina fisiológica. Para remover la sangre y contaminantes externos, el tejido conjuntivo que recubre la cola fue removido por disección cuidadosa, evitándose el rompimiento de los vasos sanguíneos y el ducto epididimario; posteriormente se separaron los testículos de los epidídimos y se lavaron con solución salina; se realizó una disección de la cola del epidídimo, eliminando la túnica albugínea, dejando de este modo una porción libre del conducto deferente. Después se obtuvo la secreción del mismo de acuerdo a cada método de recolección estudiado, esto es: colecta de flujo retrógrado y desmenuzamiento del epidídimo (Slicing), procediéndose de la siguiente manera:
Primer método (colecta de flujo retrógrado)
El epidídimo ya separado del testículo, se colocó en una caja Petri, con lactato de ringer precalentado a 37ºC, con la finalidad de lavar los residuos de sangre; a continuación, se localizó la porción más cercana de la zona media de la cola del epidídimo para realizar un corte transversal con el bisturí, antes que el diámetro del epidídimo se reduzca. Con la finalidad de obtener la mayor cantidad de espermatozoides posibles, se colocó una aguja (calibre 20, 21, 22, o 23, según el diámetro interno de cada vaso deferente) dentro del lumen de la porción libre del vaso deferente. Se adaptó una jeringa con 10 - 15 ml de “medio de lavado PBS” a 37°C colocándose una pinza contra la aguja sobre las paredes del vaso deferente, evitando de este modo la pérdida del líquido de lavado por reflujo. El fluido obtenido con los espermatozoides epididimarios se centrifugó a (300g/5min), para concentrar la muestra. El sobrenadante obtenido se removió y fue descartado, a la concentración obtenida se le realizó una predilución con AndroMed en proporción 1:1 a 37ºC.
Segundo método (desmenuzamiento del epidídimo)
El epidídimo fue separado asépticamente del testículo, se lo colocó en una caja Petri con lactato de ringer a 37ºC, con el fin de lavar los residuos de sangre. Los espermatozoides fueron recuperados por el método de picado en trozos (slicing), con una tijera quirúrgica en una caja Petri, que contenía 15 ml de medio PBS a 37°C; este contenido se succionó en una jeringa de 20 ml. para luego ser depurado a través de un filtro estéril; el mismo fue traspasado a tubos falcón (15 ml), y luego se centrifugó a una velocidad de (300g/5min). El sobrenadante obtenido se removió y fue descartado; y al igual que el método anterior a la concentración obtenida se le realizó una predilución con AndroMed en proporción 1:1 a 37ºC.
Preparación del diluyente
Se vertió 2 ml de AndroMed en un tubo falcón graduado, se agregó al concentrado 8 ml de agua bidestilada, atemperada a 37ºC, mezclándose con la ayuda del vórtex (agitador mecánico), hasta conseguir que la dilución se homogenice. Esta dilución se realizó para cada muestra de forma individual, la misma que debe prepararse en baño maría entre 35ºC y 37ºC; luego se procedió a realizar la predilución del semen en proporción 1:1; para ello el diluyente debió tener la misma temperatura que el esperma. Tras la evaluación del semen se procedió inmediatamente a la dilución final, que consistió en 2 ml de semen prediluido, más 8 ml del diluyente preparado. Esta dilución final debe descender de temperatura progresivamente, hasta alcanzar la temperatura de laboratorio (18ºC a 22ºC). Posteriormente se desciende la temperatura con agua refrigerada (8ºC - 10ºC), se debe equilibrar la temperatura por lo menos por 1 hora, seguidamente se refrigeró a 5ºC.
Evaluación microscópica de las muestras seminales
Para realizar la evaluación microscópica fue necesario esperar entre 40 y 45 minutos a fin de observar los movimientos de los espermatozoides epididimarios, durante este tiempo se mantuvo las muestras seminales y el material utilizado en baño maría a 37ºC; transcurrido este tiempo se pudo estimar los porcentajes de motilidad y movimientos progresivos de las células espermáticas; para la coloración y frotis de las muestras se utilizó eosina al 5% y nigrosina 10%; la valoración microscópica se la hizo con lente de 40X y 100X. Se analizaron las siguientes características: volumen, concentración, morfología, vitalidad, motilidad masal y motilidad individual.
Motilidad Masal : se procedió a colocar una gota de semen de 10 a 20 μl, sobre un porta objetos atemperado a 37ºC, sin colocar el cubre objetos; se observa con el lente de 10X y 40X.en un microscopio binocular biológico XSP63, el porcentaje de motilidad masal. Se calificó de acuerdo a criterios evaluativos propuestos en el cuadro 1.
Motilidad Individual : se colocó 10μl de semen en un porta objetos y se cubrió con el cubre objetos, ambos atemperados a 37ºC, se observó con el lente de 40X, se evaluó los espermatozoides con movimiento progresivo rectilíneo que atraviesan el campo observado; tanto en la motilidad masal como para la motilidad individual. Para la valoración se coloca la plantilla térmica en el microscopio y así poder mantener la temperatura. Para determinar el porcentaje de motilidad individual se calificó de acuerdo a los valores propuestos en el cuadro 2. (Chamba Ochoa, 2017).
-
Concentración espermática : para determinar la concentración espermática se realizó una dilución 1:200, es decir se mezcló 10μl de semen puro en 2 ml de solución salina formolada; (0,9% de cloruro de sodio; 0,1% de formaldehído en agua destilada) y después se homogenizó la solución (Chamba Ochoa, 2017). Con la ayuda del vortex se homogenizó la muestra, posteriormente se procedió a colocar 10μl de la dilución en la cámara de Neubauer; a continuación, se llevó la cámara al microscopio donde se observó con el lente de 40X.
Para la contabilización se procedió a contar las cabezas de los espermatozoides observados en 5 cuadros, del cuadro central grande y se aplicó la fórmula 1.
-
Morfología: para llevar a cabo la evaluación morfológica, se evaluó un total de 100 espermatozoides por muestra, con el fin de determinar el porcentaje de anormalidades. Se utilizó la tinción vital de eosina 5% y nigrosina 10%, una gota de 10μl de nigrosina, una gota de 20μl de eosina y una gota de semen de 10μl sobre un portaobjeto atemperado a 37ºC; se dejó fijar por 10 a 30 segundos; tomándose una gota de la mezcla se hizo una extensión gruesa en lámina seca; posteriormente se colocó una gota de aceite de inmersión y se determinó el porcentaje de espermas vivos y muertos por microscopía de campo claro a 100 aumentos. Se evaluaron al menos 200 células, diferenciando aquellas que estaban parcial o totalmente teñidas de las que no habían permitido el paso del colorante; el resultado se expresó como el porcentaje de espermatozoides no teñidos los cuales fueron considerados como vivos (Soler et al., 2005).
Para determinar el estado de los acrosomas se utilizó la misma muestra fijada, observando un mínimo de 200 espermatozoides. Se clasificaron como acrosomas normales aquellos que presentaban espermatozoides con bordes apicales bien definidos y nítidos en forma de semiluna oscura. Los resultados se expresaron en porcentaje de acrosomas normales.
El proceso no debe durar más de un minuto, ya que se ha demostrado que espermas que estaban vivos al morir se tiñen con el tiempo; en los espermas muertos se altera la permeabilidad de la membrana cefálica y dejan pasar el colorante, mientras que los vivos no lo permiten, los moribundos se tiñen en la cola.
Vitalidad: en la evaluación del porcentaje de vitalidad se contabilizó un número de 100 espermatozoides por muestra. Para realizar el extendido del semen igualmente colocamos una gota de nigrosina y dos gotas de eosina en el extremo de un porta objetos, y con la ayuda de otro porta objetos atemperado, se hace el extendido de la muestra, la cual debe ser fina y uniforme; dejamos secar por un minuto, colocamos una gota de aceite de inmersión y llevamos al microscópico para observar con el lente de 100X. Los espermatozoides vivos no se tiñeron, mientras que los espermatozoides no viables o muertos tomaron una coloración rosada.
donde:
n |
- Número de células contadas |
200 |
- Factor de dilución |
10 |
- Altura de la cámara de 0.1 |
5 |
- número de cuadrados contados |
1000 |
- Conversión a cm³ |
El resultado obtenido de la concentración espermática fue en millones/ml
Cuadro 1 Porcentajes de motilidad masal y criterios evaluativos
| VALOR DESCRIPTIVO | ASPECTO DEL MODELO | % CÉLULAS MÓVILES | CRITERIO EVALUATIVO |
|---|---|---|---|
| Muy buena | Movimiento en ondas vigorosas y en remolinos rápidos | 80-90% | ++++ |
| Buena | Remolinos y ondas más lentas | 60-80% | +++ |
| Regular | Sin remolinos, pero con oscilaciones generalizadas | 40-60% | ++ |
| Mala | Escasa o ninguna motilidad | 0-40% | + o - |
Adaptado de; Derivaux (1976), Hafez (1989) y Baracaldo (2007)
Cuadro 2 Escala basada en el porcentaje de células móviles
| Valor descriptivo | % células móviles |
|---|---|
| Muy buena | 80-100% de células móviles |
| Buena | 60-79% de células móviles |
| Regular | 40-59% de células móviles |
| Mala | Menos de 40% de células móviles |
Adaptado de; Salisbury (1978), Hafez (1989) y Barth (2000).
Evaluación post refrigeración
Se realizó la evaluación de la motilidad individual post refrigeración, cada grupo estudiado (2, 4, 8, 10, 24 horas). La evaluación de la calidad seminal se realizó en fresco y cada 24 horas post refrigeración por 5 días; de la muestra refrigerada a 5ºC se tomó, 0.5 ml de semen diluido en un tubo eppendorf, el mismo que fue atemperado a 37ºC por 3 minutos en baño maría; seguidamente se retiró el tubo del baño maría, se lo secó con una toalla de papel, luego se tomó 10μl de semen y se colocó en el porta objetos atemperado y colocamos el cubreobjetos; esta evaluación se la realizó sobre la platina térmica (Chamba Ochoa, 2017).
Análisis estadístico
Para el análisis de datos, se empleó el programa estadístico IBM SPSS Statistics 2.0. Para la descripción de los datos fueron utilizados promedios y la desviación estándar de cada grupo estudiado, en los casos donde la información obtenida correspondía a porcentajes, éstos fueron transformados según el modelo binomial de parámetros. Todos los datos fueron evaluados para la normalidad por el test de Shapiro-Wilk. Las variables que no pasaron en el test de normalidad (datos no paramétricos) fueron evaluados por el test de ANOVA on Ranks. Las variables que pasaron el test de normalidad (datos paramétricos) fueron evaluadas por el test One Way ANOVA. Cuando el ANOVA señaló efecto significativo, los valores fueron comparados aplicando la prueba de comparación de medias de Tukey. Finalmente se realizó la prueba de Pearson para establecer la correlación entre las variables medidas. El nivel de significancia fue considerado P < 0,05 (SPSS/PC, 2012).
Resultados y Discusión
Características morfométricas de testículos y epidídimos
En el estudio de las características morfométricas y funcionales de testículos/ epidídimos y espermatozoides recuperados, mediante la utilización de dos métodos de recuperación espermática de epidídimos de toros faenados en el Camal frigorífico de Loja; como parte del análisis descriptivo se determinó un promedio de 33,81 ± 5,9 cm para circunferencia escrotal; 11,94 ± 5,8 cm para largo testicular; 6,1 ± 4,4 cm para ancho testicular y 580 ± 50 g de peso testicular; 62,76 ± 4,2 g para el peso del epidídimo y 17,28 ± 6,3 cm de largo de epidídimo. Datos que se relacionan a los señalados por Saavedra et al.,(2012), donde indica que el peso de cada testículo está alrededor de los 250 a 500 g, el largo testicular entre 11 y 17cm y el ancho entre 5 a 8 cm, así mismo (Sudheer 2000), obtuvo promedios de 31,80 cm para circunferencia escrotal, 11,36 cm para el largo testicular; 5,56 cm para ancho o profundidad testicular; y 267,12 g para el peso de cada uno de los testículos; 1,96 cm de largo de la cola del epidídimo y 30,06 g para el peso de la cola epididimaria. Así mismo, (Rodríguez et al., 2000), obtuvo promedios para circunferencia escrotal de 31,25 cm, peso de la cola epididimaria 32 g y 16,63 cm para el largo del epidídimo. Los testículos se evaluaron dentro de las bolsas escrotales, midiéndose diámetros de circunferencia escrotal, largo, ancho y peso testicular; así como largo y peso del epidídimo.
Estudio comparativo de los métodos de recolección seminal de epidídimos post-mortem (0 horas)
Utilizando la técnica de flujo retrogrado fue recolectado, (cuadro 4) en promedio 2,0±0,5 ml. con una concentración/ml de 64,04±1,3 x 109 espermatozoides/animal, y utilizando la técnica de desmenuzamiento del epidídimo (cuadro 5). Fue colectado, en promedio 2,2±0,4 ml. con una concentración/ml de 62,12±2,8 x 109 espermatozoides/animal, lo que corresponde a la cantidad de células obtenidas en una eyaculación (Gonçalves et al., 2008). Considerando que el epidídimo es capaz de almacenar varias eyaculaciones, la cantidad colectada podría ser superior, sin embargo, los toros utilizados fueron provenientes de una planta faenadora, donde la calidad reproductiva no es un índice considerado (Cuadro 3).
Cuadro 3 Resultados estadísticos de las características microscópicas según Protocolo.
| Parámetro evaluado | Semen obtenido por lavado retrógrado | Semen obtenido por desmenuzamiento del epidídimo |
|---|---|---|
| Volumen cc. Motilidad masal % | 2 ± 0,5 61,6m ± 5,3 ᵃ | 2,2 ± 0,4 59,2± 4,2ᵃ |
| Motilidad individual % | 51,8± 3,8ᵃ | 49,6± 5,7ᵃ |
| Espermatozoides vivos % | 62,08± 4,2ᵃ | 59,12± 3,5ᵇ |
| Concentración espermática x10⁹/ml | 64,04± 1,3ᵃ | 62,12± 2,8ᵇ |
| Espermatozoides Anormales % | 7,92± 1,2ᵇ | 9,64± 1,6ᵃ |
( ᵃ ᵇ ) Medias con una letra común no son significativamente diferentes (p> 0,05)
Cuadro 5 Resultados de la evaluación microscópica del semen obtenido mediante lavado retrógrado en diferentes tiempos post-mortem.
| Tiempo de almacenamiento | Motilidad Masal % | Motilidad individual % | Espermatozoides Vivos % | Concentración Esp. X10⁹/ml | Espermatozoides Anormales % |
|---|---|---|---|---|---|
| 2h | 86±6,1 | 76±5,9 | 86±3 | 69±2 | 7,4± 1,3 |
| 4h | 76±5,7 | 66±4,7 | 76±4,6 | 67±1,8 | 8,2±2,4 |
| 8h | 56±5,5 | 47±4,4 | 63,4±3,7 | 56,2±1,5 | 8±2 |
| 10h | 48±4,2 | 41±4 | 51±2,2 | 62,8±4 | 6,6±2,3 |
| 24h | 42±3,4 | 29±3,6 | 34±2 | 65,2±2 | 9,4±2,8 |
Se optó por utilizar el promedio/animal, ya que de acuerdo con (Goovaerts et al., 2006) un epidídimo no puede ser control del otro, puesto que hay diferencias significativas en la cantidad y calidad de las células colectadas de los epidídimos del mismo animal.
Las muestras de espermatozoides frescos presentaron resultados superiores en todos los parámetros en comparación a los resultados de la evaluación con semen refrigerado.
Evaluación microscópica del semen obtenido mediante desmenuzamiento del epidídimo (slicing)
La motilidad espermática es fundamental para que los espermatozoides alcancen el ambiente uterino y el sitio de la fertilización, considerándose el criterio más importante en la evaluación de las células espermáticas antes y después a la criopreservación (Siqueira et al., 2007).
En el presente estudio las características microscópicas presentaron medias porcentuales de motilidad masal similares dentro de cada grupo, a las dos horas post-mortem de 86±6,1% (cuadro 5), para el método de lavado retrógrado (P1) y 84±4% (cuadro 6), en el método desmenuzamiento del epidídimo (P2), porcentajes análogos a los obtenidos por Chávez (2008), quien obtuvo mediante lavado retrógrado 90% de motilidad masal, en toros de Lidia, considerado valor descriptivo muy bueno. A las cuatro horas post-mortem 76±5,7% (P1) y 72±3,8% (P2), con un valor descriptivo bueno. A las ocho horas post-mortem se obtuvo 56±5,5% (P1) y 54±3,5% (P2), y a las 10h y 24h se tuvo una media de motilidad masal de 40% a 48% de células, con un valor descriptivo regular. Dichos valores descriptivos están de acuerdo a los valores de referencia presentados por Baracaldo (2007), quien señala valores descriptivos muy buenos de 80-90%, bueno de 60-79%, regular de 40-59% y mala menos de 40%.
En lo referente a motilidad individual de espermatozoides frescos colectados del epidídimo a las dos horas de almacenamiento, fue elevada, 76±5,9% (cuadro 5), con técnica de flujo retrogrado y 74±5 % (cuadro 6), con la técnica de desmenuzamiento del epidídimo; lo que puede ser considerado dentro de los límites normales para la especie, (Melo et al., 2008); valores poco inferiores al 80% encontrado por Chávez (2008); a las cuatro horas post- mortem se obtuvo valores de 66±4,7% (P1) y 64±4,3% (P2), datos afines a los obtenidos por Sánchez et al., (2010), quienes realizando un estudio a 28 toros de Lidia post-mortem, obtuvieron medias de 60±6.1% de motilidad individual, con un valor descriptivo bueno; en el tercer grupo a las ocho horas post-mortem presentaron 47±4,4% (P1) y 46±3,9% (P2) regular; y a las 10h y 24h post-mortem se obtuvieron valores de 28% y 41% respectivamente; dando un valor descriptivo malo de acuerdo a lo reportado por Barth et al., (2000).
Las lecturas de motilidad individual que se hicieron tanto para el protocolo de lavado retrogrado como para el protocolo de desmenuzamiento del epidídimo, no mantuvieron un patrón uniforme; esto pudiera relacionarse con la variabilidad entre toros de matadero, no reproductores, y más aún en este estudio en el que desconocemos el origen específico de esos machos destinados al consumo y que entendemos no tuvieron una dieta adecuada, lo que pudiera haber afectado de alguna manera su capacidad reproductora (Albers y Barrios 2006).
Calidad del semen post refrigeración a distintos tiempos de evaluación.
El porcentaje de motilidad individual de los espermatozoides obtenidos mediante lavado retrógrado y desmenuzamiento del epidídimo (slicing), luego de ser refrigerados, fueron evaluadas las muestras cada 24 h, dentro de cada método de recolección (Cuadro 6, 7 y 8).
Cuadro 6 Resultados de la evaluación microscópica del semen obtenido mediante desmenuzamiento del epidídimo (slicing) en diferentes tiempos post-mortem
| Lapso de recolección | Motilidad Masal % | Motilidad individual % | Espermatozoides Vivos % | Concentración Esp. X10⁹/ml | Esp. Anormales % |
|---|---|---|---|---|---|
| 2h | 84±4 | 74±5 | 82,6±2 | 67±0,5 | 9,4±1,2 |
| 4h | 72±3,8 | 64±4,3 | 72,2±1,8 | 67±0,3 | 8±2 |
| 8h | 54±3,5 | 46±3,9 | 57,6±1,5 | 56,2±1 | 10,6±0,5 |
| 10h | 46±3,4 | 36±4 | 49,2±3 | 58,6±2 | 9,8±1 |
| 24h | 40±4,6 | 28±3,2 | 34±3,5 | 61,8±3 | 10,4±1,5 |
Cuadro 7 Porcentaje de Motilidad Individual evaluada cada 24h post refrigeración, del semen obtenido mediante lavado retrógrado
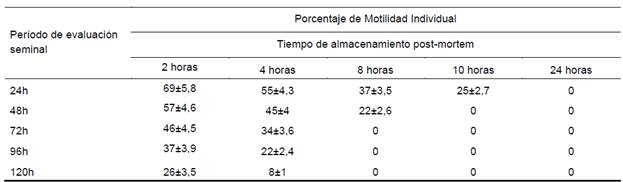
El porcentaje de espermatozoides vivos, determinado a las 2h 86±3% (P1) y 82.66±2% (P2); a las 4h 76±4,6% (P1) y 72.2±1,8% (P2), datos que se relacionan a los obtenidos por Chávez M. (2008), que en su estudio determinó 70% y 80%; valores similares encontrados por Morillo et al., (2012), quien comenta que el porcentaje mínimo aceptable para espermatozoides vivos debe alcanzar el 70%.
Barrios (2002), reportó una concentración espermática de 40 a 72 x 109 espz/ml; en el presente estudio se determinó 56,2 a 69 x 109 espz/ml, valores superiores a los anteriores y a los encontrados por Rodríguez (2000), que reportó 15 a 40 x 109 espz/ml. Sin embargo, Castro et al., (2009) encontraron promedios de espermatozoides colectados de la cola de los epidídimos de 1,7 x 109espz/ml, siendo el mínimo de 0,26 x 109 espz/ml y el máximo de 4,2 x 109 espz/ml. En otros estudios Sánchez y col. (2010), obtuvo una concentración espermática de 380.5x109 espz/ml, valores inferiores a los obtenidos en el presente estudio y el de Chávez (2008), quién reportó de 600 a 1800x106 espz/ml.
En cuanto a morfología el porcentaje de espermatozoides anormales fue 7.92±1,2%, para semen obtenido mediante lavado retrógrado y de 9.64±1,6% para el semen obtenido mediante desmenuzamiento del epidídimo, Barth (2000) y Anel et al., (2002) confirman que el total de anormalidades no debe superar el 30%; sugiriendo que cuando hay pocas anormalidades es suficiente contar 100 espermatozoides y cuando encontramos gran cantidad es recomendable contar 300 o más.
Castro et al., (2009), estudiaron la viabilidad de espermatozoides de toros, colectados de epidídimos refrigerados a 4°C, 24 horas después del sacrificio y encontraron resultados similares al de semen eyaculado. Sin embargo, en este estudio los mejores resultados, se obtuvieron en los grupos uno y dos, dentro de los protocolos evaluados; a las 24h se determinó una viabilidad dentro del protocolo uno (P1) 69±5,8% (G1) y 55±4,3% (G2); 57±4,6% (G1) y 45±4% (G2), en el protocolo 2 (P2) a las 48 h; los grupos 3,4 y 5 no presentaron motilidad individual.
Cuadro 8 Porcentaje de Motilidad Individual evaluado cada 24h post refrigeración del semen obtenido mediante desmenuzamiento del epidídimo.
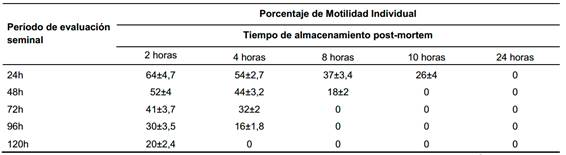
Martins et al., (2009) determinó que después de las 48h de almacenamiento en refrigeración, se produce una disminución total de la motilidad, lo que concuerda con los resultados obtenidos en este trabajo, así también lo confirma Anel (2002), mencionando que, dependiendo del intervalo entre la recuperación de los espermatozoides y la muerte, la motilidad espermática disminuirá significativamente entre las 48h.
Los resultados evidenciaron que no hay diferencia estadística significativa entre métodos de recolección espermática sobre la viabilidad de los espermatozoides. A pesar de esto, los resultados de viabilidad fueron el doble de la mortalidad espermática, lo que indica que los espermatozoides del epidídimo, después de la refrigeración se comportan de la misma manera que los eyaculados (Celeghini et al., 2008), en el cual los espermatozoides inmóviles aún pueden ser viables (Chávez, 2008)
Conclusión
Los métodos de recolección utilizados fueron eficientes y repetibles, confirmando que es posible recolectar espermatozoides vivos de la cola del epidídimo de toros postmortem, pudiendo inferirse que estos métodos no influyen sobre la cantidad y calidad de espermatozoides epididimarios. Las muestras obtenidas mediante el protocolo de lavado retrógrado alcanzaron mejores resultados que el protocolo de desmenuzamiento del epidídimo (slicing), aunque éstos no son significativamente diferentes, debiendo recalcar que son datos notables, ya que en la bibliografía revisada no se mencionan trabajos realizados por este procedimiento; más bien sólo lo describen como un método para obtener espermatozoides epididimarios post mortem. La vitalidad espermática es directamente proporcional al tiempo de almacenamiento, los mejores resultados estuvieron en el grupo uno, cuya recolección se realizó a 2h post mortem, mostraron buena sobrevivencia, aunque tienen menor movilidad que los del semen bovino recolectado por métodos convencionales. El mejor periodo de conservación en refrigeración de semen epididimario recolectado entre las 2h y 4h post mortem, se encuentra entre las 24h y 48h; pasado este periodo, la motilidad individual desciende significativamente; siendo viable realizar recuperación y criopreservación de espermatozoides del epidídimo a partir de este material con cualquier protocolo seleccionado; lo que supone una técnica prometedora para conservar recursos genéticos, que ha cobrado gran interés en el caso de algunos animales de alto valor genético que hayan muerto repentinamente.











 texto en
texto en