Introducción
La barrera gastrointestinal formada de mucosa es reconocida como la principal línea de defensa contra gérmenes patógenos, acción que puede mantenerse al modular la población microbiana, induciendo el cuidado de la integridad tisular; lo cual se reflejará en la salud y productividad (Yusrizal y Chen, 2003). Lo anterior puede lograrse al proporcionar ciertos nutrimentos con valor adicional, como por ejemplo los oligosacáridos, que pueden ayudar a modular la población microbiana del intestino (Kleessen y Blau, 2005; Volek et al., 2007). Estos compuestos se usan como prebióticos porque influyen en la composición de la población intestinal de varias especies animales (Bónai et al., 2010; Falcao-e-Cunha et al., 2007; Verdonk et al., 2005; Volek et al., 2007; Yalcinkaya et al., 2008).
Dentro de los oligosacáridos están aquellos formados por fructosa, ejemplo de ellos es la inulina y los fructooligosacáridos (FOS), que son utilizados como fibra no digestible denominados como “ingrediente funcional”. El oligosacárido inulina se encuentra en: trigo, cebolla, plátano, ajo, achicoria, entre otros, y se caracteriza por poseer enlaces del tipo β 2-1 (Álvarez-Borroto et al., 2015; Ávila-Fernández, 2013; Montañez-Soto et al., 2011), para el cual no existen enzimas en el tracto gastrointestinal del animal, pero pueden ser fermentadas por la microbiota del tracto posterior, cambiando con ello el patrón de metabolitos sintetizados (Bónai et al., 2010; Holscher et al., 2015; Maertens et al., 2004; Volek et al., 2007).
Como aditivo nutrimental funcional, el oligosacárido proviene de la raíz de la achicoria (Verdonk et al., 2005), donde se encuentra en concentraciones de 15-20%. En México las agavaceas como la variedad Tequilana azul Weber, tienen en base seca en promedio 31.5% de inulina y hasta un 10% de otros oligosacáridos (Gómez et al., 2010; Montañez-Soto et al., 2011). En general los azúcares del agave son usados principalmente para producir tequila y el fructo-oligosacárido inulina. Pérez-de la Mora et al. (2014) adicionaron ésta al agua de bebida de la codorniz japonesa, y mejoraron 10% la producción de huevo, con respecto al testigo; pero redujeron ligeramente el consumo ofrecido.
En cambio, López-Romo et al. (2008) adicionaron el prebiótico al concentrado del caballo, sin provocar alteraciones en el consumo, en cambio redujeron la glicemia. Por otro lado, Salas et al. (2013) empleando inulina proveniente de achicoria en el alimento del conejo, disminuyeron el pH del intestino y mejoraron la digestibilidad. No se encontró información sobre el uso de la inulina de agave tequilana Weber variedad azul, que contiene un mayor grado de polimerización, en el conejo.
Materiales y Métodos
Descripción del área de estudio
La actual investigación se realizó en las instalaciones del Centro Universitario de Los Altos de la Universidad de Guadalajara, ubicado en el noroeste del estado de Jalisco. En la región la temperatura media anual es de 19.1ºC., con precipitación promedio de 620.9 mm, con régimen de lluvias en los meses de junio y julio (Ruíz-Corral et al., 2012).
Animales y tratamientos
Para el estudio se emplearon dieciocho conejos machos de la cruza New Zealand x California x Rex (peso promedio; 350 gramos), estos fueron alojados individualmente en jaulas metálicas (40 x 40 cm) con piso plástico cribado. Los animales fueron asignados aleatoriamente a uno de los tres niveles de adición de inulina de agave (0, 1 o 2%) al alimento. En la parte inferior de cada una de las jaulas, se colocó una charola metálica para la recolección diaria de heces fecales. Durante todo el estudio los animales tuvieron libre acceso al alimento, el cual fue formulado para llenar sus requerimientos nutrimentales (Cuadro 1). El consumo de alimento (ofrecido menos rechazado) y de agua fueron medidos diariamente y ajustados semanalmente para satisfacer las necesidades de los animales. Para la medición de la oferta y rechazo de alimento se empleó una balanza electrónica (Adam, modelo ADP 4100L), y para el agua de bebida una probeta graduada (SP Scienceware).
La inulina de agave se obtuvo de la agroindustria tequilera (Inulina y Miel de Agave S.A. de C.V.), el prebiótico fue adicionado al alimento del conejo a niveles de; 0, 1 o 2% (base seca). Los animales del estudio fueron individualmente pesados y asignados aleatoriamente a los niveles de adición de inulina al alimento.
El experimento consistió en tres periodos de 21 días por periodo, los últimos 15 días sirvieron para evaluar el coeficiente de digestibilidad aparente, se midió diariamente el consumo de alimento y la producción fecal. Al final de cada periodo unas muestras representativas de alimento fueron mezcladas y enviadas al laboratorio para su análisis nutrimental. Por otra parte, se empleó una báscula portátil (Marca Torrey, Modelo PCR-20; con una capacidad máxima de peso de 40 kg, precisión de 0.001), para medir el peso inicial y final de cada conejo.
La materia seca (MS) de alimento y de heces fecales se determinó a 60ºC durante 24 h en una estufa de aire forzado (Fischer Scientific, modelo: Isotemp oven); después fueron molidas con malla de 1 mm (Thomas-Wiley Mill, Modelo 4), para realizar en laboratorio los análisis de fibra detergente neutro (FDN), utilizando el equipo fiber analyzer (ANKOM, modelo; A 200), la energía bruta (EB) con una bomba adiabática (Parr Instrument Co., Moline, IL, USA, modelo 1341), cenizas en un horno mufla a 500ºC (Novatech, modelo; MD 1500) y se calculó la materia orgánica (MO; MO = MS-ceniza). Además, las heces frescas en triplicado fueron empleadas para la determinación de coliformes totales (Unidades formadoras de colonias; UFC), utilizando métodos estándares y el medio de cultivo de agar EMB.
Análisis estadístico
La varianza de los datos obtenidos fue analizada como un experimento aleatorizado, estableciendo a priori una alfa de 0.05 para declarar diferencia entre ellos. Cuando ésta se presentó, los promedios de los diferentes niveles de adición de inulina al alimento fueron separados empleando el método de Tukey, del paquete estadístico SAS.
El manejo de los animales durante todo el experimento se realizó respetando la normatividad relativa al trato de los animales (NOM-051-ZOO-1995; Decreto 21741/LVII/06, Congreso de Jalisco), y se contó con constante supervisión de Médicos Veterinarios.
Resultados y Discusión
Los conejos consumieron diariamente en promedio 95.83 gramos de MS, proceso que se vio reducido significativamente (p < 0.05; Cuadro 2) con el empleo de inulina de agave en el alimento; sin embargo, la digestibilidad aparente de la MS se incrementó en un 16.96% (p < 0.05) al adicionar la inulina al alimento. De igual manera la ingesta de MO y FDN disminuyeron (p < 0.05) en respuesta a la adición de 1 y 2% del fructo-oligosacárido obtenido del agave. Bónai et al. (2010) en su estudio al adicionar inulina de achicoria, también redujeron el consumo del conejo; coincidiendo con lo observado en el presente estudio. Caso contrario lo reportaron Volek et al. (2007), donde no se afectó la ingesta de alimento al emplear 4% de inulina de achicoria.
Cuadro 2 Efecto de la inulina de agave tequilana sobre la digestibilidad de nutrimentos en el conejo
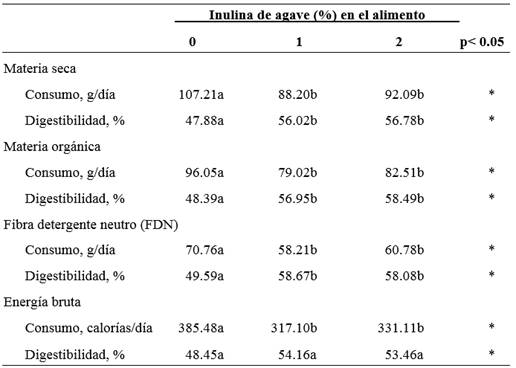
Literales diferentes denota significancia entre tratamientos (P < 0.05)
Como se puede observar en al cuadro 2, se muestra el efecto positivo de la inulina (+17.7%) en el aprovechamiento digestivo de la FDN. Volek et al. (2007) por su lado no observaron efecto de la adición de 4% de inulina al alimento del conejo sobre aprovechamiento digestivo de los diferentes nutrimentos.
Por otro lado, en el presente estudio, al evaluar la digestibilidad de la energía bruta, se encontró que ésta aumentaba significativamente (p < 0.05) cuando se utilizaba el oligofructano proveniente del agave en el alimento. De igual manera los autores Salas-Montiel et al. (2013) empleando inulina de achicoria (2.5 g/kg) en conejos de 40 días de edad, incrementaron la energía digerida del alimento, a base de grano de maíz y pasta de soya; aunque en su estudio afectó negativamente la ganancia de peso y disminuyó la cantidad de triglicéridos y glucosa en circulación.
Durante todo el presente estudio el consumo individual de agua fue en promedio de 369.36 ml/día; pero con la adición de inulina de agave al alimento se redujo en 24.75 y 13.65% con los niveles 1 y 2% del prebiótico respectivamente (p < 0.05). Por otro lado, la ganancia diaria de peso (GDP) fue de 28.025 gramos en promedio; aunque con el 1% de inulina de agave se redujo en 4 gramos (24.67 g/día) aproximadamente; con el 2% se incrementó a 30.53 g /día, respecto al testigo que mostró 25.73 g/día (p < 0.05). Usando 4% de inulina de achicoria, investigadores han reportado 33.3 (Volek et al., 2007) y 36 gramos (Bónai et al., 2010) de GDP en conejos, valores cercanos a los encontrados en el presente estudio. Pero, Falcao-e-Cunha et al. (2007) en su revisión y Bónai et al. (2010) empleando alternativas de antibióticos como promotores de crecimiento, reportan una ausencia de efecto en los parámetros productivos del conejo.
En cambio, como se puede observar en la Figura 1, la cantidad de E. coli presente (log10 UFC/gramo) en las muestras de heces fecales recolectadas, mostraron una reducción significativa (p < 0.05), cuando la inulina de agave fue adicionada al alimento del conejo.
Los autores Yusrizal y Chen (2003) emplearon el 1% de inulina de la raíz de achicoria en el alimento de pollo de engorda y encontraron una fuerte reducción tanto de E. Coli como de Campylobacter, en cambio incrementaron la presencia de Lactobacilli. Los autores también observaron una reducción en la cantidad de amoniaco en heces fecales. Por otro lado, Patel y Goya (2013) en su revisión, así como Holscher et al. (2015) en sus hallazgos sobre prebióticos, reportaron el incremento de bifidobacterias en respuesta al empleo de este tipo de fructanos, sin que estos afecten el peso del individuo o sus parámetros hemáticos











 nueva página del texto (beta)
nueva página del texto (beta)




